表1HLA-B*15:02阳性特征峰的熔点(Tm)参考值范围
Tab. 1 Reference range ofHLA-B*15:02positive melting temperature

裴斌1,郭晓彤2,冉鹏1,黄秋英2,洪素云1,钟雪婷2,李庆阁2*
(1.厦门市中心血站,福建 厦门 361004;2.厦门大学生命科学院,福建 厦门 361102)
摘要:目的对多色探针熔解曲线法(multicolor melting curve analysis,MMCA)用于卡马西平不良反应相关的HLA-B*15:02基因检测进行临床评价。方法收集厦门市中心血站1 147份厦门地区无偿献血者的外周静脉血样本,经基因DNA提取后,按双盲对照试验,分别应用MMCA法和HLA-SBT测序法对各样本进行HLA-B*15:02基因检测,比较2种检测方法的符合率。对于检测结果不一致的标本,采用第三方Sanger测序和电泳验证,计算总符合率。结果采用MMCA法共检出77份HLA-B*15:02阳性标本,1 070份HLA-B*15:02阴性标本。采用HLA-SBT测序法共检出74份HLA-B*15:02阳性标本,1 070份HLA-B*15:02阴性标本,以及3份无明确的分型信息的标本(仅显示为B*15:VG-B*15:CYS型)。该3份标本经Sanger测序以及电泳验证,确认为HLA-B*15:02阳性标本。因此,MMCA法检测HLA-B*15:02基因的阳性检出率为100%(77/77),阴性检出率为100%(1 070/1 070),总符合率为100%(1 147/1 147)。此外,在1 147份临床标本中共检出77份阳性结果,HLA-B*15:02的携带率为6.7%(77/1147),这与文献报道的数据基本一致。结论MMCA法用于HLA-B*15:02基因的检测,具有简便、快速、灵敏度高、特异性强等优点,可应用于卡马西平不良反应相关的HLA-B*15:02基因的临床辅助检测。
关键词:卡马西平;基因检测;探针熔解曲线法;HLA-B*15:02;不良反应
卡马西平(carbamazepine,CBZ)是一种情绪稳定剂,它作为一线抗惊厥药物,被广泛用于治疗双相情感障碍和癫痫等精神性疾病,但由其引发的不良反应也不可小觑。CBZ引发的不良反应为大疱性皮肤不良反应,表现为大面积皮肤剥脱,临床上按照皮肤剥脱面积占体表总面积的比例对其进行分类,<10%的为史蒂芬斯-强森综合症(Stephens-Johnson syndrome,SJS),>30%的为中毒性表皮坏死松解症(toxic epidermal necrosis,TEN),10%~30%的为SJS/TEN重叠型[1-6]。据统计,在亚洲人群中,CBZ是最常引发SJS、TEN的药物,占所有药物引发皮肤不良反应案例的25%~33%[7-8]。发生不良反应的患者会出现全身黏膜受损、多器官受累等并发症,致死率极高,幸存者通常伴有视力丧失等后遗症,危害极大[9-10]。
2004年Chung等对台湾地区汉族人群进行研究[11],在全世界首次报道HLA-B*15:02基因与CBZ引起的SJS和TEN(CBZ-SJS/TEN)存在强烈的相关性,随后的大量研究证实了HLA-B*15:02基因与CBZ-SJS/TEN的关联[12-16],但二者之间的相关性存在种族差异性[17]。对于亚裔人群,HLA-B*15:02基因可以作为生物标志物用以预测CBZ-SJS/TEN的发生[18-26]。2007年12月,FDA发布了一则警示,强调HLA-B*15:02阳性患者在服用CBZ时有发生致命性皮肤不良反应的风险,并建议亚裔人群在用药前进行HLA-B*15:02基因筛查[9,25]。
传统的HLA分型多采用血清学分型法,但由于HLA各基因座位间存在的高度同源性会使血清学出现较多、较强的交叉反应,因此不能保证分型结果的准确性。80年代后期,随着分子生物学技术的迅速发展与成熟,人们开始对HLA进行DNA分型研究。目前常用的HLA的DNA分型技术主要有测序[26-28]、限制性片段长度多态性分析(RFLP)[29-30]、聚合酶链式反应寡核苷酸探针杂交(PCR-SSO)[31]、聚合酶链式反应单链构象多态性分析(PCR-SSCP)[32-33]和序列特异性引物聚合酶链式反应(PCR-SSP)[34-36]等,但由于现存的HLA基因检测技术多用于HLA基因的分型,需同时对大量HLA基因型进行区分,检测成本高,结果分析过程繁琐,因此有必要建立一种快速准确的方法有针对性地检测HLA-B*15:02基因。目前单一检测HLA-B*15:02多利用PCR-SSP技术,如巢式PCR[37],这些方法需要在PCR扩增后对产物进行电泳,不仅耗时耗力,也容易受到污染,影响结果的准确性。因此,研究和发展一种快速、简便、高通量、低成本的检测方法成为临床医师们追求的目标。为了解多色探针熔解曲线法(multicolor melting curve analysis,MMCA)应用于CBZ不良反应相关的HLA-B*15:02基因检测的可行性和准确性,本研究用该方法对1 147份外周血标本进行了临床应用评价。
收集在厦门市中心血站经过HLA-SBT测序法获得HLA-B基因型的外周静脉血样本1 147份,样本来源为2014—2015年厦门地区无偿献血者。本研究已通过厦门市中心血站伦理委员会审查,经献血者知情同意后,用乙二胺四乙酸(EDTA)抗凝管采集外周静脉血。
1.2.1 DNA提取和浓度测定 采用厦门致善生物科技股份有限公司Lab-Aid 820全自动核酸提取仪及配套的磁珠法核酸提取试剂盒对外周静脉血样本进行核酸提取。利用ND-1000-UV-VIS波长紫外/可见光扫描分光光度计(美国NanoDrop)对样本的基因组DNA的提取质量和浓度进行检测,并将DNA的终浓度调节至10 ng·μL-1,直接使用或置于-20 ℃冰箱中保存备用。DNA样本的A260nm/A280nm比值在1.6~2.0之间,A260nm/A230nm比值≥2.0。
1.2.2 HLA-SBT测序法检测HLA-B基因 采用美国Life Technologies公司的SeCore SBT试剂盒进行HLA-B基因检测,其中B座位等位基因分型试剂批号为1540309,所采用的仪器为AB-3130基因分析仪。
1.2.3 MMCA检测HLA-B*15:02基因HLA-B*15是HLA-B基因座位上最大、最具多态性的基因家族,有150种以上的等位基因型,其多态性位点主要集中在外显子2和外显子3区域。根据NCBI数据库提供的序列比对工具dbMHC Sequence Alignment Viewer可对HLA-B座位的各基因型进行序列比对,决定HLA-B*15:02基因分型的核心基因位点主要有编码区第193位(G)、第209位(C)、第259位(A)、第261位(C)、第277位(A)、第302位(A)、第353位(T)、第355位(A)。HLA-B*15:02基因检测试剂盒(荧光PCR熔解曲线法)由厦门致善生物科技股份有限公司提供。每份标本仅需通过1个PCR反应体系进行检测,每个反应体系内含有相应的引物和三色荧光检测探针[羟基荧光素(FAM),羟基-Ⅹ-罗丹明荧光素(ROX),六氯荧光素(HEX)]及PCR的基本组成成分。首先用引物扩增人HLA基因,再通过对荧光标记探针与PCR产物形成的双链杂交体进行熔解曲线分析来判断样本是否带有HLA-B*15:02基因。具体检测流程如下:将5 μL浓度为10 ng·μL-1的待测DNA标本直接加到含PCR反应液的管中,短暂离心后,转移至全自动医用PCR分析系统(SLAN-96S,上海宏石医疗科技有限公司)上进行PCR扩增及熔解曲线分析。PCR扩增和熔解曲线分析的运行程序为:50 ℃ UNG酶处理2 min;95 ℃预变性10 min;Touchdown循环:95 ℃变性30 s,65 ℃退火30 s,每次循环减1 ℃,76 ℃延伸30 s,循环10次;PCR扩增循环:95 ℃变性30 s,55 ℃退火30 s,76 ℃延伸30 s,循环50次;熔解曲线分析程序:95 ℃变性1 min,35 ℃退火3 min,熔解曲线分析(45~85 ℃,每0.04 ℃采集FAM、HEX、ROX通道荧光信号)。参照试剂盒说明书进行样本基因型判读。
1.2.4 Sanger测序验证 应用Sanger测序法对MMCA法和HLA-SBT测序法检测结果不一致的标本进行相应片段的PCR扩增测序验证[测序由生工生物工程(上海)股份有限公司完成]。
1.2.5 临床数据分析 按照双盲对照试验,每份标本均采用MMCA法和HLA-SBT测序法进行HLA-B*15:02基因检测。试验完成后进行揭盲,计算MMCA法和HLA-SBT测序法的符合率。对于检测结果不一致的标本,采用第三方Sanger测序验证,计算总符合率。
该检测体系引入β-globin基因作为内控基因(HEX通道),各通道的阳性特征峰的熔点(Tm)参考值范围见表1。判读结果时,首先看内控对应的HEX通道是否有正常的熔解峰(内控峰)出现:①若无正常熔解峰出现,表明样本基因组有问题,检测结果无效;②若HEX通道有正常熔解峰,且Tm值在HEX通道阳性特征峰的参考区间内,则检测结果有效,可进一步根据FAM、ROX通道的熔解信号判断模板类型,当FAM和ROX通道同时出现正常熔解峰,并且Tm值在阳性特征峰的参考范围内时,表明样品带有HLA-B*15:02基因;当FAM和ROX任一通道无熔解峰或任一通道为非阳性特征峰时(Tm值不在阳性特征峰的参考范围内),表明样品不带有HLA-B*15:02基因。
表1HLA-B*15:02阳性特征峰的熔点(Tm)参考值范围
Tab. 1 Reference range ofHLA-B*15:02positive melting temperature

MMCA法检测阳性样本和阴性样本的典型结果图见图1。图1A:HEX内控峰正常且在阳性特征峰的Tm参考值范围内,FAM和ROX通道同时出现正常熔解峰且在阳性特征峰的Tm参考范围内,为阳性标本;图1B:HEX内控峰正常且在阳性特征峰的Tm参考值范围内,但ROX通道无熔解峰,为阴性标本;图1C:HEX内控峰正常且在阳性特征峰的Tm参考值范围内,FAM和ROX通道同时出现正常熔解峰,但FAM通道为非阳性特征峰(Tm值不在阳性特征峰的参考范围内),为阴性标本;图1D:HEX内控峰正常且在阳性特征峰的Tm参考值范围内,但FAM和ROX通道均无熔解峰,为阴性标本。
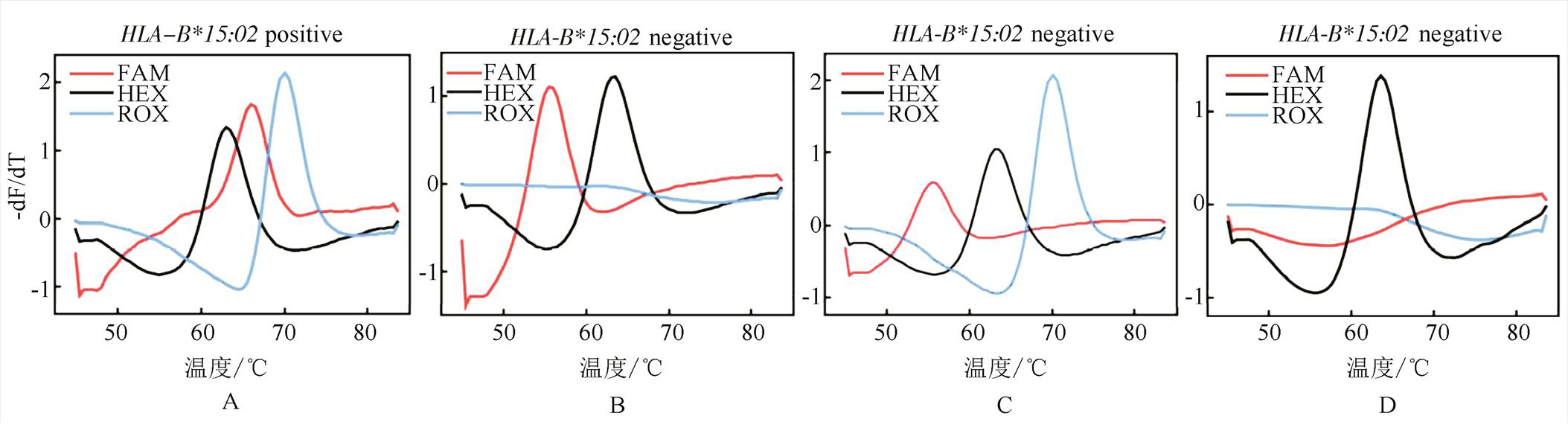
图1 MMCA法检测阳性样本和阴性样本的典型结果图
Fig. 1 Detection results of positive sample and negative samples by MMCA
本研究共检测1 147份人类基因组DNA样本。采用MMCA法共检出77份HLA-B*15:02阳性标本,1 070份HLA-B*15:02阴性标本。采用HLA-SBT测序法共检出74份HLA-B*15:02阳性标本,1 070份HLA-B*15:02阴性标本,以及3份无明确的分型信息的标本(仅显示为B*15:VG-B*15:CYS型),该3份标本检测结果无效。在MMCA法和HLA-SBT测序法都给出有效检测结果的1 144例样本中,2种检测方法的符合率为100%。
3份无明确的分型信息的标本仅显示为B*15:VG-B*15:CYS型,其中B*15:VG代表B*15:01或B*15:02,B*15:CYS代表B*15:15或B*15:25,即该3份标本的基因型可能为B*15:01-B*15:15、B*15:01-B*15:25、B*15:02- B*15:15、B*15:02-B*15:25中的一种。为了评估MMCA体系的准确性,需采用Sanger测序验证或电泳等第三方对照方法进一步确认该3份标本的基因型。
2种检测方法对3份标本的检测结果出现差异,采用MMCA法检测结果为HLA-B*15:02阳性标本,而采用HLA-SBT测序法无法得出明确分型信息(仅显示为B*15:VG-B*15:CYS型),需采用Sanger测序验证和电泳来确认每份标本的基因型是属于B*15:01-B*15:15、B*15:01-B*15:25、B*15:02- B*15:15、B*15:02-B*15:25中的哪一种。
首先采用Sanger测序验证。在NCBI数据库中进行序列比对,B*15:01、B*15:02、B*15:15、B*15:254种等位基因型在外显子区一共有8个差异位点,分别为259,261,353,355,369,409,538,539位点,见图2。图中显示的是B*15:01、B*15:02、B*15:15、B*15:25与参照序列HLA-B*07:02:01的比对结果,“-”表示相同的序列,“.”表示缺失的序列。对3份无明确分型信息标本的HLA-B基因进行测序,测序结果见图3,其259和261差异位点均显示为杂合峰,因此排除了该3份标本为B*15:01-B*15:25(纯合峰)和B*15:02-B*15:15(纯合峰)的可能性。
对于剩下2种可能(B*15:01-B*15:15和B*15:02-B*15:25),由于其测序结果在差异位点均显示为杂合峰(无差异),无法判断标本为哪一种基因型。因此又针对差异的259,261和353,355,369位点根据HLA-B*15:02序列设计一对序列特异性上、下游引物:F:5'-GAGTATTGGGACCG GCCGGAAC-3';R:5'-GCAGCCATACATCCTC TGGATGA-3'。等位基因型B*15:01、B*15:02、B*15:15、B*15:25在F、R覆盖区的差异位点见表2。
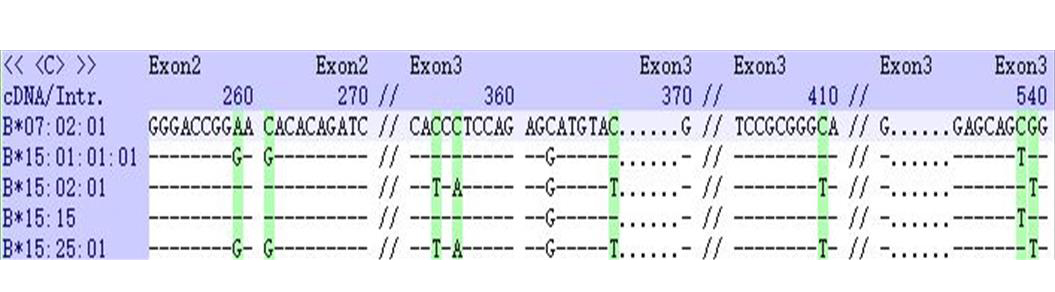
图2B*15:01、B*15:02、B*15:15、B*15:25差异位点
Fig. 2 The differences amongB*15:01,B*15:02,B*15:15andB*15:25
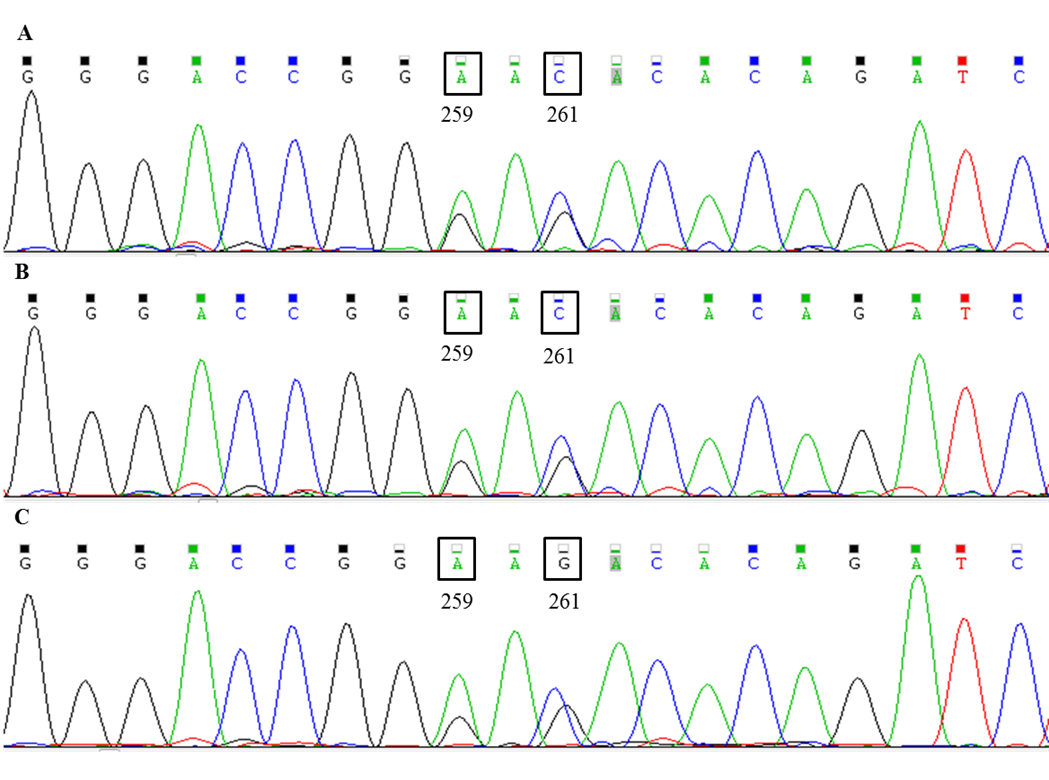
图3 3份B*15:VG-B*15:CYS标本的测序结果
Fig. 3 The sequencing results of threeB*15:VG-B*15:CYSsamples
表2B*15:01、B*15:02、B*15:15、B*15:25在Fa、Ra区域差异位点
Tab. 2 Different sites in Fa and Ra regions amongB*15:01,B*15:02,B*15:15,B*15:25

注:a带下划线的碱基代表与上下游引物错配的碱基;bR覆盖区的正链序列。
Note:aThe underlined basesdenote mismatchedsttes with primers;bsequence of positive strand covered by R.
找出在F、R覆盖区与B*15:01、B*15:02、B*15:15、B*15:25相同的纯合型标本,模拟B*15:01、B*15:02、B*15:15、B*15:25基因型模板,用F和R对该3份无明确分型信息的标本进行扩增,同时引入一对HBB的引物作为内控,PCR扩增之后对产物进行电泳,F、R的目的条带为417 bp,HBB基因的内控条带为360 bp。图4中泳道1为1 000 bp Marker;泳道2为空白对照;泳道3,4,5为3份B*15:VG-B*15:CYS标本;泳道6为HLA-B*15:01模拟模板;泳道7为HLA-B*15:02阳性对照模板;泳道8为HLA-B*15:15模拟模板;泳道9为HLA-B*15:25模拟模板。电泳结果显示,B*15:01、B*15:15和B*15:25基因型模板仅能扩增出一段360 bp的内控片段,而B*15:02阳性模板除了内控片段还能扩增出一段417 bp的HLA-B基因片段。由于3份无明确分型信息标本的电泳结果显示为与B*15:02阳性对照相同的2个条带,因此可以确定该3份标本的基因型不是B*15:01-B*15:15而是B*15:02-B*15:25,为HLA-B*15:02阳性,与MMCA法的检测结果一致。
因此,MMCA法的阳性检出率(77/77),阴性检出率(1 070/1 070)和总符合率(1 147/1 147)均为100%。此外,MMCA法在1 147份临床标本中共检出77份阳性结果,HLA-B*15:02的携带率为6.7%(77/1 147),与文献报道的数据[38]基本一致。
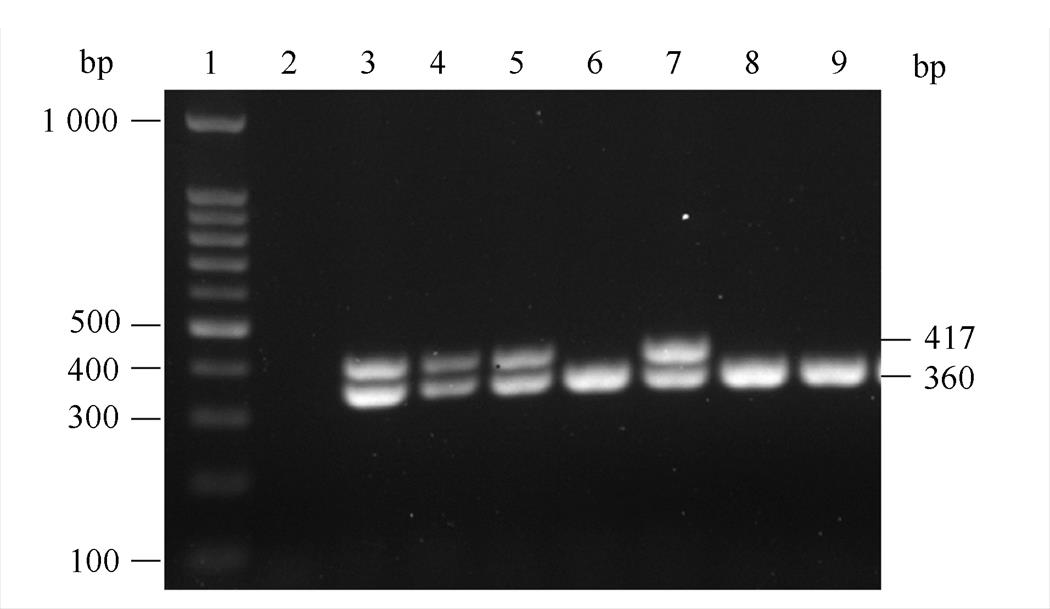
图4 3份B*15:VG-B*15:CYS标本的电泳结果
Fig. 4 The agarose gel electrophoresis results of threeB*15:VG-B*15:CYSsamples
临床药理学实施联盟(Clinical PharmacogeneticsImplementation Consortium,CPIC)针对携带HLA-B*15:02基因的患者发布了CBZ的用药指南:若患者出现不良反应,无论种族,都不应继续使用CBZ进行治疗;若患者服药3个月以上而未出现皮肤不良反应,CBZ可以被谨慎使用[17,39]。2013年4月,新加坡强烈建议在CBZ用药前进行HLA-B*15:02基因筛查,并将其列入医疗保健标准,政府对于患者有最高25%的补助。中国香港和台湾的地方行政部门也已经发布指令,规定患者在服用CBZ之前,必须进行HLA-B*15:02基因检测并对患者免费[14]。由此可见,HLA-B*15:02基因筛查对于预测CBZ不良反应、指导药物个体化治疗意义重大,香港、台湾、新加坡等地区相关政策的率先实施也预示了HLA-B*15:02基因检测项目在亚裔人群中推广的重要性和应用前景。
目前HLA-B*15:02的主要检测方法是PCR-SSP技术[40],但该方法存在明显缺陷。本研究通过MMCA法对1 147例外周血标本的HLA-B*15:02基因进行检测,经与HLA-SBT测序法比较,1 070份HLA-B*15:02阴性标本的检测结果相符,74份HLA-B*15:02阳性标本的检测结果相符,另有3份标本的检测结果有差异,这是由于HLA-SBT测序法的分辨率只有约90%,一些相似的基因型无法区分所致,经第三方对照方法验证确认,该3份标本为HLA-B*15:02阳性标本,与MMCA法的检测结果相同。
结果表明,MMCA法可实现对HLA-B*15:02基因的特异检测,并相较其他方法具有明显的优势:①检测快速简便、通量高。整个过程(包括基因组DNA提取、PCR扩增和熔解曲线分析)在4 h之内就能完成,且可一次性同时检测94份标本;②不易污染。全程闭管,可有效地避免PCR扩增产物的交叉污染;③方法可靠、结果易判读。结果的判读十分直观,通过读取熔解曲线的Tm值即可判断样本类型,各熔解峰Tm值的读数会由荧光PCR仪自带的软件自动给出,保证了检测结果的客观性和可靠性;④普及性强。由于荧光PCR仪在各实验室、医院和检验机构的普及,因此MMCA法相较其他的技术更适于临床的大规模推广。但MMCA法也存在一定的局限性,虽然可以将HLA-B*15:02与大多数其他HLA-B等位基因型区别开来,但是无法区分15:88,15:89,15:112,15:121,15:144,15:194,15:213,15:223,15:265等罕见基因型。通过在Allele Frequency Database (http://www.allelefrequencies.net/)中进行等位基因频率查询,得知15:88,15:89,15:112,15:121,15:144,15:194,15:213,15:223,15:265在全世界范围内都十分罕见(基因频率<0.1%),因此由其造成的假阳性影响可以忽略。
综上所述,MMCA法应用于HLA-B*15:02基因检测具有灵敏度高、特异性强等特点。该方法检测结果可靠、简便快捷、不易污染,检测通量高,检测成本较低,结果直观且易判定,可应用于CBZ不良反应相关的HLA-B*15:02基因的临床辅助检测。
REFERENCES
[1] NASSIF A, BENSUSSAN A, BOUMSELL L, et al. Toxic epidermal necrolysis: effector cells are drug-specific cytotoxic T cells [J]. J Allergy Clin Immunol, 2004, 114(5): 1209-1215.
[2] AUQUIER-DUNANT A, MOCKENHAUPT M, NALDI L, et al. Correlations between clinical patterns and causes of erythema multiforme majus, Stevens-Johnson syndrome, and toxic epidermal necrolysis: results of an international prospective study [J]. Arch Dermatol, 2002, 138(8): 1019-1024.
[3] HABER J, HOPMAN W, GOMEZ M, et al. Late outcomes in adult survivors of toxic epidermal necrolysis after treatment in a burn center [J]. J Burn Care Rehabil, 2005, 26(1): 33-41.
[4] ISVY-JOUBERT A, INGEN-HOUSZ-ORO S, VINCENT R, et al. Severe cutaneous adverse reactions to drugs: from patients to the national office for compensation of medical accidents [J]. Dermatology, 2014, 228(4): 338-343.
[5] ROUJEAU J C. The spectrum of Stevens-Johnson syndrome and toxic epidermal necrolysis: a clinical classification [J]. J Invest Dermatol, 1994, 102(6): 28S-30S.
[6] YANG C Y, DAO R L, LEE T J, et al. Severe cutaneous adverse reactions to antiepileptic drugs in Asians [J]. Neurology, 2011, 77(23): 2025-2033.
[7] KHOO A K, FOO C L. Toxic epidermal necrolysis in a burns centre: a 6-year review [J]. Burns, 1996, 22(4): 275-278.
[8] KAMALIAH M D, ZAINAL D, MOKHTAR N, et al. Erythema multiforme, Stevens-Johnson syndrome and toxic epidermal necrolysis in northeastern Malaysia [J]. Int J Dermatol, 1998, 37(7): 520-523.
[9] LOCHARERNKUL C, SHOTELERSUK V, HIRANKARN N. Pharmacogenetic screening of carbamazepine-induced severe cutaneous allergic reactions [J]. J Clin Neurosci, 2011, 18(10): 1289-1294.
[10] SOTOZONO C, ANG L P, KOIZUMI N, et al. New grading system for the evaluation of chronic ocular manifestations in patients with Stevens-Johnson syndrome [J]. Ophthalmology, 2007, 114(7): 1294-1302.
[11] LONJOU C, THOMAS L, BOROT N, et al. A marker for Stevens-Johnson syndrome | [hellip] | ethnicity matters [J]. Pharmacogenomics J, 2006, 6(4): 265-268.
[12] AMSTUTZ U, ROSS C , CASTRO-PASTRANA L I, et al.HLA-A 31:01andHLA-B 15:02as genetic markers for carbamazepine hypersensitivity in children [J]. Clin Pharmacol Ther, 2013, 94(1): 142-149.
[13] CHUNG W H, HUNG S I, HONG H S, et al. Medical genetics: a marker for Stevens-Johnson syndrome [J]. Nature, 2004, 428(6982): 486.
[14] THONG B Y. Stevens-Johnson syndrome/toxic epidermal necrolysis: an Asia-Pacific perspective [J]. Asia Pac Allergy, 2013, 3(4): 215-223.
[15] CUMMINS J M, RAGO C, KOHLI M, et al. Tumour suppression: disruption of HAUSP gene stabilizes p53 [J]. Nature, 2004, 428(6982): 1 p following 486.
[16] HUNG S I, CHUNG W H, LIU Z S, et al. Common risk allele in aromatic antiepileptic-drug induced Stevens-Johnson syndrome and toxic epidermal necrolysis in Han Chinese [J]. Pharmacogenomics, 2010, 11(3): 349-356.
[17] CHENG C Y, SU S C. HLA associations and clinical implications in T-cell mediated drug hypersensitivity reactions: an updated review [J]. 2014(2014): 565320. Doi: 10.1155/2014/565320.
[18] MIDDLETON D, HAWKINS B R, WILLIAMS F, et al. HLA class I allele distribution of a Hong Kong Chinese population based on high-resolution PCR-SSOP typing [J]. Tissue Antigens, 2004, 63(6): 555-561.
[19] HUNG S I, CHUNG W H, JEE S H, et al. Genetic susceptibility to carbamazepine-induced cutaneous adverse drug reactions [J]. Pharmacogenet Genomics, 2006, 16(4): 297-306.
[20] ZHANG Y, WANG J, ZHAO L M, et al. Strong association betweenHLA-B*1502and carbamazepine-induced Stevens- Johnson syndrome and toxic epidermal necrolysis in mainland Han Chinese patients [J]. Eur J Clin Pharmacol, 2011, 67(9): 885-887.
[21] WANG Q, ZHOU J Q, ZHOU L M, et al. Association betweenHLA-B*1502allele and carbamazepine-induced severe cutaneous adverse reactions in Han people of southern China mainland [J]. Seizure, 2011, 20(6): 446-448.
[22] MEHTA T Y, PRAJAPATI L M, MITTAL B, et al. Association ofHLA-B*1502allele and carbamazepine- induced Stevens-Johnson syndrome among Indians [J]. Indian J Dermatol Venereol Leprol, 2009, 75(6): 579-582.
[23] TASSANEEYAKUL W, TIAMKAO S, JANTARAROUNG- TONG T, et al. Association betweenHLA-B*1502and carbamazepine-induced severe cutaneous adverse drug reactions in a Thai population [J]. Epilepsia, 2010, 51(5): 926-930.
[24] CHANG C C, TOO C L, MURAD S, et al. Association ofHLA-B*1502allele with carbamazepine-induced toxic epidermal necrolysis and Stevens-Johnson syndrome in the multi-ethnic Malaysian population [J]. Int J Dermatol, 2011, 50(2): 221-224.
[25] FERRELL P B, MCLEOD H L. Carbamazepine,HLA-B*1502and risk of Stevens-Johnson syndrome and toxic epidermal necrolysis: US FDA recommendations [J]. Pharmacogenomics, 2008, 9(10): 1543-1546.
[26] PETERSDORF E W, HANSEN J A. A comprehensive approach for typing the alleles of the HLA-B locus by automated sequencing [J]. Tissue Antigens, 1995, 46(2): 73-85.
[27] CASAMITJANA N, FANER R, SANTAMARIA A, et al. Development of a new HLA-DRB real-time PCR typing method [J]. Hum Immunol, 2005, 66(1): 85-91.
[28] YANG G, DENG Y J, HU S N, et al. HLA-A, -B, and -DRB1 polymorphism defined by sequence-based typing of the Han population in Northern China [J]. Tissue Antigens, 2006, 67(2): 146-152.
[29] CASTELLI E C, GIL D S, VEIGA L C, et al. Typing class I HLA-A gene using a nested PCR-RFLP procedure [J]. Braz J Med Biol Res, 2005, 38(6): 837-842.
[30] MORIBE T, KANESHIGE T, INOKO H. Complete HLA-A DNA typing using the PCR-RFLP method combined with allele group- and sequence-specific amplification [J]. Tissue Antigens, 1997, 50(5): 535-545.
[31] RAMON D, BRADEN M, ADAMS S, et al. Pyrosequencing trade mark: A one-step method for high resolution HLA typing [J]. J Transl Med, 2003, 1(1): 9.
[32] PIETRAVALLE F, TKACZUK J, THOMSEN M, et al. Evaluation of HLA-DPB incompatibility by PCR-SSCP in the choice of a bone marrow donor [J]. Transplant Proc, 1994, 26(1): 238.
[33] TAMAKI J, ARIMURA Y, KODA T, et al. Heterogeneity of HLA-G genes identified by polymerase chain reaction/single strand conformational polymorphism(PCR/SSCP) [J]. Microbiol Immunol, 1993, 37(8): 633-640.
[34] SADLER A M, PETRONZELLI F, KRAUSA P, et al. Low-resolution DNA typing for HLA-B using sequence-specific primers in allele- or group-specific ARMS/PCR [J]. Tissue Antigens, 1994, 44(3): 148-154.
[35] YU N, OHASHI M, ALOSCO S, et al. Typing ofHLA-B*15alleles using sequence-specific primers [J]. Tissue Antigens, 1998, 52(3): 260-269.
[36] 傅茜, 曾文涛, 邓素雄, 等. 应用PCR-SSP和SSOP对HLA-I类进行基因分型[J]. 实用医学杂志, 2004, 20(11): 1249-1250.
[37] VIRAKUL S, KUPATAWINTU P, NAKKUNTOD J, et al. A nested sequence-specific primer-polymerase chain reaction for the detection ofHLA-B*15:02[J]. Tissue Antigens, 2012, 79(4): 295-301.
[38] WEI C Y, KO T M, SHEN C Y, et al. A recent update of pharmacogenomics in drug-induced severe skin reactions [J]. Drug Metab Pharmacokinet, 2012, 27(1): 132-141.
[39] LECKBAND S G, KELSOE J R, DUNNENBERGER H M, et al. Clinical Pharmacogenetics Implementation Consortium guidelines forHLA-Bgenotype and carbamazepine dosing [J]. Clin Pharmacol Ther, 2013, 94(3): 324-328.
[40] WANG L B, MENG L. Monitoring the safety of carbamazepine by loop mediated isothermal amplification [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2014, 31(5): 574-577.
Clinical Evaluation of Multicolor Melting Curve Analysis for Detecting Gene Related to Carbamazepine-induced Adverse Drug Reactions
PEI Bin1, GUO Xiaotong2, RAN Peng1, HUANG Qiuying2, HONG Suyun1, ZHONG Xueting2, LI Qingge2*
(1.Xiamen Blood Center, Xiamen 361004, China; 2.School of Life Sciences, Xiamen University, Xiamen 361102, China)
ABSTRACT:OBJECTIVETo evaluate the effect of multicolor melting curve analysis(MMCA) for detectingHLA-B*15:02gene related to carbamazepine-induced adverse drug reactions.METHODSA blind test of 1 147 peripheral blood samples collected from Xiamen Blood Center was performed to validate the agreement between MMCA assay and HLA-SBT assay. Sanger sequencing and electrophoresis were used to confirm inconsistent results of two methods, the agreement for all methods was validated.RESULTSIn this study, 77 cases were identified as positive samples and 1 070 cases were identified as negative samples by MMCA assay. For HLA-SBT assay, 74HLA-B*15:02positive samples, 1 070 negative samples and 3 uncertain samples(only showedB*15:VG-B*15:CYS) were detected. Three uncertain samples were confiremed to beHLA-B*15:02positive samples by Sanger sequencing and electrophoresis. Therefore, the positive agreement, negative agreement and total agreement ofHLA-B*15:02gene detection by MMCA assay were 100%(77/77), 100%(1 070/1 070) and 100% (1 147/1 147). The percentage of positive samples was 6.7%(77/1 147) which was reasonable compared to previous reports.CONCLUSIONMMCA assay is a convenient and rapid method with high sensitivity and excellent specificity, and promises to be a powerful tool for the clinical diagnosis ofHLA-B*15:02gene.
KEY WORDS:carbamazepine; gene detection; multicolor melting curve analysis;HLA-B*15:02; adverse reaction
中图分类号:R969.1
文献标志码:B
文章编号:1007-7693(2018)09-1393-07
DOI:10.13748/j.cnki.issn1007-7693.2018.09.027
引用本文:裴斌, 郭晓彤, 冉鹏, 等. 多色探针熔解曲线法在卡马西平不良反应相关基因检测中的临床评价[J]. 中国现代应用药学, 2018, 35(9): 1393-1399.
收稿日期:2017-11-28
作者简介:裴斌,男,硕士,副主任技师 Tel: (0592)2292756 E-mail: peibin@139.com
*通信作者:李庆阁,男,教授,博导 Tel: (0592)2182100 E-mail: qgli@xmu.edu.cn
(本文责编:李艳芳)