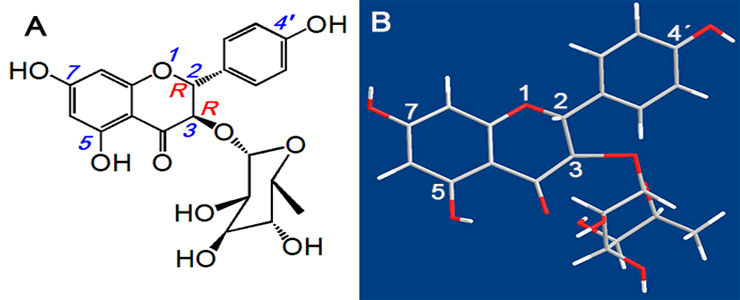
图1 黄杞苷的结构式(A)和棍状模型(B)
Fig. 1 The structure (A) and stick model (B) of engeletin
谢雨露,黄毓珧,李熙灿*
(广州中医药大学中药学院,广州 510006)
摘要:目的研究黄杞苷保护DNA氧化损伤的活性与可能机制。方法采用DNA保护分析法、超氧自由基(·O2-)清除法、Ferrozine显色法,探讨其保护DNA氧化损伤的活性与可能机制,并通过紫外可见光谱(UV-vis spectra)考察其与Fe2+络合的变化。结果在DNA保护分析法、·O2-自由基清除法、Ferrozine显色法中,黄杞苷在一定浓度范围内,表现出浓度依赖性。其IC50值分别(60.3±9.9),(44.5±7.6),(159.7±19.9)μg·mL-1。UV-vis光谱分析表明,黄杞苷与Fe2+混合后,在波长475 nm处出现新的峰,摩尔消光系数为102.5 L·mol-1·cm-1。结论黄杞苷能较好地保护DNA,免受羟基自由基(·OH)诱导的氧化损伤。其保护作用由直接清除ROS和间接清除ROS 2个途径实现。黄杞苷直接清除ROS,可能与氢转移和电子转移有关;间接清除ROS可能通过络合Fe2+的方式,阻断·OH自由基生成。不过,受3-位鼠李糖基的空间位阻影响,其Fe2+络合能力较弱。
关键词:黄杞苷;自由基;DNA氧化;Fe2+络合;机制
DNA氧化损伤可以导致细胞(尤其是干细胞)的氧化应激[1],引发基因突变、癌变,以及神经退行性病变[2-3]。DNA氧化损伤是由活性氧簇(reactive oxygen species,ROS)进攻DNA的碱基或脱氧核糖骨架而引起的。ROS的典型代表,是具有极强攻击力的羟基自由基(·OH)。如果·OH自由基进攻DNA中的鸟嘌呤碱基,则生成鸟嘌呤碱基自由基(如2’-deoxyadenosine-5’-monophosphate radical,dAMP)[2],进一步生成8-羟基-2’-脱氧鸟嘌呤核苷(8-hydroxy-2’-deoxyguanosine,8-OHdG)。所以,检测血液或尿液中的8-OHdG水平,可用于糖尿病、动脉粥样硬化和肿瘤等多种疾病的风险评估[4]。如果·OH自由基进攻脱氧核糖骨架,则可以生成丙二醛(malondialdehyde,MDA)等产物[2-3]。
无论是dAMP·自由基、8-OHdG、还是MDA,都是细胞氧化应激的毒性产物。因此,寻找合适的抗氧化剂使DNA免受氧化损伤,减少这些毒物的产生,成为自由基生物医学的一项重要研究内容。而从具有数千年历史的中药中,挖掘天然抗氧化剂,更引发了相关学者的浓厚兴趣。
笔者的前期研究表明,中药的天然抗氧化成分主要是多酚。虽然多糖也有一定的效果,但远逊于多酚[5]。中药多酚有黄酮及黄酮苷[2,6-7]、类黄酮[8]、酚酸及其酯[9]、双黄酮[10]、挥发酚[3]、咖啡酰奎宁酸[11]等。其中以黄酮及黄酮苷最常见。
黄杞苷实际上是二氢山柰酚的鼠李糖苷,它是中药黄杞(Engelhardia roxburghianaWall.)的主要成分之一[12-13],结构见图1。目前,已有一些零星的报道,提示黄杞苷具有抗氧化活性[14-15]。不过,专门针对抗氧化活性评价及机制探讨的研究,尚未见报道。
本研究拟通过DNA保护分析法、超氧自由基(·O2-)清除法和金属离子络合法,测定黄杞苷对DNA氧化损伤的保护作用,并进一步探讨其可能机制。

图1 黄杞苷的结构式(A)和棍状模型(B)
Fig. 1 The structure (A) and stick model (B) of engeletin
UV2100可见分光光度计(上海尤尼柯仪器有限公司);BS110S电子天平(北京赛多利斯天平有限公司);TDL80-2B台式离心机(上海安亭科学仪器厂);SB3200D超声波清洗机(宁波新芝生物科技股份有限公司);pH计(YSI)。
黄杞苷(CAS:572-31-6;四川省维克奇生物科技有限公司,批号:20150709A;纯度:98%);Ferrozine(CAS:69898-45-9;批号:SLBP4832V;纯度:98%)、Trolox(CAS:53188-07-1;批号:BCBL1374V;纯度:97%)均购自Sigma公司;鱼精DNA钠盐(CAS:100403-24-5;批号:0042C387)均购自美国Amresco公司;KH2PO4(AR)、Na2HPO4·12H2O、Na2EDTA、FeCl3·6H2O、FeCl2·4H2O、30%H2O2、抗坏血酸、柠檬酸钠(AR,广州化学试剂厂);三氯乙酸(AR,天津市大茂化学试剂厂);2-硫代巴比妥酸(AR,齐云生物科技有限公司);乙醇、甲醇均为分析纯。
·OH自由基是人体在新陈代谢过程中产生的对生物体毒性最强、危害最大的1种自由基,具有很强的氧化性[6],可损伤DNA等生物分子。而本实验以DNA为底物,探讨黄杞苷对·OH自由基诱导的DNA损伤的保护作用[2]。取黄杞苷溶液(2.0 mg·mL-1)xmL(x=12,24,36,48,60,72)于离心管中,置于60 ℃水浴锅挥干溶剂,往离心管加入350 µL磷酸盐缓冲液(0.2 mol·L-1,pH 7.4)、25 µL Na2EDTA溶液(80 µmol·L-1)、3 µL FeCl3·6H2O溶液(25 µmol·L-1)、3 µL H2O2溶液(2.8 mmol·L-1)、25 µL鱼精DNA钠盐(2.8 mmol·L-1),超声5 min,加入3 µL抗坏血酸溶液(0.1 mmol·L-1),置于50 ℃水浴锅加热20 min后,再加入250 µL三氯乙酸溶液和250 µL 2-硫代巴比妥酸溶液,置于115 ℃烘20 min,在532 nm下测定A值。实验以Trolox (2.0 mg·mL-1)为阳性对照,平行测定3次取平均值。清除率计算公式为:
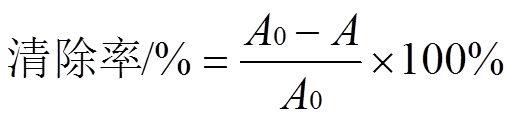
其中A0为未加样品时的吸光度;A为加入样品反应后的吸光度。
·O2-自由基是带负电的氧分子,2个氧以单键相连,具有很强的氧化性。本实验用连苯三酚自氧化法产生·O2-自由基[16]。取490 μL Tris-HCL缓冲液(0.1 mol·L-1,pH 7.4)放入比色皿,加入10 μL连苯三酚(60 mmol·L-1,含1 mmol·L-1盐酸),迅速混合(颠覆式),每隔30 s读数1次,至300 s时为止,此时的ΔA=ΔA0(ΔA=A325 nm,300 s-A325 nm,30 s)。另取黄杞苷溶液(0.5 mg·mL-1)xmL(x=12,24,36,48,60,150)加入比色皿中,加(490-x)μL Tris-HCl缓冲液,再加10 μL连苯三酚溶液,迅速混合(颠覆式),开始计时,每隔30 s测量1次,至300 s时为止。此时的ΔA=ΔA样。实验以Trolox(0.5 mg·mL-1)为阳性对照,平行测定3次取平均值。清除率计算公式[17]:
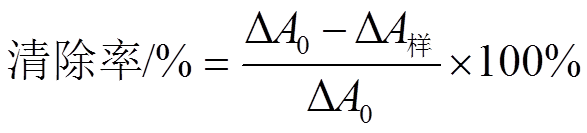
黄杞苷的Fe2+络合能力依据文献报道进行测定[11]。在FeCl2·4H2O(250 μmol·L-1)溶液中加入150 μL甲醇充分混合,置于37 ℃水浴锅水浴加热30 min后,依次加入37 μL甲醇、38 μL Ferrozine溶液(500 μmol·L-1),静置5 min,测A值(562 nm),此A值为A0值。取黄杞苷溶液(1 mg·mL-1)xmL(x=30,60,90,120,150),再加(150-x)μL甲醇、25 μL FeCl2溶液,充分混合,置于37 ℃水浴锅水浴加热30 min后,依次加入37 μL甲醇、38 μL Ferrozine溶液,静置5 min,测A值(562 nm)。实验以柠檬酸钠(1 mg·mL-1)为阳性对照,平行测定3次取平均值。计算公式:
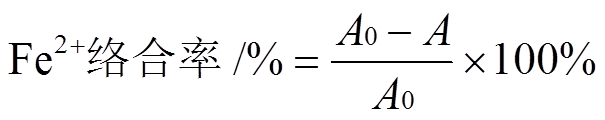
其中A0为未加样品时的吸光度;A为加入样品反应后的吸光度。
取100 μL黄杞苷(1 mg·mL-1)和100 μL的FeCl2·4H2O(10 mg·mL-1)溶液加入液相瓶中,加甲醇至1 mL。溶液充分混合后倒入比色皿,放入紫外分光光度计进行扫描,每10 min扫描1次,扫描范围是200~800 nm。1 h后放入96孔板观察颜色的变化[18]。
通过线性回归分析来计算IC50值。线性相关系数用Origin 6.0软件经线性拟合(Fit Linear)分析而得。测定样品平均IC50值的显著性用SPSS 13.0单因素方差分析的t检验。以P<0.05为差异具有统计学意义。
在保护DNA实验中,黄杞苷在一定浓度范围内,随着样品浓度的增加,保护能力相应增加,结果见图2,表1。说明黄杞苷对·OH引起的DNA损伤有保护作用。在清除·O2-自由基实验中,黄杞苷的清除能力呈现出剂量依赖性且是Trolox的4.6倍,说明黄杞苷清除·O2-自由基的能力很强。由O2+e-→·O2-,·O2-+e-→H2O2反应式可知,清除·O2-的同时间接清除了·OH,黄杞苷是清除·OH的天然抗氧化剂,也表明黄杞苷在体外有直接清除ROS的能力[10]。
由以上结果知黄杞苷清除ROS的能力很强,笔者推测与其结构上的羟基数量和位置有关[19],由图1知黄杞苷在5位、4’位和7位都有酚羟基。进一步推测,黄杞苷可能通过酚羟基与自由基反应,生成稳定的半醌自由基,从而中断链式反应。
如图3所示,Fe2+溶液和黄杞苷与二者的反应液做对比,在波长475 nm出现新的峰,反应液的颜色由无色变为淡粉色,推测黄杞苷与Fe2+发生了络合,反应液颜色比较浅,可能是黄杞苷只有4-羰基- 5-羟基的结合位点。据此,笔者推测其络合反应见图4[20]。
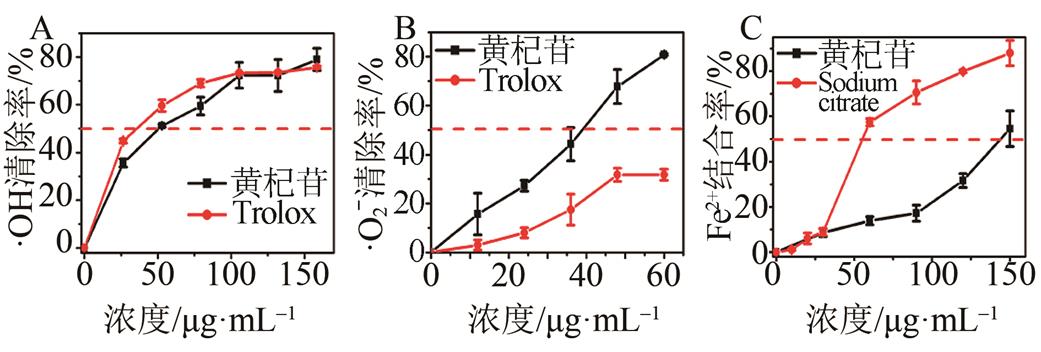
图2 黄杞苷对自由基的清除作用与络合Fe2+能力(n=3,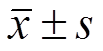 )
)
A-·OH自由基清除试验;B-·O2-自由基清除试验;C-Fe2+络合试验。
Fig. 2 Scavenging effect on free radicals and the ability to combine Fe2+of engeletin (n=3, )
)
A-·OH-scavenging assay; B-·O2--scavenging assay; C-Fe2+-binding assay.
表1 黄杞苷与阳性对照(Trolox)的IC50值
Tab. 1 The IC50values of engeletin and Trolox in various antioxidant assays

注:与Trolox相比,1)P<0.05;与柠檬酸钠相比,1)P<0.05。
Note: Compared with Trolox,1)P<0.05; compared with sodium citrate,2)P<0.05.
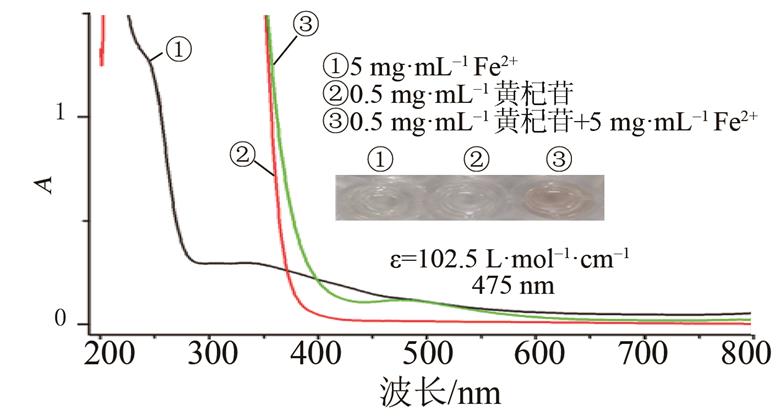
图3 黄杞苷与Fe2+的UV扫描图
Fig. 3 UV spectra of engeletin and Fe2+
黄杞苷有一定的金属络合能力,其Fe2+络合的位点在4-羰基-5-羟基之间。不过,其Fe2+络合能力比柠檬酸钠弱(表1,图2C)。这可能是受3-位鼠李糖基的空间位阻所致。
黄杞苷直接清除ROS的机制可能发生了氢转移和电子转移[21]。Fe2+络合的机制可能是黄杞苷的4-羰基-5-羟基结构与金属离子能形成稳定的五元环或六元环[22]。在H2O2通过Fenton反应变成·OH的过程中,Fe2+就是反应物之一,黄杞苷能与Fe2+络合间接阻断生成·OH,从而达到间接清除活性氧的效果。
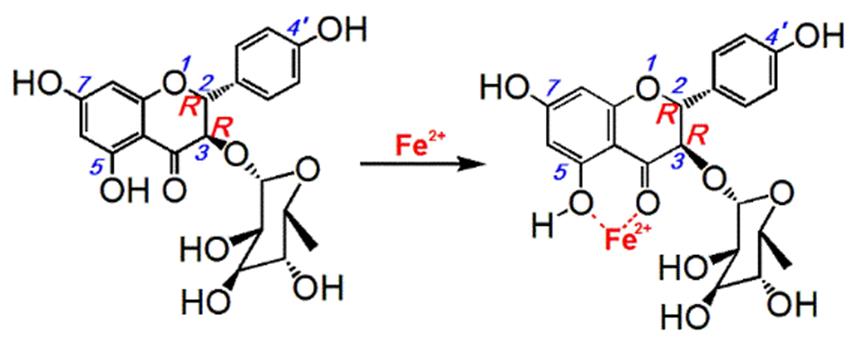
图4 黄杞苷与铁反应的可能结合位点
Fig. 4 Proposed reaction of engeletin binding to Fe2+
黄杞苷有较强的保护DNA氧化损伤的能力。黄杞苷保护DNA氧化损伤的能力是由直接清除ROS和间接清除ROS(即Fe2+络合)来实现的,其Fe2+络合的位点在4-羰基-5-羟基之间。受3-位鼠李糖基的空间位阻影响,黄杞苷的Fe2+络合能力较弱。
REFERENCES
[1] WANG T T, ZENG G C, LI X C, et al.In vitrostudies on the antioxidant and protective effect of 2-substituted-8- hydroxyquinoline derivatives against H2O2-Induced oxidative stress in BMSCs [J]. Chem Biol Drug Des, 2010, 75(2): 214-222.
[2] LI X, MAI W Q, CHEN D F. Chemical study on protective effect against hydroxyl-induced DNA damage and antioxidant mechanism of myricitrin [J]. J Chin Chem Soc, 2014, 61(3): 383-390.
[3] LIN J, LI X C, CHEN L, et al. Protective effect against hydroxyl radical-induced DNA damage and antioxidant mechanism of [6]-gingerol: A Chemical Study [J]. Bull Korean Chem Soc, 2014, 35(6): 1633-1638.
[4] MARTINS G V, TAVARES A P M, FORTUNATO E, et al. Paper-based sensing device for electrochemical detection of oxidative stress biomarker 8-hydroxy-2'-deoxyguanosine (8-OHdG) in point-of-care [J]. Sci Rep, 2017, 7(1): 14558.
[5] LI X C, CHEN D F, MAI Y, et al. Concordance between antioxidant activitiesin vitroand chemical components of Radix Astragali (Huangqi) [J]. Nat Prod Res, 2012, 26(11): 1050-1053.
[6] LI X C, LIU J J, LIN J, et al. Protective effects of dihydromyricetin against ·OH-induced mesenchymal stem cells damage and mechanistic chemistry [J]. Molecules, 2016, 21(5): E604.
[7] LI X, JIANG Q, WANG T T, et al. Comparison of the antioxidant effects of quercitrin and isoquercitrin: understanding the role of the 6’-OH group [J]. Molecules, 2016, 21(9): E1246.
[8] LI X C, GAO Y X, LI F, et al. Maclurin protects against hydroxyl radical-induced damages to mesenchymal stem cells: antioxidant evaluation and mechanistic insight [J]. Chem Biol Interact, 2014(219): 221-228.
[9] LI X C, HU Q P, JIANG S X, et al. Flos Chrysanthemi Indici protects against hydroxyl-induced damages to DNA and MSCs via antioxidant mechanism: a chemistry study [J]. J Saudi Chem Soc, 2015, 19(4): 454-460.
[10] LI X, HAN W J, MAI W Q, et al. Antioxidant activity and mechanism of tetrahydroamentoflavonein vitro[J]. Nat Prod Comm, 2013, 8(6): 787-789.
[11] JIANG Q, LI X C, TIAN Y G, et al. Lyophilized aqueous extracts of Mori Fructus and Mori Ramulus protect mesenchymal stem cells from •OH-treated damage: bioassay and antioxidant mechanism [J]. BMC Complement Altern Med, 2017, 17(1): 242.
[12] GONG J Q, JIANG C X, CHEN X, et al.Studies on flavonoids from the leaves of engelhardia roxburghiana [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2015, 32(7): 813-817.
[13] ZHENG Y J, SHAN Q, ZHOU F J, et al. Optimization of extraction and purification technology of total flavonoids from engelhardia roxburghi-ana and content determination of 3 kinds of effective components [J]. China Pharm(中国药房), 2016, 25 (27): 3545-3548.
[14] 罗丹. 菝葜抗炎有效部位群的活性成分及其作用机制研究 [D]. 武汉: 湖北中医药大学, 2016.
[15] 张慧荣. 土茯苓、红土茯苓活性成分的分析、分离及活性测定研究[D]. 长春: 长春师范大学, 2014.
[16] LI X C. Improved pyrogallol autoxidation method: a reliable and cheap superoxide-scavenging assay suitable for all antioxidants [J]. J Agric Food Chem, 2012, 60(25): 6418-6424.
[17] WANG G R, LI X C, ZENG H P. Synthesis, antioxidation activity of (E)-9-p-Tolyl-3-[2-(8-hydroxy-quinol-2-yl)vinyl]-carbazole and (E)-9-(p-Anisyl)-3-[2-(8-hydroxy-quinol-2-yl)vinyl]-carbazole and their induction proliferation of mesenchymal stem cells [J]. Act Chim Sin(化学学报), 2009, 67(9): 974-982.
[18] MLADĚNKA P, MACÁKOVÁ K, FILIPSKÝ T, et al.In vitroanalysis of iron chelating activity of flavonoids [J]. J Inorg Biochem, 2011, 105(5): 693-701.
[19] WANG C J, WU R, JIN Y. Theoretieal study on the effect of different substituted radicles on antioxidant activity of phenolic hydroxyl group [J]. J Wenzhou Med Coll(温州医科大学学报), 2007, 37(5): 440-444.
[20] LIU J J, LI X C, LIN J, et al. Sarcandra glabra (Caoshanhu) protects mesenchymal stem cells from oxidative stress: a bioevaluation and mechanistic chemistry [J]. BMC Complement Altern Med, 2016(16): 423.
[21] LI X, HAN L, LI Y R, ZHANG J, et al. Protective effect of sinapine against hydroxyl radical-induced damage to mesenchymal stem cells and possible mechanisms [J]. Chem Pharm Bull, 2016, 64(4): 319-325.
[22] NATHAN R, PERRON, JULIA L, et al. A review of the antioxidant mechanisms of polyphenol compounds related to iron chelating [J]. Cell Biochem Biophys, 2009, 53(2): 75-100.
Protection Effect of Engeletin Towards DNA Against Oxidative Damage and Its Possible Mechanisms
XIE Yulu, HUANG Yuyao, LI Xican*
(School of Pharmaceutical Sciences, Guangzhou University of Chinese Medicine, Guangzhou 510006, China)
ABSTRACT:OBJECTIVETo study engeletin’s protective effect towards DNA against oxidative damagein vitro,and further to explore the possible mechanisms.METHODSProtective effect of engeletin was measured using DNA protection assay, ·O2--scavenging assay, and Fe2+-binding colorimetry assay. Its Fe2+-binding were also analyzed by UV-vis spectra.RESULTSIn the DNA protection assay, ·O2--scavenging assay, and Fe2+-binding colorimetry assay, engeletin increased the percentages dose-dependently, and the IC50values were (60.3±9.9), (44.5±7.6), (159.7±19.9) μg·mL-1, respectively. When engeletin mixed with Fe2+, there was a new peak at 475 nm with molar extinction coefficient 102.5 L·mol-1·cm-1in UV-vis spectra.CONCLUSIONEngeletin can effectively protect DNA from oxidative damage induced by ·OH. The protective effect may be fulfilled through direct ROS-scavenging which is via electron-transfer (ET) and H+-transfer (HAT) pathways, and indirectpathway (i.e. Fe2+-binding to blocking ·OH-production). However, its Fe2+-binding reaction is sterically hindered by the huge rhamnose residue at 3-position.
KEY WORDS:engeletin; free radical; DNA oxidative damage; Fe2+-binding; mechanism
中图分类号:R285.5
文献标志码:A
文章编号:1007-7693(2018)09-1333-04
DOI:10.13748/j.cnki.issn1007-7693.2018.09.014
引用本文:谢雨露, 黄毓珧, 李熙灿. 黄杞苷保护DNA氧化损伤的活性及其可能机制[J]. 中国现代应用药学, 2018, 35(9): 1333-1336.
收稿日期:2017-11-21
基金项目:国家自然科学基金项目(81573558);广东省科技计划项目(2017A050506043)
作者简介:谢雨露,女,硕士生 Tel: 15521418607 E-mail: xieyulu1900@163.com
*通信作者:李熙灿,男,博导 Tel: 13725245780 E-mail: lixican@126.com
(本文责编:李艳芳)