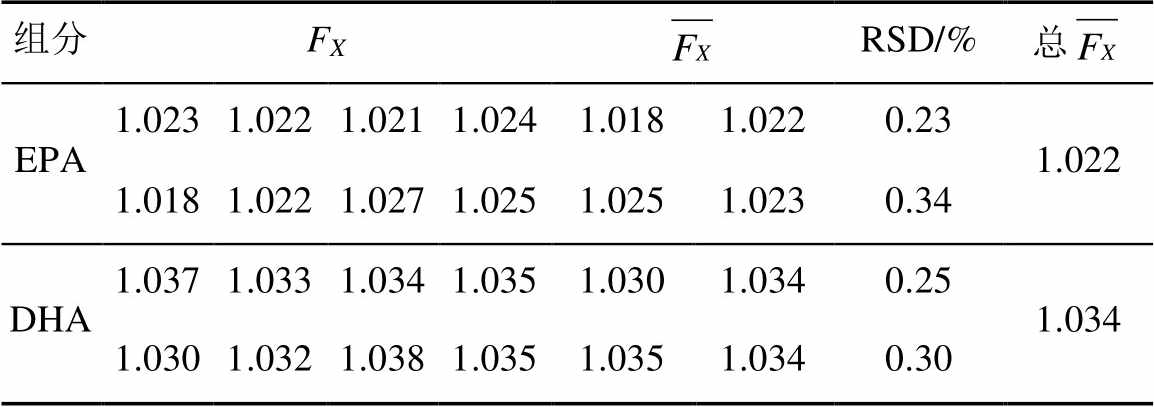
表1 相对校正因子测定结果
Tab. 1 Results of relative correction factor
王琼芬1,刘婷1,郑平安2,徐虹1
(1.舟山市食品药品检验检测研究院,浙江 定海 316021;2.海力生集团有限公司,浙江 定海 316021)
摘要:目的建立加校正因子GC内标法测定鱼肝油中EPA和DHA含量。方法样品经皂化、甲酯化、异辛烷提取,采用DB-23(30 m×0.25 mm,0.25 µm)毛细管柱,FID检测器,程序升温(起始温度170 ℃,以1 ℃·min-1的速率升温至225 ℃,保持5 min),进样口温度为250 ℃,检测器温度为280 ℃,高纯N2为载气,流速为1.0 mL·min-1,分流比为100∶1,二十三烷酸(C23∶0)甲酯为内标物。结果EPA、DHA的峰面积比和浓度比分别在0.048 7~9.740 mg·mL-1,0.051 0~ 10.206 mg·mL-1内呈良好的线性关系(r=1.000 0),EPA、DHA的平均回收率分别为98.7%(RSD=0.98%),99.4%(RSD= 1.34%)。结论该方法简便、准确、重复性好,可用于鱼肝油的质量控制和掺假鉴定。
关键词:鱼肝油;EPA;DHA;气相色谱法;相对校正因子;内标法;含量测定
鱼肝油是从鱼类肝脏提取出的主要含有维生素A、D及多种脂肪酸等天然化合物的脂肪油,各国药典均有收载[1-4]。鱼肝油中含有20多种脂肪酸,其中二十碳五烯酸(EPA)、二十二碳六烯酸(DHA)为其特有脂肪酸。EPA和DHA属ω-3多不饱和脂肪酸,陆地上的动植物体内几乎没有,在鱼类肝脏中含量很高。EPA、DHA是人体不可缺少的重要营养素,具有多种生理功效,如降血脂、血压和胆固醇,预防动脉硬化,减少血栓形成,预防心脑血管疾病等。DHA除上述功效外,还能通过血脑屏障,进入大脑,作用于神经系统,具有保护视网膜、改善视力、促进婴幼儿智力发育、提高记忆力等作用[5]。国内外药典均未收载鱼肝油中EPA、DHA含量测定方法,文献也未见报道。欧美药典鱼肝油品种项下仅收载脂肪酸组成测定,中国药典和日本药局方未收载该项目。欧美药典收载的鱼肝油脂肪酸组成测定方法中,供试品制备采用氢氧化钠甲醇皂化,三氟化硼甲醇甲酯化进行柱前衍生化处理,再经异辛烷提取,按GC面积归一化法对15种主要脂肪酸的占比进行分析。衍生化反应中甲酯化是影响结果的关键,查阅有关鱼油食品的EPA和DHA含量测定文献和有关标准,脂肪酸甲酯化方法有氢氧化钾酯交换法[6-8]、盐酸甲酯化法[9-10]、三氟化硼甲酯化法[11-14]和硫酸甲酯化法[15]。本研究参考上述文献,对欧美药典的鱼肝油脂肪酸测定方法进行改进,用5%硫酸甲醇溶液替代14%三氟化硼甲醇溶液,三氟化硼为毒性试剂,腐蚀性强,易燃易爆。并对GC检测方法和衍生化反应条件进行优化,建立加校正因子GC内标法快速测定鱼肝油中EPA和DHA含量,该法具有简便,准确,安全,环保,检测成本低的优点。
Agilent 7890A气相色谱仪(美国Agilent公司);CPA 225D分析天平(德国Sartorius公司);DTK-200干式恒温器(杭州米欧仪器有限公司); MS 3圆周振荡器(德国IKA公司)。
异辛烷、甲醇(色谱纯,J.T.Baker公司);氢氧化钠、硫酸、无水硫酸钠(分析纯,国药集团化学试剂有限公司);EPA甲酯(批号:E6540099)、DHA甲酯(批号:I2920075)、EPA(批号:H0660050)、DHA(批号:I2950035)均由上海安谱实验科技有限公司提供,纯度均≥99.0%;二十三烷酸(C23∶0)甲酯(Sigma公司,批号:BCBV4775;纯度≥99.0%);鳕鱼肝油(批号:170411,170420,170508)、鲨鱼肝油(批号:170109,170518,170524)均由海力生集团有限公司提供。
色谱柱:DB-23毛细管柱(30 m×0.25 mm,0.25 µm);程序升温:起始温度为170 ℃,以1 ℃·min-1的速率升温至225 ℃并保持5 min;进样口温度:250 ℃;检测器温度:280 ℃;载气:高纯N2,流速1.0 mL·min-1;进样量:1 µL;进样方式:分流进样,分流比:100∶1。
2.2.1 混合对照品溶液制备 精密称取C23∶0甲酯、EPA甲酯和DHA甲酯对照品各50 mg置10 mL棕色量瓶中,加异辛烷溶解并稀释至刻度,摇匀,即得,平行制备2份。
2.2.2 内标溶液制备 精密称取C23∶0甲酯对照品250 mg置50 mL棕色量瓶中,加异辛烷溶解并稀释至刻度,摇匀,即得。
2.2.3 混合对照储备液制备 精密称取EPA甲酯和DHA甲酯对照品各400 mg置20 mL棕色量瓶中,加异辛烷溶解并稀释至刻度,摇匀,制成混合对照储备液。
2.2.4 供试品溶液制备 精密称取供试品100 mg置20 mL带螺口反应瓶中,加1.5 mL 2%氢氧化钠甲醇溶液,旋紧瓶盖,漩涡混合30 s,置90 ℃恒温器中加热20 min,冷却。加2 mL 5%硫酸甲醇溶液,旋紧瓶盖,漩涡混合30 s,置100 ℃恒温器中加热10 min,冷却。精密加入2 mL内标溶液,旋紧瓶盖,漩涡混合1 min,立即加5 mL饱和氯化钠溶液,轻轻振摇,静置分层。吸取上清液转移至装有少量无水硫酸钠的试管中,振摇脱水,即得。
取混合对照品溶液,按“2.1”项下色谱条件进样,2份溶液各分别连续进样5针,记录峰面积并计算相对校正因子(FX),结果见表1。
表1 相对校正因子测定结果
Tab. 1 Results of relative correction factor

注:计算公式: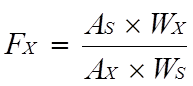
AX-EPA甲酯或DHA甲酯峰面积;AS-C23∶0甲酯峰面积;WS-C23∶0甲酯加入量(mg);WX-EPA甲酯或DHA甲酯加入量(mg)。
Note: Calculation formula: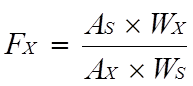
AX-peak area of EPA methyl ester or DHA methyl ester;AS-Peak area of C23∶0 methyl ester;WS-C23∶0 methyl ester addition(mg);WX-EPA methyl ester or DHA methyl ester addition(mg).
按“2.2.4”项下方法,称取样品2份,一份在甲酯化反应后溶液中加2 mL异辛烷,另一份加2 mL内标溶液,按“2.1”项下色谱条件进样,记录色谱图,结果显示供试品色谱图中在与内标物质相同的保留时间处未发现干扰峰。C23∶0、EPA、DHA甲酯峰与左右相邻峰之间的分离度均>1.5,三者之间的分离度均>15,表明该方法专属性良好。色谱图见图1。
精密吸取混合对照储备液0.05,0.5,1.0,2.0,5.0,10 mL至20 mL量瓶中,加2 mL内标溶液,加异辛烷稀释至刻度,制成EPA浓度分别为0.048 7,0.487,0.974,1.948,4.870,9.740 mg·mL-1;DHA浓度分别为0.051 0,0.510,1.021,2.041,5.103,10.206 mg·mL-1的系列溶液。按“2.1”项下色谱条件进样,记录峰面积,以EPA、DHA甲酯浓度/内标浓度比值为横坐标(X),EPA、DHA甲酯峰面积/内标峰面积比值为纵坐标(Y),绘制标准曲线,计算回归方程。EPA甲酯回归方程为Y=0.971 7X+0.001 8,r=1.000 0;DHA甲酯回归方程为Y=0.962 9X+0.000 8,r=1.000 0。结果表明EPA、DHA在0.048 7~9.740 mg·mL-1,0.051 0~ 10.206 mg·mL-1内,峰面积比和浓度比呈良好的线性关系。
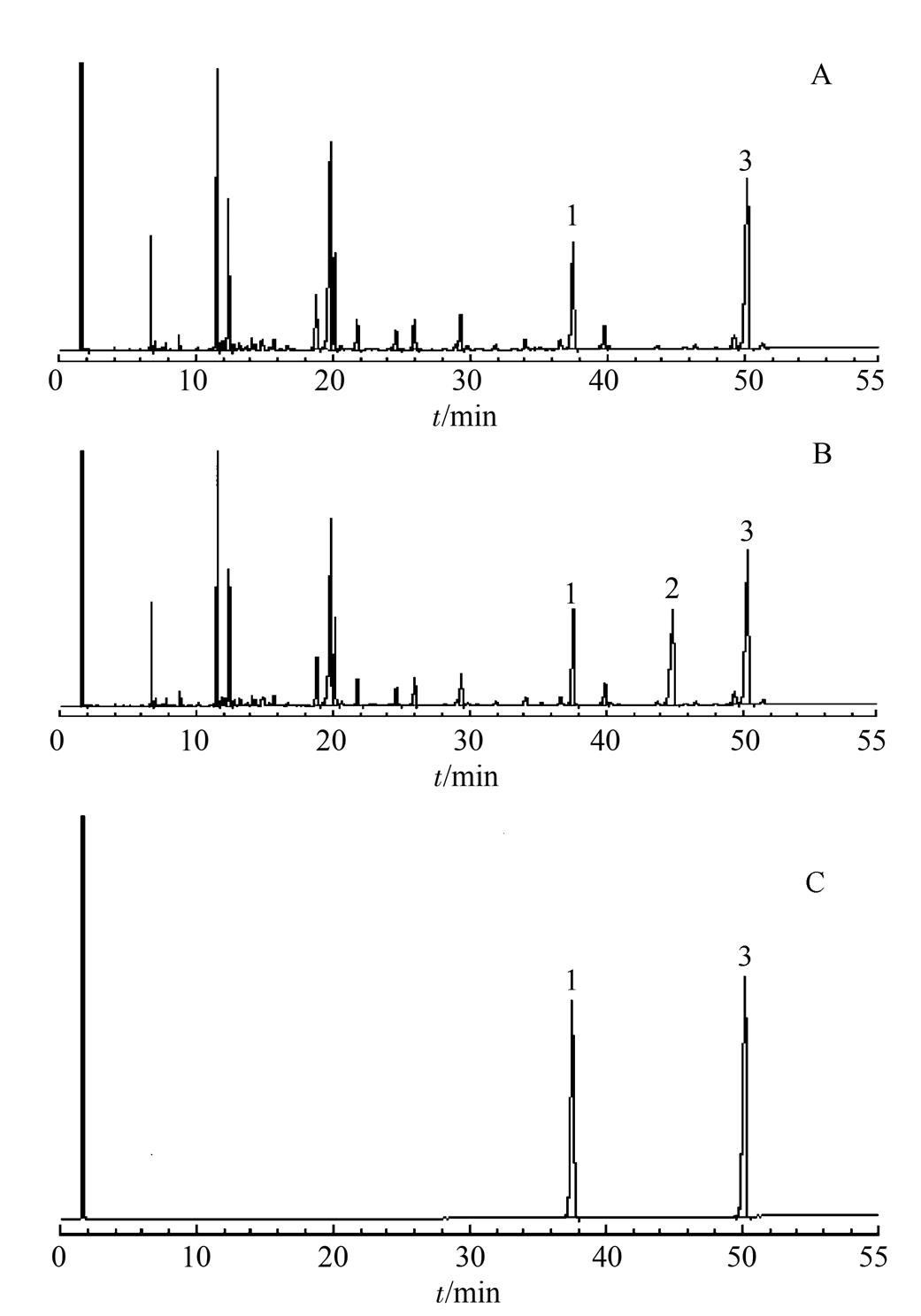
图1 GC色谱图
A-不加内标供试品溶液;B-供试品溶液;C-对照品溶液;1-EPA甲酯;2-C23:0甲酯;3-DHA甲酯。
Fig. 1 GCchromatograms
A-no internal standard sample solution; B-sample solution; C-control solution; 1-EPA methyl ester; 2-C23:0 methyl ester; 3-DHA methyl ester.
精密吸取“2.5”项下最低浓度溶液2 mL至4 mL量瓶中,加异辛烷稀释至刻度,制成含EPA 0.023 3 mg·mL-1、DHA 0.024 4 mg·mL-1的溶液,进样测定,测得EPA和DHA的信噪比(S/N)分别为10.32,9.66,结合供试品制备方法,计算EPA、DHA的定量限分别为0.466 mg·g-1和0.488 mg·g-1。
精密吸取“2.5”项下最低浓度溶液1.5 mL至10 mL量瓶中,加异辛烷稀释至刻度,制成含EPA 0.007 0 mg·mL-1、DHA 0.007 3 mg·mL-1的溶液,进样测定,测得EPA和DHA的信噪比(S/N)分别为3.25,2.92,结合供试品制备方法,计算EPA、DHA的检测限分别为0.140 mg·g-1,0.146 mg·g-1。
精密吸取“2.2.1”项下混合对照品溶液1 µL,按“2.1”项下色谱条件连续进样5次,记录峰面积,计算EPA、DHA甲酯峰面积的RSD分别为0.41%,0.65%,表明仪器精密度良好。
精密称取同一批样品(批号:170420)6份,按“2.2.4”项下分别制备供试品溶液,按“2.1”项下色谱条件进样,记录峰面积,按下述公式计算EPA、DHA含量,EPA含量为73.22 mg·g-1,RSD为0.66%;DHA含量为145.62 mg·g-1,RSD为0.78%,表明该方法重复性良好。
计算公式:
AX、AS、FX、WS同“2.3”项;W:供试品称样量(mg);k:EPA甲酯或DHA甲酯转换成脂肪酸的转换系数,EPA:1.046,DHA:1.043。
取同一份供试品溶液,室温下放置,按“2.1”项下色谱条件分别在0,4,8,12,16,20,24 h进样测定,测得EPA、DHA甲酯的峰面积RSD分别为1.67%,1.89%,表明供试品溶液在24 h内稳定。
2.10.1 样品溶液制备 精密称取EPA 70 mg、DHA 140 mg至10 mL量瓶中,制成约含EPA 7 mg·mL-1和DHA 14 mg·mL-1的混合样品溶液。
2.10.2 加样回收试验 取“2.8”项下已测知含量的样品,共9份,分别精密称取50 mg至20 mL带螺口反应瓶中,精密加入上述标液0.48,0.6,0.72 mL各3份,制成加样水平为80%,100%,120%的加样样品,按“2.2.4”项下方法制备供试品溶液,按“2.1”项下色谱条件进样测定。加样回收率试验结果见表2。
2.11.1 不同气相色谱仪对FX值的影响 采用Shimadzu GC-2010和Agilent 7890B气相色谱仪按“2.3”项下方法测定EPA和DHA的FX值,结果3台仪器测定结果一致,FEPA值的RSD为0.48%(n=3),FDHA值的RSD为0.64%(n=3)。
表2 加样回收率试验结果
Tab. 2 Results of recovery tests

2.11.2 测定条件变动对结果的影响 分别考察进样口温度、检测器温度改变±10 ℃,流速改变±0.2 mL·min-1,适当改变升温速率,采用不同色谱柱(DB-WAX,Rtx-WAX)对测定结果的影响,结果表明上述条件的改变,对EPA、DHA和C23∶0甲酯的理论板数和相互间的分离度影响不大,分离度均>12,各甲酯峰与相邻峰之间的分离度均>1.5,满足检测要求。
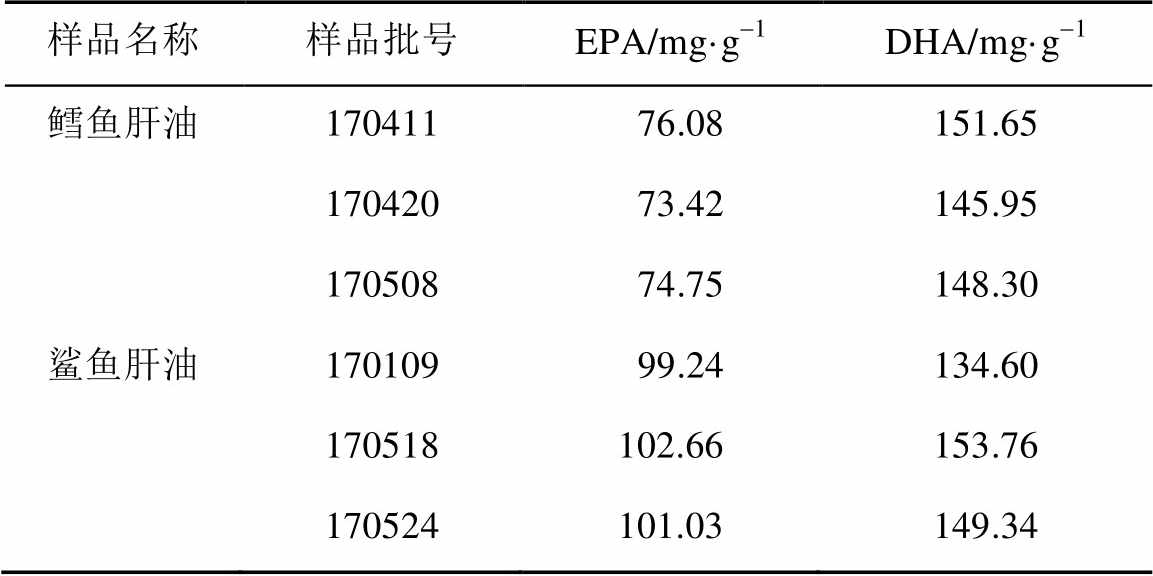
取鳕鱼肝油和鲨鱼肝油各3批,按“2.2.4”项下方法制备供试品溶液,按“2.1”项下色谱条件进样,记录峰面积,按“2.8”项下公式计算EPA和DHA含量。结果见表3。
表3 样品含量测定结果(n=3)
Tab. 3 Results of the content determination of samples(n=3)
本研究分别考察了各种催化法的催化效率,结果显示鱼肝油碱催化法甲酯化效率仅为酸催化法的70%,酸催化法中经重复性和加样回收率考察,显示三氟化硼/硫酸-甲醇溶液催化效率基本一致,盐酸甲醇溶液明显低于前两者。三氟化硼毒性大,价格昂贵,经方法学验证,硫酸甲醇溶液可完全替代三氟化硼甲醇溶液,不仅能有效降低检测成本,且符合绿色化学的要求。同时实验中发现采用硫酸甲醇溶液作催化剂,上清液澄清时间明显短于三氟化硼催化剂,可快速获得上层清液,缩短操作时间,提高效率。
采用L16(45)正交试验,设计皂化时间为5,10,20,30 min;酯化时间为5,10,15,20 min;皂化/甲酯化温度为70,80,90,100 ℃;以EPA、DHA含量为考察指标,通过优选和验证试验,结果显示“2.2.4”项所述供试品柱前衍生化条件为最佳条件,EPA、DHA含量最高,方法稳定性最好。
鱼肝油中所含的20多种脂肪酸均为偶数脂肪酸,C23∶0和鱼肝油中脂肪酸不存在相互干扰。C23∶0为饱和脂肪酸,性质稳定,对照品溶液易于保存,且其保留时间恰在EPA和DHA之间,符合内标物质要求。二十三烷酸价格低廉,仅为EPA、DHA的1/5,采用本法只需使用C23∶0甲酯对照品即可测得EPA、DHA含量,可大大降低检测成本。
脂肪酸皂化和甲酯化反应均需要甲醇的参与,甲醇沸点低,皂化和甲酯化反应温度均高于甲醇沸点,且发现在皂化过程中已发生部分酯交换反应,故反应选择在密闭容器中进行,可克服较高温度下甲醇挥发所致的反应不完全,同时密闭容器可减少供试品和空气的接触,降低EPA、DHA的氧化降解。
在相同实验条件下比较了本法和外标法的测定结果,结果显示外标法的平均加标回收率为103.8%,RSD为3.5%,回收率和重复性均较差。主要源于异辛烷的易挥发性,在加饱和氯化钠以及上清液转移等步骤中易造成因异辛烷挥发所致的脂肪酸浓度变大,同时因气相进样体积小,易引入误差,内标法可排除上述缺点。
本研究建立了加校正因子内标法测定鱼肝油中特有脂肪酸EPA和DHA的含量,方法简便、准确、重复性好,精密度高,可用于鱼肝油及其制剂的质量控制和掺假鉴定。
REFERENCES
[1] 中国药典. 二部[S]. 2015: 686.
[2] EP(8.0) [S]. 2012: 104-108.
[3] USP(39) [S]. 2016: 110-112.
[4] JP XVI [S]. 2011: 674.
[5] XIAO M, OU Z Q. Research progress of the physiological function and mechanism of two kinds of fatty acid (EPA and DHA) in the fish oil of deep sea [J]. Food Sci(食品科学), 2005, 26(8): 522-526.
[6] CAI W J, ZHANG X J, SU Z L. Determination of eicosapentaenoic acid, docosahexaenoic acid, and docosapentaenoic acid in fish oil by gas chromatography [J]. Food Safe Qual Detec Technol(食品安全质量检测学报), 2015, 6(5): 1924-1928.
[7] ZHUANG J Y, FENG Z Q, XIE Z Y. Determination of EPA and DHA in deep sea fish oil by gas chromatography using internal standard method [J]. Mod Food Sci Tech(现代食品科技), 2009, 25(11): 1363-1365.
[8] HUANG J L, SUN F, REN Q. Determination of EPA and DHA contents in deep sea fish oil by capillary gas chromatography [J]. Chem Anal Met(化学分析计量), 2001, 10(5): 9-10.
[9] WU L Y, LIAO T X. Content determination of EPA and DHA in deep sea fish oil soft capsules by GC [J]. Drug Stand Chin (中国药品标准), 2011, 12(5): 357-360.
[10] HONG Y M, MA J P, ZHANG Y W, et al. Determination of contents of EPA ethyl ester and DHA ethyl ester in ethyl esterified fish oil microcapsule by gas chromatography [J]. Chin Oils Fats(中国油脂), 2015, 40(12): 88-91.
[11] 盛洁, 包亚君. 一种鱼油中EPA、DHA及总ω-3酸含量测定的色谱方法: 中国, 104634908 A [P]. 2015-05-20.
[12] SONG J Y, CHEN J D, LIU W J, et al. Determination of DHA, EPA in fish oil food by capillary gas chromatography [J]. Chem Anal Met(化学分析计量), 2013, 22(4): 53-56.
[13] GB 5009. 168-2016(食品安全国家标准食品中脂肪酸的测定) [S]. 2017.
[14] SN/T 2922-2011(出口食品中EPA和DHA的测定气相色谱法) [S]. 2011.
[15] LI S, LI L, CAO J, et al. Improvement of pre-column derivatization for the Determination of eicosapentaenoic acid and docosahexaenoic acid in fish oil soft capsules by gas chromatography [J]. Food Safe Qual Detec Technol(食品安全质量检测学报), 2016, 7(3): 951-957.
Determination of EPA and DHA in Cod-liver Oil by GC
WANG Qiongfen1, LIU Ting1, ZHENG Pingan2, XU Hong1
(1.Zhoushan Institute for Food and Drug Control, Dinghai 316021, China; 2.Hailisheng Group Co., Ltd., Dinghai 316021, China)
ABSTRACT:OBJECTIVETo establish a method for the determination of EPA and DHA in cod-liver oil by gas chromatography internal standard method with relative correction factor.METHODSThe samples were saponified, methyl esterified and extracted with isooctane. The sample was chromatographed on a DB-23(30 m×0.25 mm, 0.25 μm) capillary column with a FID detector. The column temperature was raised by program (the initial temperature was 170 ℃ and the temperature was raised to 225 ℃ at a rate of 1 ℃·min-1for 5 min). The injector temperature was 250 ℃, detector temperature was 280 ℃, high purity nitrogen was used as carrier gas, flow rate was 1.0 mL·min-1, split flow was 100∶1, methyl ester(C23∶0) was used as an internal standard.RESULTSEPA and DHA showed good linear relationships(r=1.000 0) with the peak area ratio and concentration ratio at the range of 0.048 7-9.740 mg·mL-1, 0.051 0-10.206 mg·mL-1, respectively. The average recoveries of EPA and DHA were 98.7%(RSD=0.98%), 99.4%(RSD=1.34%).CONCLUSIONThe method is sample, accurate and reproducible. It can be used for the quality control and adulteration identification of cod-liver oil.
KEY WORDS:cod-liver oil; EPA; DHA; GC; relative correction factor; internal standard method; determination
中图分类号:R917
文献标志码:B
文章编号:1007-7693(2018)09-1322-05
DOI:10.13748/j.cnki.issn1007-7693.2018.09.011
引用本文:王琼芬, 刘婷, 郑平安, 等.GC测定鱼肝油中EPA和DHA含量[J]. 中国现代应用药学, 2018, 35(9): 1322-1326.
收稿日期:2018-01-25
基金项目:浙江省食品药品监管系统科技计划项目(SP201627)
作者简介:王琼芬,女,主任药师 Tel: (0580)2033860 E-mail: 2451568883@qq.com
(本文责编:李艳芳)