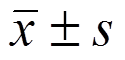 表示,方差齐采用单因素方差分析,方差不齐采用Kraskal-Wallis H检验整体均数差异,Neimenyi检验两两均数差异,计数资料以例数和百分比表示,组间比较采用c2检验。以P<0.05为差异有统计学意义。
表示,方差齐采用单因素方差分析,方差不齐采用Kraskal-Wallis H检验整体均数差异,Neimenyi检验两两均数差异,计数资料以例数和百分比表示,组间比较采用c2检验。以P<0.05为差异有统计学意义。吴敏,魏洪平,赵平鸽*
(温州医科大学附属义乌医院,浙江 义乌 322000)
摘要:目的观察阿法骨化醇对过敏性紫癜(henoch-schonlein purpura,HSP)患儿免疫功能及临床疗效的影响。方法选择60例HSP患儿随机分为阿法骨化醇组和常规治疗组,各30例,2组患儿均给予常规治疗,阿法骨化醇组加用阿法骨化醇口服。检测所有患儿治疗前及治疗1月后Th17/Treg细胞比例及血清1,25(OH)2D3、IL-10、IL-17及MMP-9水平。比较2组患儿的临床疗效。结果治疗后2组患儿Th17细胞比例均有下降(P<0.01),Treg细胞比例均有上升(P<0.01),阿法骨化醇组变化更明显。治疗后,阿法骨化醇组血清1,25(OH)2D3水平较常规治疗组升高(P<0.01),血清IL-10、IL-17及MMP-9水平较常规治疗组降低(P<0.01)。阿法骨化醇组的腹痛、关节肿痛、肾脏病变消退时间及半年内复发次数优于常规治疗组(P<0.05)。结论阿法骨化醇能改善HSP患儿免疫功能,对HSP患儿有效,但需更多研究进一步证实。
关键词:阿法骨化醇;过敏性紫癜;细胞免疫;疗效
过敏性紫癜(henoch-schonlein purpura,HSP)是以小血管炎为主要病变的系统性血管炎,易反复发作,一般预后良好,但部分患儿可合并肾功能损害,形成紫癜性肾炎(henoch-schonlein purpura nephritis,HSPN),约2%的HSP患儿最终发展为终末期肾病。因此,HSPN发现并治疗的时间决定其预后效果。近年来研究发现,1,25-二羟基维生素D3[1,25(OH)2D3]在免疫调节方面具有重要功能,与哮喘等自身免疫性疾病密切相关,郭桂梅[1]等报道HSP患儿存在1,25(OH)2D3合成及维生素D受体应答异常。马蕾[2]等研究证实HSP患儿存在外周血辅助性T细胞17(T Helper cell 17,TH17)/调节性T细胞(regulatory T cell,Treg)失衡。HSP患儿特别是合并HSPN者,需较长时间使用糖皮质激素,既往研究大都关注使用糖皮质激素的同时予阿法骨化醇口服以预防糖皮质激素引起的骨密度降低,但较少关注其对免疫功能的影响。邵美琪[3]等报道通过1,25(OH)2D3体外干预培养哮喘患者外周血单个核细胞,可使Th17细胞比例降低,Treg细胞升高。但给予HSP患儿补充阿法骨化醇是否能影响患儿免疫功能及治疗效果,目前少见相关报道。蒋鲲等[4]研究表明在哮喘患儿体内血清1,25(OH)2D3水平与患儿支气管肺泡灌洗液的基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)水平呈负相关,MMP-9与HSP患儿肾脏损害密切相关,但给予HSP患儿补充阿法骨化醇是否影响患儿血清中的MMP-9水平,目前未见相关报道。本研究加用阿法骨化醇辅助治疗HSP,观察其对Th17/Treg细胞平衡及血清MMP-9水平的影响及治疗效果,现报道如下。
选取2013年7月—2016年7月温州医科大学附属义乌医院儿科收住的HSP患儿60例,其中男38例,女22例;年龄2~12(8.6±1.8)岁。根据就诊顺序,按随机数字表法分为常规治疗组和阿法骨化醇组。纳入标准:①均符合2006年欧洲抗风湿联盟/欧洲儿童抗风湿学会制定的HSP诊断标准[5];②可触性皮疹伴以下任何1条:弥散性腹痛;任何部位活检提示IgA沉积;关节炎/关节痛;肾脏受损表现。入选HSP患儿中有9例合并轻度肾脏损害,主要表现为孤立性血尿或(和)孤立性蛋白尿(24 h蛋白量<25 mg×kg-1)。排除标准:①合并有其他血管炎性疾病、结缔组织病、血液系统疾病;②合并肿瘤、肝炎、免疫缺陷疾病;③本次入院前3月内使用过糖皮质激素及免疫抑制剂的患儿。2组患儿性别、年龄、疾病严重程度均具有可比性。本研究经医院伦理委员会批准(批号:2012-9-011),并且患儿家属均已签署知情同意书。
常规治疗组患儿予控制感染、抗过敏、抗凝、补充维生素等对症支持治疗。急性期有腹痛和关节痛者,予醋酸泼尼松片(江苏鹏鹞药业有限公司,国药准字H32021728,规格:每粒5 mg)口服,1 mg×kg-1×d-1,连用1周;合并肾脏损害患儿,予醋酸泼尼松口服,1 mg×kg-1×d-1,连用3周。阿法骨化醇组在常规治疗的基础上加用阿法骨化醇胶囊(昆明贝克诺顿制药有限公司,国药准字J20030092,规格:每粒0.25 μg)口服,剂量为0.01 μg×kg-1,体质量>50 kg者,给予0.5 μg,每日1次,持续治疗30 d。
所有患儿入院第2天及开始治疗后第30天空腹取外周静脉血2 mL,采用Ficoll密度梯度离心法分离外周血单个核细胞。Th17表面染色采用荧光标记的表面抗体抗人CD4-PreCP-Cy5.5(BD Pharmingen),4 ℃避光孵育30 min,洗涤后,用破膜固定液破膜固定,4 ℃避光孵育20 min,细胞内染色采用IL-17-FITC(Biolegend);Treg细胞表面染色采用荧光标记的表面抗体抗人CD4-PreCP-Cy5.5(BD Pharmingen)和抗人CD25-PE染CD4和CD25分子,用Cytofix/Cytop-erm (e-biosience)缓冲液试剂4 ℃避光孵育30 min,破膜固定,用Foxp3-FITC(e-biosience) 4 ℃避光孵育60 min进行Foxp3染色,所有样本采用流式细胞仪进行检测。
2组患儿入院第2天及开始治疗后第30天分别抽取外周静脉血4 mL,分离血清,-70 ℃冰箱冷藏待检,采用双抗体酶联免疫吸附试验法检测血清1,25(OH)2D3、IL-10、IL-17及MMP-9水平。
统计方法采用SPSS 17.0统计软件。计量资料采用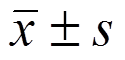 表示,方差齐采用单因素方差分析,方差不齐采用Kraskal-Wallis H检验整体均数差异,Neimenyi检验两两均数差异,计数资料以例数和百分比表示,组间比较采用c2检验。以P<0.05为差异有统计学意义。
表示,方差齐采用单因素方差分析,方差不齐采用Kraskal-Wallis H检验整体均数差异,Neimenyi检验两两均数差异,计数资料以例数和百分比表示,组间比较采用c2检验。以P<0.05为差异有统计学意义。
2组患儿性别、年龄及是否合并肾脏损害比较均无统计学差异。见表1。
表1 2组患儿一般临床资料比较
Tab. 1 Comparison of the basic date between two groups
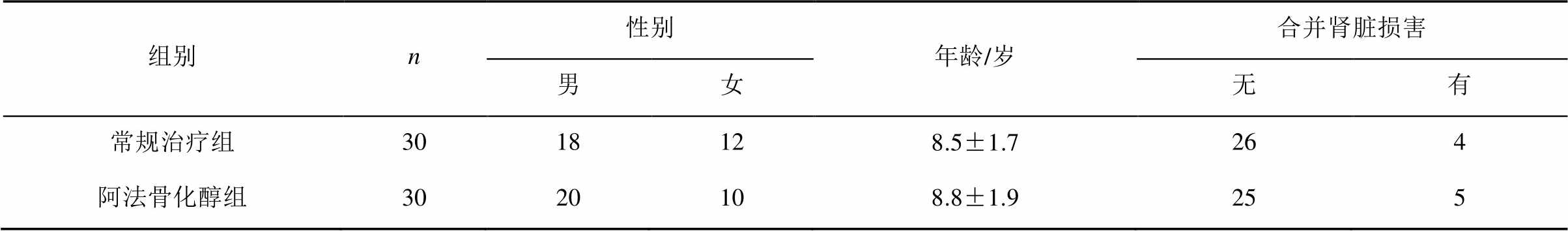
与本组治疗前比较,2组患儿治疗后Th17细胞比例均有下降(P<0.01),Treg细胞比例均有升高(P<0.01),阿法骨化醇组患儿血清1, 25(OH)2D3水平升高(P<0.01);治疗后与常规治疗组相比,阿法骨化醇组Th17细胞比例下降、Treg细胞比例及血清1,25(OH)2D3水平升高(P<0.01),见表2。
与本组治疗前比较,2组患儿血清IL-17及MMP-9水平均下降(P<0.01),阿法骨化醇组患儿血清IL-10水平显著降低(P<0.01);治疗后与常规治疗组相比,阿法骨化醇组血清IL-10、血清IL-17及MMP-9水平下降程度均大于常规治疗组(P<0.01),见表3。
表2 2组患儿治疗前后Th17、Treg细胞及血清1, 25(OH)2D3水平比较(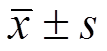 )
)
Tab. 2 Comparison of the proportion of Th17, Treg and the levels of serum 1,25(OH)2D3cell between two groups before and after treatment( )
)
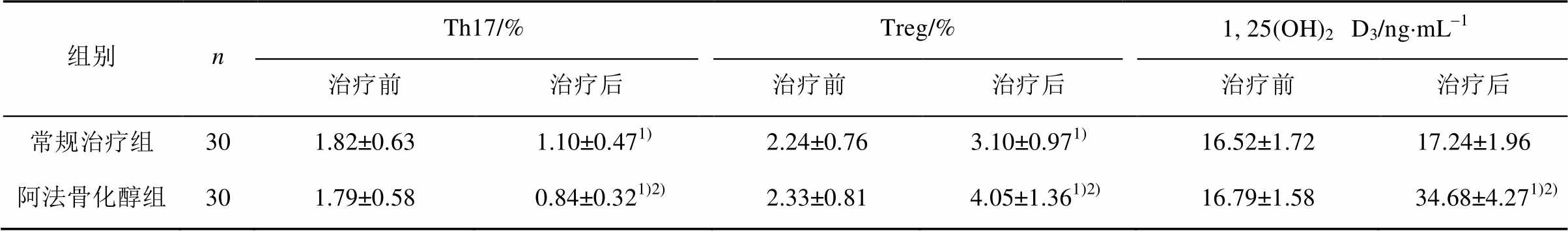
注:与治疗前比较,1)P<0.01;与常规治疗组比较,2)P<0.01。
Note: Compared with the group before treatment,1)P<0.01; compared with the convntional treatment group,2)P<0.01.
表3 2组患儿治疗前后血清IL-10、IL-17及MMP-9水平比较( )
)
Tab. 3 Comparison of the levels of serum cytokines between two groups before and after treatment( )
)

注:与治疗前比较,1)P<0.01;与常规治疗组比较,2)P<0.01。
Note: Compared with the group before treatment,1)P<0.01; compared with the convntional treatment group ,2)P<0.01.
2组患儿在皮肤紫癜消失时间上无差异,但在腹痛、关节肿痛及肾脏病变消退时间上阿法骨化醇组优于常规治疗组(P<0.05或<0.01)。见表4。
表4 2组患儿治疗后临床症状消失时间比较(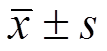 )
)
Tab. 4 Comparison of disappearance time of clinical symptoms between two groups after treatment(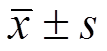 ) d
) d

注:与常规治疗组比较,1)P<0.05,2)P<0.01。
Note: Compared with the convntional treatment group,1)P<0.05,2)P<0.01.
随访半年内HSP复发次数,常规治疗组(2.1±0.6)次,阿法骨化醇组(1.8±0.4)次,2组比较差异有统计学意义(P<0.05)。
HSP患儿给予阿法骨化醇治疗过程中未见明显不良反应。
HSP是儿童期最常见的出血性疾病之一,主要病理改变为全身性小血管炎性病变,具体发病机制尚未完全明确。HSP患儿急性期存在Th17/Treg细胞失衡,主要表现为Th17细胞、IL-17A及其特异性转录基因RORγt mRNA的高表达,Treg细胞其特异性转录基因FoxP3+mRNA表达水平降低。Th17细胞表达上调导致过渡炎症反应,Treg细胞下调导致免疫抑制效应不足,二者共同作用可能是导致HSP患儿广泛小血管炎的原因之一[6]。既往大量研究证实,维生素D在众多自身免疫性疾病中发挥免疫调节作用,Th17和Treg细胞正是维生素D发挥免疫作用的执行者。ZHANG等[7]研究表明,1,25(OH)2D3可抑制IL-6和RORγt产生,导致初始CD4+T细胞向Th17细胞的分化和增殖受限。维生素D也可促进FoxP3调节性T细胞的表达,Chambers等[8]研究表明CD4+T细胞受到1,25(OH)2D3和转化生长因子β刺激后,FoxP3+调节性T细胞显著增加,通过刺激FoxP3+的表达,1,25(OH)2D3也可能通过增加FoxP3+与RORγt的相互作用而抑制IL-17A的产生。郭桂梅等[1]研究发现急性期HSP患儿存在血浆1,25(OH)2D3明显降低及维生素D受体过渡表达,由于1,25(OH)2D3主要抑制表达维生素D受体的淋巴细胞增殖,产生不足导致对淋巴细胞的抑制降低,维生素D受体过表达导致下游靶基因转录,引起包括肾脏在内的靶器官损伤。笔者研究发现,给HSP患儿额外补充阿法骨化醇,提高血清1,25(OH)2D3浓度,可有效降低外周血单个核细胞中Th17细胞比例,提高Treg细胞比例,部分纠正Th17/Treg细胞失衡。
HSP发病机制可能为各种刺激因子作用于具有遗传背景的个体,激发B细胞克隆扩增,导致IgA介导的小血管炎。IL-10是一种炎症抑制因子,可以阻止炎性细胞因子分泌,调节B淋巴细胞、T淋巴细胞及NK细胞等的分化和增殖[9]。余燕娟等[10]报道HSP患儿急性期血清IL-10水平显著高于健康儿童,推测可能为反馈性增高,发挥一定的保护作用。IL-10既能抑制炎性细胞因子的分泌,又能抑制B细胞凋亡,调节IL-10的分泌,可能有助于HSP及HSPN的治疗,本研究发现HSP患儿补充阿法骨化醇后,伴随1,25(OH)2D3血清浓度提升,患儿血清IL-10水平显著降低,推测与治疗后炎症反应减轻或恢复,正反馈作用减弱有关。IL-17是由Th17细胞分泌的前炎因子,在HSP患儿体内,IL-17可能通过促使内皮细胞产生细胞因子、趋化因子及其他炎症介质,参与血管的病理损伤,甚至认为其可作为是否发生HSPN的早期诊断指标[11]。MMPS是一组钙、锌离子依赖性蛋白水解酶,对细胞外基质有特异的降解作用,MMP-9是MMPS家族中降解Ⅳ型胶原最主要的酶。MMP-9可由中性粒细胞大量释放,破坏血管基底膜及组织结构,导致组织损伤。HSP患儿急性期血清MMP-9水平显著升高,导致肾小球基底膜损伤,从而出现血尿与蛋白尿[11]。本研究显示,给予HSP患儿口服阿法骨化醇后,血清IL-17及MMP-9水平显著降低,Dragan等[12]研究发现,在类风湿性关节炎中,IL-17可诱导外周血单核细胞中MMP-9的生成,二者呈相关性。在HSP患儿中,1,25(OH)2D3可能通过减少IL-17表达进一步影响MMP-9生成,可能减轻急性期HSP患儿血管炎症,特别是保护肾脏血管,改善本病预后。
既往给予长期使用糖皮质激素的患儿补充阿法骨化醇,侧重于观察对患儿骨密度的影响,但对于患儿免疫功能的影响却较少关注。笔者发现给予HSP患儿补充阿法骨化醇后,患儿血清1,25(OH)2D3水平升高,对患儿免疫功能产生影响,可能进一步影响患儿的临床治疗效果。虽然2组患儿在皮肤紫癜消失时间上未见明显差异,但腹痛、关节肿痛、肾脏病变消失时间上阿法骨化醇组均优于常规治疗组。HSP易于反复发作,给患儿及家属带来精神和经济的双重压力。笔者特别随访了2组患儿6月内的复发情况,发现阿法骨化醇组复发次数少于常规治疗组。范丽等[13]报道了血清维生素D水平与HSP患儿病情及治疗的关系,发现在血清维生素D缺乏或者严重缺乏的HSP患儿中,肾脏受累发生率、激素使用率均增高,中位住院天数延长。补充维生素D对HSP有无治疗作用,能否缩短HSP患儿病程,改善远期预后,值得进一步研究。Searing等[14]发现在哮喘患儿,无论雾化吸入或者口服糖皮质激素,患儿总激素量均与维生素D水平呈负相关,加用维生素D后诱导单个核细胞内蛋白激酶-1(MPK-1)和IL-10 mRNA表达明显高于单用激素,提示维生素D可加强激素的抗炎作用,改善哮喘患者对激素治疗的反应。笔者推测维生素D在HSP患儿体内可能发挥类似作用,但需今后实验进一步证实。本研究样本例数较少,可能对临床疗效判断带来偏差,所得结论仍需大样本、高质量的随机对照试验加以证实。
REFERENCES
[1] GUO J M, WANG J, XIA M, et al. Expressions of 1,25(OH)2D3, vitamin D receptor and 24-hydroxylase in henoch-schiinlein purpura [J]. Chin J Appl Pediatr(中华实用儿科临床杂志), 2013, 28(21): 1640-1642.
[2] MA L, LI X H, ZHANG Y J, et al. Detection of Thl7/Treg cell balance in peripheral blood of patients with henoch-schiinlein purpur [J]. Chin J Dermatol(中华皮肤科杂志), 2010, 43(9): 617-619.
[3] SHAO M Q, WU S M, LIU J, et al.In vitrostudy in the regulation of periphreral blood Thl7/Treg in bronchialasthma by calcitrialon [J]. Chin J Clinicians(Electronic Edition)(中华临床医师杂志电子版), 2015, 9(19): 3521-3526.
[4] JIANG Q, ZHANGG H Y, LU X X, et al. Relationship between different levels of 24-hydroxyl-vitamin D3 in serum and levels of matrix metalloproteinase-9 in serum and bronchoalveolar lavage fluid in children with asthma [J]. Chin J Appl Pediatr(中华实用儿科临床杂志), 2016, 31(4): 279-283.
[5] OZEN S, RUPERTO N, DILLON M J, et al. EULAR/PRES endorsed consensuscriteria for the classification of childhood vasculitides [J]. Ann Rheum Dis, 2006, 65(7) : 936-941.
[6] YANG J, LI C R, WANG G B, et al. Role of Th17 cell and CD4+CD25+regulatory T cell in pathogenesis of Henoch- Schiinlein purpura in children [J]. J Clin Pediatr(临床儿科杂志), 2009, 27(7): 645-648.
[7] ZHANG H, SHIH D Q, ZHANG X. Mechanisms underlying effects of 1,25-dihydroxyvitamin D3on the Th17 cells [J]. Eur J Microbiol Immunol, 2013, 3(4): 237-240.
[8] CHAMBERS E S, SUWANNASAEN D, MANN E H, et al. 1a,25-dihydroxyvitamin D3in combination with transforminggrowth factor-βincreases the frequency of Foxp3+regulatory T cells through preferential expansion and usage ofinterleukin-2 [J]. Immunology, 2014, 143(1): 52-60.
[9] ALBUQUERQUE C, MORINHA F, REQUICHA J, el al. A case-conrol study between interleukin-10 gene variants and periodontaldisease in dogs [J]. Gene, 2014, 539(1): 75-81.
[10] YU Y J, ZHANG Y H. Association between interleukin-10 gene polymorphisms and susceptibility to henoch-schonlein purpura in children [J]. Chin J Appl Pediatr(中华实用儿科临床杂志), 2015, 30(9): 689-693.
[11] YU Y J, LIU L, YANG Y J, et al. Changes and significance of serum interleukin-17 and matrix metalloproteinase-9 in children of henochschonlein purpura [J]. Int J Pediatr(国际儿科杂志), 2014, 41(4): 431-433.
[12] DRAGAN V J, JOHANNE M P, JOHAN A, et al. Stimulation of 92-kd gelatinase(Matrix Metalloproteinase 9)production by interleukin-17 in human monocyte/macrophages [J]. Arthritis Rheum, 2000, 43(5): 1134-1144.
[13] FANG L, LIU H, WANG Y C, et al. Association of serum vitamin D level with severity and treatment in children with Henoch-Schonlein purpura [J]. Chin J Contemp Pediatr(中国当代儿科杂志), 2017, 19(7): 796-799.
[14] SEARING D A, ZHANG Y, MUPHY J R, et al. Decreased serum vitamin dlevels in children with asthma are associated with increased corticosteroid use [J]. Allergy Clin Immunol, 2010, 125(5): 995-1000.
Effects of Alfacalcidol on Immun Function in Children with Henoch-schonlein Purpura and Observation of Clinical Efficacy
WU Min, WEI Hongping, ZHAO Pingge*
(Yiwu Hospital Affiliated Wenzhou Medical University, Yiwu 322000, China)
ABSTRACT:OBJECTIVETo investigate the effects of alfacalcidol on immun function and clinical efficacy in children with henoch-schonlein purpura(HSP).METHODSSixty cases of HSP were selected and randomly divided into the alfacalcidol treatment group and the conventional treatment group, 30 cases in each group. The conventional treatment group was given the routine therapy, while the alfacalcidol treatment group was added alfacalcidol oral on the basis of the routine therapy. The peripheral frequence of Th17 cell and Treg cell of all the objects(before treatment and after 1 month treatment) were detected, and the serum concentrations of 1,25-(OH)2D3, IL-10, IL-17 and MMP-9 were also detected. The clinical efficacy and symptom control time were compared between two groups.RESULTSCompared with pre-treatment, the proportion of Th17 cell were decreased significantly and the proportion of Treg cell were increased significantly after treatment, all those difference were significantly(P<0.01). The alfacalcidol treatment group had a significant change compared with the conventional treatment group. After treatment, the serum of 1,25-(OH)2D3in the alfacalcidol treatment group was higher than the convntional treatment group(P<0.01), while the serum of IL-10, IL-17 and MMP-9 levels were significantly reduced(P<0.01). The alfacalcidol treatment group was superior to the conventional treatment group in abdominal pain, joint swelling and pain, renal lesion regression time and recurrence times within half a year(P<0.05).CONCLUSIONAlfacalcidol can improve the immune function of children with HSP, and it has a certain clinical efficacy, but more research is need to prove.
KEY WORDS:alfacalcidol; henoch-schonlein purpura; cellular immunity; clinical effect
中图分类号:R969.4
文献标志码:A
文章编号:1007-7693(2018)09-1388-05
DOI:10.13748/j.cnki.issn1007-7693.2018.09.026
引用本文:吴敏,魏洪平,赵平鸽. 阿法骨化醇对儿童过敏性紫癜免疫功能的影响及疗效观察[J]. 中国现代应用药学, 2018, 35(9): 1388-1392.
收稿日期:2017-11-14
作者简介:吴敏,女,硕士,主管药师 Tel: (0579)85209117 E-mail: andy790w@126.com
*通信作者:赵平鸽,男,主任药师 Tel: (0579)85209117 E-mail: 347948512@qq.com
(本文责编:李艳芳)