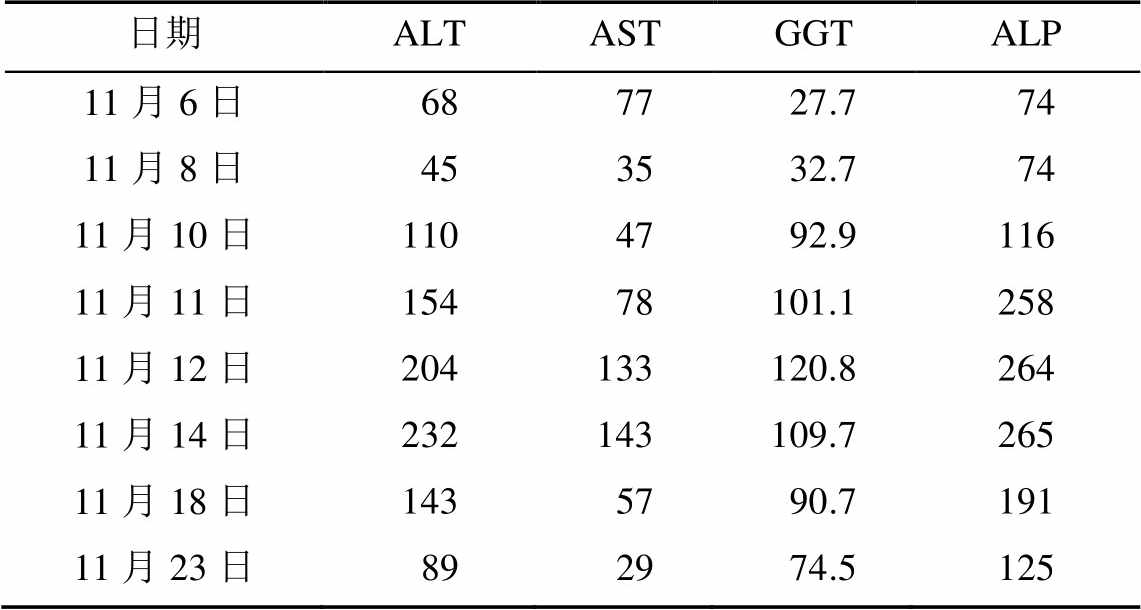
表1 患者住院期间肝功能变化情况
Tab. 1 Changes of liver function in patient during hospitalization U·L-1
孙国先a,单清a,蔡萍a,孙安修a,侯红玲b
(扬州大学附属医院,a.药剂科,b.神经内科,江苏 扬州 225001)
摘要:目的探讨临床药师参与1例疑似利奈唑胺引发肝功能损伤患者的药学监护。方法针对肺部感染患者在使用利柰唑胺过程中出现肝功能损伤的具体病例,临床药师从原发疾病、肝功能变化、合并用药等因素推断利奈唑胺是肝功能损伤的可能原因,并适时提出干预建议。结果临床药师对患者肝功能损伤的原因进行了及时和准确的分析,医师采纳了临床药师的建议,患者病情得到了控制。结论临床药师主动参与患者用药过程,给予医师相应的建议,可以确保患者的用药安全有效。
关键词:利奈唑胺;肝功能损伤;药学监护;临床药师
利奈唑胺是第1个应用于临床的人工全合成噁唑烷酮类抗菌药物[1],用于严重的革兰阳性球菌感染,包括耐甲氧西林金黄色葡萄球菌引起的医院获得性肺炎和复杂的皮肤及软组织感染。利奈唑胺常见的不良反应有腹泻、头痛和血小板减少等,少见乳酸酸血症、周围神经痛、高血压等。其导致肝功能损伤引起肝酶升高罕有报道。本研究通过对1例疑似利奈唑胺引发肝功能损伤患者的药物治疗分析,探讨其用药选择和不良反应判定,提出临床药师对于该患者发生肝功能损伤时的药学监护要点。
患者,女,61岁。因“突发意识障碍19 h余”于2016年11月4日入院。患者2016年11月3日晨突发小脑出血,伴发呼吸心跳骤停,在其他医院立即行心肺复苏,并于2016年11月4日零时转入扬州大学附属医院ICU监护治疗。既往有“2型糖尿病”病史5年,未正规治疗。否认手术、外伤及食物、药物过敏史。入院查体:T 36.6 ℃,P 102次/分,R 20次/分,BP 125/83 mm Hg,镇静状态,双侧瞳孔等大等圆(D≈1.5 mm),对光反射迟钝,双侧额纹对称,鼻唇沟对称,口角无歪斜,四肢肌张力偏低,双侧巴宾斯基征阴性,余查体不配合。外院血常规示(2016年11月3日):白细胞计数10.62×109·L-1,中性粒细胞百分率73.20%,随机血糖11.9 mmol·L-1。入科诊断“小脑出血、心肺复苏术后、2型糖尿病”。
2016年11月4日—2016年11月7日,患者入ICU后呼吸机辅助通气,体温波动于36.6~37.5 ℃。血常规示(2016年11月4日):白细胞计数10.39×109·L-1,中性粒细胞百分率73.60%。血生化示(2016年11月4日):ALT 55 U·L-1、AST 61 U·L-1、Scr 84 mmol·L-1。胸部CT示(2016年11月4日):两下肺后缘见多发片状影,考虑两肺炎症。予哌拉西林舒巴坦3.0 g,q12h,静脉滴注抗感染;盐酸氨溴索30 mg,bid,静脉推注化痰;20%甘露醇注射液125 ml,q8h,静脉滴注脱水降颅压;奥美拉唑40 mg,qd,静脉滴注预防应激性溃疡;单唾液酸四己糖神经节苷脂40 mg,qd,静脉滴注营养脑神经;20%脂肪乳250 ml+复方氨基酸500 ml+丙氨酰谷氨酰胺10 g+10%氯化钾20 ml+注射用多种维生素1支,qd,静脉滴注补充能量。11月8日—11月9日,夜间有发热,体温最高达38.8 ℃且痰液较多,为黄脓痰,白细胞计数12.40×109·L-1,中性粒细胞百分率83.63%,Scr 79 mmol·L-1,胸部CT示两肺斑片状影,较前明显增多,可见少量散在小结节。医师欲使用利奈唑胺0.6 g,q12h,静脉滴注,临床药师赞同,同时建议医师调整哌拉西林舒巴坦剂量为3.0 g,q8h,静脉滴注,医师接受建议。11月10日—11月11日,查ALT 110 U·L-1、AST 47 U·L-1。停用可能导致肝酶升高的奥美拉唑,停用肠外营养,改为肠内营养;加用还原型谷胱甘肽1.5 g,qd,静脉滴注。11月12日—11月13日,体温波动于37.2~37.8 ℃,白细胞计数10.50× 109·L-1,中性粒细胞百分率79.80%,ALT 204 U·L-1、AST:133 U·L-1。血培养阴性,痰培养为洋葱伯克霍尔德菌,对庆大霉素、多黏菌素B耐药;对氨苄西林舒巴坦、美罗培南敏感。立即停用利奈唑胺,同时调整还原型谷胱甘肽为异甘草酸镁0.1 g,qd,静脉滴注。11月14日,患者体温37.2 ℃,白细胞计数8.50×109·L-1,中性粒细胞百分率85.60%,感染控制可,但肝酶仍呈上升趋势,临床药师建议加用熊去氧胆酸胶囊250 mg,bid胃管注入联合异甘草酸镁保肝治疗,医师接受建议。11月18日,体温36.3 ℃、白细胞计数8.2×109·L-1,中性粒细胞百分率68.80%。肝酶较前降低,停用哌拉西林舒巴坦,转入神经内科治疗。5 d后追踪肝酶ALT 89 U·L-1、AST 29 U·L-1、ALP 125 U·L-1。出院1周后门诊随访ALT 43 U·L-1、AST 37 U·L-1、ALP 126 U·L-1。患者住院期间肝功能变化情况见表1。
表1 患者住院期间肝功能变化情况
Tab. 1 Changes of liver function in patient during hospitalization U·L-1

入科第5天,患者体温、血象升高,结合胸部CT,考虑肺部感染加重。患者既往有2型糖尿病病史多年,免疫功能受损,不能排除耐甲氧西林金黄色葡萄球菌(MRSA)及产超广谱β-内酰胺酶细菌(ESBL)感染可能。根据我国2014年ESBL专家共识[2],碳青霉烯类和头孢哌酮舒巴坦、哌拉西林他唑巴坦等少数含有β-内酰胺酶抑制剂的复方制剂对ESBL高度敏感,对未发生脓毒症或脓毒性休克的感染患者,可予β-内酰胺类/β-内酰胺酶抑制剂合剂治疗。患者体质量51.5 kg,第5天查Scr 79 mmol·L-1,计算内生肌酐清除率为53.6 ml·min-1,故临床药师建议哌拉西林舒巴坦3.0 g,q12h调整为3.0 g,q8h静脉滴注加强抗感染治疗。
患者有大量黄脓痰,不能排除MRSA感染[3]。医师欲选用利奈唑胺,临床药师赞同提议。虽然万古霉素是治疗MRSA一线药物,但其相对分子质量较大,对生物膜渗透能力低,可导致肺组织药物浓度不足[4]。国外指南[5]已不推荐万古霉素用于MRSA引起的肺部感染,我国VAP指南[6]引用多项RCT研究显示,利奈唑胺与万古霉素在临床治愈率、病死率及不良反应发生率虽无显著差异,但在微生物学总治愈率方面前者显著高于后者。目前患者自身免疫功能弱,肺部感染重,且结合家属高期望值,临床药师同意选择分子量小、脂溶性高、蛋白结合率低的利奈唑胺,更有利于肺部细菌清除。
2015年3月3日修订的利奈唑胺(斯沃)说明书描述肝功能损伤发生率为1%~10%,国内少见报道[7-8]。该患者既往无肝病病史,入科后体温、血象大致正常,肺部感染轻微,但肝酶轻度升高,考虑患者心肺复苏术后存在短暂缺氧和强烈应激,是肝酶升高的原因。机械通气2 d后,患者肝酶恢复正常水平,同日复测肝酶结果ALT 42 U·L-1、AST 38 U·L-1,可认为患者已从短暂缺氧状态逐渐恢复过来,故排除原发疾病引起肝酶升高的可能性。本患者使用利奈唑胺次日,肝酶明显升高,停用可致肝功能损伤的奥美拉唑和肠外营养液后,肝酶仍持续升高,但考虑患者原发疾病及11月12日感染情况均较前好转,合并使用的哌拉西林舒巴坦等药物一直使用至出院,故排除了原发疾病和其他药物导致肝功能的继续恶化,更倾向于利奈唑胺引起的肝功能损伤。
药物性肝损伤(drug induced liver injury,DILI)的诊断评估方法有多种[9],Roussel-Uclaf因果关系评估法(the Roussel Uclaf Causality Assessment Method,简称RUCAM量表)由国际医学科学组织理事会(CIOMS)首次提出,1993年改良Danan方案形成,2015年第二版RUCAM量表发布。实践证明RUCAM量表的准确率和可操作性最好,已被我国《药物性肝损伤诊治指南》(2015版)推荐用于评价药物与肝损伤的关系。RUCAM量表共评价7部分内容,各部分内容事先设置既定分值,并根据分值结果,将药物与肝损伤之间的关系明确为“极可能>8分”“很可能6~8分”“可能3~5分”“不太可能1~2分”“无关≤0分”。依据RUCAM量表,本患者的评价内容包括:①用药至发病的时间:<5 d发病,为可疑(+1分);②病程:180 d内ALP实测值/ALP正常值上限下降≥50%(+2分);③危险因素:年龄≥55岁(+1分);④合并用药:伴随用药,如哌拉西林舒巴坦有肝毒性,且发病时间相符(-2分);⑤除外其他肝损伤原因:除外导致肝损伤的各种疾病(+2分);⑥药物以往的肝损伤信息:利奈唑胺说明书有肝脏损伤(+2分);⑦再用药反应:未再使用利奈唑胺(+0分)。故本患者ADR关联性评价6分,为很可能。
关于利奈唑胺致肝功能损伤的危险因素,庞昶等[10]的研究证实了年龄、性别、治疗时间、联用抗菌药物与肝功能损伤有关。国外文献报道[11],长时间使用利奈唑胺(>14 d)会增加肝功能损伤的风险,国内的研究表明[10],用药≤7 d与>7 d比较,前者发生肝损伤的病例数明显少于后者。本例患者用药后次日出现肝酶升高,原因可能为患者高龄、女性、药物易在体内蓄积产生毒性,且患者肺部感染,机体释放促炎细胞因子和其他促炎物质,如氧自由基、白细胞介素等,促进肝酶迅速升高。综上所述,对于高龄、女性、预计疗程长、存在严重感染的利奈唑胺使用者,临床药师应密切注意肝功能情况。
还原型谷胱甘肽由谷氨酸、半胱氨酸及甘氨酸组成,在抗氧自由基,保护肝细胞膜等方面有多重作用[12]。DILI是还原型谷胱甘肽的适应症,初始药物选择合理。2 d后,患者肝酶继续升高,临床药师建议换用异甘草酸镁,异甘草酸镁是第4代甘草酸制剂,具有抗炎、保护肝细胞膜及抗纤维化的作用,与还原型谷胱甘肽相比,前者的降酶作用迅速而显著[13]。此外,2014年9月22日国家药品监督管理局批准增加急性DILI为异甘草酸镁的适应证,可用于治疗ALT明显升高的DILI[14]。
调整用药后,患者肝酶仍持续升高,原因为停药后,利奈唑胺至少需要5个半衰期才能完全排出体外,结合患者肝功能已经受损,可能导致药物代谢减慢,双重因素造成肝酶持续性升高。Borraz等[15]认为,急性肝功能损伤发病3个月后约42%的患者仍存在肝脏生化指标异常,佐证了部分患者的肝酶需要相对较长的时间恢复。
CIOMS基于肝脏受损靶细胞的类型[16],将DILI主要分为①肝细胞损伤型:ALT≥3 ULN (upper limit of normal,正常值上限),且R[R值= (ALT实测值/ALT正常值上限)/(ALP实测值/ALP正常值上限)]≥5;② 胆汁瘀积型:ALP≥2 ULN,且R≤2;③混合型:ALT≥3 ULN,ALP≥2 ULN,且2<R<5,若ALT和ALP达不到上述标准,则称为“肝脏生化学检查异常”。本例患者动态监测R值为1.91~3.03,属于胆汁淤积型或混合型。故临床药师建议加用熊去氧胆酸250 mg,bid,胃管注入。虽然指南[9]暂不推荐保肝药联合使用,但考虑UDCA与异甘草酸镁作用机制不同[17],且UDCA还可缩短药物性肝损伤的病程[18]。两药联合使用可能使患者更多获益。医师接受了临床药师的建议。
利奈唑胺引起的肝功能损伤少有报道。本例患者排除自身疾病和其他药物因素更倾向于利奈唑胺引起的肝功能损伤。肖永久等[19]对利奈唑胺致肝功能损伤的回顾性病例对照研究发现,应用利奈唑胺组ALT水平与对照组相比存在显著性差异。本患者亦为ALT变化较为明显,与其研究结论相同,提示ALT可能对药物较敏感。因此,临床药师在工作中应密切关注使用利奈唑胺患者的肝功能生化指标变化情况,尤其是ALT变化情况,及早识别药物导致的急性肝功能损伤,保障患者用药安全。
REFERENCES
[1] ZHAO W Y, ZHANG J. Linezolid-induced hematologic toxicity and its prevention [J]. Adv Drug React J(药品不良反应杂志), 2012, 14(5): 294-298.
[2] 周华, 李光辉, 陈佰义, 等. 中国产超广谱β-内酰胺酶肠杆菌科细菌感染应对策略专家共识[J]. 中华医学杂志, 2014, 94(24): 1847-1856.
[3] 王建中. 实验诊断学(第2版)[M]. 北京: 北京大学医学出版社, 2010: 298-299.
[4] CHEN C Y, ZHU S Y, ZHOU K T, et al. Retrospective analysis of nephrotoxicity and efficacy of vancomycin trough concentrations in patients with severe pneumonia [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2016, 33(9): 1188-1194.
[5] McCluggage L, Lee K, Potter T, et al. Implementation and evaluation of vancomycin nomogram guidelines in a computerized prescriber-order-entry system [J]. Am J Health Syst Pharm, 2010, 67(1): 70-75.
[6] 中华医学会重症医学分会. 呼吸机相关性肺炎诊断、预防和治疗指南(2013) [J]. 中华内科杂志, 2013, 52(6): 524-543.
[7] PANG C, BAI Y L. One case report of linezolid-induced liver damage and lactic acidosis [J]. Chin J Infect Chemother(中国感染与化疗杂志), 2013, 13(2): 148-149.
[8] FANG Z H, ZENG H H, ZHANG J. Aanalysis of liver injury induced by linezolid combined with caspofungin (one case) [J]. Clin Med J(临床药物治疗杂志), 2011, 9(5): 55-57.
[9] 中华医学会肝病学分会药物性肝病学组. 药物性肝损伤诊治指南[J]. 临床肝胆病杂志, 2015, 31(11): 1752-1769.
[10] PANG C, Piao C H, LIN S W. Risk factor analysis of liver injury induced by linezolid for treatment of methicillin- resistantStaphylococcus aureuspneumonia [J]. Her Med(医药导报), 2015, 34(1): 43-46.
[11] Manfredi R. Update on the appropriate use of linezolid in clinical practice [J]. Ther Clin Risk Manag, 2006, 2(2): 455-464.
[12] 谢海丽, 万世泽. 还原型谷胱甘肽治疗化疗药物性肝损害32例[J]. 医药导报, 2010, 29(6): 740-741.
[13] YANG Y Y, ZHU J F. Clinical efficacy of Magnesium isoglycyrrhizinate injection in treatment of chronic hepatitis with high blood level of aminotransferas [J]. Tongji Univ(Med Sci)(同济大学学报: 医学版), 2009, 30(6): 114-116.
[14] MAO Y M, ZENG M D, CHEN Y, et al. Magnesium isoglycyrrhizinate in the treatment of chronic liver diseases: A randomized, double-blind, multi-doses, active drug controlled, muitl-center study [J]. Chin J Hepatol(中华肝脏病杂志), 2009, 17(11): 847-851.
[15] Borraz Y, Fernandez M C, Garcia-Munoz B, et al. Would it be desirable to modify the cut -off point for definition of chronicity in drug-induced liver injury(DILI)? [C]. 61st Annual Meeting of the American Association for the Study of Liver Diseases, 2010: a270.
[16] Hayashi P H, Fontana R J. Clinical features, diagnosis, and natural history of drug-induced liver injury [J]. 2014, 34(2): 134-144.
[17] SHI H, WEI J, WANG Z K, et al. Common agents in patients with drug-induced liver injury and observation of therapeutic efficacy of ursodeoxycholic acid [J]. J Pract Hepatol(实用肝脏病杂志), 2015, 18(1): 34-37.
[18] 张长江, 郭建琼, 游忠岚, 等. 熊去氧胆酸治疗药物性肝损伤的随机、对照研究[J]. 肝脏, 2014, 19(3): 190-192.
[19] XIAO Y J, XIE L X. Effect of linezolid in combination with other antibiotics on liver function of patients: A retrospective analysis [J]. J Chin PLA Postgr Med Sch(军医进修学院学报), 2011, 32(6): 596-597.
Pharmaceutical Care of Liver Function Injury in the Suspicion of Linezolid-induced within a Patient
SUN Guoxiana, SHAN Qinga, CAI Pinga, SUN Anxiua, HOU Honglingb
(Affiliated Hospital of Yangzhou University, a.Department of pharmacy, b.Department of Neurology, Yangzhou 225001, China)
ABSTRACT:OBJECTIVETo discuss pharmaceutical care of liver function injury in the suspicion of linezolid-induced with clinical pharmacist's participation.METHODSThe use of linezolid maybe a possible cause of liver injury through analyzing primary disease, changes in liver function, combined medications and other factors by clinical pharmacist, who also promptly put forward intervention recommendations, in a pulmonary infection case who suffered liver function impairment during use of linezolid.RESULTSA timely and accurate analyse of the causes with liver function injury was carried out by clinical pharmacists, whose recommendations were adopted by clinicians, thus, the patient's condition had been controlled.CONCLUSIONClinical pharmacists actively participate in the treatment processes, give corresponding suggestions to clinical doctors, can ensure the drug safety and effectiveness in patients.
KEY WORDS:linezolid; liver function injury; pharmaceutical care; clinical pharmacist
中图分类号:R969.3
文献标志码:B
文章编号:1007-7693(2018)09-1412-04
DOI:10.13748/j.cnki.issn1007-7693.2018.09.031
引用本文:孙国先, 单清, 蔡萍, 等. 疑似利奈唑胺引发肝功能损伤患者的药学监护[J]. 中国现代应用药学, 2018, 35(9): 1412-1415.
收稿日期:2017-11-07
作者简介:孙国先,男,硕士生,主管药师 Tel: (0514)82981199 E-mail: 178362802@qq.com
(本文责编:曹粤锋)