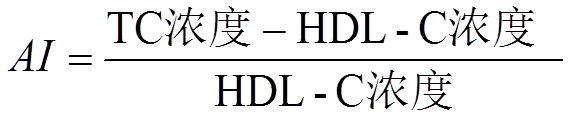 (1)
(1)信长慧1,张竞超1,张付菊2
(1.天津市第五中心医院,天津 300451;2.天津市宁河中医院,天津 301500)
摘要:目的研究雷公藤多苷片对高脂小鼠血脂的影响。方法采用高血脂小鼠模型,通过小鼠尾静脉注射不同剂量(0.5,1.0,1.5 mg·kg-1·d-1)雷公藤多苷,测定不同时间段小鼠体质量和血清总胆固醇(total cholesterol,TC)、甘油三酯(total triglyceride,TG)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)的含量及卵磷脂胆固醇酰基转移酶(lecithin cholesterol acyltransferase,LCAT)、肝脂酶(hepatic lipase,HL)和脂蛋白脂酶(lipoprotein lipase,LPL)的活性,研究雷公藤多苷对小鼠体质量、血脂代谢、动脉粥样硬化指数、肝脏LCAT水平等的影响。结果给予高脂饲料后小鼠体质量和血脂显著升高(p<0.01),动脉粥样硬化指数显著升高(p<0.01),抗动脉粥样硬化指数显著下降(p<0.01)。注射雷公藤多苷能显著降低高血脂模型小鼠血清TC、TG和LDL-C,同时显著降低高脂饮食所导致的动脉粥样硬化指数升高。此外,雷公藤多苷片能显著提高血清LCAT水平和HL、LPL的活性。结论雷公藤多苷片具有一定的降血脂功能,并能有效降低动脉粥样硬化的发生几率。
关键词:雷公藤多苷片;小鼠高脂模型;降血脂;抗动脉粥样硬化
高血脂症是指机体代谢或运转异常而造成的血浆中一种或多种脂质含量高于正常水平的病理状态,表现为高胆固醇血症、高甘油三酯血症等,临床上又分为原发性和继发性2类。随着人们生活习惯的改变,我国患高血脂患者群呈逐年上升趋势。据WHO统计的数据表明,2016年全球有1 500多万人死于心血管疾病,且这一数据每年都在增长,心血管疾病已经成为21世纪夺取人们性命的头号杀手。而高血脂症是引发心血管疾病的重要因素,此外,高血脂症患者还可引发糖尿病、脂肪肝等多种并发症[1-2],严重影响着人们生活,已成为人类健康的第一号隐形杀手,因此,高血脂症的研究治疗越来越受人们关注。
雷公藤多苷是从卫矛科植物雷公藤根部中粗提取的一种脂溶性混合物,具有抗炎、免疫抑制、抗肿瘤等作用[3]。雷公藤多苷片是最早研制成功的、迄今为止应用最广泛的雷公藤制剂[4]。目前对雷公藤多苷片的研究主要集中于雷公藤多苷片的抗肿瘤、抗炎、抗风湿作用及其机制[5-6],而对其降血脂能力研究较少。本实验通过建立高脂血症小鼠模型,研究不同剂量雷公藤多苷片对动物体质量、血脂代谢、动脉粥样硬化指数(atherosclerosis index,AI)、肝脏卵磷脂胆固醇脂酰基转移酶(lecithin cholesterol acyltransferase,LCAT)水平等的影响,探讨雷公藤多苷片在降脂方面的效果和作用机制。
SPF级昆明种小鼠60只,♂,6周龄,体质量18~22 g,北京华阜康生物科技股份有限公司提供,生产合格证号:No.11401300073225;生产许可证号:SCXK(京)2014-0004;恒温饲养[(24±1)℃],相对湿度50%~60%,明暗周期12 h,自由饮水、进食。
高脂饲料配方参照《保健食品检验与评价技术规范(2003版)》[7]:猪油10%、蛋黄粉10%、胆固醇1%、基础饲料78.8%、脱氧胆酸盐0.2%。
辛伐他汀片(山东鲁抗医药集团赛特有限责任公司,批号:101411);总胆固醇(total cholesterol,TC)检测试剂盒、总甘油三酯(total triglyceride,TG)检测试剂盒、高密度脂蛋白(high density lipoprotein cholesterol,HDL-C)检测试剂盒、低密度脂蛋白(low density lipoprotein cholesterol,LDL-C)检测试剂盒(中生北控生物科技股份有限公司,批号:110116,110411,110121,110133);卵磷脂胆固醇酰基转移酶(lecithin cholesterol acyltransferase,LCAT)试剂盒、肝脂酶(hepaticlipase,HL)试剂盒、脂蛋白脂酶(lipoprteinlipase,LPL)试剂盒(南京建成生物工程研究所,批号:20160715,20160716,20160720);雷公藤多苷片(浙江得恩德制药股份有限公司,批号:900-01577)。
健康♂昆明小鼠60只,适应性饲养5 d后,随机取10只作为正常对照组,其余50只随机分为5组,每组10只,饲喂高脂饲料,分别为高脂模型组,辛伐他汀组(10 mg·kg-1·d-1)和雷公藤多苷片低、中、高剂量组(0.5,1.0,1.5 mg·kg-1·d-1),尾静脉注射给药,正常对照组和高脂模型组给予等体积的PBS。饲喂高脂饲料42 d后,小鼠TC水平均高于《保健食品检验与评价技术规范(2003版)》中正常范围(2.35~3.53 mmol·L-1),表明高脂小鼠模型建造成功。
实验持续6周,每周采用电子分析天平称定小鼠体质量,组内加权平均,眼球取血法取小鼠全血,4 ℃沉降30 min,以10 000 r·min-1在4 ℃离心5 min,分离血清,测定血清TG、TC、HDL-C、LDL-C、LCAT的含量。冰上取肝脏,预冷生理盐水洗涤后吸干水分,-80 ℃保存备用。按公式(1)、(2)计算AI、抗动脉粥样硬化指数(anti- atherosclerosis index,AAI)。
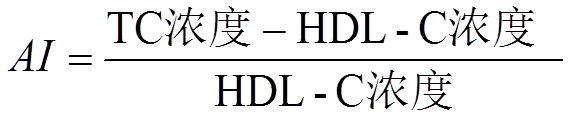 (1)
(1)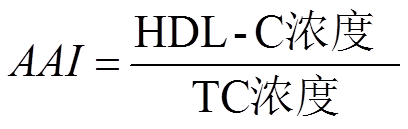 (2)
(2)
试验数据采用SPSS 17.0软件进行统计学处理,数据均以 表示,各组间比较采用t检验,P<0.05为差异具有统计学意义。
表示,各组间比较采用t检验,P<0.05为差异具有统计学意义。
与正常对照组比较,高脂模型组小鼠体质量显著增加(P<0.01);与高脂模型组比较,雷公藤多苷片低、中、高剂量组小鼠体质量均显著降低(P<0.05或 <0.01),表明雷公藤多苷片对于高脂小鼠体质量增长具有显著抑制作用,且抑制作用在一定范围内随着给药量的增加而增加,其中雷公藤多苷高剂量组效果最显著(P<0.01)。结果见表1。
与高脂模型组比较,辛伐他汀组和雷公藤多苷低、中、高剂量组小鼠血清中TC、HDL-C、LDL-C、TG指标明显降低(P<0.05)。表明雷公藤多苷片可显著降低高血脂小鼠血清TC、HDL-C、LDL-C、TG等病理指标。结果见图1A。
与高脂模型组比较,辛伐他汀组和雷公藤多苷低、中、高剂量组小鼠血清中TC/HDL-C、TG/HDL-C、LDL-C/HDL-C水平明显降低(P<0.05),且高剂量组TG/HDL-C低于辛伐他汀组。由此可见,高剂量的雷公藤多苷片还可有效降低血清中TG的含量,即具有一定减肥功效。结果见图1B。
表1 雷公藤多苷片对高脂小鼠体质量的影响(n=10,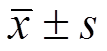 )
)
Tab. 1 Effect of tripterygium glycosides on body weight of hyperlipemia mice(n=10,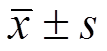 )
)

注:与正常对照组比较,1)P<0.01;与高脂模型组比较,2)P<0.05,3)P<0.01。
Note: Compared with control group,1)P<0.01; compared with high fat group,2)P<0.05,3)P<0.01.
图1 雷公藤多苷片对小鼠血清中TC、HDL-C、LDL-C、TG指标的影响(n=10, )
)
与正常对照组比较,1)P<0.01;与高脂模型组比较,2)P<0.05,3)P<0.01。
Fig. 1 Effect of tripterygium glycosides on serum TC, HDL-C, LDL-C and TG levels in mice(n=10, )
)
Compared with normal control group,1)P<0.01; compared with high fat group,2)P<0.05,3)P<0.01.
与正常对照组比较,高脂模型组小鼠的AI显著升高(P<0.01),表明高脂饮食能够增加动脉粥样硬化的发生几率。与高脂模型组比较,辛伐他汀组和雷公藤多苷片低、中、高剂量组小鼠AI显著降低(P<0.01),表明雷公藤多苷片能够显著降低高脂小鼠的AI,从而减少动脉粥样硬化的发生;雷公藤多苷片高剂量组AI降幅大于辛伐他汀组,小鼠AAI变化与AI变化趋势相反。小鼠AI和AAI变化见图2。
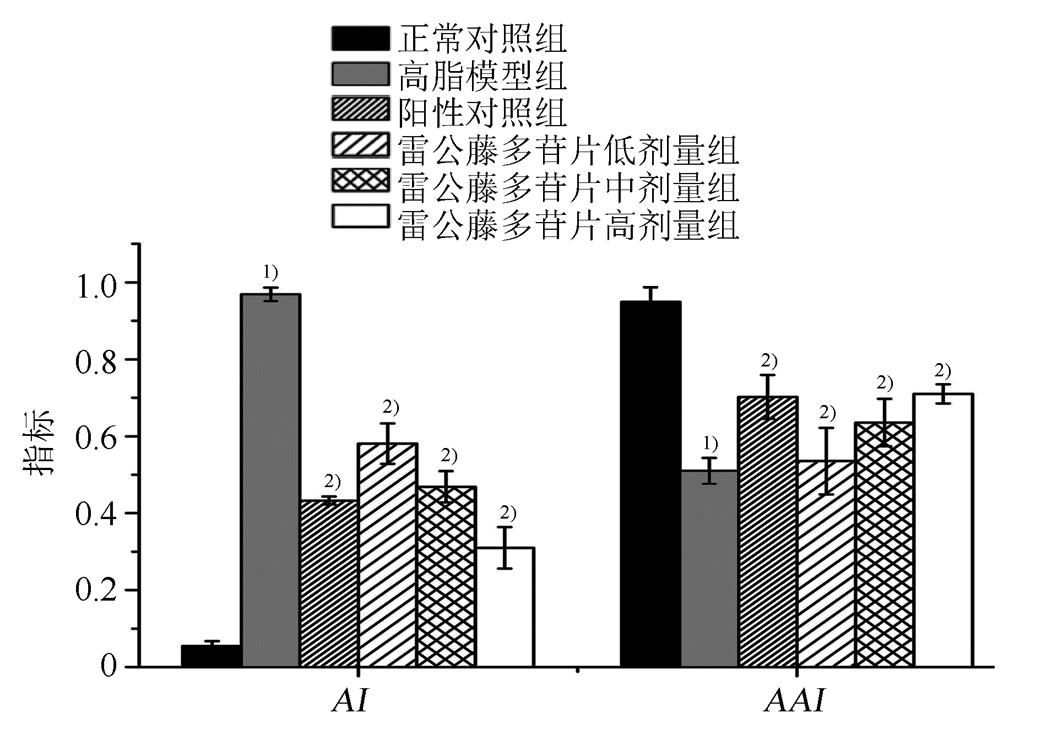
图2 雷公藤多苷片对AI和AAI的影响
与正常对照组比较,1)P<0.01;与高脂模型组比较,2)P<0.01。
Fig. 2 Effect of tripterygium glycosides onAIandAAIin mice
Compared with normal control group,1)P<0.01; compared with high fat group,2)P<0.01.
与正常对照组比较,高脂模型组小鼠肝脏LCAT水平显著降低;与高脂模型组比较,雷公藤多苷片各剂量组LCAT水平有不同程度提高,其中、高剂量组作用效果最佳,比高脂模型组作用效果提高了81.05%,表明雷公藤多苷片能够增强小鼠肝脏分解过剩胆固醇的能力。结果见表2。
与正常对照组比较,高脂模型组LPL和HL活性均显著降低,辛伐他汀和雷公藤多苷片组均能够显著降低高脂引起的LPL和HL活力降低,雷公藤多苷片高剂量组的作用效果最佳;与高脂模型组比较,雷公藤多苷片高剂量组对于LPL和HL活力的提高分别高达121%,140%,表明雷公藤多苷片在调节LPL和HL活性方面效果显著。结果见表2。
表2 雷公藤多苷片对小鼠肝脏LCAL水平、LPL和HL活力的影响(n=10, )
)
Tab. 2 Effect of tripterygium glycosides on LCAT, LPL and HL in liver of hyperlipidemic mice(n=10, )
)
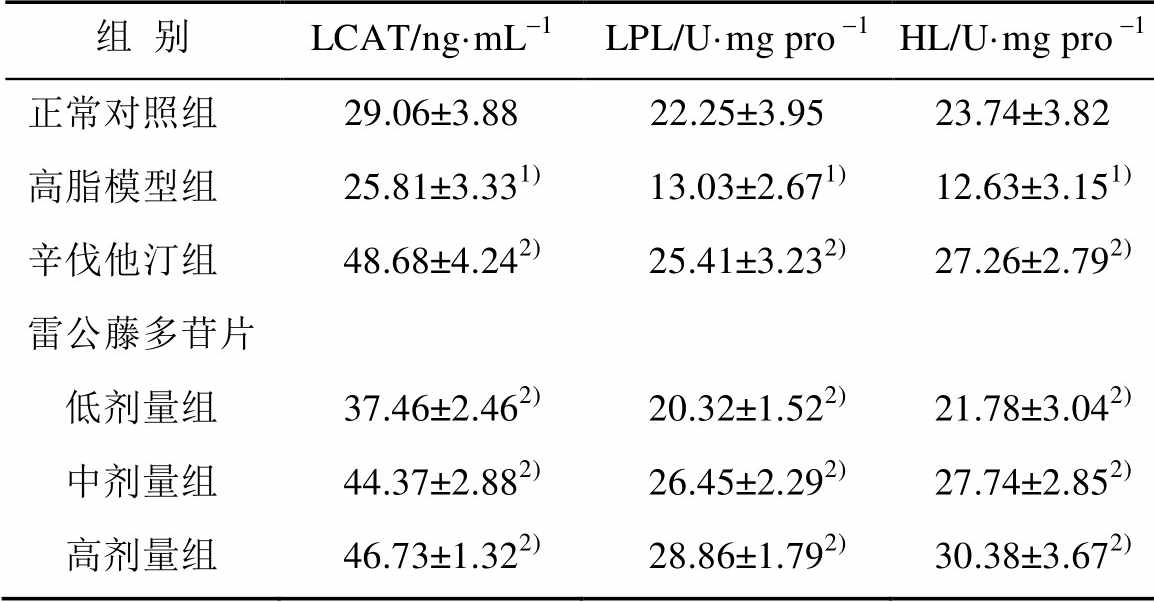
注:与正常对照组比较,1)P<0.01;与高脂模型组比较,2)P<0.01。
Note: Compared with control group,1)P<0.01; compared with high fat group,2)P<0.01.
高血脂症是由于脂肪代谢或运转异常使TC、TG和(或)LDL-C过高和(或)HDL-C过低而引发的一种病症。高脂血症是许多心脑血管疾病(如动脉粥样硬化、脑中风等)发病的重要原因[8],所以控制血脂水平对降低心脑血管疾病的发病率具有重要意义。
近年来,植物来源的天然药物在防治高血脂症方面的应用受到广泛关注,具有疗效稳定、不良反应小等优点。雷公藤多苷从植物雷公藤中提取,具有抗炎、抗肿瘤、免疫抑制等多种药理活性。最新研究发现,雷公藤多苷片能够结合细胞核中的孤儿核受体Nur77,诱导产生特定的机制作用,清除损伤的线粒体,从而抑制炎症及肥胖等相关疾病[9];另一方面,雷公藤多苷是复杂的多组分体系,有些成分是雷公藤多苷中的有效药理成分,有些是毒性成分[10-12],但通过优化分离提取工艺,可降低雷公藤多苷中雷公藤甲素等引起的肝毒性[13],雷公藤多苷片在降血脂症方面具有较好的应用价值。
本研究建立了小鼠高脂模型,实验研究表明:雷公藤多苷片具有降低血脂中TC、TG和LDL-C的能力,同时雷公藤多苷片能够降低高脂饮食所引起的AI、升高AAI。因此,笔者认为雷公藤多苷可以通过调节血脂指标达到降血脂作用。
REFERENCES
[1] ZHANG X, WU Z, LI H A. Review of pharmacological research progress and clinical use on multi-glycoside of tripterygium wilfordi hook tablet [J]. Clin Med J(临床药物治疗杂志), 2014, 12(4): 8-13.
[2] 陈铭祥, 冯玉静, 王定勇, 等. 雷公藤红素的研究进展[J]. 中成药, 2010, 32(3): 473-476.
[3] Miner M, Esposito K, Guay A, et al. Cardiometabolic risk and female sexual health: the Princeton III summary [J]. J Sex Med, 2012, 9(3): 641-651.
[4] Dibaba D T, Xun P, Song Y, et al. The effect of magnesium supplementation on blood pressure in individuals with insulin resistance, prediabetes, or noncommunicable chronic diseases: a meta-analysis of randomized controlled trials [J]. Am J Clin Nutr, 2017, 106(3): 921-929.
[5] Catoe H, Jarvis J, Gupta S, et al. The road to addressing noncommunicable diseases and cancer in global health policy [J]. Am Society Clin Oncol-Educat Book, 2017(37): 29-33.
[6] GAO G, FU H X, XU F Y, et al. Anti-rejection effect of tripterygium glycosides on allogeneic islet transplantation in mice [J]. Herld Med(医药导报), 2017, 36(7): 757-761.
[7] 卫生部卫生监督司. 保健食品检验与评价技术规范实施手册[M]. 北京: 中科多媒体电子出版社, 2003.
[8] 庄一义. LCAT、CETP、LpAl在胆固醇逆向转运中的作用[J]. 上海医学, 1997(2): 121-124.
[9] Fang W, Peng F, Yi T, et al. Biological activity and safety of Tripterygium extract prepared by sodium carbonate extraction [J]. Molecules, 2012, 17(9): 11113-11123.
[10] Wu W, Yang J J, Yang H M, et al. Multi-glycoside of Tripterygium wilfordiiHook. f. attenuates glomerulosclerosis in a rat model of diabetic nephropathy by exerting anti-microinflammatory effects without affecting hyperglycemia [J]. Int J Mol Med, 2017, 40(3): 721-730.
[11] Chyun D A. Nursing research and the global burden of noncommunicable diseases [J]. Nurs Res, 2013, 62(4): 217.
[12] De Jong W H, Van Der Ven L T, Sleijffers A, et al. Systemic and immunotoxicity of silver nanoparticles in an intravenous 28 days repeated dose toxicity study in rats [J]. Biomaterials, 2013, 34(33): 8333-8343.
[13] LI C Q, SUN W, SHAO J D, et al. Review research on attenuating toxicity of Chinese herbTripterygium wilfordii[J]. Chin J Exp Tradit Med Form(中国实验方剂学杂志), 2011, 17(10): 263-265.
Study on the Effect of Tripterygium Glycosides on Hyperlipidemia Mice
Xin Changhui1, Zhang Jingchao1, Zhang Fuju2
(1.The 5th Central Hospital of Tianjin, Tianjin 300451, China; 2.Tianjin Ninghe District Hospital, Tianjin 301500, China)
ABSTRACT:OBJECTIVETo investigate the effect of tripterygium glycosideson hyperlipidemia micein vivo.METHODSThe hyperlipidemia mice model was established by feeding with high-fat diet. Low-, middle- and high-dose tripterygium glycosides groups were injected intravenously at dosages of 0.5, 1.0, 1.5 mg·kg-1·d-1, respectively. The changes in body weight, serum total cholesterol(TC), total triglyceride(TG), high density lipoprotein cholesterol(HDL-C), low density lipoprotein cholesterol(LDL-C), the activity of lecithin cholesterol acyltransferase(LCAT), hepatic lipase(HL) and lipoprotein lipase(LPL) were measured. At the same time, the atherosclerosis index(AI) and anti-atherogenic index(AAI) were measured to explore the effect of tripterygium glycosides on atherosclerosis.RESULTSbody weight, serum lipids andAIwere significantly increased after feeding with high-fat diet(P<0.01), whileAAIwas significantly decreased(P<0.01). Tripterygium glycosides could significantly reduce serum TC, TG and LDL-C, and significantly inhibitAIinduced by high-fat diet in hyperlipidemic mice. In addition. the level of LCAT and activity of HL and LPL were significantly increased after treat with tripterygium glycosides.CONCLUSIONTripterygium glycosides has hypolipidemic effect and it can decrease the rate of atherosclerosis.
KEY WORDS:tripterygium glycosides; hyperlipidemia mice; hypolipidemic; anti-atherosclerosis
中图分类号:R285.5
文献标志码:A
文章编号:1007-7693(2018)09-1351-04
DOI:10.13748/j.cnki.issn1007-7693.2018.09.018
引用本文:信长慧, 张竞超, 张付菊. 雷公藤多苷片对高脂小鼠血脂的影响[J]. 中国现代应用药学, 2018, 35(9):1351-1354.
收稿日期:2018-01-25
作者简介:信长慧,女,中药师 Tel: (022)25815143 E-mail: 22845474@qq.com
(本文责编:李艳芳)