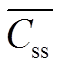 =(0.48±0.03)mg·mL-1,AUC0–τ=(3.87±0.26)h·mg·mL-1。结论建立的柱前衍生-HPLC法适用于白消安血药浓度测定及药动学研究,不同给药途径的药动学参数为临床药动学研究提供了依据。
=(0.48±0.03)mg·mL-1,AUC0–τ=(3.87±0.26)h·mg·mL-1。结论建立的柱前衍生-HPLC法适用于白消安血药浓度测定及药动学研究,不同给药途径的药动学参数为临床药动学研究提供了依据。刘秋梅1,田卫伟2,喻光燚1,温美强1,任雅楠1,赵琪1,张丽锋1*
(1.山西医科大学药学院,太原 030001;2.山西医学科学院山西大医院血液内科,太原 030032)
摘要:目的建立测定家兔血清中白消安浓度和家兔体内药动学特征的柱前衍生化HPLC。方法以1,5-戊二醇二甲磺酸酯为内标,二乙基二硫代氨基甲酸钠为衍生化试剂。流动相:甲醇-水(54∶46),流速:0~20 min(1.0 mL·min-1),20~27 min (1.3 mL·min-1)。柱温:30 ℃,检测波长:280 nm,进样量:25 μL。家兔分别以灌胃、静注的方式给予白消安,按本法测定血药浓度,DAS 3.0计算药动学参数。结果白消安的血药浓度在0.1~3.4mg·L-1内线性关系良好(r=0.999 7),日内、日间精密度以及样品稳定性符合中国药典2015年版的规定。低、中、高浓度的萃取回收率分别为90.0%,89.0%,91.5%。不同给药途径获得的药动学参数:单剂量口服t1/2=(2.26±0.66)h,k=(0.33±0.12)·h-1,ka=(2.54±1.3)·h-1,AUC0–t=(1.95± 0.18)h·mg·mL-1;单剂量静脉注射t1/2=(1.53±0.09)h,k=(0.45±0.03)·h-1,AUC0–∞=(4.38±0.26)h·mg·mL-1。多剂量口服后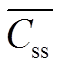 =(0.48±0.03)mg·mL-1,AUC0–τ=(3.87±0.26)h·mg·mL-1。结论建立的柱前衍生-HPLC法适用于白消安血药浓度测定及药动学研究,不同给药途径的药动学参数为临床药动学研究提供了依据。
=(0.48±0.03)mg·mL-1,AUC0–τ=(3.87±0.26)h·mg·mL-1。结论建立的柱前衍生-HPLC法适用于白消安血药浓度测定及药动学研究,不同给药途径的药动学参数为临床药动学研究提供了依据。
关键词:白消安;柱前衍生;高效液相色谱法;药动学参数
白消安化学名为1,4-丁二醇二甲磺酸酯,是一种双功能烷化剂,是肿瘤治疗中最主要的一类药物,结构式见图1[1]。白消安对造血干细胞有细胞毒作用,目前临床上在造血干细胞移植前普遍使用的大剂量预处理方案是白消安联合环磷酰胺[2-3]。使用时的问题是白消安安全治疗窗狭窄,剂量过小会增加移植排斥和疾病复发的风险,过大可直接产生肝、肾、肺和神经毒性,疗效和不良反应与AUC或稳态血药浓度密切相关[4-5]。而且白消安存在较大的个体差异,会受到患者年龄、体质量、体内酶活性等因素的影响[6-7]。目前国内外关于白消安的临床药动学数据很少,本研究通过参考国内外相关文献[8-17],建立了一种柱前衍生的HPLC,为临床血药浓度的监测提供一种较简便的检测方法。
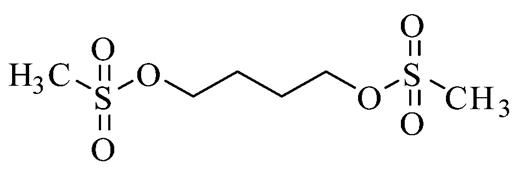
图1 白消安结构式
Fig. 1 Structural formula of busulfan
HITACHI高效液相色谱仪(日本日立公司);微量高速离心机(日立工机株式会社);TDZ5-WS台式离心机(湖南湘仪实验室仪器开发有限公司);XW-80A微型漩涡混合器(上海沪西分析仪器厂有限公司);NDK200氮气吹扫仪(杭州米欧仪器有限公司);LaboStar 2 DI 超纯水机(西门子股份公司)。
白消安对照品(上海阿拉丁生化科技股份有限公司,批号:L1305060;纯度:98%);1,5-戊二醇二甲磺酸酯(杭州麦俊化工科技有限公司,批号:2374-22-3;纯度:98%);二乙基二硫代氨基甲酸钠(DDTC,上海源叶生物科技有限公司,批号:Z29S7Y22163;纯度:99%);甲醇、乙腈为色谱纯;丙酮、乙醚、无水乙醇等均为分析纯试剂,试验用水为三蒸水。
家兔12只,体质量(2±0.5)kg,由山西医科大学动物中心实验室提供,许可证号:SYXK(晋) 2016-004。
衍生化反应会受各种因素影响,其中反应温度、反应时间、衍生化试剂浓度为最主要影响因素,会影响白消安的衍生化反应程度,直接与白消安的测量有关。
2.1.1 色谱条件 色谱柱:Diamonsil(Ⅱ)C18柱(150 mm×4.6 mm,5 μm);柱温:30 ℃;流动相:甲醇-水(60∶40);流速:1.0 mL·min-1,检测波长:280 nm,进样量:10 μL。
2.1.2 反应温度 据王成来[13]研究中所设计的正交试验结果,衍生反应温度对衍生反应的结果无统计学意义;据Henner[17]研究中对白消安衍生产物的稳定性实验结果所述,衍生产物在21 ℃稳定,超过36 ℃不稳定;本研究固定一个衍生化试剂浓度(摩尔比1∶3),分别在25,30,35 ℃下进行衍生化反应,平行反应大概6 h,3种温度下峰面积如表1。选定反应温度30 ℃。
表1 不同温度下白消安衍生产物的峰面积(n=3)
Tab. 1 Peak area of busulfan derived products in different temperature(n=3)

2.1.3 反应时间 固定衍生化试剂浓度,反应条件30 ℃,平行反应6 h,于不同时间点记录衍生产物的峰面积。结果发现,随着反应时间的延长,产物峰面积一直近似线性增加,一定时间(大概30 min)后,会有另一种产物生成。本研究选定反应时间为30 min。衍生化反应随时间的增长趋势见图2,衍生化反应见图3,其他产物的生成见图4。
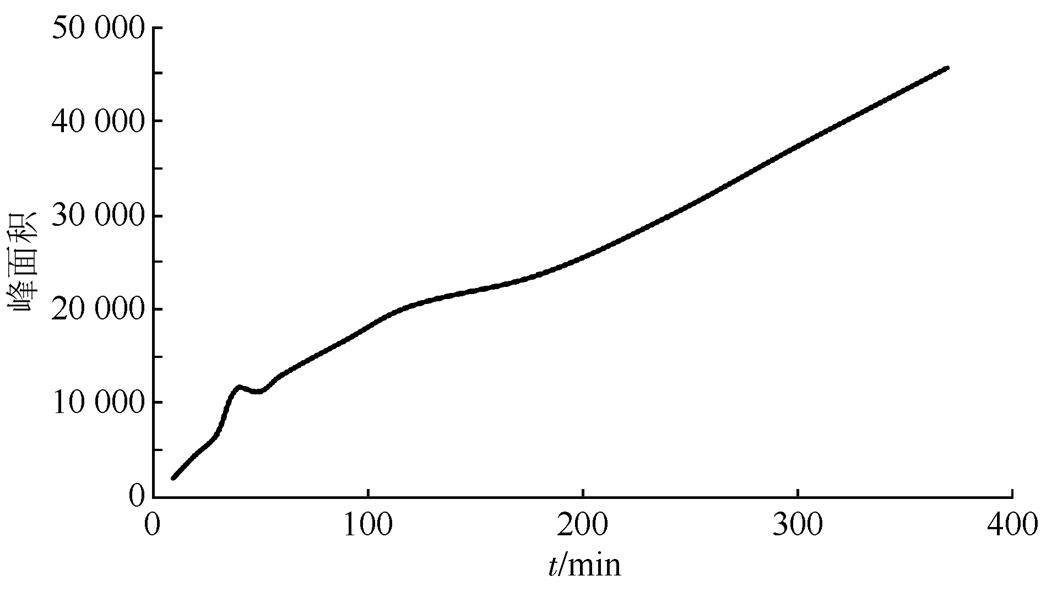
图2 反应时间对衍生化反应的影响
Fig. 2 The influence of derivative time on derivatization reaction
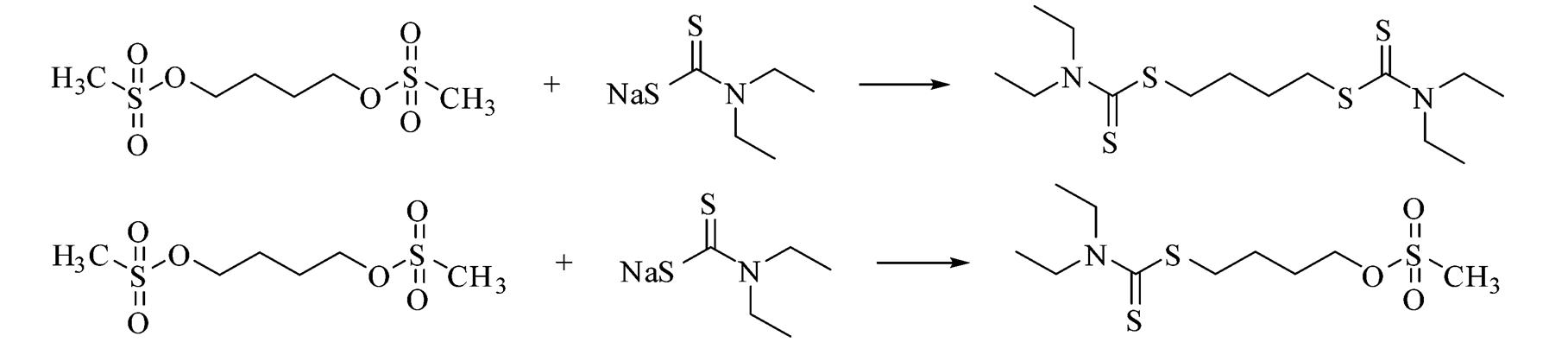
图3 白消安衍生化反应产物
Fig. 3 Derived products of busulfan
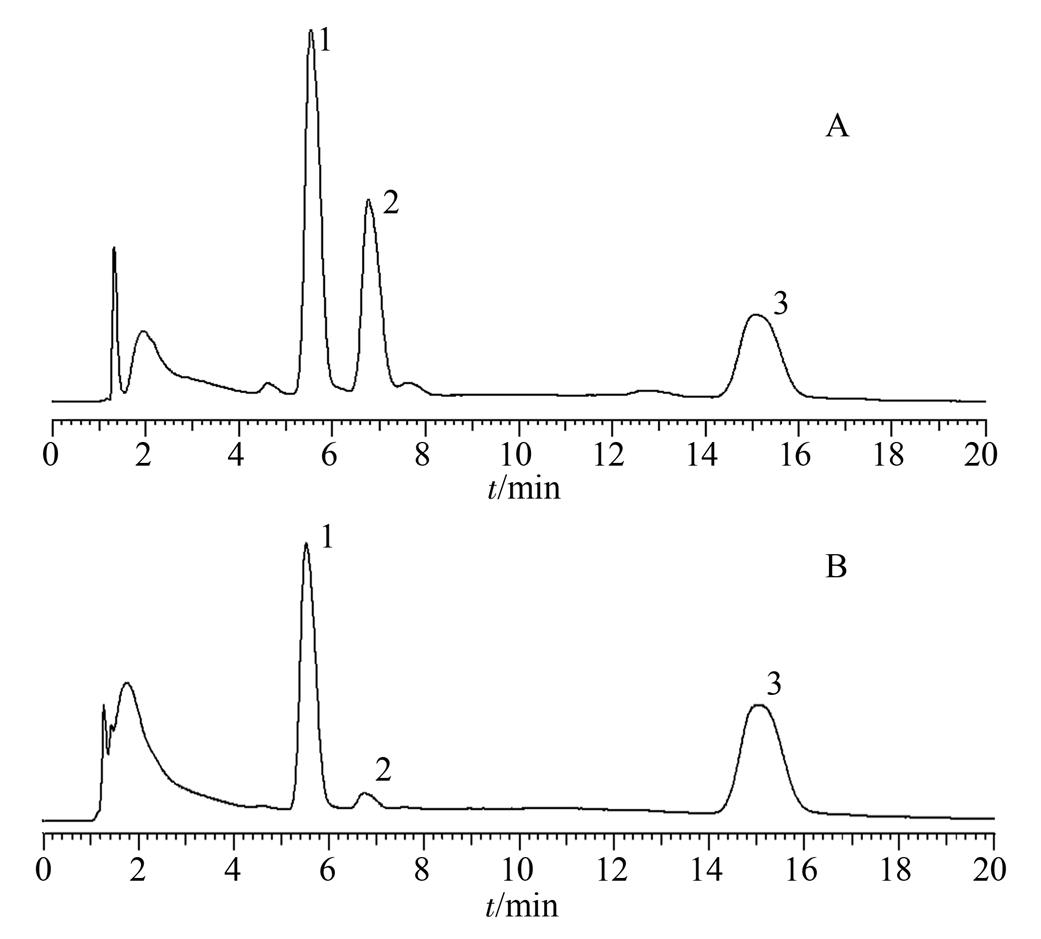
图4 不同时间峰的比较
A-反应10 min;B-反应120 min;1-目标产物峰;2-其他产物峰;3-衍生化试剂峰。
Fig. 4 Comparison of different time peaks
A-react 10 min; B-react 120 min; 1-target product peak; 2-other product peaks; 3-derivative reagent peak.
2.1.4 衍生化试剂浓度 固定反应温度、反应时间、白消安浓度,记录使用不同浓度的衍生化试剂浓度时的峰面积。结果发现,随着衍生化试剂浓度的增大,反应产物峰面积一直近似线性增加,以摩尔比为横坐标,峰面积为纵坐标作图,见图5。据王玲玲[21]文献中所述,0.08 g·mL-1的DDTC溶液已达饱和。为了提高白消安的响应值,本研究选定DDTC的饱和浓度作为最终衍生化浓度。
2.2.1 色谱条件 色谱柱:Diamonsil(Ⅱ)C18柱(150 mm×4.6 mm,5 μm);柱温:30 ℃;流动相:甲醇-水(54∶46);流速:0~20 min,1.0mL·min-1,20~27 min,1.3mL·min-1;检测波长:280 nm,进样量:25 μL。
2.2.2 标准溶液与衍生化试剂的配制 白消安标准工作液的配制:精密称取白消安标准品1.25 mg于25 mL量瓶,加入丙酮600 μL溶解,用乙腈稀释成50 mg·L-1的白消安储备液,进一步用乙腈将储备液稀释成0.4,0.8,1,2,4,8,10,13.6 mg·L-1的系列工作液。
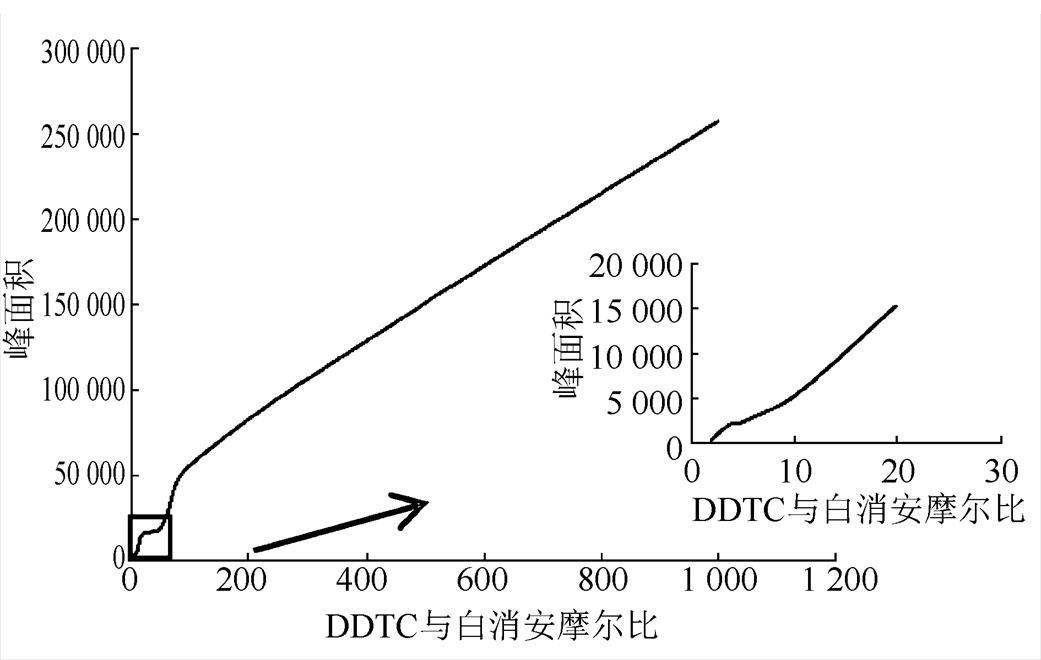
图5 DDTC与白消安不同摩尔比时峰面积
Fig. 5 Derivatization product peak area at different molar ratios of DDTC with busulfan
内标工作液的配制:精密称取1,5-戊二醇二甲磺酸酯1.3 mg于25 mL量瓶,用乙腈稀释成52 mg·L-1的标准储备液,再用乙腈稀释成4 mg·L-1,以此作为内标工作液。
衍生化试剂使用前临时配制,称取DDTC 0.8 g,加入三蒸水溶解至10 mL,涡旋10 s,过滤,备用。
2.2.3 血清样品的处理 吸取血清样品200 μL,加入内标溶液50 μL,涡旋10 s,混匀后加入乙腈400 μL,涡旋20 s,加入新鲜配制的衍生化试剂200 μL,涡旋1 min,在30 ℃、150 r·min-1的恒温摇床中反应30 min,立即加入冰水400 μL,涡旋10 s,随后加入乙醚3.5 mL,涡旋混合2 min,4 000 r·min-1离心10 min。定量取乙醚(上层)3 mL,置于30 ℃氮吹仪下吹干,用甲醇150 μL复溶,取25 μL进样。
2.2.4 方法专属性 分别取空白血清、空白血清外加标准溶液和家兔服药后的血清,按“2.2.3”项下方法处理,进样分析后得色谱图,见图6。白消安和内标保留时间分别为11.8 min和18.7 min,峰形好,白消安和内标能完全分离,血清中内源性物质不影响白消安和内标的测定。
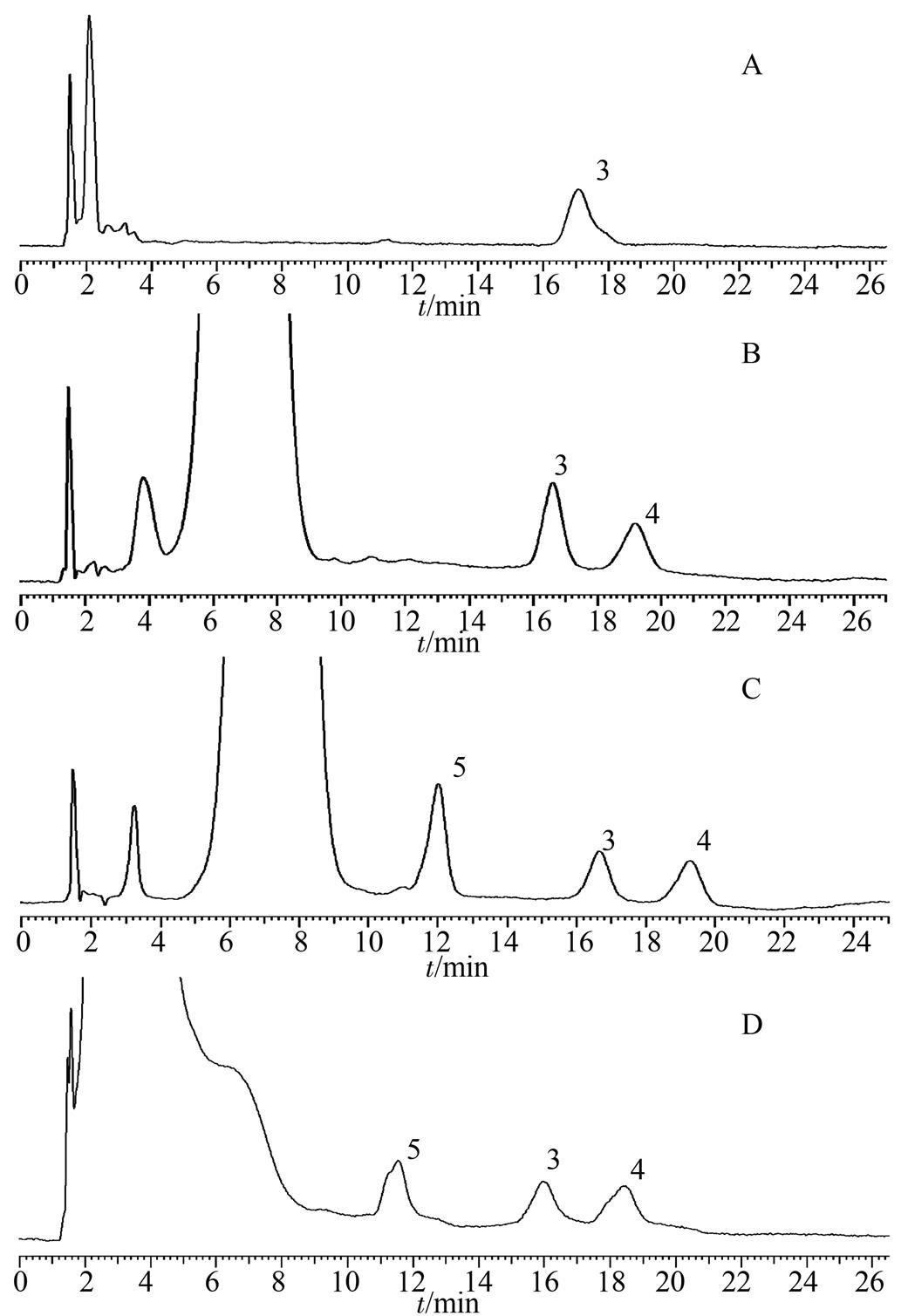
图6 白消安、内标衍生化色谱图
A-空白血清(含DDTC);B-空白血清+内标标准液;C-空白血清+白消安标准液+内标标准液;D-家兔口服给药后1 h的血清样品;3-DDTC;4-内标衍生化产物;5-白消安衍生化产物。
Fig.6 Chromatograms of derived busulfan and internal standard
A-blank serum(contain DDTC); B-blank serum+internal standard solution; C-blank serum+busulfan standard solution+standard internal standard solution; D-serum samples after administration for 1 h; 3-DDTC; 4-derivatization product of internal standard; 5-ddrivatization product of busulfan.
2.2.5 标准曲线和定量下限 取不同质量浓度的标准液、加入空白血清,配制成分别为0.1,0.2,0.25,0.5,1,2,2.5,3.4 mg·L-1的血清样品,按“2.2.3”项下方法处理对照品血清,以血清中待测物浓度为横坐标C,待测物与内标物的峰面积比值为纵坐标R,用加权最小二乘法进行回归运算,求得的直线回归方程为R=0.804 5C-0.008 7 (r=0.999 7)。结果表明白消安在0.1~3.4 mg·L-1内线性关系良好。白消安的定量下限为0.1 mg·L-1,RSD=9.4%,n=5,准确度RE=95%。
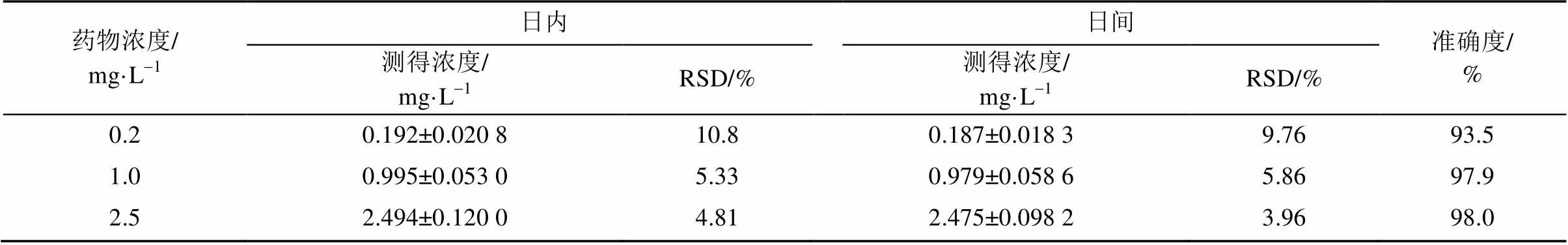
2.2.6 精密度与准确度试验 配制低、中、高(0.2,1,2.5 mg·L-1)3种质控浓度的白消安对照品血清,每种浓度5份,按“2.2.3”项下方法处理后同日内测定,依据当日的标准曲线计算白消安的血药浓度,考察日内精密度;连续3 d同法操作,考察日间精密度,结果见表2。
表2 精密度与准确度试验结果(n=5)
Tab. 2 Results of precision and accuracy(n=5)
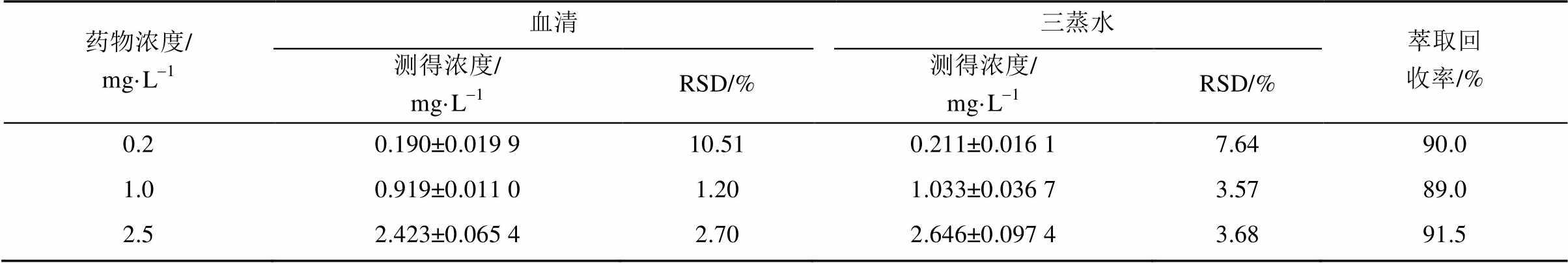
2.2.7 萃取回收率 配制低、中、高(0.2,1,2.5 mg·L-1)3种质控浓度的白消安对照品血清,每种浓度5份,按“2.2.3”项下方法处理后进样分析;另以三蒸水代替空白血清配制相应浓度的样品,同法进行处理分析,以每一浓度2种处理方法测得的峰面积值之比计算血清提取回收率。
表3 萃取回收率(n=5)
Tab. 3 Results of extraction recovery(n=5)
2.2.8 样品稳定性 短期室温稳定性:白消安低、中、高质控血清样品按“2.2.3”项下方法处理,氮气吹干后,分别于0,2,4,6,24 h用甲醇复溶进样分析,3种浓度的RSD分别为8.24%,6.89%,10.91%;冻融稳定性:血清样品进行3次冰冻-解冻循环处理,白消安低、中、高3种浓度的RSD分别为2.83%,1.73%,4.27%;长期冷冻稳定性:血清样品在-20 ℃放置15 d后处理测定,白消安低、中、高3种浓度的RSD分别为11.01%,1.57%,3.54%。
家兔和人同属灵长类动物,和人类基因相近,便于多次采样。本研究初步考察了白消安在其体内的动力学规律,分别设计了不同给药途径,测定家兔体内血药浓度,计算药动学参数。
3.1.1 单剂量口服给药 取3只体质量相近的同种族家兔,按1 mg·kg-1给予白消安混悬剂,换算之后,家兔给药剂量为3.27 mg·kg-1,分别于给药前及给药后0.083,0.17,0.25,0.33,0.42,0.5,1,2,3,4,5,6 h于家兔耳缘静脉取血,分离出血清,按“2.2.3”项下方法进行处理,样品进液相测定,药时曲线见图7A,药动学参数见表4。
3.1.2 多剂量口服给药 取3只体质量相近的同种族家兔,按3.27 mg·kg-1给予白消安混悬剂,q8h,在第4次给药前及给药后0.083,0.17,0.25,0.33,0.42,0.5,1,2,3,4,5,6 h于家兔耳缘静脉取血,分离出血清,按“2.2.3”项下方法进行处理,样品进液相测定,药-时曲线见图7B,药动学参数见表4。
取2只体质量相近的同种族家兔,按0.8 mg·kg-1给予白消安注射剂,换算之后,家兔给药剂量为2.62 mg·kg-1,分别于给药前及给药后0.33,0.5,0.75,1,2,3,4,5,6 h于家兔耳缘静脉取血,分离出血清,按“2.2.3”项下方法进行处理,样品进液相测定,药-时曲线见图7C,药动学参数见表4。
目前国内外白消安的测定方法主要有高效液相色谱-荧光检测器[18]、LC-MS/MS[19]、高效液相色谱-紫外检测器,由于高效液相色谱仪在实验室是比较常用的仪器,灵敏度高、专一性好,易于实现白消安的准确测定。因此,本研究采用柱前衍生HPLC测定白消安的含量。
本研究首先对衍生化反应条件进行了优化,筛选出了适宜的反应温度、反应时间、衍生化试剂的浓度,摸索出合适的血清样品处理步骤以及色谱条件。通过大量的衍生化反应试验可知,反应时间太短,反应进行的程度低;反应时间太长,会有其他产物的生成,因此本实验选择反应时间为30 min。为了更准确地测定白消安的血药浓度,本实验相比其他文献报道确证了有机溶剂吹干温度不能>30 ℃,复溶溶剂选择甲醇,效果较好。沉淀蛋白使用乙腈,效果较甲醇更好;对衍生化产物提取时采用了乙醚,因乙醚极性小,萃取更充分,更利于与大浓度DDTC分离,减小其对产物峰的干扰,而且乙醚沸点较低(34.6 ℃),易于挥发,大大缩短了溶剂挥发时间。
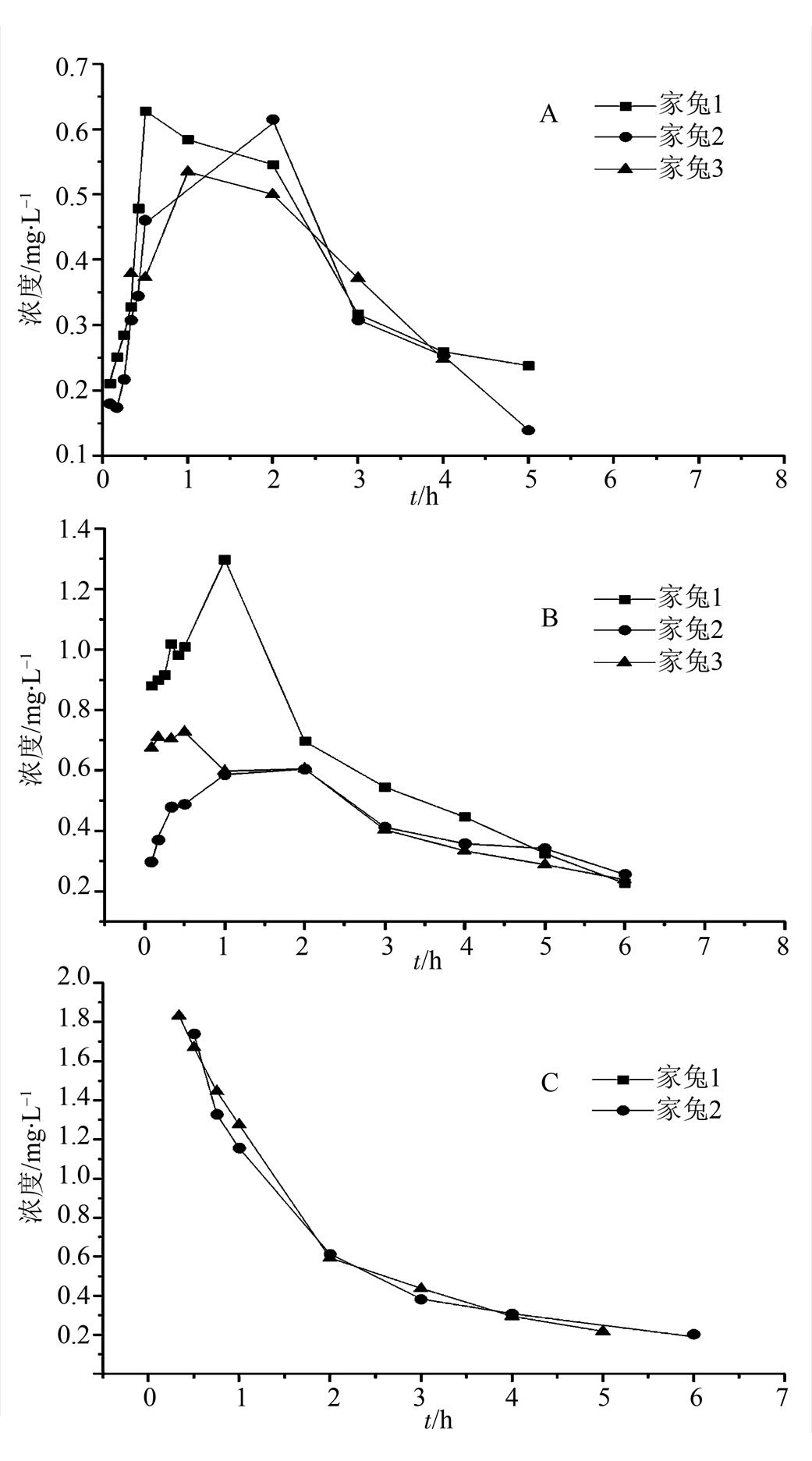
图7 不同给药途径的药-时曲线图
Fig. 7 The concentration-time graph of different administration routes
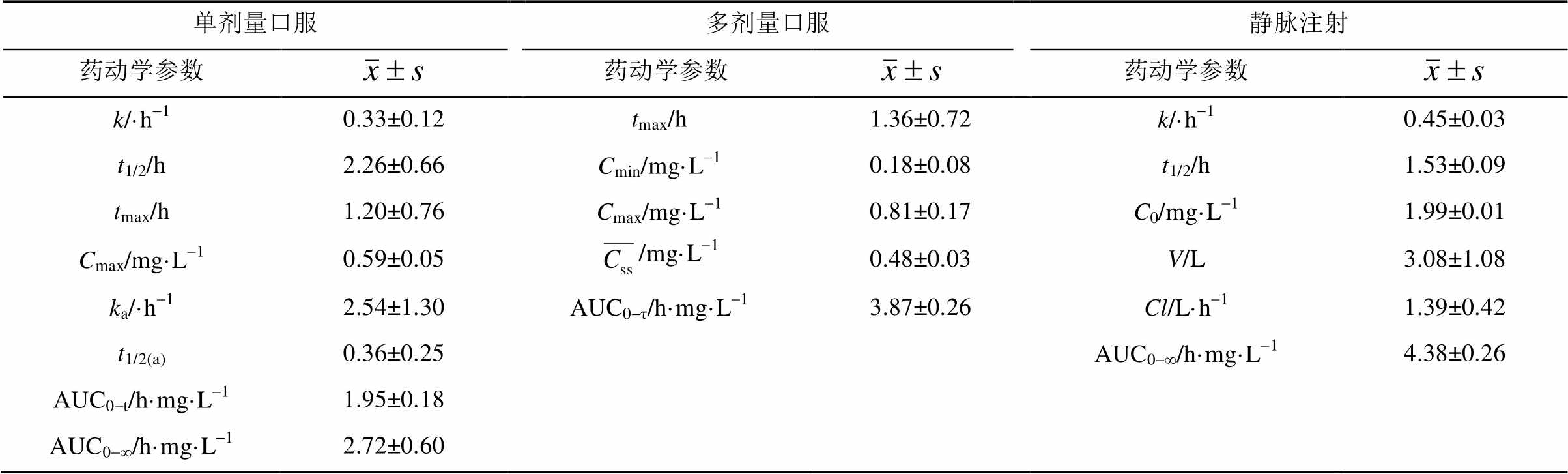
表4 不同给药途径的药动学参数
Tab. 4 Pharmacokinetic parameters of various methods of administration
目前临床上主要以口服、静脉滴注、静脉注射的给药途径于骨髓移植前大剂量给药白消安[20-22]。本研究以家兔为研究对象,分别采取了口服、静注给药途径,其中口服给药又分别进行了单剂量、多剂量灌胃给药,初步研究了不同给药途径的白消安体内药动学规律。
REFERENCES
[1] HUANG J J , CHEN B, YANG W H. Determination of busulfan in human plasma by HPLC [J]. China Pharm(中国药师), 2013, 16(3): 395-397.
[2] TANG W. Intravenous busulfan as a preparative regimen before allogeneic hematopoietic stem cell transplantation for adult patients with Acute Leukemia1 [D]. Shanghai: Shanghai Jiaotong University(上海交通大学), 2015.
[3] WANG L, HAN B. Resent progresses in the treatment of aplastic anemia [J]. Clin Focus(临床荟萃), 2014, 29(10): 1083-1086.
[4] SU H Z, ZHANG H T, SUN Z M, et al. Limitied sampling strategy for primary estimation of the area under the curve of busulfan in HSCT patients [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2014, 31(10): 1220-1225.
[5] TEN BRINK M H, ZWAVELING J, SWEN J J, et al. Personalized busulfan and treosulfan conditioning for pediatric stem cell transplantation: the role of pharmacogenetics and pharmacokinetics [J]. Drug Discov Today, 2014, 19(10): 1572-1586.
[6] BEUMER J H, OWZAR K, LEWIS L D, et al. Effect of age on the pharmacokinetics of busulfan in patients undergoing hematopoietic cell transplantation; an alliance study (CALGB 10503, 19808, and 100103) [J]. Cancer Chemother Pharmacol, 2014, 74(5): 927-938.
[7] KIM S D, LEE J H, HUR E H, et al. Influence of GST gene polymorphisms on the clearance of intravenous busulfan in adult patients undergoing hematopoietic cell transplantation [J]. Biol Blood Marrow Transplant, 2011, 17(8): 1222-1230.
[8] PERIS J E, LATORRE J A, CASTEL V, et al. Determination of busulfan in human plasma using high-performance liquid chromatography with pre-column derivatization and fluorescence detection [J]. J Chromatogr B Biomed Sci Appl, 1999, 730(1): 33-40.
[9] QUERNIN M H, POONKUZHALI B, MÉDARD Y, et al. High-performance liquid chromatographic method for quantification of busulfan in plasma after derivatization by tetrafluorothiophenol. [J]. J Chromatogr B Biomed Sci Appl, 1999, 721(1): 147-152.
[10] MOON S Y, MIN K L, HONG S, et al. Quantification of human plasma-busulfan concentration by liquid chromatography-tandem mass spectrometry [J]. Ann Lab Med, 2014, 34(1): 7-14.
[11] MÜRDTER T E, COLLER J, CLAVIEZ A, et al. Sensitive and rapid quantification of busulfan in small plasma volumes by liquid chromatography-electrospray mass spectrometry [J]. Clin Chem, 2001, 47(8): 1437-1442.
[12] CHOW D S, BHAGWATWAR H P, PHADUNGPOJNA S, et al. Stability-indicating high-performance liquid chromato- graphic assay of busulfan in aqueous and plasma samples [J]. J Chromatogr B Biomed Sci Appl, 1997, 704(1/2): 277.
[13] WANG C L, YUN Y Y, LI Z Y, et al. Determination of busulfan in human plasma by HPLC [J]. Acta Acad Med Xuzhou(徐州医学院学报), 2012, 32(5): 337-340.
[14] É. PAP, ERDÉLYI-TÓTH V, KRALOVÁNSZKY J. High-performance liquid chromatographic determination of busulfan in plasma [J]. Chromatographia, 2000, 51(1): S188-S192.
[15] MACKICHAN J J, BECHTEL T P. Quantitation of busulfan in plasma by high-performance liquid chromatography [J]. J Chromatogr, 1990, 532(2): 424-428.
[16] BLEYZAC N, BAROU P, AULAGNER G. Rapid and sensitive high-performance liquid chromatographic method for busulfan assay in plasma. [J]. J Chromatogr B Biomed Sci Appl, 2000, 742(2): 427-432.
[17] HENNER W D, FURLONG E A, FLAHERTY M D, et al. Measurement of busulfan in plasma by high-performance liquid chromatography [J]. J Chromatogr, 1987, 416(2): 426-432.
[18] REIS E O D, VIANNA-JORGE R, SUAREZ-KURTZ G, et al. Development of a rapid and specific assay for detection of busulfan in human plasma by high-performance liquid chromatography/electrospray ionization tandem mass spectrometry [J]. Rapid Commun Mass Spectrom, 2005, 19(12): 1666-1674.
[19] XIE H L, ZHUANG B Y, WU X M, et al. Determination of busulfan plasma drug concentration by HPLC-MS/MS [J]. Strait Pharm J (海峡药学), 2014(11): 243-246.
[20] SU H Z. Population Pharmaceutics of intravenous infusing busulfan in patients undergoing hematopoietic stem cell transplatation [D]. Anhui: Anhui University of Chinese Medicine(安徽中医药大学), 2006.
[21] WANG L L, ZONG G J, GAO S, et al. Determination of busulfan injections with pre-column derivatization by high performance liquid chromatography [J]. Chin J Anal Lab(中国分析实验室), 2006, 25(6): 18-20.
[22] ZHANG S T, SUN Z M, LIU H L, et al. Pharmacokinetics of oral busulfan in patients undergoing allogeneic hematopoietic stem cell transplantation [J]. Chin Pharm J(中国药学杂志), 2009, 44(18): 1416-1419.
Determination of pharmacokinetic parameters of busulfan in rabbits bypre-column derivatization HPLC
Liu Qiumei1, Tian Weiwei2, Yu Guangyi1, Wen Meiqiang1, Ren Yanan1, Zhao Qi1, Zhang Lifeng1*
(1.School of Pharmacy, Shanxi Medical University,Taiyuan 030001, China; 2.Department of Hematology, Shanxi University Hospital of Shanxi Medical Sciences, Taiyuan030032, China)
Abstract:ObjectiveTo establish a pre-column derivatization HPLC method which was used for determining the busulfan concentration in serum and pharmacokinetic characteristic of rabbits.Methods1,5-pentanediol dimethanesulfonate was used as internal standard, sodium diethyldithiocarbamate was used as derivatization reagent, and the derivatives of the busulfan and the internal standard were eluted with methanol-water(54∶46) as mobile phase at a flow rate of 1.0 mL·min-1(0-20 min), 1.3 mL·min-1(20-27 min). The column temperature was 30 ℃, the detective wavelength was 280 nm and the injection volume was 25 μL. The rabbits were given busulfan by intragastric administration and intravenous injection respectively. The busulfan concentration in serum were measured by this method and the DAS 3.0 software was used to calculate pharmacokinetic parameters.ResultsThe blood concentration of busulfan was linear in the range of 0.1-3.4 mg·L-1(r=0.999 7). The intraday, interday precision and sample stability were in accordance with the 2015 edition of the Chinese Pharmacopoeia. The extraction recoveries of low, medium and high concentrations were 90.0%, 89.0% and 91.5%, respectively. The pharmacokinetic parameters of single dose orally were:t1/2=(2.26±0.66)h,k=(0.33±0.12)·h-1,ka=(2.54±1.3)·h-1, AUC0–t= (1.95±0.18)h·mg·mL-1; those of intravenous injection were:t1/2=(1.53±0.09)h,k=(0.45±0.03)·h-1, AUC0–∞=(4.38±0.26)h·mg·mL-1and those of multi-dose oral administration were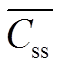 =(0.48±0.03)mg·mL-1,AUC0–τ=(3.87±0.26)h·mg·mL-1.ConclusionThe established method is suitable for determining the concentration of busulfan in serum and studying the pharmacokinetics. The pharmacokinetic parameters of the different routes of administration provide a practical basis for clinical pharmacokinetic studies.
=(0.48±0.03)mg·mL-1,AUC0–τ=(3.87±0.26)h·mg·mL-1.ConclusionThe established method is suitable for determining the concentration of busulfan in serum and studying the pharmacokinetics. The pharmacokinetic parameters of the different routes of administration provide a practical basis for clinical pharmacokinetic studies.
Key words:busulfan; pre-column derivation; HPLC; pharmacokinetic parameters
中图分类号:R969.1
文献标志码:B
文章编号:1007-7693(2018)09-1308-06
DOI:10.13748/j.cnki.issn1007-7693.2018.09.008
引用本文:刘秋梅, 田卫伟, 喻光燚, 等. 柱前衍生-HPLC测定白消安在家兔体内的药动学参数[J]. 中国现代应用药学, 2018, 35(9): 1308-1313.
收稿日期:2017-10-22
基金项目:山西省重点研发计划(指南)项目(201603D321055);山西医科大学创新创业校级项目(20170708);山西省高校重点学科建设专项资金项目(〔2016〕4号)
作者简介:刘秋梅,女,硕士生 Tel: 15965054581 E-mail: 1483276026@qq.com
*通信作者:张丽锋,博士,副教授 Tel: 13513641356 E-mail: zhlf7@163.com
(本文责编:曹粤锋)