 表示,P<0.05认为差异有统计学意义。采用多元线性回归(Stepwise)分析各基因多态性对华法林维持剂量的贡献率。
表示,P<0.05认为差异有统计学意义。采用多元线性回归(Stepwise)分析各基因多态性对华法林维持剂量的贡献率。方素君1,林玮玮2,林荣芳2,王长连2*
(1.莆田市第一医院药剂科,福建 莆田 351100;2.福建医科大学附属第一医院药剂科,福州 350005)
摘要:目的探讨VKORC1-3673G>A、CYP2C9*3、CYP4F2 rs2108622和CYP2C19*2位点基因多态性对中国汉族房颤患者华法林维持剂量的影响。方法收集107例服用华法林达维持剂量的汉族房颤患者的血样和临床相关资料,应用PCR-RFLP法检测VKORC1-3673G>A、CYP2C9*3、CYP4F2 rs2108622和CYP2C19*2基因型,采用独立样本t检验分析基因型与华法林维持剂量的相关性。多元线性回归建立给药模型,探讨基因多态性对华法林维持剂量的影响。结果VKORC1-3673G>A、CYP2C9*3、CYP4F2 rs2108622基因多态性和患者年龄、体质量能解释45.2%的华法林维持剂量差异。CYP2C19*2基因多态性对本研究人群华法林维持剂量无影响。结论VKORC1-3673G>A、CYP2C9*3、CYP4F2 rs2108622基因多态性显著影响中国汉族房颤患者的华法林维持剂量。
关键词:华法林;维持剂量;VKORC1;CYP2C9;CYP2C19*2;CYP4F2 rs2108622
华法林是临床常用的口服抗凝药物,主要用于心脏瓣膜置换术后房颤血栓的预防、静脉血栓栓塞性疾病的一级和二级预防。国内外大量研究表明,VKORC1和CYP2C9基因多态性显著影响华法林维持剂量,二者介导的给药模型可解释大约40%左右的华法林维持剂量个体差异[1]。另有研究表明,还有其他基因位点多态性对华法林剂量有影响[2]。国外已有关于细胞色素P4502C19(CYP2C19)基因多态性对华法林维持剂量影响的研究,但结果不一致[2-3]。国内尚未见有关CYP2C19基因多态性与华法林维持剂量关系的研究报道。本实验针对中国汉族房颤患者开展VKORC1、CYP2C9、CYP4F2和CYP2C19基因多态性与华法林维持剂量关系研究,为优化华法林个体化给药提供参考。
入选标准:选取福建医科大学附属第一医院接受华法林(芬兰奥立安集团,规格:每片3 mg)抗凝治疗的房颤患者,均为汉族人群,肝肾功能正常。房颤包括阵发性房颤、持续性房颤、永久性房颤,不包括瓣膜性房颤。患者按医嘱规律服用华法林抗凝治疗≥1个月,所用华法林剂量已经达到维持剂量。本研究经医院医学伦理委员会批准,且获得患者知情同意。华法林维持剂量定义:在≥3个月的时间内,连续3次测得的INR在2.0~3.0,且剂量保持稳定。
排除标准:有明确的出血性疾病或出血倾向,如活动性溃疡、支气管扩张等;肝、肾功能不全;血液病或凝血系统障碍;心功能Ⅲ级或以上;严重营养不良、怀孕;长期合并使用与华法林有相互作用的药物,如维生素K等。
血样采集和收集:采集患者空腹12 h以上的外周静脉血各2 mL于2个EDTA抗凝管,1管送至检验科测INR,另1管4 ℃冷藏,24 h内提取DNA。
1.2.1 试剂 引物由上海生工生物工程有限公司合成;限制性内切酶MspI、NsiI、SmaI、PvuII均由美国Promega公司提供;血液基因组DNA提取试剂盒及Taq DNA聚合酶、dNTP、50 bp及100 bp DNA Ladder由北京天根生化公司提供;琼脂糖(英格兰OXOID公司);GoodView核酸染料(赛百胜公司)。
1.2.2 仪器 Thermal cycler T100 PCR仪(美国Bio-Rad公司);DYY-7C电泳仪、电泳槽、WD-9413B凝胶成像分析仪(北京六一仪器厂)。
1.3.1 临床资料收集 记录患者临床相关资料,包括姓名、性别、年龄、身高、体质量、住院号或门诊号、联系方式及家庭住址、临床诊断、肝肾功能状态、华法林服用剂量、平时服药时间、末次服药时间、采血时间及合并用药等。
1.3.2 基因型检测 采用试剂盒提取DNA样品,采用PCR-RFLP法检测患者VKORC1-3673G>A、CYP2C9*3、CYP4F2 rs2108622和CYP2C19*2基因型[4-7]。
采用独立样本t检验分析各基因型间华法林维持剂量是否存在显著性差异。统计数据以 表示,P<0.05认为差异有统计学意义。采用多元线性回归(Stepwise)分析各基因多态性对华法林维持剂量的贡献率。
表示,P<0.05认为差异有统计学意义。采用多元线性回归(Stepwise)分析各基因多态性对华法林维持剂量的贡献率。
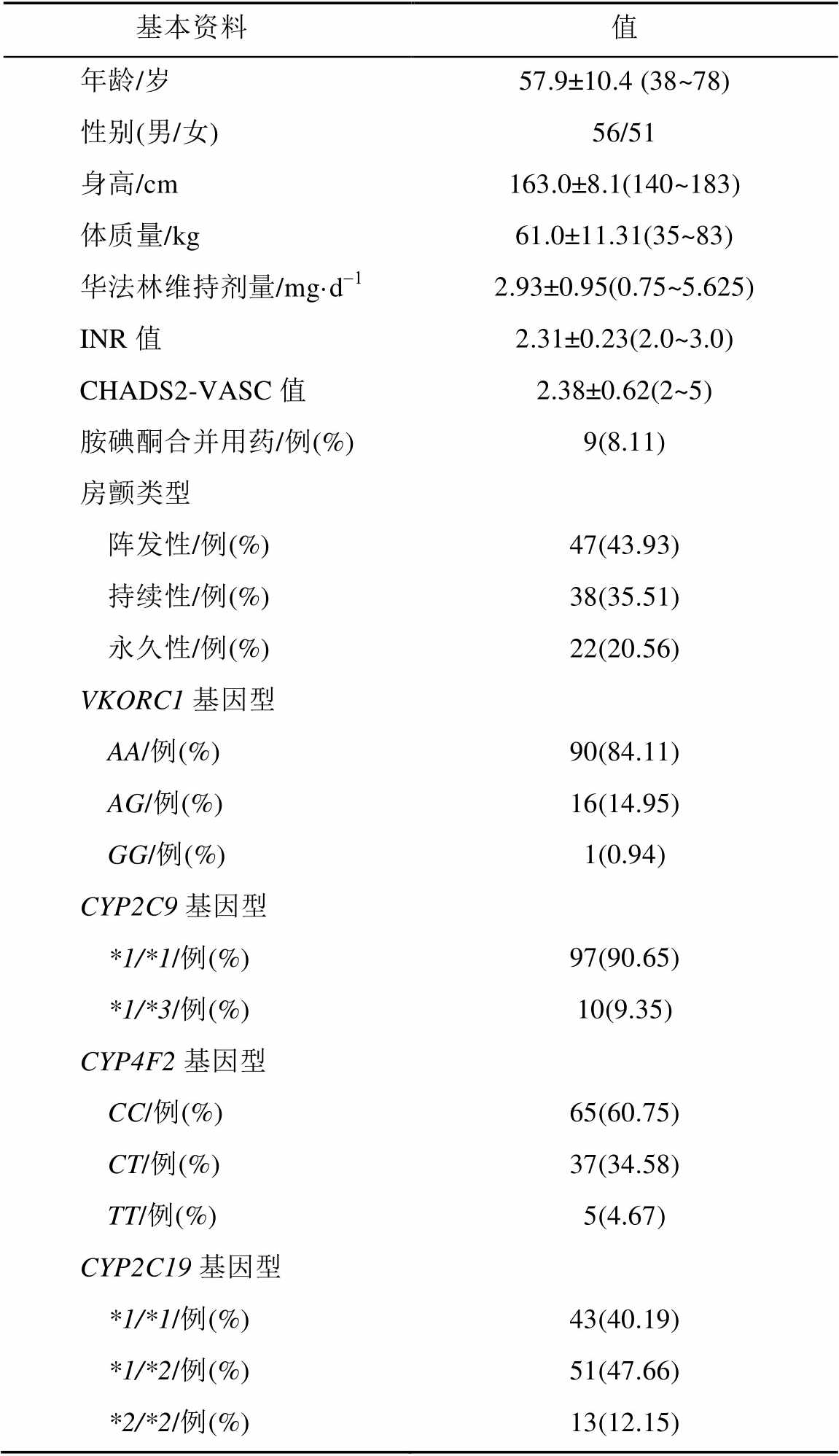
研究对象基本资料见表1,共入组107例患者,并全部完成试验。
表1 患者基本资料
Tab. 1 Baseline of patients
基因分型结果表明VKORC1、CYP2C9、CYP4F2和CYP2C19各基因型频率分布经检验均符合Hardy-weinberg平衡定律。本研究人群VKORC1、CYP2C9、CYP4F2和CYP2C19基因等位基因频次分别为8.41%,4.67%,21.96%,35.98%。见表2。
表2 房颤患者4个基因位点等位基因频率和基因型频率分布
Tab. 2 Allelic frequency and genotype frequency distribution of the four studied SNPs in atrial fibrillation patients

VKORC1、CYP2C9、CYP4F2和CYP2C19基因多态性对华法林剂量的影响见表3。由于只有少数患者携带VKORC1GG、CYP4F2TT和CYP2C19*2/*2基因型,因此分别都归类到VKORC1AG、CYP2C9*1/*3、CYP4F2CT和CYP2C19*1/*2组。未发现有患者携带CYP2C9 *3/*3基因型。分别对VKORC1和CYP4F2基因多态性与华法林维持剂量的关系进行分析,发现携带AG/GG和CT/TT基因型的患者,华法林维持剂量均高于携带AA和CC基因型患者(P<0.05)。另外对CYP2C9基因多态性与华法林维持剂量的关系进行分析,发现携带*1/*3基因型的患者华法林维持剂量低于野生型(*1/*1)患者(P<0.05)。对CYP2C19基因多态性分析发现,各基因型间华法林维持剂量无显著差异(P=0.142)。
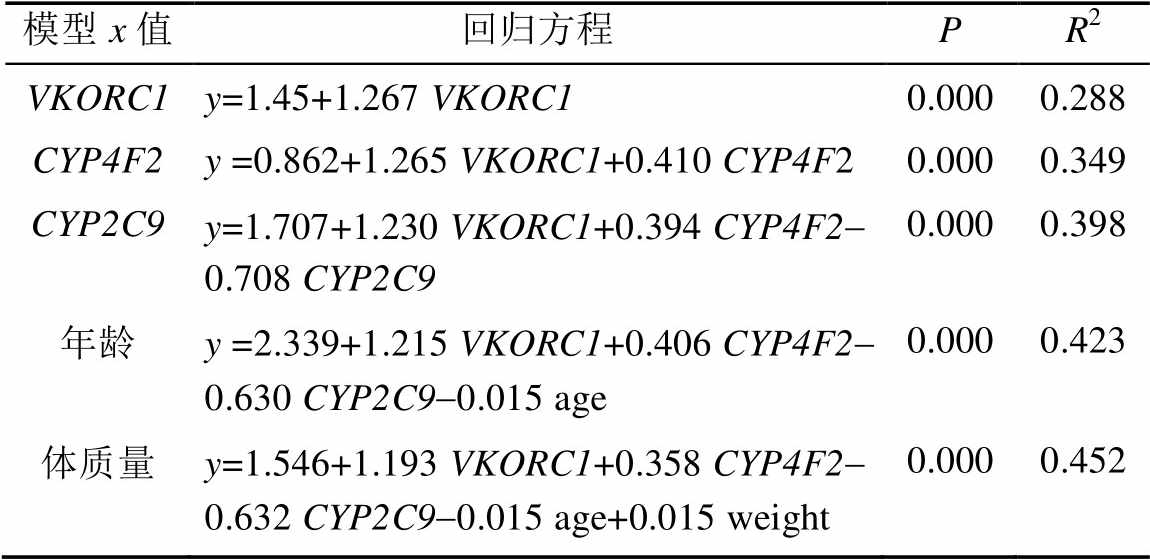
采用多元线性回归(Stepwise)分析各基因多态性对华法林维持剂量(y值)的贡献率,结果见表4。结果显示VKORC1、CYP2C9、CYP4F2基因多态性、年龄和体质量能解释45.2%的华法林维持剂量差异。VKORC1、CYP4F2、CYP2C9、年龄和体质量的贡献率分别为28.8%,6.1%,4.9%,2.5%和2.9%。由于合用胺碘酮组和未合用胺碘酮组之间华法林维持无显著差异(P=0.524),故未把胺碘酮纳入回归方程分析。
表3 房颤患者4个基因位点华法林维持剂量差异比较
Tab. 3 Comparison of mean warfarin maintenance doses for the four studied SNPs in atrial fibrillation patients

表4 多元线性回归预测华法林给药剂量
Tab. 4 Muitiple linear regeression model predicted the stable dose of difference of warfarin
参考相关文献[4-7],采用PCR-RFLP法检测患者VKORC1、CYP2C9、CYP4F2和CYP2C19基因型时,发现VKORC1、CYP2C9、CYP4F2基因型均能按参考文献方法检测出来。但对CYP2C19基因型的酶切条件进行了调整,考虑SmaI酶最适的酶切温度是25 ℃,调整为25 ℃酶切3 h,电泳结果表明酶切完全(采用文献报道的酶切条件37 ℃酶切3 h[4],发现野生型酶切不完全,延长酶切时间和增加内切酶用量效果均不理想)。
本实验结果显示,对于VKORC1,携带AG/GG基因型的患者,华法林维持剂量显著高于携带AA基因型的患者(P<0.05)。现有研究表明,对于国人,CYP2C9*2突变频率大约只有0.6%,CYP2C9*3突变频率约4.6%[8],因此本研究只探讨CYP2C9*3等位基因突变对华法林维持剂量的影响。结果显示携带*1/*3的患者华法林维持剂量显著低于CYP2C9*1/*1的患者(P<0.05)。此外,本研究还建立了基于基因多态性与年龄、体质量的华法林给药模型,试图预测华法林给药剂量。结果显示,VKORC1基因多态性能解释28.8%的华法林个体剂量差异,与现有的大部分研究结果相似[9-13]。本研究显示CYP2C9基因多态性能解释大约4.9%的华法林个体剂量差异,然而现有的大部分研究表明,CYP2C9基因多态性能解释大约10%~15%的华法林个体剂量差异[9-11]。原因可能是本研究病例数偏少,导致结果与现有的研究结果有偏差;另外本研究人群是房颤患者,既往的大部分研究人群包括了瓣膜置换患者、房颤患者及静脉血栓栓塞患者,目标INR的不同,从而华法林需求剂量不同,也可能导致结果不同。
本研究显示国人CYP4F2基因突变率较高,约为21.96%,与国内大部分研究一致[5,14]。CYP4F2基因突变使华法林维持剂量增加,多元线性回归表明CYP4F2基因多态性可解释6.1%个体剂量差异,略高于国内相关研究的3.9%[14],与国外相关研究[15-16]的CYP4F2基因多态性可解释2%~7%个体剂量差异相似。其可能的机制是CYP4F2参与维生素K1代谢,突变导致酶活性下降,维生素K1浓度增加,从而使华法林剂量需求增加[17]。基于VKORC1、CYP4F2、CYP2C9、年龄和体质量的给药模型能解释大约45.2%的华法林个体剂量差异。
本研究还通过2例病例验证了本研究建立的模型的准确性和安全性,结果初步表明,本研究建立的模型安全有效。
病例1:门诊患者,中老年女性,51岁,体质量56 kg。既往有高血压、糖尿病、房颤病史。平素服用氨氯地平降压,阿卡波糖、二甲双胍降糖。2周之前复诊,医师建议加用华法林预防血栓形成,药师建议医师留取血样监测DNA,取得医师同意,同时告知患者。基因检测结果为VKORC1-AA、CYP2C9*1/*3、CYP4F2 CC、CYP2C19 *1/*1。药师根据已建立的模型,预测该患者所需华法林日剂量为1.962 mg,建议医师给予患者2 mg·d-1的剂量,医师采纳,并对患者进行用药教育,嘱3 d后监测INR,3 d之后测INR值为2.56,在正常范围内。此后多次复诊测的INR均保持在2.3~2.7。病例2:住院患者,老年女性,65岁,体质量65 kg。既往有高血压、房颤病史。平素服用缬沙坦降压、阿司匹林预防血栓形成。此次因行房颤射频消融住心内科。药师与医师沟通,住院当天采血监测DNA,并取得医师同意,同时告知患者。监测结果为VKORC1AG、CYP2C9 *1/*1、CYP4F2 CC、CYP2C19 *1/*2。药师根据实验室已建立的模型,预测该患者所需华法林日剂量为3.658 mg,建议医师给予患者3.75 mg·d-1的剂量,医师采纳,射频消融术后当天给予华法林3.75 mg·d-1,术后第3天测INR为2.64,此后多次复诊测的INR均保持在2.5~2.8。
验证组2个病例均采用模型计算出的维持剂量替代初始剂量。
国内尚未见CYP2C19基因多态性与华法林维持剂量的关系。本研究检测的CYP2C19*2基因突变频率为35.98%,与国内大部分研究相似[18-19]。结果表明CYP2C19*2基因多态性对华法林维持剂量无显著影响,多元线性回归显示该基因多态性只能解释0.7%华法林维持剂量个体差异,与国外文献[3]报道的可解释2.2%个体剂量差异不同。可能原因是其研究对象为墨西哥人群,研究对象存在种族差异,且基因突变频率也不同,其突变频率为15.7%。
本研究结果中,CYP2C19基因多态性对华法林维持剂量无明显影响的原因可能是CYP2C19主要参与R-华法林代谢,而S-华法林活性是R-华法林的3~5倍,因此CYP2C19基因多态性可能对华法林抗凝结果的影响不显著[20]。本研究虽未对CYP2C19*3突变进行考察,但由于国人CYP2C19基因突变主要以*2为主,*3突变率很低,约为5.5%[18]。因此,目前无证据表明CYP2C19基因多态性对国人华法林维持剂量的影响有显著意义。
本研究结果显示,VKORC1-3673G>A、CYP2C9*3、CYP4F2rs2108622显著影响华法林维持剂量,并通过2个病例验证模型的准确性和安全性,可用于指导中国汉族房颤患者的华法林个体化给药。CYP2C19基因多态性对华法林维持剂量无影响。鉴于本研究病例数较少,且验证组例数只有2例,因此未来还需要大样本的研究来验证。
REFERENCES
[1] Wadelius M, Chen L Y, Lindh J D, et al. The largest prospective warfarin-treated cohort supports genetic forecasting [J]. Blood, 2009, 113(4): 784-792.
[2] Wadelius M, Chen L Y, Eriksson N, et al. Association of warfarin dose with genes involved in its action and metabolism [J]. Hum Genet, 2007, 121(1): 23-34.
[3] Nastasi-Catanese J A, Padilla-Gutierrez J R, Valle Y, et al. genetic contribution ofCYP2C9,CYP2C19, and apoe variants in acenocoumarol response [J]. Genet Mol Res, 2013, 12(4): 4413-4421.
[4] Goldstein J A, Blaisdell J. Genetic tests which identify the principal defects inCYP2C19responsible for the polymorphism in mephenytoin metabolism [J]. Methods Enzymol, 1996(272): 210-218.
[5] Cen H J , Zeng W T, Leng X Y, et al.CYP4F2 rs2108622: a minor significant genetic factor of warfarin dose in Han Chinese patients with mechanical heart valve replacement [J]. Br J Clin Pharmacol, 2010, 70(2): 234-240.
[6] Ozer N, Cam N, Tangurek B, et al. The impact ofCYP2C9andVKORC1genetic polymorphism and patient characteristics upon warfarin dose requirements in an adult Turkish population [J]. Heart Vessels, 2010, 25(2): 155-162.
[7] JIANG N x, JU H n, JIANG B, et al. Effects ofCYP2C9,CYP4F2,GGCXandVKORC1polymorphisms on warfarin dose in patients with atrial fibrillation [J]. Chin J Hosp Pharm(中国医院药学杂志), 2016,36(7): 574-577.
[8] Xiong y, Wang m, Fang k, et al. A systematic genetic polymorphism analysis of theCYP2C9gene in four different geographical Han populations in mainland China [J]. Genomics, 2011, 97(5): 277-281.
[9] Miao L, Yang J, Huang C, et al. Contribution of age, body weight, andCYP2C9andVKORC1genotype to the anticoagulant response to warfarin: proposal for a new dosing regimen in Chinese patients [J]. Eur J Clin Pharmacol, 2007, 63(12): 1135-1141.
[10] LEI Z J, ZHANG R L, LI Z D. Influence of various genotypic combinations ofCYP2C9andVKORCl-1639G>Aon mean daily dose of warfarin: a meta-analysis [J]. Chin J New Drugs(中国新药杂志), 2014, 23(10): 1154-1162.
[11] Carlquist J F, Horne B D, Muhlestein J B, et al. genotypes of the cytochrome p450 isoform,CYP2C9, and the vitamin K epoxide reductase complex subunit 1 conjointly determine stable warfarin dose: a prospective study [J]. J Thromb Thrombolysis, 2006, 22(3): 191-197.
[12] Caldwell M D, Berg RL, Zhang K Q, et al. Evaluation of genetic factors for warfarin dose prediction [J]. Clin Med Res, 2007, 5(1): 8-16.
[13] Huang S W, Chen H S, Wang X Q, et al. Validation ofVKORC1andCYP2C9genotypes on interindividual warfarin maintenance dose: a prospective study in Chinese patients [J]. Pharmacogenet Genomics, 2009, 19(3): 226-234.
[14] Liang R, Wang C, Zhao H, et al. Influence ofCYP4F2genotype on warfarin dose requirement-a systematic review and meta-analysis [J]. Thromb Res, 2012, 130(1): 38-44.
[15] Borgiani P, Ciccacci C, Forte V, et al.CYP4F2genetic variant (rs2108622) significantly contributes to warfarin dosing variability in the Italian population [J]. Pharmacogenomics, 2009, 10(2): 261-266.
[16] Takeuchi F, McGinnis R, Bourgeois S, et al. A genome-wide association study confirmsVKORC1,CYP2C9, andCYP4F2as principal genetic determinants of warfarin dose [J]. PLoS Genet, 2009, 5(3): e1000433.
[17] McDonald M G, Rieder M J, Nakano M, et al.CYP4F2is a vitamin K1 oxidase: An explanation for altered warfarin dose in carriers of the V433M variant [J]. Mol Pharmacol, 2009, 75(6): 1337-1346.
[18] Goldstein J A, Ishizaki T, Chiba K, et al. Frequencies of the defectiveCYP2C19alleles responsible for the mephenytoin poor metabolizer phenotype in various Oriental, Caucasian, Saudi Arabian and American black populations [J]. Pharmacogenetics, 1997, 7(1): 59-64.
[19] Niu C Y, Luo J Y, Hao Z M. Genetic polymorphism analysis of cytochromeP4502C19in Chinese Uigur and Han populations [J]. Chin J Dig Dis(中国消化疾病杂志), 2004, 5(2): 76-80.
[20] Rusdiana T, Araki T, Nakamura T, et al. Responsiveness to low-dose warfarin associated with genetic variants ofVKORC1,CYP2C9,CYP2C19, andCYP4F2in an Indonesian population [J]. Eur J clin pharmacol, 2013, 69(3): 395-405.
Relationship ofVKORC1-3673G>A,CYP2C9*3,CYP4F2 rs2108622andCYP2C19*2genetic Polymorphisms and Maintenance warfarin dose requirement in Han-Chinese patients with atrial fibrillation
FANG Sujun1, LIN Weiwei2, LIN Rongfang2, WANG Changlian2*
(1.Department of Pharmacy, The First Hospital of Putian City, Putian 351100, China; 2.Department of Pharmacy, The First Affiliated Hospital of Fujian Medical University, Fuzhou 350005, China)
ABSTRACT:OBJECTIVETo explore the influence ofVKORC1-3673G>A,CYP2C9*3,CYP4F2rs2108622, andCYP2C19*2genetic polymorphism on maintenance warfarin dose in a Han-Chinese population with atrial fibrillation.METHODSGenetic polymorphisms were detected in 107 patients with atrial fibrillation receiving warfarin by the polymerase chain reaction-restriction fragment length polymorphism(PCR-RFLP) method. Independent-samplest-test was used to investigate the association betweenVKORC1-3673G>A,CYP2C9*3,CYP4F2rs2108622, andCYP2C19*2genetic polymorphisms and maintenance warfarin dose. Multiple linear regression analysis was used to investigate the contribution of genetic polymorphisms to maintenance warfarin dose.RESULTSVKORC1-3673G>A,CYP2C9*3,CYP4F2rs2108622genotypes and clinical characteristics(age, body weight) could account for 45.2% of the variance in the warfarin maintenance dose in patients with atrial fibrillation. No relationship was found between the maintenance warfarin dose andCYP2C19*2genotype.CONCLUSIONVKORC1-3673G>A,CYP2C9*3andCYP4F2rs2108622genetic polymorphism are significantly affect the maintenance warfarin dose in Han-Chinese patients with atrial fibrillation.
KEY WORDS:warfarin; maintenance warfarin dose;VKORC1;CYP2C9;CYP2C19*2;CYP4F2 rs2108622
中图分类号:R969.3
文献标志码:B
文章编号:1007-7693(2018)09-1379-05
DOI:10.13748/j.cnki.issn1007-7693.2018.09.024
引用本文:方素君, 林玮玮, 林荣芳, 等.VKORC1-3673G>A、CYP2C9*3、CYP4F2 rs2108622和CYP2C19*2基因多态性对中国汉族房颤患者华法林维持剂量的影响[J]. 中国现代应用药学, 2018, 35(9): 1379-1383.
收稿日期:2017-10-21
基金项目:福建省教育厅中青年教师教育科研项目(JA14282)
作者简介:方素君,女,硕士,主管药师 Tel: (0594)6923310 E-mail: 472502703@qq.com
*通信作者:王长连,男,主任药师 Tel: (0591)78891331 E-mail: WCL@medmail.com.cn
(本文责编:曹粤锋)