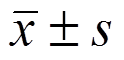 表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验,P<0.05为差异有统计学意义。卢理英1,彭潇1,2,张旭2*
(1.丽水市中心医院神经内科,浙江 丽水 323000;2.温州医科大学附属第一医院神经内科,浙江 温州 325000)
摘要:目的探讨N-乙酰半胱氨酸(N-acetyl-L-cysteine,NAC)对糖氧剥夺(oxygen and glucose deprivation,OGD)诱导的星形胶质细胞损伤过程中AKT信号通路的影响及其意义。方法以原代培养的星形胶质细胞建立OGD模型,并分为4组:对照组,OGD组,NAC组和NAC+ AKT特异性抑制剂MK-2206组(NAC+MK-2206组);细胞培养24 h后,采用噻唑蓝(MTT)法检测细胞存活率、流式细胞仪技术分析细胞凋亡比例,试剂盒检测细胞内SOD活性和丙二醛(MDA)含量,蛋白免疫印迹法检测细胞内AKT、磷酸化AKT(p-AKT)、mTORC1、磷酸化mTORC1(p-mTORC1)、胞浆型磷脂酶A2(cLPA2)、caspase3及Bcl-2的表达水平。结果与OGD组相比,NAC组的细胞存活率,p-AKT、p-mTORC1及Bcl-2表达和SOD活性增加,细胞凋亡比例,cPLA2、caspase3表达,MDA含量降低。与NAC组相比,NAC+MK-2206组的细胞存活率,p-AKT、p-mTORC1及Bcl-2表达和SOD活性降低,细胞凋亡比例、cPLA2、MDA含量、caspase3表达增加。结论NAC缓解OGD诱导AKT信号通路抑制作用,降低cPLA2诱导细胞凋亡作用。
关键词:N-乙酰半胱氨酸;AKT信号通路;星形胶质细胞;糖氧剥夺
随着人口老龄化,血管疾病已成为危害国民健康的重要因素。据统计,2006—2012年期间,脑卒中的年发病率>318.2/10万,死亡率>151.91/10万[1]。研究证实继发性脑缺血再灌注损伤是脑卒中后高致残率和高病死率的重要原因之一[2]。因此,如何降低脑细胞缺血再灌注损伤已是脑卒中治疗的焦点和难点[3]。近年来,有学者发现N-乙酰半胱氨酸(N-acetyl-L-cysteine,NAC)作为一种氧化清除剂,对氧化应激引起的脑细胞损伤具有保护作用[4]。秦文等[5]研究表明,NAC具有缓解糖氧剥夺(oxygen and glucose deprivation,OGD)诱导细胞增殖抑制作用、减少乳酸脱氢酶(LDH)的漏出率和Na+-K+ATP酶活性的作用。本课题组前期研究发现氧化清除剂丹酚酸A对脑缺血再灌注诱导细胞凋亡具有保护作用,其机制可能与丹酚酸A激活AKT信号通路有关[6]。因此,本研究在体外构建大鼠星形胶质细胞OGD损伤模型,探讨NAC对星形胶质细胞的AKT信号通路的影响及其意义,为探索治疗脑卒中的药物提供科学根据。
NAC(阿拉丁公司,批号:616-91-1;纯度> 99.0%);MK-2206(阿拉丁公司,批号:1032350-13-2;纯度≥98%);噻唑蓝(Sigma公司,批号:298-93-1);SOD活性检测试剂盒(批号:S0101)、MDA检测试剂盒(批号:S0131)、凋亡试剂盒(批号:C1063)均购自Beyotime Biotechnology公司;抗体:AKT(批号:75692)、p-AKT(批号:9018)、mTORC1(批号:2983)、p-mTORC1(批号:5536)、caspase3(批号:9662)、Bcl-2(批号:15071)和β-actin(批号:3700)均购自Cell signal technology公司。
1.2.1 提取新生大鼠星型胶质细胞并纯化培养 取出生3 d的SD大鼠[由温州医科大学实验动物中心提供,动物许可证号:SCXK(浙)2015-0009]的大脑皮质,用1.25 g·L-1胰蛋白酶在37 ℃无菌条件下,消化15 min,并制成单细胞悬液(细胞存活率为90%)。成功提取大鼠脑单细胞悬液,以1×106·cm-2密度接种于多聚L-赖氨酸(0.1 mg·mL-1)的培养瓶中,用差速贴壁法去除成纤维细胞,置入37 ℃、5% CO2、饱和湿度的培养箱中,48 h后,72 h内每隔24 h更换含有双抗、20% FBS的DMEM培养基,以后每隔3 d更换培养基1次。待细胞融合>80%时,传代培养,取第3代以后的细胞做实验。
1.2.2 实验分组和OGD模型的建立 将等量的细胞随机分为对照组、OGD组、NAC组和NAC+MK-2206组;按照文献[7]方法,建立OGD细胞,待细胞融合>80%时,弃培养液,用温PBS缓冲液洗涤细胞1遍,加入无糖培养基,并将培养器皿置入含有95% N2、5% CO2混合气体的OGD培养装置中,向内冲入混合气,持续90 min后,更换含有20%FBS、高糖培养基,即为OGD组;NAC组和NAC+MK-2206组在OGD的条件下,给予10 mmol·L-1NAC或10 mmol·L-1NAC和10 nmol·L-1MK-2206;对照组按常规条件下置于培养箱中培养;将各组置入37 ℃、5% CO2、饱和湿度的培养箱中继续培养24 h,采用噻唑蓝(MTT)法检测细胞存活率,检验细胞损伤模型。
1.2.3 细胞存活率的检测 取第4~8代生长旺盛的星形胶质细胞,调整细胞密度为2×104·mL-1,接种于96孔培养板,常规培养,待细胞贴壁,细胞融合达80%左右时,按“1.2.2”项下分组方法进行实验,并设置调零孔,每组设置6个复孔,继续培养24 h后,加入20 μL MTT,37 ℃恒温箱孵育1~2 h,加入二甲亚砜后,以调零孔光密度值调零校准,用酶联免疫检测仪在492 nm波长处测各孔吸光度值,计算细胞存活率。
1.2.4 细胞内总超氧化物歧化酶(SOD)活性和丙二醛(MDA)含量的检测 以细胞密度为2×105·mL-1,接种于6孔板中,按“1.2.2”项下分组方法进行实验后,根据总SOD活性检测试剂盒和脂质氧化检测试剂盒说明书进行操作。检测细胞内SOD活性和MDA含量。
1.2.5 流式细胞仪技术检测细胞凋亡比例 细胞处理24 h后,采用流式细胞仪技术检测上述各组细胞凋亡比例,按照Annexin V/PI试剂盒的方法,用0.25%胰酶消化细胞,收集细胞,以1 mL的PBS重悬细胞2次,去除参与血清,依次加入500 μL上样缓冲液、5 μL Annexin V-FITC、5 μL PI,轻轻混匀,室温下避光15 min孵育后转到流式细胞仪中检测。
1.2.6 Western blot检测AKT信号通路相关蛋白的表达 以细胞密度为2×105·mL-1,接种于6孔板中,按“1.2.2”项下分组方法进行实验后,加入RIPA细胞裂解液冰上裂解15 min,12 000 r·min-1离心15 min,取上清。BCA法定量后,取20 μg总蛋白用10%聚丙烯酰胺梯度凝胶电泳分离,电转至聚偏二氟乙烯膜(PVDF)上,3%脱脂牛奶封闭1 h。加入适当稀释度的一抗(AKT、p-AKT、mTORC1、p-mTORC1、caspase3、Bcl-2和β-actin),4 ℃孵育,过夜,TBST洗涤3次,每次8~10 min,加入辣根过氧化物酶标记的二抗体室温孵育1~2 h,再用TBST洗涤3次,每次8~10 min,用化学发光试剂发光、显影和定影。用Image J分析条带的灰度值。
采用SPSS 22.0统计软件,计量资料以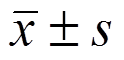 表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
24 h后,OGD组细胞活性较对照组明显降低(P<0.05)。NAC组细胞存活率高于OGD组,低于对照组(P<0.05)。NAC+MK-2206组细胞存活率低于对照组和NAC组(P<0.05)。结果见表1。
表1 各组细胞存活率改变情况(n=3,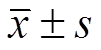 )
)
Tab. 1 The cell survival rate in each group (n=3,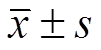 )
)

注:与对照组相比,1)P<0.05;与OGD组相比,2)P<0.05;与NAC组相比,3)P<0.05。
Note: Compared with the control group,1)P<0.05; compared with the OGD group,2)P<0.05; compared with the NAC group,3)P<0.05.
与OGD相比,NAC组SOD活性增加,MDA含量降低(P<0.05)。与NAC组相比,NAC+ MK-2206组SOD活性降低,MDA含量增加(P<0.05)。结果见表2。
表2 各组SOD活性和MDA含量情况(n=3,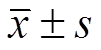 )
)
Tab. 2 The activity of SOD and content of MDA in each group(n=3,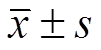 )
)

注:与对照组相比,1)P<0.05;与OGD组相比,2)P<0.05;与NAC组相比,3)P<0.05。
Note: Compared with the control group,1)P<0.05; compared with the OGD group,2)P<0.05; compared with the NAC group,3)P<0.05.
OGD后,OGD组cPLA2表达增加,p-AKT和p-mTORC1降低(P<0.05);与OGD相比,NAC组cPLA2活性降低,p-AKT和p-mTORC1表达增加(P<0.05)。与NAC组相比,NAC+MK-2206组cPLA2活性增加(P<0.05)。结果见图1,表3。
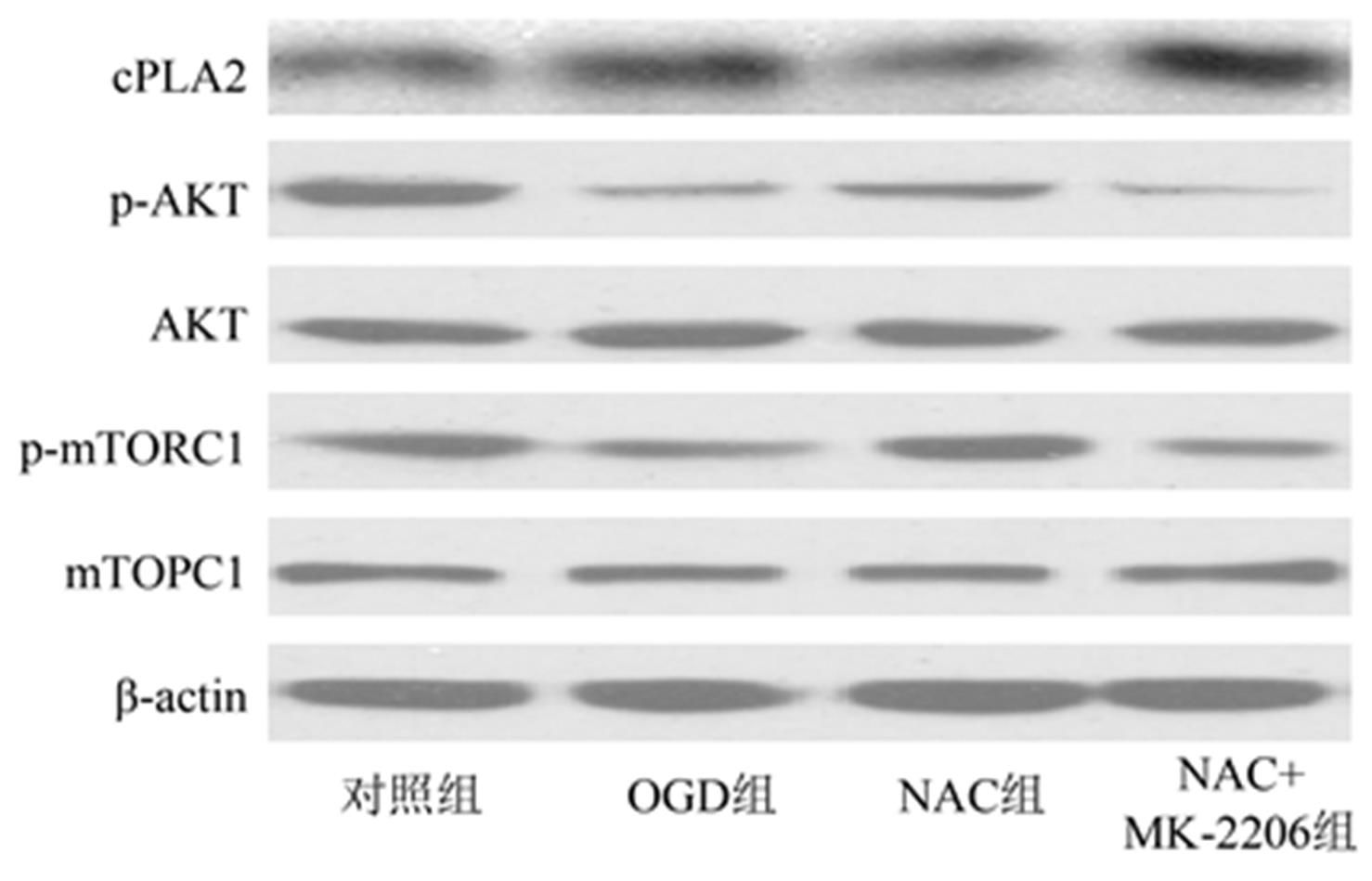
图1 各组p-AKT、p-mTORC1以及cPLA2表达情况
Fig. 1 The expression of p-AKT, p-mTORC1 and cPLA2 in each group
表3 各组p-AKT、p-mTORC1和cPLA2表达情况(n=3,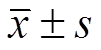 )
)
Tab. 3 The expression of p-AKT, p-mTORC1 and cPLA2 in each group(n=3,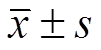 )
)

注:与对照组相比,1)P<0.05;与OGD组相比,2)P<0.05;与NAC组相比,3)P<0.05。
Note: Compared with the control group,1)P<0.05; compared with the OGD group,2)P<0.05; compared with the NAC group,3)P<0.05.
与OGD组相比,NAC组细胞凋亡比例及caspase3表达降低,Bcl-2表达增高(P<0.05)。与NAC组相比,NAC+MK-2206组细胞凋亡比例及caspase3表达增加;Bcl-2表达降低(P<0.05)。结果见图2,表4。
AKT是一种丝氨酸/苏氨酸蛋白激酶,经PI3K、PDK1等上游信号刺激后,引起Ser 473位点和Thr 308位点发生磷酸化,形成活化蛋白激酶,激活下游的mTORC1、S6K、S6以及4E-BP1等,促进细胞存活、增殖和分化[8-9]。研究证实AKT信号激活促进脑组织损伤修复[10-11]。笔者所在课题组的前期研究结果亦证实丹酚酸A对大鼠缺血再灌注模型细胞凋亡的保护作用与激活AKT信号通路有关[6]。本研究结果发现,在体外OGD诱导细胞中,AKT和mTORC1的磷酸化水平显著下降,提示AKT信号被抑制;10 mmol·L-1NAC明显增加AKT和mTORC1的磷酸化水平,提示NAC可改善OGD对AKT信号抑制作用。
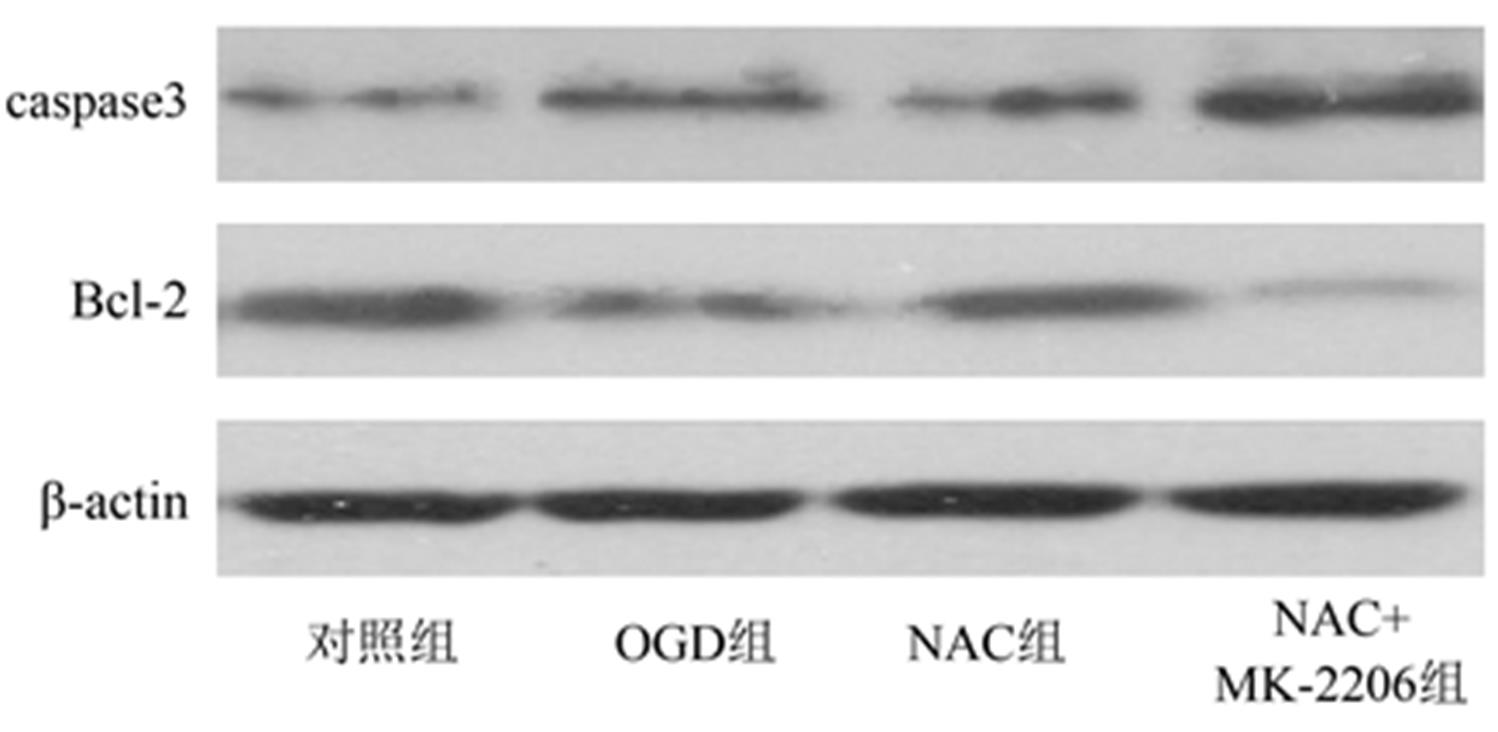
图2 各组凋亡相关蛋白表达改变情况
Fig. 2 The expression of apoptosis related proteins in each group
表4 NAC对OGD细胞细胞凋亡比例、caspase3和Bcl-2表达的影响(n=3,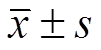 )
)
Tab. 4 The effect of NAC on apoptosis, the expression of caspase3 and Bcl-2 in OGD cells(n=3,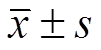 )
)

注:与对照组相比,1)P<0.05;与OGD组相比,2)P<0.05;与NAC组相比,3)P<0.05。
Note: Compared with the control group,1)P<0.05; compared with the OGD group,2)P<0.05; compared with the NAC group,3)P<0.05.
研究表明OGD还参与细胞内产生应激反应有关,主要表现为SOD活性降低、MDA含量增高[12-13]。本研究结果显示,NAC组SOD活性增高、MDA含量降低,说明NAC抑制OGD诱导的氧化应激作用。细胞增殖实验结果显示:OGD组星形胶质细胞存活率较对照组显著下降,NAC组细胞存活率较OGD组明显增高,提示NAC对OGD诱导的星形胶质细胞有保护作用,该结果与文献汇报一致[5]。另外,NAC+MK-2206组细胞存活率和SOD活性无明显增高,MDA含量亦无明显降低,说明NAC通过AKT信号通路抑制OGD诱导细胞氧化应激和增殖抑制作用。
细胞凋亡是细胞程序性死亡,是细胞内多种蛋白的级联效应的总过程。在氧化应激条件下,氧自由基增加,抗氧化酶活性降低,启动内源性凋亡途径,诱导Bcl-2/Bax二聚体形成、细胞色素C释放,引起凋亡效应分子caspase3的活化,导致细胞凋亡[10-11,14]。研究证实胞浆型磷脂酶A2(cP,A2)诱发脑缺血再灌注损伤血脑屏障功能和脑组织损伤与其激活细胞凋亡途径有密切关系[15],而AKT信号激活显著抑制cPLA2诱导的细胞凋亡[16]。笔者所在课题组前期研究证实药物激活AKT信号显著抑制cPLA2表达,抑制脑细胞凋亡[6],说明通过调节AKT-cPLA2途径可达到抑制缺血再灌注损伤的作用。本研究结果显示,NAC组cPLA2表达较OGD组明显下降,NAC+MK-2206组cPLA2表达较NAC组明显增加。事实上,与OGD组相比,NAC组细胞凋亡比例和caspase3表达较明显降低,Bcl-2表达增加;NAC+MK-2206组细胞凋亡比例和caspase3表达较NAC组明显增加,Bcl-2表达降低,说明NAC调节AKT-cPLA2途径,抑制OGD诱导细胞凋亡。
本研究设计在体外初步证实了NAC抑制OGD诱导的细胞损伤作用,缓解OGD诱导AKT信号通路的抑制作用,降低cPLA2的表达,减少细胞凋亡。但仍存在一定的不足,例如在证实AKT活性在NAC保护细胞损伤作用时,单用AKT抑制剂MK-2206作为阳性对照,证据仍不够充分,需采用基因干扰,甚至基因敲出手段阻断AKT活性后,进一步明确AKT在NAC保护星形胶质细胞损伤的作用。
综上所述,OGD条件下,星形胶质细胞AKT信号通路被抑制;NAC缓解OGD诱导AKT信号通路抑制作用,降低cPLA2诱导细胞凋亡作用。
References
[1] 陈伟伟, 高润霖, 刘力生, 等. 《中国心血管病报告2015》概要[J]. 中国循环杂志, 2016, 31(6): 521-528.
[2] MENG W T, LI D X, TONG L. Progress in research of the treatment of ischemic stroke [J]. Chin J New Drugs(中国新药杂志), 2016, 25(10): 1114-1120.
[3] CATANESE L, TARSIA J, FISHER M. Acute ischemic stroke therapy overview [J]. Circ Res, 2017, 120(3): 541-558.
[4] HAN J Y, LI Q, MA Z Z, et al. Effects and mechanisms of compound Chinese medicine and major ingredients on microcirculatory dysfunction and organ injury induced by ischemia/reperfusion [J]. Pharmacol Ther, 2017(177): 146-173.
[5] 秦文, 张晓侠, 刘萍, 等.N-乙酰半胱氨酸对糖氧剥夺大鼠皮层星形胶质细胞的保护作用[J]. 山东大学学报(医学版), 2008, 46(9): 859-862.
[6] 彭潇, 方世记, 郑丽云, 等. 丹酚酸A对大鼠脑缺血再灌注后细胞凋亡的保护作用及其机制[J]. 温州医科大学学报, 2017, 47(9): 674-677.
[7] ZHU K, HE Q, LI L, et al. Silencing thioredoxin1 exacerbates damage of astrocytes exposed to OGD/R by aggravating apoptosis through the Actin-Ras2-cAMP-PKA pathway [J]. Int J Neurosci, 2018, 128(6): 512-519.
[8] MANNING B D, TOKER A. AKT/PKB signaling: Navigating the network [J]. Cell, 2017, 169(3): 381-405.
[9] ZHONG J B, LI X, ZHONG S M, et al. Knockdown of long noncoding antisense RNA brain-derived neurotrophic factor attenuates hypoxia/reoxygenation-induced nerve cell apoptosis through the BDNF-TrkB-PI3K/Akt signaling pathway [J]. Neuroreport, 2017, 28(14): 910-916.
[10] CHEN L, REN Z, WEI X, et al. Losartan protects against cerebral ischemia/reperfusion-induced apoptosis through β-arrestin1-mediated phosphorylation of Akt [J]. Eur J Pharmacol, 2017(815): 98-108.
[11] XU J, HUAI Y, MENG N, et al.L-3-N-butylphthalide activates Akt/mTOR signaling, inhibits neuronal apoptosis and autophagy and improves cognitive impairment in mice with repeated cerebral ischemia-reperfusion injury [J]. Neurochem Res, 2017, 42(10): 2968-2981.
[12] ZHANG L M, ZHANG D X, ZHAO X C, et al. Sevoflurane pre-conditioning increases phosphorylation of Erk1/2 and HO-1 expression via inhibition of mPTP in primary rat cortical neurons exposed to OGD/R [J]. J Neurol Sci, 2017(372): 171-177.
[13] CAO Y, ZHANG L, SUN S, et al. Neuroprotective effects of syringic acid against OGD/R-induced injury in cultured hippocampal neuronal cells [J]. Int J Mol Med, 2016, 38(2): 567-573.
[14] JIANG S, ZHANG X Q. Mechanism of apoptosis induced by quercetin in human colon cancer HT-29 cells [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2017, 34(11): 1535-1538.
[15] ZHANG J, BARASCH N, LI R C, et al. Inhibition of cytosolic phospholipase A(2) alpha protects against focal ischemic brain damage in mice [J]. Brain Res, 2012, 1471: 129-137.
[16] NAINI S M, CHOUKROUN G J, RYAN J R, et al. Cytosolic phospholipase A2α regulates G1 progression through modulating FOXO1 activity [J]. FASEB J, 2016, 30(3): 1155-1170.
Study of Protect Effect and Its Medhanism ofN-acetyl-L-cysteine Protecting Astrocyte Injury Induced by Glucose and Oxygen Deprivation
LU Liying1, PENG Xiao1,2, ZHANG Xu2*
(1.Department of Neurology, Lishui Municipal Central Hospital, Lishui 323000, China; 2.Department of Neurology, the First Affiliated Hospital of Wenzhou Medical University, Wenzhou 325000 ,China)
Abstract:ObjectiveTo investigate the role of AKT signaling pathway in protecting cell injury byN-acetyl-L-cysteine(NAC) induced by oxygen and glucose deprivation(OGD) in astrocytes.MethodsThe astrocytes were used to establish an OGD model. The astrocytes were divided into four groups including control group, OGD group, NAC group and NAC+MK-2206 group. MTT was used to detect cell survival rate. Apoptosis was analyzed by flow cytometry. SOD activity detection kit (WST-8) and lipid peroxidation superoxide dismutase assay kit was used to analyze the SOD activity and malondialdehyde (MDA) content respectively. Western blot was applied to test expression level of AKT and phosphorylated AKT(p-AKT), mTORC1, phosphorylated mTORC1(p-mTORC1), cytosolic phospholipase A2(cPLA2), caspase3 and Bcl-2.ResultsCompared with OGD group, the cell survival rate, the expression of p-AKT, p-mTORC1 and Bcl-2, the activity of SOD increased in NAC group, but the the proportion of apoptosis, expression of cPLA2 and caspase3, MDA content decreased. Compared with NAC group, the cell survival rate, the expression of p-AKT, p-mTORC1 and Bcl-2, the activity of SOD decreased in NAC+MK-2206 group, but the the proportion of apoptosis, expression of cPLA2 and caspase3, MDA content increased.ConclusionNAC alleviate the inhibition of AKT signaling pathway and reduce the expression of cPLA2 and apoptosis by OGD.
KEY WORDS:N-acetyl-L-cysteine; AKT signaling pathway; astrocyte; oxygen and glucose deprivation
中图分类号:R964
文献标志码:A
文章编号:1007-7693(2018)09-1290-05
DOI:10.13748/j.cnki.issn1007-7693.2018.09.004
引用本文:卢理英, 彭潇, 张旭.N-乙酰半胱氨酸对糖氧剥夺诱导星形胶质细胞损伤的抑制作用及机制研究[J]. 中国现代应用药学, 2018, 35(9): 1290-1294.
收稿日期:2017-10-06
作者简介:卢理英,女,主治医师 Tel: 13884352128 E-mail: fsj1216@163.com
*通信作者:张旭,男,博士,主任医师,教授,硕导 Tel: 13626783639 E-mail: 385908814@qq.com
(本文责编:曹粤锋)