栝楼桂枝颗粒抑制MCAO大鼠神经元凋亡的机制研究
曾洁a,张玉琴b,王宏运b,黄彬a,徐伟b,林羽b*
(福建中医药大学,a.康复医疗技术国家地方联合工程研究中心;b.药学院,福州 350122)
摘要:目的研究栝楼桂枝颗粒(Gualou Guizhi granule,GLGZG)是否通过调控PI3K/AKT通路抑制脑缺血再灌注损伤大鼠神经元凋亡而达到抗脑缺血再灌注损伤的作用。方法SD大鼠36只,♂,分为假手术组、大脑中动脉栓塞(middle cerebral artery occlusion,MCAO)组、GLGZG组,每组12只。其中MCAO组、GLGZG组采用线栓法致MCAO建立大鼠脑缺血再灌注损伤模型,GLGZG灌胃给药,连续给药7 d。采用改良的神经功能缺损评分法对大鼠神经功能损伤进行评分,MRI观察大鼠脑梗死体积,Real-time PCR检测脑组织中PI3K、Akt mRNA的表达,Western blot法检测大鼠缺血侧脑组织PI3K(p85)、Akt、p-Akt、PDK1、Bcl-2、Bcl-xL、cleaved-caspase-3、Bad、Bax蛋白表达。结果与MCAO组比较,GLGZG组神经行为学评分降低,第5、7天神经评分显著低于MCAO组(P<0.05);与MCAO组比较,MRI观察发现GLGZG组大鼠脑梗死体积显著减小(P<0.05);PI3K(p85)、p-Akt、PDK1、Bcl-2、Bcl-xL蛋白的表达上调(P<0.01),cleaved-caspase-3、Bad、Bax蛋白的表达下调(P<0.01),对Akt的表达没有影响。结论GLGZG能够提高MCAO大鼠神经功能,抑制神经细胞凋亡,其作用机制可能是通过激活PI3K/AKT信号通路抑制MCAO大鼠神经元凋亡。
关键词:栝楼桂枝颗粒;PI3K/AKT;脑缺血再灌注损伤;大脑中动脉栓塞
由于社会和生活方式的改变以及人口老龄化加重,中风的发病率持续上升,成为导致人类死亡的第二大病因,也是导致严重残疾的主要原因[1]。
栝楼桂枝颗粒(Gualou Guizhi granule,GLGZG,批件号:闽2013S0001)为福建省第二人民医院的院内制剂,临床上主要用于治疗脑卒中后痉挛性偏瘫。课题组在临床上观察发现栝楼桂枝方对中风后患者的运动功能、痉挛状态、以及日常生活活动能力均有明显的改善[2-3],另外,研究者祝玉朴、战美玲[4-5]应用栝楼桂枝汤治疗患者脑卒中后下肢痉挛,发现可有效改善下肢运动功能、提高患者日常生活活动能力。在实验研究方面,课题组前期研究发现栝楼桂枝汤能够提高脑缺血再灌注损伤大鼠的网屏抓握能力及肌力、H-反射,抑制兴奋性氨基酸(谷氨酸、天门冬氨酸、甘氨酸)的释放,改善脑缺血再灌注损伤大鼠的痉挛状态[6-7]。同时研究还发现栝楼桂枝汤能够抑制神经元凋亡、抑制谷氨酸诱导的兴奋性毒性损伤与细胞凋亡的作用[8-9]。本课题组根据栝楼桂枝汤/方制备了GLGZG,疗效确切,但其作用机制尚不明确。内源性保护PI3K/Akt信号通路是脑缺血过程中重要的细胞存活通路。为探讨GLGZG是否应用内源性保护机制,通过PI3K/Akt信号通路减轻脑缺血损伤,抑制神经元凋亡,减轻神经功能损伤,本研究在前期药效学研究基础上[6-7],选择有效的剂量浓度观察基于PI3K/Akt信号通路的GLGZG对脑缺血再灌注损伤大鼠的抗神经元凋亡作用。
1 仪器与材料
1.1 动物
36只SPF级SD大鼠,♂,体质量240~260 g,购于上海斯莱克实验动物有限公司,许可证号:SC-SCXK(沪)2007-0005,由福建中医药大学实验动物中心饲养。
1.2 试剂
GLGZG(由福建省第二人民医院药学部提供,批号:20160809);异氟烷(瑞沃德生命技术有限公司,批号:R510-22);RevertAid First Strand cDNA Synthesis Kit(Thermo Fisher,批号:K1622);Power SYBR®Green PCR Master Mix(Thermo Fisher,批号:4367659);PI3K(p85)单克隆抗体(批号:#4257)、p-Akt单克隆抗体(批号:#4060)、Akt单克隆抗体(批号:#4685)、PDK1单克隆抗体(批号:#5662)、Bcl-2单克隆抗体(批号:#3498)、Bcl-xl单克隆抗体(批号:#2764)、cleaved-caspase-3单克隆抗体(批号:#9661)、Bad单克隆抗体(批号:#9292)、Bax单克隆抗体(批号:#2772)、β-actin抗体(批号:#4970)均购自Cell Signaling Technology公司;SDS-PAGE 凝胶快速配制试剂盒(碧云天生物技术有限公司);HRP结合山羊抗兔IgG、HRP结合兔抗鼠IgG均购自厦门鹭隆生物科技有限公司。
1.3 仪器
Biospec 70/20USR型7.0T小动物核磁共振成像系统(Bruker);气体麻醉机(瑞沃德生命技术有限公司);7900HT型实时荧光定量PCR仪(AppLied Biosystems);ChemiDoc XRS+型凝胶成像分析系统(Bio-Rad);PrimoR型高速台式冷冻离心机(ThermoFisher)。
2 方法
2.1 建立大鼠大脑中动脉栓塞(middle cerebral artery occlusion,MCAO)动物模型
SD大鼠适应性喂养1周后造模,实验前动物禁食12 h,自由饮水。根据参考文献及前期经验[6-7]实行左侧MCAO手术。假手术组除不插入线栓外其余操作相同,自由摄食饮水。
实验动物分为假手术组、MCAO组、GLGZG组(灌胃给药),每组各12只。假手术组和MCAO组给予0.9%氯化钠溶液(10 mL·kg-1);根据人体与动物药物等效剂量换算[10],GLGZG组灌胃给予GLGZG(3.6 g·kg-1·d-1),GLGZG被配制成0.4 g·mL-1的药液,故灌胃体积为0.9 mL·(100 g)-1,于造模后2 h给药,连续给药7 d。
2.2 大鼠神经行为学评价
使用国际上公认的大鼠脑卒中后神经功能缺损评价标准即改良的神经功能缺损评分法(modified neurological severity score,mNSS)对大鼠进行神经行为学评价[11-12],包括平衡木实验、行走测试、反常运动、感觉测试、反射缺失和提尾反射。评判标准:1~6分认为轻型受损;7~12分认为中型受损;13~18分认为重型受损。纳入标准:以mNSS评分>6分,且4项神经功能均有缺损为标准,判定模型成功。
2.3 大鼠核磁共振成像观察与分析
假手术组、MCAO组、GLGZG组分别于最后一次灌胃后6 h采用小动物核磁共振仪观察。各组大鼠使用异氟烷进行麻醉后,将头部固定于核磁共振推进床,呈俯卧位。大鼠头部表面线圈检测,观察前先进行冠状位定位扫描,后用T2WI增强系列扫描。MRI成像参数为:T2WI采用TSE序列;Repetition Time:2 000 ms;Echo Time:28 ms;扫描层数:24层;Field ofview:30 mm×30 mm;Number of Signal Averaged:15;扫描时间为5 min 50 s。
观察健侧脑区、缺血周围脑区有无异常信号强化,以及强化部位、类型。观察T2WI脑结构扫描图像,利用Image J图像处理软件,计算脑梗死体积百分比,公式为脑梗死体积百分比=[每层脑梗面积×(层间距+层厚)]/[同层面全脑面积×(层间距+层厚)]=每层脑梗体积/同层面全脑体积×100%。一共统计15层。
2.4 Real-Time PCR检测脑组织中相关基因 mRNA的表达
每组随机抽取5只大鼠,取大鼠脑组织100 mg,加入Trizol试剂1 mL后匀浆,提取总RNA。测量A260值,根据A260计算RNA浓度,-80 ℃保存。采用RevertAid First Strand cDNA Synthesis Kit进行逆转录反应,各目的基因的扩增引物序列见表1。实时定量PCR反应:50 ℃预热2 min,95 ℃预热10 min,95 ℃变性15 s,60 ℃退火30 s,60 ℃延伸30 s,共40个循环;采用荧光定量PCR仪上的软件进行数据的分析处理,计算目的基因mRNA相对表达水平。
表1 引物序列
Tab. 1 Primer sequence

基因引物序列 PI3K Forward5’-GCACGGCGATTACACTCTTAC-3’ Reverse5’-TGGACACTGGGTAGAGCAACT-3’ Akt Forward5’-ACTCATTCCAGACCCACGAC-3’ Reverse5’-AGCCCGAAGTCCGTTAT-3’ GADPH Forward5’- TGAACGGGAAGCTCACTGG-3’ Reverse5’- GCTTCACCACCTTCTTGATGTC-3’
2.5 Western blot检测大鼠脑组织PI3K(p85)、Akt、p-Akt、PDK1、Bcl-2、Bcl-xL、cleaved-caspase-3、Bad、Bax蛋白的表达
提取总蛋白:采用SDS-PAGE垂直板全湿法电泳,蛋白经SDS-PAGE胶分离后,将凝胶中的蛋白转移至PVDF膜,用封闭液封闭2 h后,加入稀释的一抗(稀释比例均为1∶1 000),4 ℃下孵育过夜,次日TBST洗3遍,每次10 min,加入1∶5 000稀释HRP标记的第二抗体,室温下孵育2 h,TBST洗3遍。加ECL显色剂经凝胶成像分析系统检测,分析目标条带的灰度值,以目标蛋白与β-actin的灰度值比值作为目标蛋白的相对量,并统计各组之间的差异。
2.6 统计学方法
用SPSS 18.0统计软件进行分析,数据以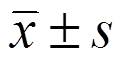 表示,各组数据间的差别用ANOVA方法分析,以P<0.05为差异具有统计学意义。
表示,各组数据间的差别用ANOVA方法分析,以P<0.05为差异具有统计学意义。
3 结果
3.1 GLGZG对MCAO大鼠神经功能损伤的影响
采用mNSS评分法对大鼠进行神经行为学评价。结果显示,MCAO大鼠术后3 d内神经功能缺损情况逐渐加重,mNSS评分显著高于假手术组(P<0.01);GLGZG干预后,mNSS评分下降,均低于MCAO组,即GLGZG可逆转MCAO大鼠模型神经功能缺损,但是第1,3天2组间无显著性差异,第5,7天mNSS评分显著低于MCAO组(P<0.05或P<0.01),提示GLGZG可提高MCAO组大鼠的神经功能。各组大鼠mNSS评分见表2。
表2 GLGZG对大鼠神经行为学的影响
Tab. 2 Effect of GLGZG on neurological deficits in rats
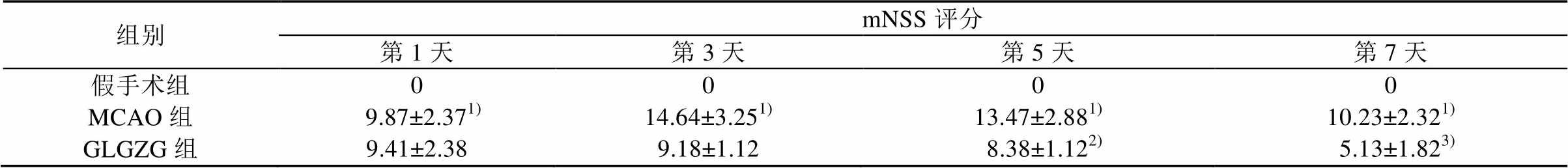
组别mNSS评分 第1天第3天第5天第7天 假手术组0000 MCAO组 9.87±2.371)14.64±3.251)13.47±2.881)10.23±2.321) GLGZG组9.41±2.389.18±1.12 8.38±1.122) 5.13±1.823)
注:与假手术组相比,1)P<0.01;与MCAO组相比,2)P<0.05,3)P<0.01。
Note: Compared with the sham operation group,1)P<0.01; compared with the MCAO group,2)P<0.05,3)P<0.01.
3.2 大鼠核磁共振成像结果分析
以T2WI系列,大鼠MRI观察灌胃给药GLGZG对MCAO模型大鼠脑梗死体积的影响。实验结果表明,相较于假手术组,模型组大鼠造模后,脑梗死体积占全脑体积百分比显著提升[0vs(58.226±8.8)%],且差异有统计学意义(P<0.01)。GLGZG组大鼠脑梗死体积比相较于MCAO模型组显著降低[(35.169±5.2)%vs(58.226±8.8)%],且差异有统计学意义(P<0.01)。以上结果表明GLGZG连续灌胃给药7 d可以显著减少MCAO模型大鼠脑梗死体积。MRI扫描图见图1。
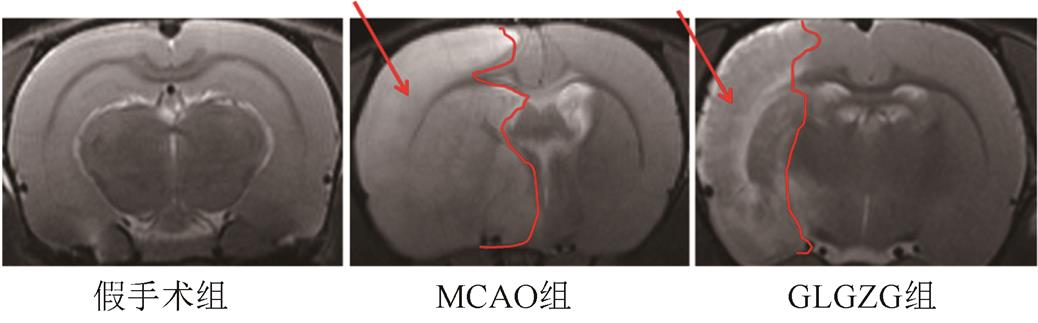
图1 大鼠脑梗死体积MRI扫描图
Fig. 1 MRI scan of cerebral infarction in rats
3.3 GLGZG对大鼠脑组织中PI3K、Akt mRNA 的影响
与假手术组比较,MCAO组大鼠PI3K mRNA、Akt mRNA表达明显降低(P<0.01)。与MCAO组比较,GLGZG组大鼠PI3K mRNA、Akt mRNA表达明显增高(P<0.01)。提示GLGZG对MCAO模型大鼠的神经功能损伤具有保护作用。结果见图2。
3.4 GLGZG对MCAO大鼠脑组织Bcl-2、Bcl-xL、cleaved-caspase-3、Bad、Bax蛋白表达的影响
采用Western blot检测Bcl-2、Bcl-xL、cleaved-caspase-3、Bad、Bax蛋白表达。结果显示,与假手术组相比,MCAO模型组Bcl-2、Bcl-xL蛋白表达量显著降低(P<0.01);与MCAO组相比,GLGZG组Bcl-2、Bcl-xL则显著上调(P<0.01)。与假手术组相比,MCAO模型组中cleaved- caspase-3、Bad、Bax蛋白表达量显著升高(P<0.01);与MCAO组相比,GLGZG组cleaved-caspase-3、Bad、Bax显著下调(P<0.01或P<0.05)。结果见图3。

图2 GLGZG对MCAO大鼠脑组织中PI3K、Akt mRNA 的影响
与假手术组相比,1)P<0.01;与MCAO组相比,2)P<0.01。
Fig. 2 Effect of GLGZG on mRNA expression of PI3K, Akt in MCAO rats
Compared with the sham operation group,1)P<0.01; compared with MCAO group,2)P<0.01.
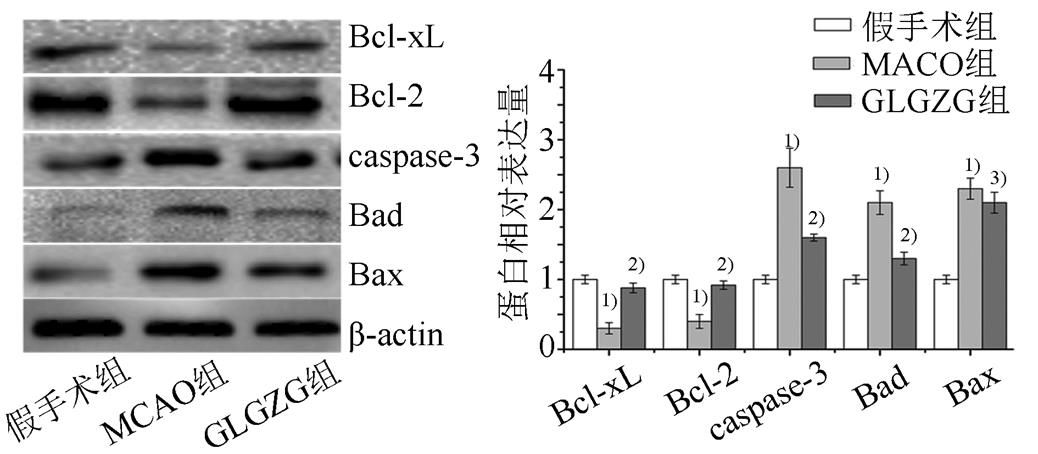
图3 GLGZG对MCAO大鼠脑组织中Bcl-2、Bcl-xL、caspase-3、Bad、Bax蛋白的影响
与假手术组相比,1)P<0.01;与MCAO组相比,2)P<0.05,3)P<0.01。
Fig. 3 Effect of GLGZG on protein expression of Bcl-2, Bcl-xL, caspase-3, Bad, Bax in MCAO rats
Compared with the sham operation group,1)P<0.01; compared with the MCAO group,2)P<0.05,3)P<0.01.
3.5 GLGZG对MCAO大鼠脑组织PI3K(p85)、Akt、p-Akt、PDK1蛋白表达的影响
采用Western blot检测PI3K(p85)、p-Akt、Akt、PDK1蛋白表达。与假手术组相比,MCAO组中PI3K(p85)、p-Akt、PDK1蛋白表达量显著降低(P<0.01);与MCAO组相比,GLGZG组 PI3K(p85)、p-Akt、PDK1则显著上调(P<0.01),各组中Akt蛋白表达差异无统计学意义。结果见图4。
4 讨论
细胞凋亡的过程涉及一系列蛋白,如caspase家族蛋白、Bcl-2家族蛋白等。caspase-3为半胱氨酸蛋白酶家族成员,是细胞凋亡的重要执行者。Bcl-2家族蛋白中Bcl-xL、Bcl-2发挥抑制凋亡的作用,相反,Bax、Bad蛋白发挥促凋亡作用[13]。林羽等[14]研究表明,GLGZG能够显著升高谷氨酸损伤原代神经细胞的活力,显著降低谷氨酸损伤原代海马神经元caspase-3 mRNA、Bax mRNA的表达,升高Bcl-2 mRNA的表达;蛋白表达的趋势与mRNA相似,GLGZG组与模型组比较,可降低大鼠海马组织caspase-3、Bax蛋白的表达,升高Bcl-2蛋白的表达。据报道GLGZG可显著提高NMDA损伤神经元活性,显著减少乳酸脱氢酶的H释放,抑制NMDA诱导的神经元凋亡[15]。表明GLGZG可抑制神经细胞凋亡,与本研究结果一致。
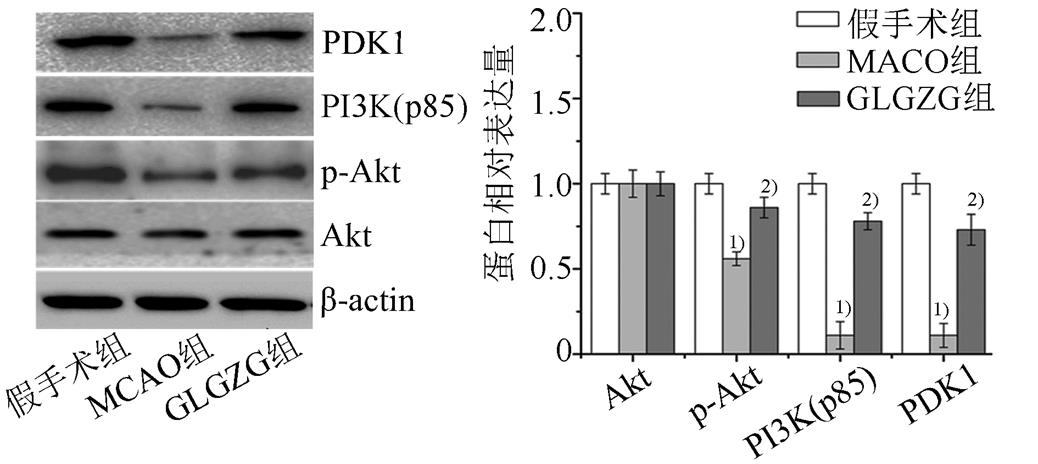
图4 GLGZG对MCAO大鼠脑组织中PI3K(p85)、p-Akt、Akt、PDK1蛋白的影响与假手术组相比,1)P<0.01;与MCAO组相比,2)P<0.01。
Fig. 4 Effect of GLGZG on protein expression of PI3K(p85), p-Akt, Akt and PDK1 in brain tissues of MCAO rats Compared with the sham operation group,1)P<0.01; compared with the MCAO group,2)P<0.01.
PI3K/Akt信号通路是介导细胞存活的1条经典通路[16],是细胞信号通路中1个重要的激酶家族[17],尤其对哺乳动物细胞的存活、生长、增殖起到关键作用[18]。通路的激活有助于发挥对神经细胞的保护作用,尤其是在缺血/缺氧神经元受到损伤时。PI3K/Akt作为一种促细胞存活的内源性保护机制信号通路,在脑缺血时的神经保护作用受到越来越多的关注[19]。当脑损伤发生时,激活PI3K,使PI3K磷酸化,磷酸化的PI3K在蛋白PIP2作用下,激活下游蛋白PDK1,使PDK1蛋白上的苏氨酸(Thr376、Thr373)位点、丝氨酸(Ser241)位点磷酸化,磷酸化的蛋白在PIP2作用下,活化蛋白Akt,使Akt蛋白上的Thr308位点、Ser473位点磷酸化,成为有活性的激酶,从而激活或抑制下游靶蛋白,进而调节细胞的凋亡、增殖等[20-21]。本研究采用Real-time PCR、Western blot法检测了P13K/Akt信号通路上基因、蛋白的水平,结果表明GLGZG干预后,P13K、Akt基因水平、PI3K(p85)、p-Akt、PDK1蛋白表达增加。GLGZG可能通过激活p-Akt,调控PI3K/Akt信号通路,进而抑制Bax、Bad蛋白的表达。
GLGZG是经典的中药复方制剂,由多味中药组成,含有数百种成分[22]。课题组前期研究鉴定了栝楼桂枝汤的42个吸收入血成分。包括单萜苷类、黄酮类、酚酸类、姜酚类、三萜皂苷类及没食子酰糖类等[23]。推断GLGZG改善大鼠脑缺血再灌注损伤的作用可能是因为瓜氨酸、芍药内酯苷、芍药苷、芹糖甘草苷、芹糖异甘草苷、异甘草苷、异甘草素和甘草酸等成分入脑而发挥了神经保护作用[24-25]。GLGZG的药效物质基础仍有待深入研究。
综上所述,GLGZG具有减轻大鼠脑缺血再灌注损伤的作用,其机制可能与调控PI3K/Akt信号通路有关。此外本课题仍有待深入研究,比如GLGZG激活PI3K/Akt信号通路对减轻脑卒中后肢体痉挛药效作用的影响还不够明确。今后有必要采用侧脑室注射LY294002抑制剂,研究PI3K/Akt信号通路被阻断后GLGZG对神经元凋亡的抑制作用。另外,还有必要利用体外原代神经细胞,建立氧糖剥夺/复氧模型进行相关研究,体外实验可以更好地控制实验条件,避免多种复杂因素的影响。体内、体外实验相结合,以求更准确阐释GLGZG激活PI3K/AKT通路抑制神经元凋亡的药理机制。
REFERENCES
[1] KIM J, FANN D Y, SEET R C, et al. Phytochemicals in ischemic stroke [J]. Neuromol Med, 2016, 18(3): 283-305.
[2] 杨春梅, 陈立典, 陶静. 古方今用瓜蒌桂枝汤[J]. 辽宁中医杂志, 2012, 39(8): 1599-1600.
[3] CHEN Y L, CHEN L D, TAO J. Clinical research on treating limbs spasm from cerebral apoplexy with the Gualou Guizhi decoction [J]. Clin J Chin Med(中医临床研究), 2013, 5(4): 7-9.
[4] ZHU Y P. Clinical Effect analysis of Trichosanthes Kirilowii Cassia Twig Decoction for treatment of lower limb spasm after cerebral apoplexy patients [J]. Guide Chin Med(中国医药指南), 2015, 13(29): 27-28.
[5] 战美玲. 脑卒中后下肢痉挛应用栝楼桂枝汤治疗的效果分析[J]. 双足与保健, 2017, 26(11): 160-161.
[6] CHEN X, LI H, HUANG M, et al. Effect of Gua Lou Gui Zhi decoction on focal cerebral ischemia-reperfusion injury through regulating the expression of excitatory amino acids and their receptors [J]. Mol Med Rep, 2014, 10(1): 248-254.
[7] HUANG J, TAO J, XUE X, et al. Gua Lou Gui Zhi decoction exerts neuroprotective effects on post-stroke spasticity via the modulation of glutamate levels and AMPA receptor expression [J]. Int J Mol Med, 2013, 31(4): 841-848.
[8] LI Z F, LI R H, MAO J J, et al, Protective effect of Gualou Guizhi decoction on BV-2 cells injuried by glutamate [J]. J Fujian Univ Tradit Chin Med(福建中医药大学学报), 2013, 23(5): 14-17.
[9] LI Z, HU H, LIN R, et al. Neuroprotective effects of Gua Lou Gui Zhi decoction against glutamate-induced apoptosis in BV-2 cells [J]. Int J Mol Med. 2014, 33(3): 597-604.
[10] HUANG J H, HUANG X H, CHEN Z Y, et al. Dose conversion among different animals and healthy volunteers in pharmacological study [J]. Chin J Clin Pharm Therap(中国临床药理学与治疗学), 2004, 9(9): 106-107.
[11] GAO Y, CHEN T, LEI X, et al. Neuroprotective effects of polydatin against mitochondrial-dependent apoptosis in the rat cerebral cortex following ischemia/reperfusion injury [J]. Mol Med Rep, 2016, 14(6): 5481-5488.
[12] JI Y, TENG L, ZHANG R, et al. NRG-1β exerts neuroprotective effects against ischemia reperfusion-induced injury in rats through the JNK signaling pathway [J]. Neuroscience, 2017(362): 13-24.
[13] LEVESLEY J, STEELE L, BRÜNING-RICHARDSON A, et al. Selective BCL-xL inhibition promotes apoptosis in combination with MLN8237 in medulloblastoma and pediatric glioblastoma cells [J]. Neuro Oncol, 2017, 20(2): 203-214.
[14] 林羽, 徐伟, 张玉琴, 等. 栝楼桂枝颗粒抗缺血性脑卒中大鼠神经元及原代海马神经元凋亡研究[J]. 康复学报, 2015, (1): 38-43.
[15] 王宏运, 张玉琴, 李煌, 等. 栝楼桂枝颗粒对NMDA诱导海马神经元兴奋性毒性损伤的保护作用[J]. 中华中医药杂志, 2017, 32(9): 4115-4120.
[16] JIANG X, TANG X, ZHANG P, et al. Cyanidin-3-O-β- glucoside protects primary mouse hepatocytes against high glucose-induced apoptosis by modulating mitochondrial dysfunction and the PI3K/Akt pathway [J]. Biochem Pharmacol, 2014, 90(2): 135-144.
[17] 马陈晨. 新型PI3K抑制剂的设计合成及抗肿瘤活性研究[D]. 济南: 山东大学, 2017.
[18] FAIVRE S, DJELLOUL S, RAYMOND E. New paradigms in anticancer therapy: targeting multiple signaling pathways with kinase inhibitors [J]. Semin Oncol, 2006, 33(4): 407-420.
[19] XUE X, YOU Y, TAO J, et al. Electro-acupuncture at points of Zusanli and Quchi exerts anti-apoptotic effect through the modulation of PI3K/Akt signaling pathway [J]. Neurosci Lett, 2014, (558): 14-19.
[20] XUE M, JI X, XUE C, et al. Caspase-dependent and caspase-independent induction of apoptosis in breast cancer by fucoidan via the PI3K/AKT/GSK3β pathwayin vivoandin vitro[J]. Biomed Pharmacother, 2017(94): 898-908.
[21] ZHU X, JIANG X, LI A, et al. S-allylmercaptocysteine suppresses the growth of human gastric cancer xenografts through induction of apoptosis and regulation of MAPK and PI3K/Akt signaling pathways [J]. Biochem Biophys Res Commun, 2017, 491(3): 821-826.
[22] XU W, HUANG M, LI H, et al. Chemical profiling and quantification of Gua-Lou-Gui-Zhi decoction by high performance liquid chromatography/quadrupole-time-of-flight mass spectrometry and ultra-performance liquid chromatography/ triple quadrupole mass spectrometry [J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2015(986/987): 69-84.
[23] XU W, WU X, HUANG M Q, et al Analysis on pharmacodynamic constituents in Gualou Guizhi Decoction by serum pharmacochemistry [J]. Chin Tradit Herb Drugs(中草药), 2017, 48(10): 2033-2043.
[24] ZHANG Y Q, LI H, XU W, et al. Effects of Gualou Guizhi granule on blood brain barrier permeabillity and neuroprotection in cerebral ischemia-reperfusion injury rat [J]. Chin J Tradit Chin Med Pharm(中华中医药杂志), 2015, 30(5): 1410-1417.
[25] 陈阿虹, 刘杰, 许文, 等. RRLC-MS/MS法测定栝楼桂枝颗粒中γ-氨基丁酸和瓜氨酸含量[J]. 福建中医药, 2015, 46(4): 43-45.
(本文责编:李艳芳)
Mechanism of Gualou Guizhi Granule Inhibits Neuronal Cell Apoptosis in MCAO Rats
ZENG Jiea, ZHANG Yuqinb, WANG Hongyunb, HUANG Bina, XU Weib, LIN Yub*
(Fujian University of Traditional Chinese Medicine, a.National-local Joint Engineering Research Center of Rehabilitation Medicine Technology; b.Pharmacy College, Fuzhou 350122, China)
ABSTRACT: OBJECTIVETo investigate the inhibitive effect of Gualou Guizhi granule(GLGZG) on nerve cell apoptosis in cerebral ischemia-reperfusion injury rat through activatig PI3K/nAKT pathway.METHODSThirty-six male SD rats were divided into sham operation group,middle cerebral artery occlusion(MCAO) model group and GLGZG group, 12 for each group. MCAO model group and GLGZG group subjected to focal cerebral ischemia reperfusion with suture-occluded induced MCAO method.GLGZG was gave by intragastric administration, once daily for 7 d. Neurobehavioral deficit was performed with modified neurological severity score(mNSS) scale. MRI was used to observe the cerebral infarct volume in rats. PI3K, Akt mRNA were detected by qRT-PCR in the infarcted cortex. The protein expression of PI3K(p85), p-Akt, PDK1, Bcl-2, Bcl-xL, cleaved-caspase-3, Bad, Bax were detected by Western blot.RESULTSThe mNSS score of GLGZG group was reduced compared with the MACO model group, especially on 5th and 7th day(P<0.05). Compared with MCAO group, the cerebral infarct volume in GLGZG group rats were decreased significantly(P<0.05) and upregulated the proteins expression of PI3K(p85), p-Akt, PDK1, Bcl-2, Bcl-xL(P<0.01), downregulated cleaved-caspase-3, Bad, Bax(P<0.01), however, the protein expression of Akt was not change.CONCLUSIONGLGZG can improve the nerve function deficit of MCAO rat and inhibit the apoptosis of neural cell, which may be associated with activating the PI3K/AKT pathway.
KEY WORDS:Gualou Guizhi granule; PI3K/AKT; cerebral ischemia-reperfusion injury; middle cerebral artery occlusion
中图分类号:R965.2
文献标志码:A
文章编号:1007-7693(2018)07-1007-05
DOI:10.13748/j.cnki.issn1007-7693.2018.07.014
基金项目:国家自然科学基金项目(81674046);福建省教育厅资助省属高校科研专项立项项目(JK2017023)
作者简介:曾洁,男,副主任药师 Tel: (0591)22861135 E-mail: zjfjtcm@163.com
*通信作者:林羽,男,博士,教授 Tel: (0591)22861693 E-mail: lyfjlab@163.com
收稿日期:2018-01-19
引用本文:曾洁, 张玉琴, 王宏运, 等. 栝楼桂枝颗粒抑制MCAO大鼠神经元凋亡的机制研究[J]. 中国现代应用药学, 2018, 35(7): 1007-1011.

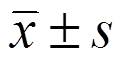 表示,各组数据间的差别用ANOVA方法分析,以P<0.05为差异具有统计学意义。
表示,各组数据间的差别用ANOVA方法分析,以P<0.05为差异具有统计学意义。



