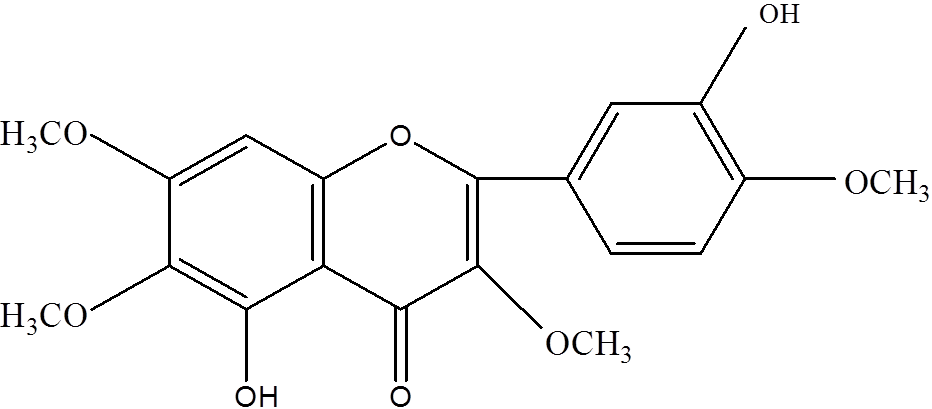
图1 紫花牡荆素化学结构式
Fig. 1 chemical structure formula of casticin
盛萍,乔美玲
(新疆医科大学中医学院,乌鲁木齐 830011)
摘要:目的研究维药一枝蒿中指标成分紫花牡荆素的单体制备方法,并建立其含量测定方法。方法利用HPD-450型大孔树脂吸附法提取富集紫花牡荆素,配合Sephadex LH-20柱色谱技术与波谱手段,分离纯化并鉴定其化学结构;含量测定色谱条件:采用色谱柱为Agilent HC-C18(250 mm×4.6 mm,5 μm);流动相为甲醇-水(70∶30);柱温30 ℃,检测波长350 nm,流速1.0 mL·min-1。结果紫花牡荆素纯度为99.7%,在9.42~ 75.36 μg·mL-1(r=0.999 6)内呈良好的线性关系,平均回收率为109.2%(RSD=2.12%)。结论大孔吸附树脂纯化可以获得高纯度紫花牡荆素;建立的含量测定方法简便、准确、稳定,可以用于维药一枝蒿的质量控制。
关键词:一枝蒿;紫花牡荆素;大孔吸附树脂;高效液相色谱法;维药
一枝蒿(Artemisia rupestrisL.)为菊科蒿属岩蒿植物,以全草入药,是维吾尔医常用药材。因其野生品种唯独生长在中国新疆境内的天山、阿尔泰山和昆仑山山脉,海拔1 600~4 500 m的森林草原带地区[1],并在新疆民间沿用已久,故名新疆一枝蒿。维吾尔药志记载其具有祛风活血、散瘀消肿、健胃消食、清热解毒、抗过敏、解蛇毒等功效,其化学成分主要含有黄酮类、酮酸类、倍半萜类、多糖类、挥发油化合物[2],其中紫花牡荆素等黄酮类化合物为其主要活性成分[3]。现代药理研究表明,紫花牡荆素具有明显的体内外抗炎、抗肿瘤等作用[4-7]。目前,新疆学者对一枝蒿的研究主要集中在种子萌发[8]、化学成分[9-10]、药理作用[11-12]等方面,但关于一枝蒿中指标成分紫花牡荆素的单体制备方法及含量测定方法的研究尚未见报道,也未收载于《中华人民共和国卫生药品标准—维吾尔药分册》。本实验从天然产物维药一枝蒿中分离富集紫花牡荆素单体化学成分,并建立其含量测定方法。
试验药材3批(S1,S2,S3)由新疆维吾尔自治区人民医院药剂科提供,由新疆医科大学热娜•卡斯木教授鉴定为一枝蒿(Artemisia rupestrisL.);紫花牡荆素对照品自制,IR、1H-NMR、和13C-NMR数据均符合文献数据要求[13-14],液相色谱面积归一化测定其纯度为99.7%;HPD-450型树脂(河北沧州宝恩化工有限公司);Sephadex LH-20 (Pharmacia公司);200~300目柱层析硅胶(青岛海洋化工厂产品);薄层层析硅胶G(青岛海洋化工厂产品);甲醇为色谱纯;水为重蒸馏水;其他试剂均为分析纯。
X4型显微熔点测定仪(北京第三光学仪器厂,温度计未校正);BP211D电子天平(德国赛多利斯公司);Inova 600 MHZ型核磁共振仪(美国瓦里安公司);RE-52旋转式蒸发器(上海安亭电子仪器厂);1100型高效液相色谱仪(美国Agilent);KQ-400D型数控超声提取器(昆山市超声仪器有限公司)。
取一枝蒿药材(过四号筛)455 g,用水煎煮3 次,每次30 min,合并提取液,减压回收至生药含量为0.04 g·mL-1的样品溶液。样品溶液通过经预处理的HPD-450型大孔吸附树脂柱,静置30 min,用2倍树脂体积的蒸馏水洗脱至洗脱液近无色,再用70%乙醇洗脱,减压回收洗脱液,冷冻干燥得70%乙醇洗脱物。再对70%乙醇洗脱物进行硅胶柱色谱分离,用氯仿-甲醇梯度洗脱收集含紫花牡荆素部分,再经Sephadex LH-20柱色谱,甲醇-水纯化,得黄色针状结晶单体化合物(约410 mg),收率为0.09%,经液相色谱面积归一化测定其纯度为99.7%。
黄色针状结晶,易溶于甲醇、氯仿,熔点为180~182 ℃。盐酸-镁粉反应阳性,提示该化合物为黄酮类化合物。EI-MSm/z:374(M+)。UVλmax(MeOH):350,258,231 nm。IR光谱3 370 cm-1处提示结构中有一羟基存在。在1H-NMR (600 MHZ,CDCl3)谱中δ12.7(1H,s)为5-OH的信号;在δ7.72(1H,d,J=1.5 Hz)、7.01(1H,d,J=8.7 Hz)与7.61(1H,dd,J邻= 8.7 Hz,J间=1.5 Hz)处出现的峰分别为B环上H-2′、H-5′、H-6′的信号;δ6.51(1H,s)为H-8的信号;δ3.99(3H,s)、3.97(3H,s)、3.93(3H,s)、3.86(3H,s)为3、6、7、4′位上取代的甲氧基信号峰。13C-NMR(CDCl3),δppm:178.8(C=O),155.9(C-2),138.5(C-3),152.6(C-5),132.1(C-6),158.1(C-7),90.3(C-8),152.2(C-9),106.4(C-10),122.5(C-1′),114.5(C-2′),146.6(C-3′),148.3(C-4′),110.8(C-5′),122.2(C-6′),56.3、56.0、60.8、60.1(4个OCH3)。经UV、IR、1H-NMR、13C-NMR谱的综合分析,上述数据与文献[13-14]一致,故确定该化合物结构为3,6,7,4’-四甲氧基-5,3’-二羟基黄酮(3,6,7,4’-tetramethoxy-5,3’- dihydroxy flavone),即紫花牡荆素。结构式见图1。

图1 紫花牡荆素化学结构式
Fig. 1 chemical structure formula of casticin
2.3.1 色谱条件 色谱柱:Agilent HC-C18(250 mm×4.6 mm,5 μm)柱;流动相:甲醇-水(70∶30);检测波长:350 nm;柱温:30 ℃;流速:1.0 mL·min-1。样品中紫花牡荆素峰与其他峰分离度>1.5,理论板数≥5 000。对照品及供试品色谱图见图2。
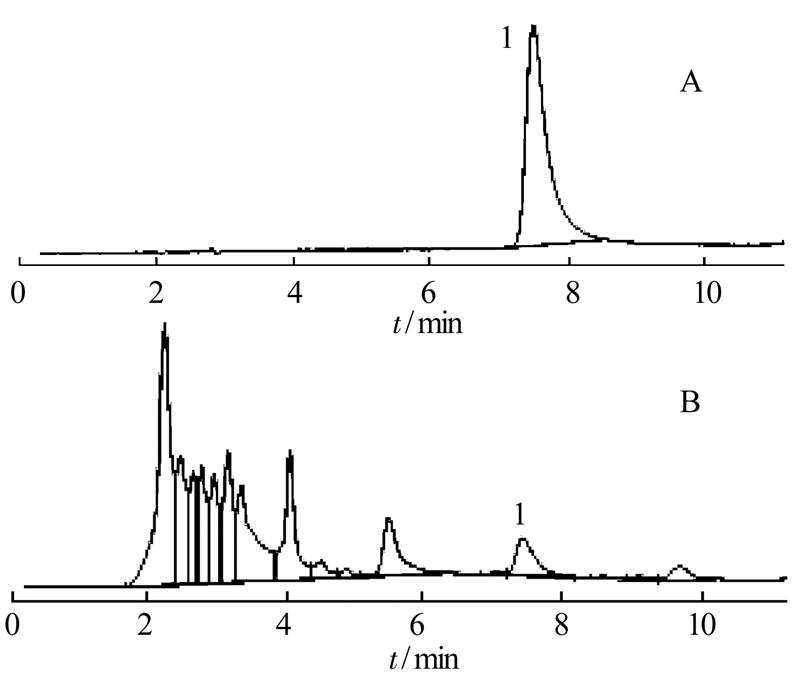
图2 HPLC色谱图
A-对照品;B-供试品;1-紫花牡荆素。
Fig. 2 HPLC chromatograms
A-standard solution; B-sample solution; 1-casticin.
2.3.2 对照品溶液的制备 精密称取紫花牡荆素对照品23.55 mg,置25 mL量瓶中,用甲醇定容,摇匀,作为对照品溶液。
2.3.3 供试品溶液的制备 精密称取一枝蒿药材粉末0.50 g,置25 mL量瓶中,加60%的甲醇20 mL,浸泡30 min,超声提取30 min,放置至室温,加60%的甲醇至刻度,微孔滤膜(0.45 μm)滤过,取续滤液作为供试品溶液。
2.3.4 线性关系考察 分别精密吸取对照品溶液0.1,0.2,0.4,0.6,0.8 mL,置10 mL量瓶中,加甲醇至刻度,摇匀。按“2.3.1”项下色谱条件进样,进样量为1 μL,以色谱峰面积为纵坐标,对照品进样量(μg)为横坐标,进行线性回归,得回归方程A=2.518 511 97C-0.984 591 7,r=0.999 6,表明紫花牡荆素在9.42~75.36 μg·mL-1内线性关系良好。
2.3.5 仪器精密度试验 精密吸取9.42μg·mL-1紫花牡荆素对照品溶液1 μL,连续进样5次,峰面积分别为20.801,21.102,20.201,20.001,20.602,峰面积的RSD为2.18%。
2.3.6 稳定性试验 取同一供试品溶液,分别于0,2,4,6,8,24,48 h进样,记录峰面积为53.941,53.910,54.411,54.922,52.622,54.781,53.001,RSD为1.73%,表明供试品溶液在48 h内稳定。
2.3.7 重复性试验 同一批药材(S1)取样5份,按“2.3.3”项下方法制备供试品溶液,测定紫花牡荆素含量,RSD为1.43%,表明此方法的重复性良好。
2.3.8 回收率试验 精密称取样品粉末0.25 g,共6份,置25 mL量瓶中,分别加入9.42μg·mL-1的紫花牡荆素对照品溶液,按供试品溶液制备法操作,记录峰面积,计算回收率,结果显示平均回收率为109.2%,RSD为2.12%。
2.3.9 含量测定 取3批样品分别按“2.3.3”项下方法制备样品溶液。外标法计算一枝蒿中紫花牡荆素的含量,平均含量为0.108%,RSD为1.23%(n=5)。
在分离制备紫花牡荆素单体成分实验过程中,本研究首次利用大孔吸附树脂、硅胶柱色谱、葡聚糖凝胶(Sephadex LH-20)柱色谱,对一枝蒿药材水煎液中的黄酮类化合物进行提取、分离、富集。由于一枝蒿水煎液中所含的成分极性较大,经筛选确定HPD-450型大孔吸附树脂为分离纯化一枝蒿总黄酮的最佳树脂,同时考察了HPD-450型大孔吸附树脂富集一枝蒿总黄酮的最佳工艺参数[15]。在上述样品纯化条件下,分离纯化的一枝蒿总黄酮含量和回收率均最高。由于黄酮类化合物多具羟基,有的母核上连有数量不等的糖,极性较强,因此单纯使用硅胶柱色谱分离效果不理想,结合采用葡聚糖凝胶Sephadex LH-20柱色谱进行分离纯化,分离制备的紫花牡荆素效率高,收率0.09%,纯度99.7%。
在建立紫花牡荆素含量测定实验过程中,试用了甲醇-水、乙腈-水不同比例为流动相系统,结果以甲醇-水(70∶30)系统分离效果好,此时的保留时间为7.47 min,理论板数、分离度、脱尾因子、不对称度均符合中国药典的规定要求。同时在供试品溶液制备中考察了水浴回流提取、超声提取2种方法,结果以超声提取效果较好。在以超声提取为提取方法的基础上,对不同浓度的甲醇作为提取溶剂、提取时间进行考察,结果以60%甲醇提取30 min为宜,提取较完全。
REFERENCES
[1] 张馨, 张志英. 中国蒿属药用植物资源[J]. 中药材. 1990, 13(7): 16-20.
[2] 刘勇民, 刘伟新, 伊吾提·依克木, 等. 维吾尔药志[M]. 乌鲁木齐: 新疆人民出版社, 1985: 1-4.
[3] YANG L, ZHANG S w, LIU Z q, et al. Studies onin vivoanti hepatitis B virus activity and chemical constituents analysis of flavonoids fromArtemisia rupestrisL. [J]. J Xinjiang Med Univ(新疆医科大学学报), 2016, 39(5): 5781-581.
[4] WANG H y, WANG J, MA W z, et al. Effects of casticin on swelling of voix pedis and cytokines in adjuvant arthritis mice [J]. Northwest Pharm J(西北药学杂志), 2017, 32(3): 326-329.
[5] LIU L p, OUYANG Q c, CAO J g, et al. Casticin induces breast cancer cell apoptosis by inhibition of FOXM1 [J]. China Oncol(中国癌症杂志), 2012, 22(12): 898-901.
[6] ZHANG C c, XUAN Y r, WANG Y h, et al. Influence of casticin on proliferation and apoptosis of A549 cells [J]. Shangdong Med J(山东医药), 2016, 56(36): 12-16.
[7] ZULEHUMAER·W, ZHU J, LI X j, et al. The research on the seed germination characteristics ofArtemisia rupestris[J]. Shangdong Med J Seed(种子), 2016, 35(2): 76-78.
[8] LIU Y m, YU D q. Studies chemical constituents ofArtemisia rupestrisL [J]. Acta Pharm Sin(药学学报), 1985, 20(7): 514-518.
[9] WANG Y, DU N s, TU E h. Studies chemical constituents ofArtemisia rupestrisL. [J]. J Xinjiang Med Univ(新疆医科大学学报), 2004, 27(4): 361-363.
[10] ZHANG S w, YANG L, GU Z y. Studies chemical constituents ofArtemisia rupestrisL. [J]. J Xinjiang Med Univ(新疆医科大学学报). 2016, 36 (4): 408-410.
[11] XU Y, LIU Y, SHI Y z, et al. Investigation on the effects ofArtemisia volatileoil in allergy and acute inflammation [J]. J Xinjiang Med Univ(新疆医科大学学报), 2017, 40(6): 805-809.
[12] ZHANG A l, WANG D y, ZHAO S s, et al. Crude polysaccharides extracted from cultivatedArtemisia rupestrisL. in Xinjiang enhances the efficacy of OVA [J]. Chin J Microbiol Immunol(中华微生物学和免疫学杂志), 2016, 36(9): 654-657.
[13] Yoshikazu K, Kyoko S, Shigeo N. Studies on the Constituents ofVitex rotundifoliaL. [J]. Chem Pharm Bull, 1986, 34(11): 4829-4832.
[14] CEN X y, FANG Z p, WU Y z, et al. Studies chemical constituents ofFructus viticisL. [J]. China J Chin Mater Med(中国中药杂志), 1996, 21(3): 167-168.
[15] RENA·K, SHENG P. Study on enrichment process of total flavone fromArtemisia rupestrisL. with macroporous adsorption resin [J]. Lishizhen Med Mat Med Res(时珍国医国药), 2008, 19(7): 1749-1751.
(本文责编:蔡珊珊)
Isolation and Elucidation of Casticin from Uighur MedicineArtemisia Rupestrisand Its Quantitative Analysis
SHENG Ping, QIAO Meiling
(College of Traditional Chinese Medicine, Xinjiang Medical University, Urumqi 830011, China)
ABSTRACT: OBJECTIVETo study isolation and elucidation of casticin from Uighur medicineArtemisia rupestrisand its quantitative analysis.METHODSCasticin was isolated and enriched by HPD-450 macroporous absorption resin with silica gel column and Sephadex LH-20 column chromatography. Its structure was elucidated by spectral analysis. HPLC was used to determine the content of casticin from Uighur medicineArtemisia rupestris. The Agilent HC-C18(250 mm×4.6 mm, 5 μm) column was used with mathnol-warter (70∶30 ) as the mobile phase at a flow rate of 1.0 mL·min-1. The detection wavelength was set at 350 nm. The column temperature was 30 ℃.RESULTSthe casticin content in purified product was up to 99.7%. Casticin was linear over the ranges of 9.42-75.36 μg·mL-1(r=0.999 6), and the average recovery rate was 109.2%, RSD was 2.12%.CONCLUSIONHighly purified casticin may be obtained effectivly by macroporous absorption resin method. The HPLC method for determination the content of casticin is simple, accurate and steady. It can be used for the quality control of Uighur medicineArtemisia rupestris.
KEY WORDS:Artemisia rupestris; casticin; macroporous absorption resin; HPLC; Uighur medicine
中图分类号:R284.2
文献标志码:B
文章编号:1007-7693(2018)07-1004-03
DOI:10.13748/j.cnki.issn1007-7693.2018.07.013
引用本文:盛萍, 乔美玲. 维药一枝蒿中紫花牡荆素成分的分离制备、鉴定及含量测定[J]. 中国现代应用药学, 2018, 35(7): 1004-1006.
基金项目:国家自然科学基金项目(81560633 );2017年自治区中药民族药特色技术传承人才项目(201727)
作者简介:盛萍,女,博士,教授 Tel: (099l)4362253 E-mail: xjsphwy@163.com
收稿日期:2017-08-28