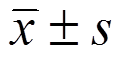 表示。P<0.05为差异具有统计学意义。
表示。P<0.05为差异具有统计学意义。张长青,张葵玲,王育斌,林志金,黄奕森
(福建医科大学附属泉州第一医院消化内科,福建 泉州 362000)
摘要:目的探究谷氨酰胺联合异甘草酸镁治疗重症急性胰腺炎(severe acute pancreatitis,SAP)疗效及对炎症因子、肠黏膜屏障功能的影响。方法选取2014年2月—2017年2月收治的SAP患者80例,随机分为对照组和联合组,各40例。2组均给予常规治疗,对照组在肠内营养基础上加用谷氨酰胺0.3 g·kg-1·d-1,联合组在对照组基础上静脉滴注含150 mg异甘草酸镁的5%葡萄糖注射液250 mL,每天1次。2组均连续治疗14 d。比较2组临床疗效,治疗前,治疗3,7,14 d后急性生理及慢性健康评分Ⅱ(APACHE Ⅱ),IL-6、IL-8、IL-10、TNF-α等炎症因子水平,二胺氧化酶(diamine oxidase,DAO)、D-乳酸、内毒素(endotoxin,ET)等肠黏膜屏障功能指标。结果联合组总有效率为92.50%,明显高于对照组的75.00%(P<0.05)。治疗3,7,14 d后,联合组APACHE Ⅱ评分均明显低于同期对照组(P<0.05);联合组血清TNF-α、IL-6、IL-8水平均明显低于同期对照组(P<0.05),血清IL-10水平明显高于同期对照组(P<0.05);联合组血清DAO、D-乳酸、ET水平均明显低于同期对照组(P<0.05)。结论谷氨酰胺联合异甘草酸镁治疗SAP患者能有效缓解炎症反应,改善肠黏膜屏障功能,提高临床疗效。
关键词:谷氨酰胺;异甘草酸镁;重症急性胰腺炎;炎症;肠黏膜屏障功能
重症急性胰腺炎(severe acute pancreatitis,SAP)属于病情严重的急腹症,易导致多器官衰竭、休克、急性呼吸窘迫综合征等并发症[1],致死率高达20%~30%,对患者身心健康造成巨大影响。SAP发病主要和胰消化酶分泌异常对胰腺及周围组织的自身消化有关。另外,炎症介质过度释放在SAP发生发展过程中起到重要作用[2]。有研究表明,肠黏膜上皮细胞过度凋亡、肠道菌群失调、细菌易位与炎症反应密切相关[3]。谷氨酰胺作为肠黏膜细胞危重应激状态时的唯一能量来源[4],可逆转肠黏膜萎缩,抑制肠道细菌异位,防止内毒素入血。异甘草酸镁属于第四代甘草酸制剂,可替代糖皮质激素发挥抗炎、调节免疫的作用。本研究通过谷氨酰胺联合异甘草酸镁治疗SAP,分析其临床疗效和对炎症因子、肠黏膜功能的影响。
选取2014年2月—2017年2月福建医科大学附属泉州第一医院收治的SAP患者80例,按随机数字表法分为对照组及联合组各40例。对照组男27例,女13例;年龄19~65岁,平均年龄(45.23±5.71)岁;发病时间3~21 h,平均发病时间(16.35±2.53)h;体质指数(BMI):19.23~ 28.37 kg·m-2,平均(23.61±2.38)kg·m-2;发病原因:胆源性20例,酒精性13例,其他7例。联合组男26例,女14例;年龄18~65岁,平均年龄(44.95±5.13)岁;发病时间3~23 h,平均发病时间(16.95±2.87)h;BMI:20.04~29.15 kg·m-2,平均(23.88±2.65) kg·m-2;发病原因:胆源性19例,酒精性12例,其他9例。2组年龄、性别、发病时间、BMI、病因等一般资料比较差异无统计学意义。本研究经医院伦理委员会审核批准,且患者知情同意。
纳入标准:①符合SAP相关诊断标准[5];②年龄18~65岁;③无本研究所用药物过敏史;④依从性良好。排除标准:①既往有心、肝、肾、脑等脏器严重疾病;②发病至入院时间>24 h;③入院时存在明确外科手术指征;④合并恶性肿瘤、免疫系统疾病;⑤长期使用糖皮质激素;⑥哺乳或妊娠期妇女。
2组患者均给予禁食、胃肠减压、营养支持、抗感染、抑制胃酸及胰酶分泌、维持水电解质、酸碱平衡等常规治疗。对照组在肠内营养同时加用谷氨酰胺0.3 g·kg-1·d-1。联合组在对照组基础上静脉滴注含150 mg异甘草酸镁的5%的葡萄糖注射液250 mL,每天1次。2组均连续治疗14 d。
参照文献[5]进行判定,治愈:7 d内临床症状、体征消失,实验室及影像学检查恢复正常;显效:7 d内临床症状、体征明显改善,实验室及影像学检查基本正常;有效:7 d内临床症状、体征、实验室及影响学检查有所改善;无效:临床症状、体征、实验室及影像学检查无明显变化甚至加重。总有效=治愈+显效+有效。
于治疗前,治疗3,7,14 d评价2组急性生理及慢性健康评分Ⅱ(APACHE Ⅱ),得分越高,病情越严重。于治疗前,治疗3,7,14 d清晨空腹取外周静脉血5 mL,3 000 r·min-1离心10 min,取上清保存于-80 ℃待测,检测炎症指标及肠黏膜屏障功能指标。炎症指标包括IL-6、IL-8、IL-10、TNF-α,均采取ELISA法测定。肠黏膜屏障功能指标包括二胺氧化酶(diamine oxidase,DAO)、D-乳酸、内毒素(endotoxin,ET)。采用ELISA法测定DAO水平,酶学分光光度法测定D-乳酸水平,鲎试剂显色法测定ET水平。
利用SPSS 20.0统计软件进行数据处理分析,计量资料采取t检验,结果以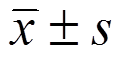 表示。P<0.05为差异具有统计学意义。
表示。P<0.05为差异具有统计学意义。
联合组总有效率为92.50%,明显高于对照组的75.00%(P<0.05)。结果见表1。
表1 2组临床疗效比较
Tab. 1 Comparison on clinical efficacy between two groupsn(%)

治疗前,2组APACHE Ⅱ评分比较无明显差异。治疗3,7,14 d后,2组APACHE Ⅱ评分均较治疗前明显下降(P<0.05),且联合组APACHE Ⅱ评分显著低于同期对照组(P<0.05)。结果见表2。
治疗前,2组血清TNF-α、IL-6、IL-8、IL-10水平比较无明显差异。治疗3,7,14 d后,2组血清TNF-α、IL-6、IL-8水平均较治疗前明显下降,IL-10水平较治疗前明显上升(P均<0.05),且联合组血清TNF-α、IL-6、IL-8水平均显著低于同期对照组,IL-10水平显著高于同期对照组(P均<0.05)。结果见表3。
表2 2组治疗前后APACHE Ⅱ评分比较(n=40,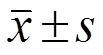 )
)
Tab. 2 Comparison on scores of APACHE Ⅱ before and after treatment between two groups(n=40,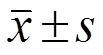 )
)

注:与同期对照组相比,1)P<0.05;与治疗前相比,2)P<0.05。
Note: Compared with the control group in the same period,1)P<0.05; compared with before treatment,2)P<0.05.
表3 2组治疗前后血清TNF-α、IL-6、IL-8、IL-10水平比较(n=40,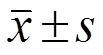 )
)
Tab. 3 Comparison on the levels of serum TNF-α, IL-6, IL-8 and IL-10 before and after treatment between two groups(n=40,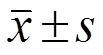 ) ng·L-1
) ng·L-1

注:与同期对照组相比,1)P<0.05;与治疗前相比,2)P<0.05。
Note: Compared with the control group in the same period,1)P<0.05; compared with before treatment,2)P<0.05.
治疗前,2组血清DAO、D-乳酸、ET水平比较无明显差异。治疗3,7,14 d后,2组血清DAO、D-乳酸、ET水平均较治疗前明显下降(P<0.05),且联合组上述指标明显低于同期对照组(P<0.05)。结果见表4。
SAP早期胰酶的消化作用会引发急性炎症反应,同时治疗过程中持续禁食、胃肠减压等会破坏肠黏膜屏障[6],造成肠道菌群异位,ET释放进入血循环。以上均易导致SAP患者并发多器官功能障碍、全身炎症反应综合征,故维持肠黏膜的正常功能,抑制促炎因子的释放,维持内环境稳定对治疗SAP具有重要意义。
表4 2组血清DAO、D-乳酸、ET水平比较(n=40,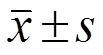 )
)
Tab. 4 Comparison on the levels of serum DAO,D-lactate, ET before and after treatment between two groups(n=40,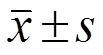 )
)

注:与同期对照组相比,1)P<0.05;与治疗前相比,2)P<0.05。
Note: Compared with the control group in the same period,1)P<0.05; compared with before treatment,2)P<0.05.
异甘草酸镁是甘草酸经碱催化、异构化后成盐的产物,具有更强的抗炎解毒、抗氧化等作用[7],能通过作用于激素受体,抑制巨噬细胞趋化;通过抑制核因子(NF-κB)激酶活性,下调NF-κB通路,抑制相关炎症因子的合成分泌[8]。SAP患者体内的谷氨酰胺储存量远远低于消耗量,易导致肠壁通透性增加,屏障作用减弱,需要外源性补充谷氨酰胺。谷氨酰胺可参与三羧酸循环提供能量,也可作为氮源碳源参与核酸及蛋白质的合成代谢,促进肠黏膜细胞的修复与再生,维持其超微结构的完整,还能提高还原型谷胱甘肽水平,减少氧自由基从而减轻其对肠道上皮细胞的损伤,通过调节cAMP及Ca2+水平,降低肠黏膜通透性[9]。本研究结果显示,联合组临床总有效率为92.50%,明显高于对照组的75.00%;治疗3,7,14 d后,联合组APACHE Ⅱ评分显著低于同期对照组,提示两药联合使用能有效提高疗效。
D-乳酸是肠道固有菌群的发酵产物,在正常状态下无法穿越肠黏膜屏障,当肠黏膜受损,通透性增加时会进入血液循环[10],因此D-乳酸可作为反映肠道菌群失调和肠黏膜受损的指标[11]。DAO是肠黏膜上层绒毛细胞的标志酶,在其他组织中水平极低,当血液中DAO水平升高,则代表肠上皮细胞受损。ET多见于肠杆菌属细胞壁中,由于肠黏膜屏障的存在很难入侵至血液中,一旦肠道受损,肠道菌群失调,ET大量产生,通过破损肠黏膜进入血液中,因此可通过检测血液中ET含量来评价肠黏膜功能[12]。本研究结果显示,治疗3,7,14 d后,联合组血清DAO、D-乳酸、ET含量明显下降,显著低于同期对照组,表明两药联合使用能有效减轻肠黏膜受损,降低肠黏膜通透性,改善肠黏膜屏障功能。IL-6、IL-8、TNF-α属于促炎细胞因子,在SAP患者中上述因子水平呈明显上升趋势。TNF-α是炎症反应最早出现的促炎因子,能增加内皮细胞通透性,促进其他细胞因子释放,有研究发现,尽早抑制TNF-α的表达有利于提高SAP患者预后[13]。IL-6具有诱导T细胞增殖分化、增强自然杀伤细胞活性,加重炎症反应的作用,其水平与SAP严重程度显著相关[14]。IL-8能富集中性粒细胞、嗜酸性粒细胞,刺激中性粒细胞释放蛋白酶损伤组织器官。IL-10属于抗炎细胞因子,能抑制中性粒细胞聚集,降低促炎因子的表达。本研究结果显示,治疗3,7,14 d后,联合组血清IL-6、IL-8、TNF-α水平均明显下降且显著低于同期对照组,血清IL-10水平明显升高且显著高于同期对照组,表明两药联合使用可有效改善炎症因子水平。
综上所述,谷氨酰胺联合异甘草酸镁治疗SAP可有效改善炎症因子水平,减轻肠黏膜屏障功能损伤,提高临床疗效。
REFERENCES
[1] MAHESHWARI R, SUBRAMANIAN R M. Severe acute pancreatitis and necrotizing pancreatitis [J]. Crit Care Clin, 2016, 32(2): 279-290.
[2] FENG C, LI B, WANG L L, et al. Effect of peritoneal lavage with ulinastatin on the expression of NF-κB and TNF-α in multiple organs of rats with severe acute pancreatitis [J]. Exp Ther Med, 2015, 10(6): 2029-2034.
[3] ONYIAH J C, COLGAN S P. Cytokine responses and epithelial function in the intestinal mucosa [J]. Cell Mol Life Sci, 2016, 73(22): 4203-4212.
[4] 雷微, 王艳丽. 谷氨酰胺联合早期空肠营养治疗重症急性胰腺炎的临床研究[J]. 检验医学与临床, 2016, 13(6): 819-822.
[5] 中华医学会外科学分会胰腺外科学组. 急性胰腺炎诊治指南(2014)[J]. 临床肝胆病杂志, 2015, 14(1): 1-5.
[6] YANG C, WEN J, XIA M, et al. Effect of glutamine nutrition support on the intestinal mucosal barrier function and inflammatory response in patients with severe acute pancreatitis [J]. J Hainan Med Univ(海南医学院学报), 2017, 23(14): 1896-1899.
[7] XIE C, LI X, WU J, et al. Anti-inflammatory activity of magnesium isoglycyrrhizinate through inhibition of phospholipase A2/arachidonic acid pathway [J]. Inflammation, 2015, 38(4): 1639-1648.
[8] 陈胜全, 杨全德, 王绪山, 等. 异甘草酸镁治疗急性胰腺炎的临床研究[J]. 重庆医学, 2015, 44(28): 3985-3987.
[9] WANG G, HAN J L, WANG F, et al. The effect of Domestic Somatostatin combined Propylene Ammonia Acyl Glutamine in the treatment on intestinal function in patients with acute pancreatitis [J]. Chin J Integr Tradit Western Med Dig(中国中西医结合消化杂志), 2017, 25(7): 511-514.
[10] NIELSEN C, KIRKEGARD J, ERLANDSEN E J, et al. D-lactate is a valid biomarker of intestinal ischemia induced by abdominal compartment syndrome [J]. J Surg Res, 2015, 194(2): 400-404.
[11] XIA W Q. The change of serum c-reactive protein, procalcitonin and lactic acid levels in patients with severe acute pancreatitis and its clinical significance [J]. Lab Immun Clin Med(标记免疫分析与临床), 2017, 24(7): 766-769.
[12] YAN Y H, CHEN Y M, MIAO C, et al. The protective effect of Dahuang Hongteng anti-inflammatory decoction on the intestinal barrier of the patients with acute pancreatitis [J]. Chin J Hosp Pharm(中国医院药学杂志), 2017, 37(19): 1961-1964.
[13] WANG Z N, LU X M. Efficacy of glutamine therapy for patients with severe acute pancreatitis and its effect on inflammatory cytokines and liver function [J]. Med Recap(医学综述), 2016, 22(12): 2434-2437.
[14] SHEN Y P, TANG X Y, JIANG S Y, et al. Effect of Dachengqi decoction on intestinal dysfunction in rats with severe acute pancreatitis [J]. Chin Arch Tradit Chin Med(中华中医药学刊), 2017, 35(5): 1138-1141.
(本文责编:李艳芳)
Clinical Study of Glutamine Combined with Magnesium Isoglycyrrhizinate on Severe Acute Pancreatitis
ZHANG Changqing, ZHANG Kuiling, WANG Yubin, LIN Zhijin, HUANG Yisen
(Department of Gastroenterology, Quanzhou First Hospital Affiliated to Fujian Medical University, Quanzhou 362000, China)
ABSTRACT: OBJECTIVETo explore the clinical efficacy of glutamine combined with magnesium isoglycyrrhizinate in the treatment of severe acute pancreatitis(SAP) and its effects on inflammatory factors and intestinal mucosal barrier function.METHODSA total of 80 patients with SAP from February 2014 to February 2017 were enrolled and randomly divided into control group and combination group, 40 cases in each group. Both groups were given routine treatment. Control group were given glutamine 0.3 g·kg-1·d-1on the basis of enteral nutrition, while combination group were given intravenous infusion of magnesium isoglycyrrhizinate 150 mg added into 5% glucose injection 250 mL on the basis of control group, once daily. Both groups were treated for 14 d. The efficacy and APACHE II score, level of IL-6, IL-8, IL-10 and TNF-α, intestinal mucosal barrier function index of diamine oxidase(DAO),D-lactate, endotoxin(ET) were compared before treatment and 3th,7th,14th day of treatment in two groups.RESULTSThe total effective rate in combination group was 92.50%, which was significantly higher than that of 75.00% in control group(P<0.05). On the 3th, 7th, 14th day of treatment, the scores of APACHE II in combination group was significantly lower than that in control group(P<0.05). The levels of serum TNF-α, IL-6, IL-8 in combination group were significantly lower than those in control group while the level of serum of IL-10 was significantly higher(P<0.05). The levels of serum DAO, D-lactate, ET in combination group were significantly lower than those in control group(P<0.05).CONCLUSIONGlutamine combined with magnesium isoglycyrrhizinate in the treatment of SAP can improve clinical efficacy, which can effectively reduce inflammation, improve intestinal mucosal barrier function.
KEY WORDS:glutamine; magnesium isoglycyrrhizinate; severe acute pancreatitis; inflammation; intestinal mucosal barrier function
中图分类号:R969.4
文献标志码:B
文章编号:1007-7693(2018)07-1082-04
DOI:10.13748/j.cnki.issn1007-7693.2018.07.030
引用本文:张长青, 张葵玲, 王育斌, 等. 谷氨酰胺联合异甘草酸镁治疗重症急性胰腺炎的临床研究[J]. 中国现代应用药学, 2018, 35(7): 1082-1085.
作者简介:张长青,男,主任医师 Tel: 18905958123 E-mail:zhangff6859@163.com
收稿日期:2017-12-10