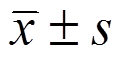 表示,采用单因素方差分析(One-Way ANOVA)。P<0.05为差异具有统计学意义。
表示,采用单因素方差分析(One-Way ANOVA)。P<0.05为差异具有统计学意义。张波,李钦,石晨阳,张玲希,谷丽丽,张信岳*
(浙江省医学科学院,杭州 310013)
摘要:目的研究清开灵注射液诱发类过敏反应的作用及其机制。方法采用BALB/c小鼠和BN大鼠,观察给予清开灵注射液后小鼠皮肤血管渗透性以及大鼠平均动脉血压等类过敏指标的变化;利用RBL-2H3大鼠嗜碱性粒细胞白血病细胞,观察清开灵注射液作用后磷脂酰肌醇3-激酶(PI3K)活性以及Rac1、PAK1、LIMK1和人肌动蛋白素(Cofilin)蛋白含量的变化。结果5 mL·kg-1清开灵注射液即可引起小鼠以血管通透性增高为主要表现的较为轻微的类过敏反应,而7.5 mL·kg-1和15 mL·kg-1清开灵注射液均可引起较为严重的类过敏反应,其反应呈剂量依赖性;另外,5,7.5和15 mL·kg-1清开灵注射液可在一定时间范围内剂量依赖性地引起大鼠平均动脉血压降低。清开灵注射液体外可诱导RBL-2H3细胞发生类过敏反应,PI3K激酶活性增加,Rac1、PAK1、LIMK1和Cofilin蛋白含量增高,且具有剂量依赖性。结论小鼠和大鼠体内类过敏反应检查法和RBL-2H3细胞中PI3K激酶及Rac1、PAK1、LIMK1、Cofilin蛋白含量检查法可作为类过敏反应检查方法。初步认定清开灵注射液诱导类过敏反应的发生可能是基于PI3K-Rac1细胞运动信号转导通路。
关键词:清开灵注射液;类过敏反应;机制
类过敏反应又称假过敏反应、非过敏性药物超敏反应[1],近年来在临床上发生频率不断升高。在中药注射剂引起的过敏性休克中,约3/4属于类过敏反应[2-3]。类过敏反应发病机制与过敏反应不同,不需要IgE介导,是首次用药因药物直接刺激嗜碱性粒细胞和肥大细胞释放大量组胺而表现出与过敏反应相似的临床反应[4]。钟邱等[5]对313例清开灵注射液致不良反应分析发现,其中首次用药出现不良反应290例,占92.65%。前期研究发现清开灵注射液能诱导嗜碱性粒细胞脱颗粒,有诱发非免疫系统介导的类过敏反应的潜在作用[6]。本实验从体内外多种角度进一步探讨清开灵注射液诱导类过敏反应作用及其可能机制,期望为临床上预防中药注射剂引起类过敏反应的发生,或者快速阻断类过敏反应的关键技术提供科学依据。
清开灵注射液(河北神威药业股份有限公司,批号:15070852);伊文思蓝(aladdin公司,批号:E104208);C48/80(Sigma公司,批号:C2313);DMEM、胰蛋白酶、胎牛血清均购自杭州四季青生物工程材料有限公司;磷脂酰肌醇3-激酶(PI3K) HTRF检测试剂盒(Millipore公司,批号:33-016);兔抗LIMK1(批号:3842S)、兔抗人肌动蛋白素(Cofilin,批号:5175S)、兔抗PAK1(批号:2602S)、兔抗RAC(批号:2465P)均购自CST;GAPDH(杭州贤至生物科技有限公司,批号:AB-M-M001);山羊Anti-Rabbit IgG H&L (HRP)(abcam,批号:ab6721)。MP150型生理记录仪(BIOPAC);BioRad 680型酶标仪(BioRad);凝胶成像仪(BioRad);SpectraMax M4多功能酶标仪(Molecular Devices)。
SPF级BALB/c小鼠,♂,由上海西普尔-必凯实验动物有限公司提供,许可证号:SCXK(沪)2013-0016。SPF级BN大鼠,♂,北京维通利华实验动物技术有限公司提供,许可证号:SCXK(京)2016-0011。均饲养于浙江省医学科学院动物房,温度为18~24 ℃,相对湿度为60%~80%,全价颗粒饲料来源于浙江省实验动物中心。
RBL-2H3大鼠嗜碱性粒细胞白血病细胞购自中国科学院细胞库,用10%胎牛血清的DMEM培养液,于37 ℃,5%CO2饱和湿度的培养箱中传代培养,收集对数生长期细胞用于实验。
BALB/c小鼠50只,♂,体质量18~20 g,随机分为5组,每组10只,包括生理盐水组、清开灵注射液15,7.5,5 mL·kg-1组、C48/80组(0.1 mg·kg-1)。小鼠戊巴比妥钠麻醉后,剪去背毛,尾静脉注射1%伊文思蓝0.001 mL·kg-1,15 min后,分别在每只动物背部皮内注射给药,给药容积为50 μl,60 min后脱臼处死小鼠,剪取给药部位皮肤,剪碎后浸泡于1.5 ml组织浸出液中,37 ℃放置48 h,使染料充分溶出,离心,将上清加入到96孔板中,每孔300 μl,用酶标仪于610 nm处测量吸光度值。根据伊文思蓝标准曲线,计算伊文思蓝含量(μg),并计算伊文思蓝渗出升高率。伊文思蓝渗出升高率=(测试组伊文思蓝含量-对照组伊文思蓝含量)/对照组伊文思蓝含量×100%。升高率≤50%,认为不引起类过敏反应;50%<升高率≤150%,认为可引起轻度类过敏反应;升高率>150%,认为可引起严重类过敏反应[7]。
BN大鼠30只,♂,体质量200~250 g,随机分为5组,每组6只,包括生理盐水对照组、清开灵注射液15,7.5,5 mL·kg-1组、C48/80组(0.1 mg·kg-1)。实验当天用10%戊巴比妥钠3.5 ml·kg-1腹腔注射麻醉,仰卧固定于鼠板上,于颈部剪开一倒“T”字型开口,用弯头眼科镊分离一侧颈动脉,结扎远心端,近心端使用小动物动脉夹夹住,颈动脉上剪一小口,插入连接生理记录仪的动脉插管并结扎,管内充满肝素钠注射液,开启动脉夹记录大鼠平均动脉血压(mean arterial blood pressure,MABP)。手术后稳定5~10 min,进行供试品的注射,记录给药后1,3,5,10,20 min的MABP。
2.2.1 细胞株、培养条件及药物处理 RBL-2H3细胞,调整细胞悬液密度为每毫升2×105个,接种于24孔细胞培养板中,培养24 h后弃去培养液改用孵育液,37 ℃预孵育10 min,然后分别给予终浓度为5,10,20 mL·L-1的清开灵注射液,阴性对照组细胞给予等量孵育液,阳性组C48/80终浓度为10 μg·ml-1,37 ℃孵育30 min后冰浴10 min终止反应,收集细胞。
2.2.2 均相时间分辨荧光(HTRF)法检测PI3K活性 按“2.2.1”项下方法收集细胞后,裂解细胞,提取总蛋白,参照试剂盒BCA蛋白浓度测定总蛋白浓度。设立无酶参照和有酶参照孔,每孔加入0.5 μl DMSO;对于测试样品孔,每孔加入0.5 μl药液。无酶参照孔加入14.5 μl脂质工作液,有酶参照孔和样品测试孔,则加入14.5 μl含PI3K激酶的脂质工作液。所有检测孔均加入5 μl ATP工作液,室温下反应30 min,每孔加入5 μl终止液并混合均匀。再加入5 μl检测混合物,混匀。封盖,暗处反应2 h,利用SpectraMax M4多功能酶标仪检测均相时间分辨荧光比率。计算公式:
HTRF=OD665 nm/OD620nm×10 000。
2.2.3 Western blot法检测Rac1、PAK1、LIMK1、Cofilin含量 按“2.2.1”项下方法处理并收集细胞后,裂解细胞,BCA法检测总蛋白浓度。取80 μg总蛋白进行SDS-PAGE,电泳条件为浓缩胶80 V,分离胶110 V,使用NC膜进行湿转,200 mA转移90 min,5%脱脂奶封闭2 h,加入相应一抗(1∶1 000),4 ℃温育过夜。TBST洗膜3次,每次10 min。分别加入相应二抗(1∶3 000),室温缓慢震摇2 h,TBST洗膜3次,每次10 min。采用ECL化学发光试剂,凝胶成像系统进行图像采集。
采用SPSS Statistics 17 统计软件进行分析统计,计量资料均采用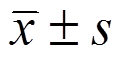 表示,采用单因素方差分析(One-Way ANOVA)。P<0.05为差异具有统计学意义。
表示,采用单因素方差分析(One-Way ANOVA)。P<0.05为差异具有统计学意义。
通过定量测定小鼠背部皮肤伊文思蓝渗出量来评价小鼠皮肤血管渗出反应的程度。结果显示,生理盐水对照组小鼠未见明显的蓝斑;C48/80阳性组皮肤伊文思蓝渗出升高率为201%,属于较为严重的类过敏反应;清开灵注射液7.5,15 mL·kg-1组小鼠皮肤显示出明显的蓝斑,皮肤伊文思蓝渗出升高率均>150%,属于较为严重的类过敏反应;清开灵注射液5 mL·kg-1组小鼠皮肤伊文思蓝渗出升高率为84.3%,属于轻微的类过敏反应,见表1。
表1 清开灵注射液诱导小鼠类过敏反应情况(n=10,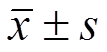 )
)
Tab 1 The pseudoallergy of Qingkailing injection in mice (n=10,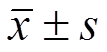 )
)
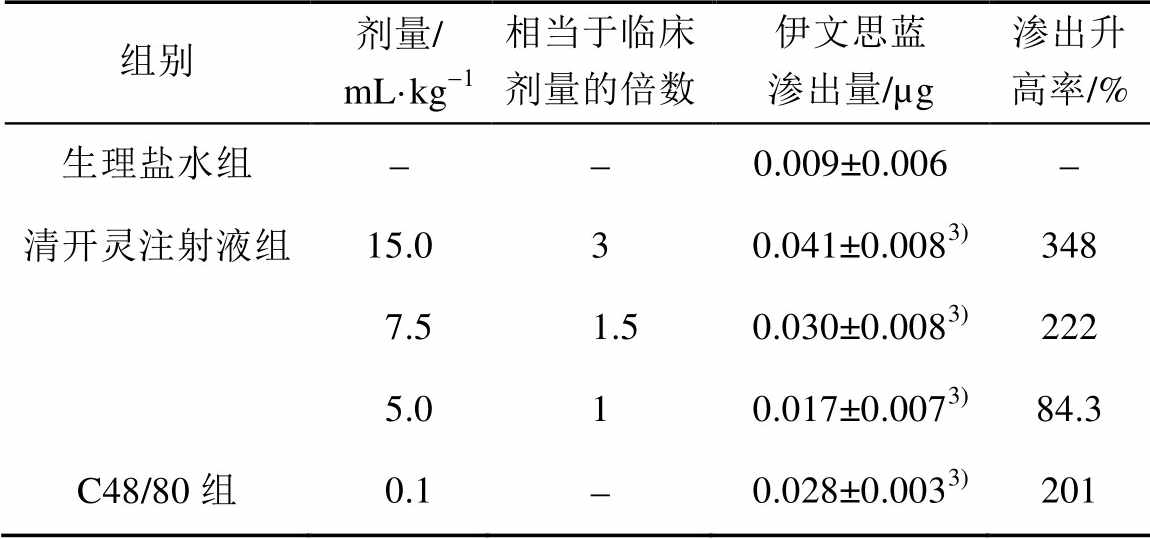
BN大鼠给予5,7.5和15 mL·kg-1清开灵注射液后MABP迅速降低,并且具有剂量依赖性,随着给药剂量的逐渐增加,MABP恢复速度也逐渐减慢,结果见表2。将各组给药前后MABP进行比较,大鼠注射生理盐水对MABP无显著性影响(P>0.05)。与生理盐水组比较,C48/80组MABP显著降低(P<0.01);15 mL·kg-1清开灵注射液组MABP显著降低(P<0.05);7.5 mL·kg-1清开灵注射液组给药1~5 min,MABP显著降低(P<0.05)。5 mL·kg-1清开灵注射液组给药1~3 min,MABP显著降低(P<0.01)。
激酶活性不存在或较弱时,铕标记的anti-GST抗体、GST标记的PH结构域和生物素标记的PIP3形成复合物,在激发光波长为330 nm,发射波长为665,620 nm时产生较强的时间分辨荧光共振能量转移信息,而当激酶活性较强时,激酶底物PIP3取代生物素标记的PIP3,阻断了上述复合物的形成,使得能量转移减弱,从而减弱了在665,620 nm处检测到的吸光度信息;HTRF比率大小与PI3K的活性大小呈反比, HTRF值小,则PI3K活性较大,HTRF值大,则PI3K活性较小。与阴性对照组比较,5,10,20 mL·L-1清开灵注射液组激酶活性均增高,且呈现出剂量依赖性;阳性药C48/80组PI3K激酶活性增高,具有显著性差异(P<0.01)。结果见图1。
与阴性对照组比较,RBL-2H3细胞在清开灵注射液的作用下,Rac1蛋白表达增多,位于其下游的PAK1、LIMK1和Cofilin蛋白的表达量也呈现出同样趋势,且呈现出剂量依赖性。结果见图2。
表2 清开灵注射液对大鼠MABP水平的影响(n=6, )
)
Tab. 2 MABP levels following the administration of several injections in rats(n=6, ) mmHg
) mmHg
注:与生理盐水组相比,1)P<0.05,2)P<0.01。
Note: Compared with normal saline group,1)P<0.05,2)P<0.01.
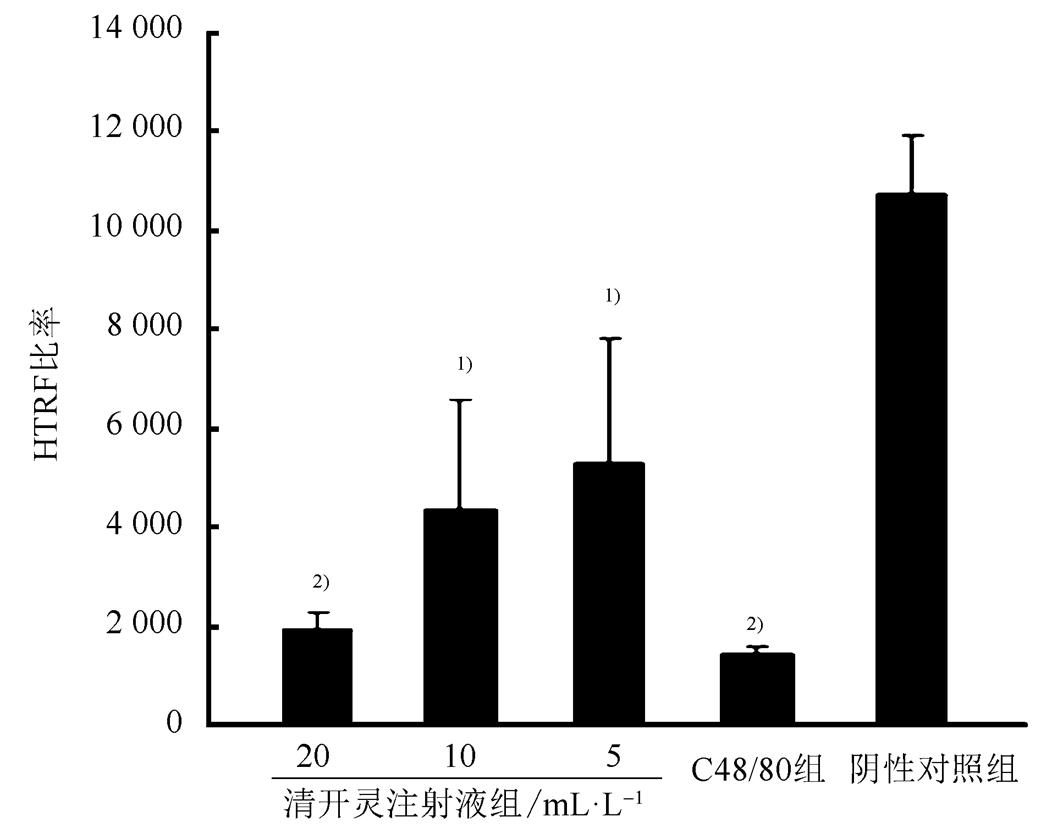
图1 清开灵注射液对RBL-2H3细胞中PI3K激酶水平的影响(n=3, ) 与阴性对照组相比,1)P<0.05,2)P<0.01。
) 与阴性对照组相比,1)P<0.05,2)P<0.01。
Fig. 1 The effect of Qingkailing injection on up-regulate the PI3K kinase activity(n=3, ) Compared with negative control group,1)P<0.05,2)P<0.01.
) Compared with negative control group,1)P<0.05,2)P<0.01.
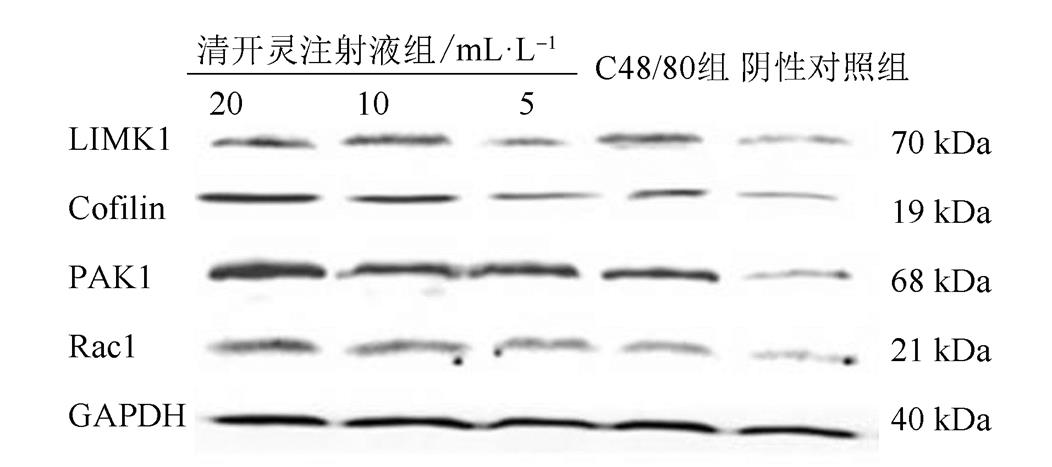
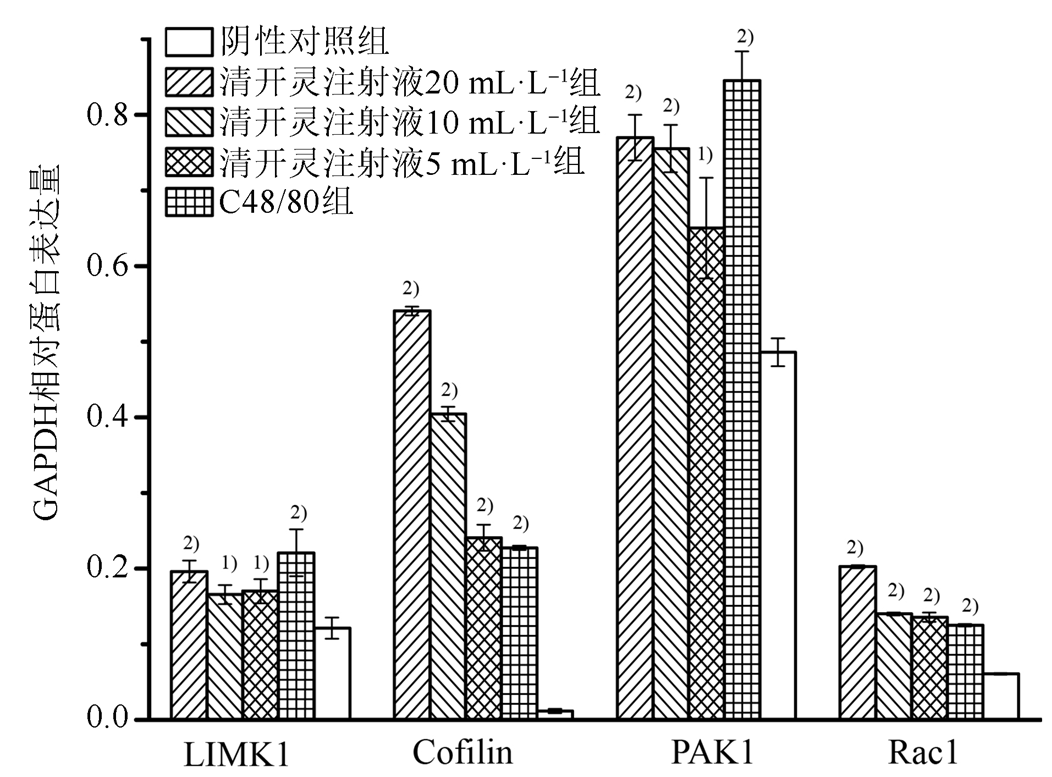
图2 清开灵注射液对RBL-2H3细胞中LIMK1、Cofilin、PAK1、Rac1蛋白水平的影响
与阴性对照组相比,1)P<0.05,2)P<0.01
Fig. 2 The effect of Qingkailing injection on regulate LIMK1, Cofilin, PAK1, Rac1
Compared with negative control group,1)P<0.05,2)P<0.01
类过敏反应无需经过致敏阶段,且不经特异性免疫球蛋白介导,首次接触即可引发过敏样症状,与过敏反应相同的是类过敏反应一样是通过激活组织内的肥大细胞或嗜碱性粒细胞,使其脱颗粒释放出过敏介质,过敏介质作用于效应部位引起的局部或系统性过敏反应症状,严重者可导致心动过速和血压迅速下降,引起过敏性休克甚至死亡[8]。中药注射剂成分复杂,制剂成型过程中又添加大量辅料,因此短时间大量进入血管,与主要存在于血液中的嗜碱性粒细胞直接接触,很可能促使后者发生类过敏反应。
从本研究结果分析,在一定用药剂量和浓度下,清开灵注射液可导致小鼠皮肤血管通透性增高,大鼠MABP升高,RBL-2H3细胞中PI3K激酶活性增加,Rac1、PAK1、LIMK1、Cofilin蛋白含量增高,且具有明显的剂量依赖性。本研究所用的清开灵注射液规格为2 ml,根据本实验预实验研究结果,体内实验选择了5,7.5,15 mL·kg-13个给药剂量,体外实验根据前期实验基础,选择了5,10,20 mL·L-13个浓度,主要是为了在离体和在体条件下,模拟临床体内给药时短时间局部相对较高的药物浓度。
小鼠在静脉注射不同剂量的清开灵注射液后未出现明显的皮肤黏膜红肿、瘙痒、呼吸困难等典型的过敏反应症状;然而在静脉给予伊文思蓝作为指示剂的条件下,给予清开灵注射液的小鼠皮肤血管渗透性显著增高,并且这种血管通透性增高反应与剂量呈正比关系。因此在小鼠模型上,皮肤血管通透性增高可认为是类过敏反应特征[9]。
本实验将MABP作为检测类过敏反应大鼠动物模型的指标,以观察清开灵注射液是否引起类过敏反应的发生。从实验结果可看出,大鼠在给药后,MABP即显著低于对照组大鼠MABP,因此可以把MABP作为判断是否发生类过敏反应的指标[9]。
PI3K-Rac1是细胞运动信号转导通路。PI3K是一种胞内磷脂酰肌醇酶,它参与大量细胞功能的调节,同时在细胞骨架重排方面扮演了重要角色。PI3K的活性主要受到Rac1-GTPase调节[10]。Rac1的活化可以先激活下游PAK1蛋白从而引起一系列的细胞骨架重排活动[11-12]。Rac1属于Rho家族,是肌动蛋白细胞骨架的重要调节因子。PAK1是Rac1调节细胞骨架重构的效应蛋白,其活性也受到PI3K-AKt信号的调节[13-14]。PAK1通过肌球蛋白轻链的磷酸化使Rac1与细胞活动性相关联。PAK1磷酸化同时激活LIMK1酶,与Cofilin磷酸化是同一个靶点。Cofilin刺激肌动蛋白解聚同时改变细胞结构,而LIMK1酶激活的人肌动蛋白素磷酸化则抑制其活性[15]。本实验发现,RBL-2H3细胞在清开灵注射液的作用下,PI3K激酶活性及Rac1、PAK1、LIMK1、Cofilin蛋白含量均出现剂量依赖性的升高,笔者认为清开灵注射液诱发的类过敏反应很可能是基于细胞膜流动性改变,通过PI3K-Rac1细胞运动信号转导通路进一步引起细胞骨架发生改变,最终导致类过敏反应的发生;是否有其他机制参与,尚待进一步研究。
REFERENCES
[1] Farnam K, Chang C, Teuber S, et al. Nonallergic drug hypersensitivity reactions [J]. Int Arch Allergy Immunol, 2012, 159(4): 327-345.
[2] LI J, HUANG Z Y. Non-clinical evaluation on pseudoallergy induced by injective excipient [J]. Drugs Eval Res(药物评价研究), 2010, 33(1):9-12.
[3] GAO J B. Research rrogress about anaphylactoid reactions [J].Chin J Pharmacovigil(中国药物警戒), 2014, 11(6): 344-346.
[4] ZHENG X L, LI Q, ZHAO Y, et al. Anaphylactoid reaction induced by Qingkailing injection via basophils cells degranulation [J]. China J Chin Mater Med(中国中药杂志), 2010, 35(21): 2904-2907.
[5] 钟邱, 林凯, 温坚. 清开灵注射液致不良反应313例文献分析[J]. 中医药临床杂志, 2012, 24(8): 7.
[6] YU X Y, LIN Y H, WU Y X, et al. Investigation of emergency monitoring methods for anaphylactoid reaction caused by Qingkailing Injection [J]. J North Pharm(北方药学), 2015(3): 121-122.
[7] YI Y, LI C Y, ZHANG Y S, et al. Evaluation and study of pseudo-allergic reactions of three kinds of traditional Chinese medicine injections and its mechanisms [J]. China J Chin Mater Med(中国中药杂志), 2015, 40(14): 2711-2716.
[8] XIANG Z, ZHANG J F, XIAO H, et al. Research in acute hypersensitive reaction caused by Xuesaitong injection [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2012, 29(9): 767-771.
[9] 汪怀山. 类过敏反应检测模型的建立及在中药注射剂类过敏反应检测中的应用[D]. 山东大学, 2011.
[10] Waterman-Storer C M, Worthylake R A, Liu B P, et al. Microtubule growth activates Rac1 to promote lamellipodial protrusion in fibroblasts [J]. Nature Cell Biol, 1999, 1(1): 45-50.
[11] Jung J, Kim H Y, Kim M, et al. Translationally controlled tumor protein induces human breast epithelial cell transformation through the activation of Src [J]. Oncogene, 2011, 30(19): 2264-2274.
[12] Mócsai A. Reprint of Neutrophil cell surface receptors and their intracellular signal transduction pathways [J]. Int Immunopharmacol, 2013, 17(3): 638-650.
[13] Barua D, Goldstein B. A mechanistic model of early FcεRI signaling: lipid rafts and the question of protection from dephosphorylation [J]. Plos One, 2012, 7(12): e51669.
[14] Zhang H, Sun C, Glogauer M, et al. Human neutrophils coordinate chemotaxis by differential activation of Rac1 and Rac2 [J]. J Immunol, 2009, 183(4): 2718-2728.
[15] Bustelo X R, Ojeda V, Barreira M, et al. Rac-ing to the plasma membrane: the long and complex work commute of Rac1 during cell signaling [J]. Small Gtpases, 2012, 3(1): 60-66.
(本文责编:曹粤锋)
ZHANG Bo, LI Qin, SHI Chenyang, ZHANG Lingxi, GU Lili, ZHANG Xingyue*
(Institute of Materia Medica, Zhejiang Academy of Medical Sciences, Hangzhou 310013, China)
ABSTRACT: OBJECTIVETo study the effect of pseudoallergic reactions of Qingkailing injections and its mechanisms.METHODSThe BALB/c mice and BN rats were used to observe the changes of vascular permeability, mean arterial blood pressure(MABP) and other pseudoallergic reactions indicators with Qingkailing injection. RBL-2H3 cells were stimulated with Qingkailing injections and then were used to observe the activity of PI3K and the protein expression of Rac1, Pak1, Limk1 and cofilin.RESULTSThe 5 mL·kg-1Qingkailing injection could cause to vascular permeability increase in mice as the main performance of the pseudoallergic reactions, while 7.5 mL·kg-1and 15 mL·kg-1Qingkailing injection caused serious pseudoallergic reactions in mice. Qingkailing injection in 5, 7.5 and 15 mL·kg-1caused rats’ MABP to reduce in a dose dependent manner. In vitro, Qingkailing injection can induce pseudoallergic reactions and increase in levels of PI3K, Rac1, PAK1, LIMK1 and cofilin in a dose dependent manner in RBL-2H3 cells.CONCLUSIONThe tests in mice, rats and the content test of PI3K kinase, Rac1, PAK1, LIMK1 and cofilin in RBL-2H3 cells can be used as kinds of pseudoallergic reactions tests. Pseudoallergic reactions induced by Qingkailing injection is likely to be based on PI3K-Rac1 signal transduction pathways.
KEY WORDS:qingkailing injection; pseudoallergic reactions; mechanisms
中图分类号:R965.3
文献标志码:A
文章编号:1007-7693(2018)07-1031-05
DOI:10.13748/j.cnki.issn1007-7693.2018.07.019
引用本文:张波,李钦,石晨阳,等. 清开灵注射液诱发类过敏反应作用及其机制研究[J]. 中国现代应用药学, 2018, 35(7): 1031-1035.
基金项目:浙江省自然科学基金项目(LY15H280010)
作者简介:张波,女,硕士 Tel: (0571)88215613 E-mail: 17858618786@163.com
*通信作者:张信岳,男,研究员 Tel: (0571)88215600 E-mail: zhangxy2003@aliyun.com
收稿日期:2018-01-18