依帕司他对肺动脉高压大鼠肺血管重构的影响
俞婷婷1,张倩2,蒋莉莉2,左东泽2,李先伟2*
(1.皖南医学院机能学实验实训中心,安徽 芜湖 241002;2.皖南医学院药理学教研室,安徽省多糖药物工程技术研究中心,安徽 芜湖 241002)
摘要:目的通过观察依帕司他(epalrestat,EPS)对野百合碱(monocrotaline,MCT)诱导的肺动脉高压(pulmonary arterial hypertension,PAH)大鼠肺血管重构的保护作用,探讨其作用是否与其抑制转化生长因子-β1(TGF-β1)和醛糖还原酶(aldose reductase,AR)的表达有关。方法SD大鼠48只,随机分为正常对照组、MCT组、EPS 50 mg·kg-1组及EPS 100 mg·kg-1组,每组12只。MCT(60 mg·kg-1)皮下注射诱导PAH大鼠模型。连续灌胃给药4周后,由右颈外静脉将直径为0.5 mm的Cournand心导管缓慢推进到右心室和肺动脉,用MedLab多导生理记录仪分别记录右心室收缩压(right ventricular systolic pressure,RVSP)和平均肺动脉压(mean pulmonary arterial pressure,mPAP)。HE染色观察肺动脉病理学变化,Masson染色观察肺动脉胶原沉积的变化。免疫组化法检测肺动脉AR的蛋白表达。qPCR和(或)Western blot检测肺动脉增殖细胞核抗原(PCNA)、I型胶原蛋白(collagen I)、AR和TGF-β1的表达。结果EPS连续给药4周后能明显降低PAH大鼠RVSP及mPAP,减轻肺血管重构,降低肺动脉PCNA、collagen I表达。同时,EPS还能明显抑制肺动脉AR和TGF-β1的表达。结论EPS对MCT诱导的PAH大鼠肺血管重构具有一定的抑制作用,其机制可能与抑制TGF-β1介导AR的表达有关。
关键词:依帕司他;肺动脉高压;肺血管重构;转化生长因子-β1;醛糖还原酶
肺血管重构是肺动脉高压(pulmonary arterial hypertension,PAH)的重要病理特征,其发病机制至今不明[1-2]。多项研究证明转化生长因子-β1(transforming growth factor-β1,TGF-β1)通过调控多种信号通路促进血管平滑肌细胞增殖、细胞外基质沉积进而引起肺动脉血管重构,最终导致PAH[3-4]。醛糖还原酶(aldose reductase,AR)是NADPH依赖性的醛酮还原酶超家族成员之一,激活后导致NADPH/NADP+比值下降,抗氧化能力下降,自由基清除减少,氧化应激增强,ROS生成增加,进而导致血管平滑肌的增殖和血管重构[5-7]。最新研究发现[8-9],TGF-β1介导的AR高表达在高糖诱导的内皮细胞损伤和Ang-Ⅱ诱导的血管平滑肌细胞增殖中起着关键的作用。而TGF-β1是否介导了AR高表达进而参与了PAH肺血管重构未见文献报道。
依帕司他(epalrestat,EPS)作为一种AR抑制剂,对糖尿病血管并发症具有明显的改善作用[10]。近期研究发现EPS还具有降压、抑制血管平滑肌细胞增殖和血管重构等作用[11]。笔者所在课题组最新的研究结果显示EPS通过抑制TGF-β1诱导的AR高表达而减轻肺成纤维细胞增殖及博莱霉素诱导的肺纤维化[12]。目前关于EPS对PAH肺血管重构的作用未见文献报道。因此,本研究采用野百合碱(monocrotaline,MCT)诱导制备PAH大鼠模型,以TGF-β1和AR为靶点,探讨EPS对PAH大鼠肺血管重构的作用及其机制。
1 材料与方法
1.1 动物
健康SD大鼠,♂,体质量180~220 g,购自上海杰恩捷实验动物有限公司,许可证号SCXK(沪)2013-0006。动物饲养条件:温度为(25±2)℃,湿度<60%,光照时间为7: 00~19: 00。实验前禁食12 h,不禁水。
1.2 药物及试剂
EPS(扬子江药业集团南京海陵药业有限公司,规格为50 mg,国药准字:H20040012;批号:B14202075390);MCT(美国Sigma,货号:C2401)。
Masson胶原染色试剂盒(北京索莱宝科技有限公司,货号:G1340);TRIzol RNA提取试剂盒(美国Invitrogen公司,货号:15596-018);RNA逆转录试剂盒(货号:RR037A)、qPCR试剂盒(货号:RR430A)均购自大连宝生物工程有限公司;PCR引物设计合成(上海生工)。小鼠抗大鼠GAPDH(货号:sc-137179)、TGF-β1(货号:sc-52893)、AR(货号:sc-33219)单克隆抗体均购自美国Santa Cruz公司;小鼠抗大鼠增殖细胞核抗原(货号:ab18197)、I型胶原蛋白(collagen I)单克隆抗体(货号:ab34710)均购自美国Abcam公司;LunimataTM Crescendo发光液(美国Millipore公司,货号:WBLUR0100)。
1.3 方法
1.3.1 动物分组、模型制备及给药方式 分组:SD大鼠适应性喂养1周,随机分为正常对照组、MCT组、EPS 50 mg·kg-1组和EPS 100 mg·kg-1组,每组12只。
造模:MCT以0.5 mol·L-1盐酸溶解,0.5 mol·L-1氢氧化钠调节pH至7.4,再以适量生理盐水配成2% MCT溶液。除正常对照组外,所有大鼠背部一次性皮下注射60 mg·kg-1MCT建立PAH模型。
给药:造模后第2天开始给药,EPS用0.5%羧甲基纤维素钠混匀,每日灌胃给药1次,正常对照组和MCT组灌胃给予等体积[1 mL·(100 g)-1] 0.5%羧甲基纤维素钠,连续给药4周。
1.3.2 右心室收缩压(right ventricular systolic pressure,RVSP)和平均肺动脉压(mean pulmonary arterial pressure,mPAP)的测定 给药4周(末次给药24 h)后,戊巴比妥钠(30 mg·kg-1)腹腔注射麻醉大鼠。分离右颈外静脉,将直径为0.5 mm的Cournand心导管缓慢推进到右心室和肺动脉,用MedLab多导生理记录仪分别记录RVSP和mPAP。
1.3.3 标本收集 肺动脉压力测定结束后立即颈动脉放血处死大鼠,迅速打开胸腔,用蠕动泵将PBS灌流液经右心房蠕动进入右心室、肺动脉和肺组织,进行组织灌流冲洗。灌流1 min后取出肺动脉及肺组织置于预冷的PBS中洗涤干净。进一步分离右肺中叶,放置于4%多聚甲醛溶液中固定;在无RNA酶环境下分离一部分肺动脉置于1 mL Trizol中,用于提取RNA;剩余肺动脉置于1 mL组织裂解液中,用于提取蛋白。
1.3.4 形态学观察 HE及Masson染色分别观察各组大鼠肺血管病理变化及胶原沉积差异情况。
1.3.5 肺动脉AR免疫组化检测 免疫组化方法参照课题组前期的研究方法[12]。AR抗体浓度(1:ê500),相应二抗浓度(1:1 000)。结果判断:AR阳性表达呈黄至棕黄色颗粒,主要定位于细胞浆。
1.3.6 qPCR检测肺动脉增殖细胞核抗原(PCNA)、collagen I、TGF-β1和AR mRNA的表达 用Trizol、氯仿、异丙醇等试剂一步法提取肺动脉总RNA,RNA定量后进行逆转录合成cDNA(反应条件为37 ℃,15 min;85 ℃,5 s)。以2 µL cDNA为模板,GAPDH为内参,在荧光定量PCR仪上进行PCR反应。PCR反应参数参照课题组前期的研究方法[12]。用StepOnePlus System SDS Software软件分析数据,统计各组ΔΔCt值,计算相应RQ值,比较各组mRNA的表达水平。引物见表1。
表1 qPCR引物序列表
Tab.1 Sequence of primers for qPCR

引物序列 PCNA Forward: 5′-GGGTGAAGTTTTCTGCGAGT-3′Reverse: 5′-CAGTGGAGTGGCTTTTGTGA-3′ collagen I Forward: 5′-CCAACTGAACGTGACCAAAAACCA-3′Reverse: 5′-GAAGGTGCTGGGTAGGGAAGTAGGC-3′ AR Forward: 5′-TCCCAGGATCAAGGAAATTG-3′Reverse: 5′-ACAACAGGAACTGGAGGGTG-3′ TGF-β1 Forward: 5′-TGGCGTTACCTTGGTAACC-3′Reverse: 5′-GGTGTTGAGCCCTTTCCAG-3′ GAPDH Forward: 5′-TGGCCTCCAAGGAGTAAGAAAC-3′Reverse: 5′-GGCCTCTCTCTTGCTCTCAGTATC-3′
1.3.7 Western blot检测肺动脉PCNA、collagen I、TGF-β1和AR蛋白表达 肺动脉用液氮研磨后,加入适量的含0.1% PMSF的RIPA裂解液裂解30 min,低温条件下提取蛋白,蛋白浓度用BCA法进行测定;蛋白变性后每组取50 µg蛋白用12% SDS-聚丙烯酰胺凝胶分离蛋白,用PVDF膜进行转膜,封闭,分别滴加GAPDH(1∶2 000),PCNA(1∶1 000),collagen I(1∶1 000),TGF-β1 (1∶1 000),AR(1:500)一抗4 ℃过夜;相应二抗(1∶1 000或1∶2 000)室温孵育1 h;膜的正面加入高灵敏的LunimataTMCrescendo发光剂后用Bio-Rad ChemiDoc XRS+成像系统进行拍照;用Image J 1.43(National Institutes of Health)软件进行灰度值分析。
1.4 统计学分析
采用SPSS 16.0软件进行统计分析,各组数据以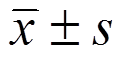 表示,多组均数比较采用单因素方差分析(One-way ANOVA),P<0.05为差异有统计学意义。
表示,多组均数比较采用单因素方差分析(One-way ANOVA),P<0.05为差异有统计学意义。
2 结果
2.1 EPS对PAH大鼠RVSP和mPAP的影响
与正常对照组相比,MCT处理4周后大鼠RVSP、mPAP均明显升高(P<0.01)。与MCT组相比,不同剂量EPS给药4周后,大鼠RVSP、mPAP均不同程度降低(P<0.05或P<0.01),结果见图1。
2.2 EPS对PAH大鼠肺血管重构的影响
肺组织切片后HE染色,细胞核染成蓝色,胞质显示红色。MCT处理组动物肺动脉中膜染色蓝色颗粒增多,排列紊乱,提示肺动脉平滑肌细胞大量增殖、肺动脉管壁明显增厚。而不同剂量EPS给药4周后,肺动脉血管壁增厚明显减轻。提示EPS有减轻MCT诱导的肺血管重构的作用。见图2。
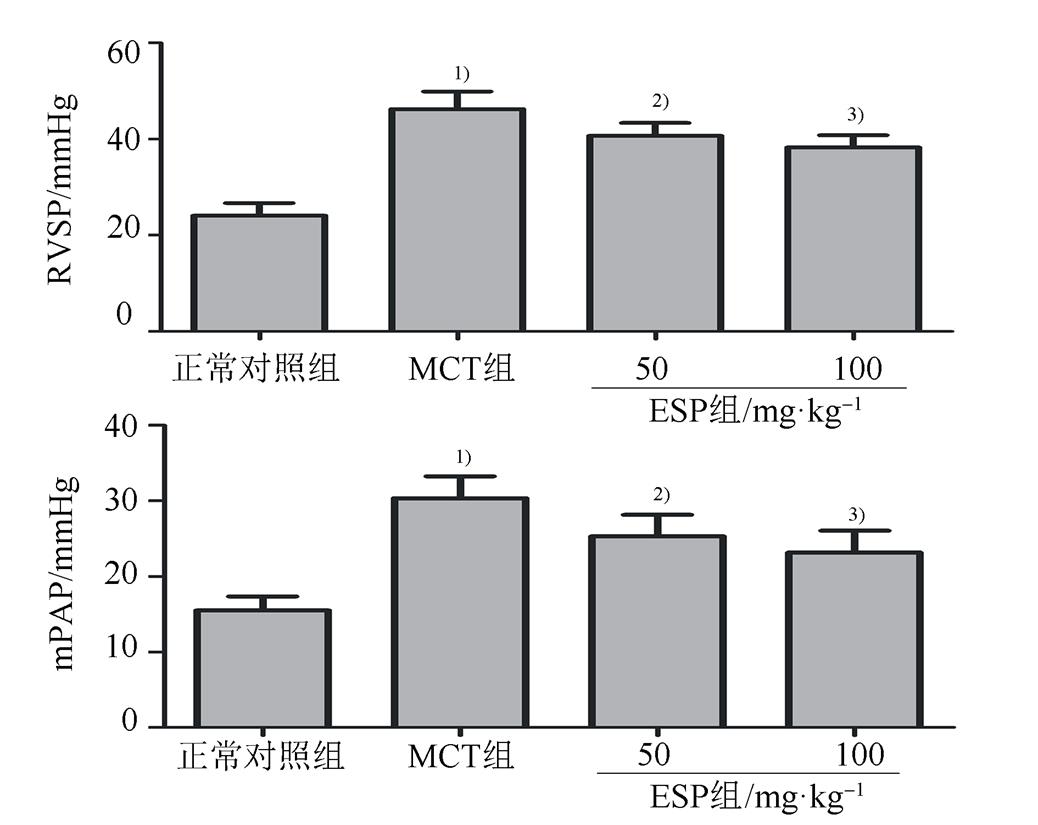
图1 EPS对MCT诱导的PAH大鼠RVSP和mPAP的影响(n=8,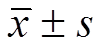 )
)
与正常对照组比较,1)P<0.01;与MCT组比较,2)P<0.05,3)P<0.01。
Fig. 1 Effect of epalrestat on RVSP and mPAP of MCT-induced PAH rats (n=8,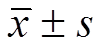 )
)
Compared with the normal control group,1)P<0.01; compared with MCT group,2)P<0.05,3)P<0.01.
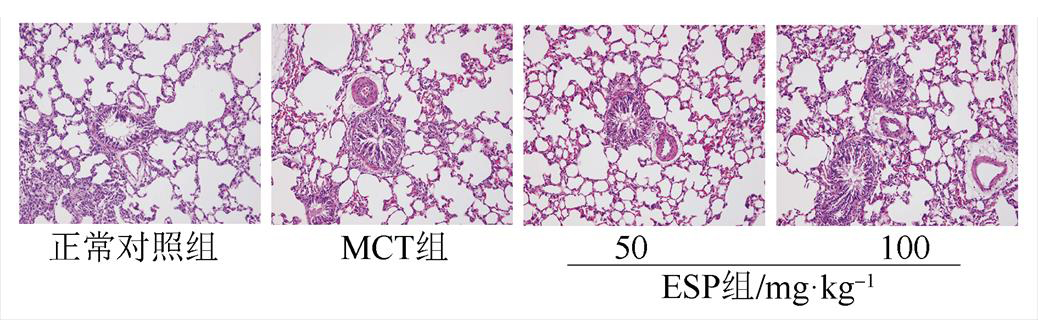
图2 EPS对MCT诱导的PAH大鼠肺血管重构的影响(HE,100×)
Fig. 2 Effect of EPS on pulmonary vascular remodeling in MCT-induced PHA rats(HE,100×)
2.3 EPS对PAH大鼠肺动脉PCNA表达的影响
PCNA是一种增殖细胞相关的核抗原,其功能与细胞有丝分裂密切相关,常作为增殖标志物反应细胞增殖[13]。使用qPCR和Western blot检测肺动脉中增殖标志物PCNA的表达情况。结果显示,MCT组肺动脉PCNA mRNA和蛋白水平明显升高。与MCT组相比,不同剂量EPS组肺动脉PCNA mRNA和蛋白水平明显降低(P<0.05或P<0.01)。提示EPS对PAH大鼠肺动脉细胞增殖具有显著的抑制作用。结果见图3。
2.4 EPS对PAH大鼠肺动脉胶原表达的影响
肺组织切片Masson染色结果显示,正常对照组大鼠仅少数动脉外膜出现蓝染的纤维组织,动脉中层和内膜没有蓝染的纤维组织。MCT组肺动脉中层增生平滑肌组织中出现散在的蓝色纤维组织,内膜增厚纤维化,外膜显著增厚,纤维组织向肺泡间隔生长。而给予不同剂量的EPS处理4周后,上述病理变化明显改善。结果见图4。同时经qPCR和Western blot检测发现,MCT组大鼠肺动脉collagen I mRNA及蛋白表达水平显著升高,而给予不同剂量EPS4周后collagen I的表达水平显著降低(P<0.05或P<0.01)。结果见图5。
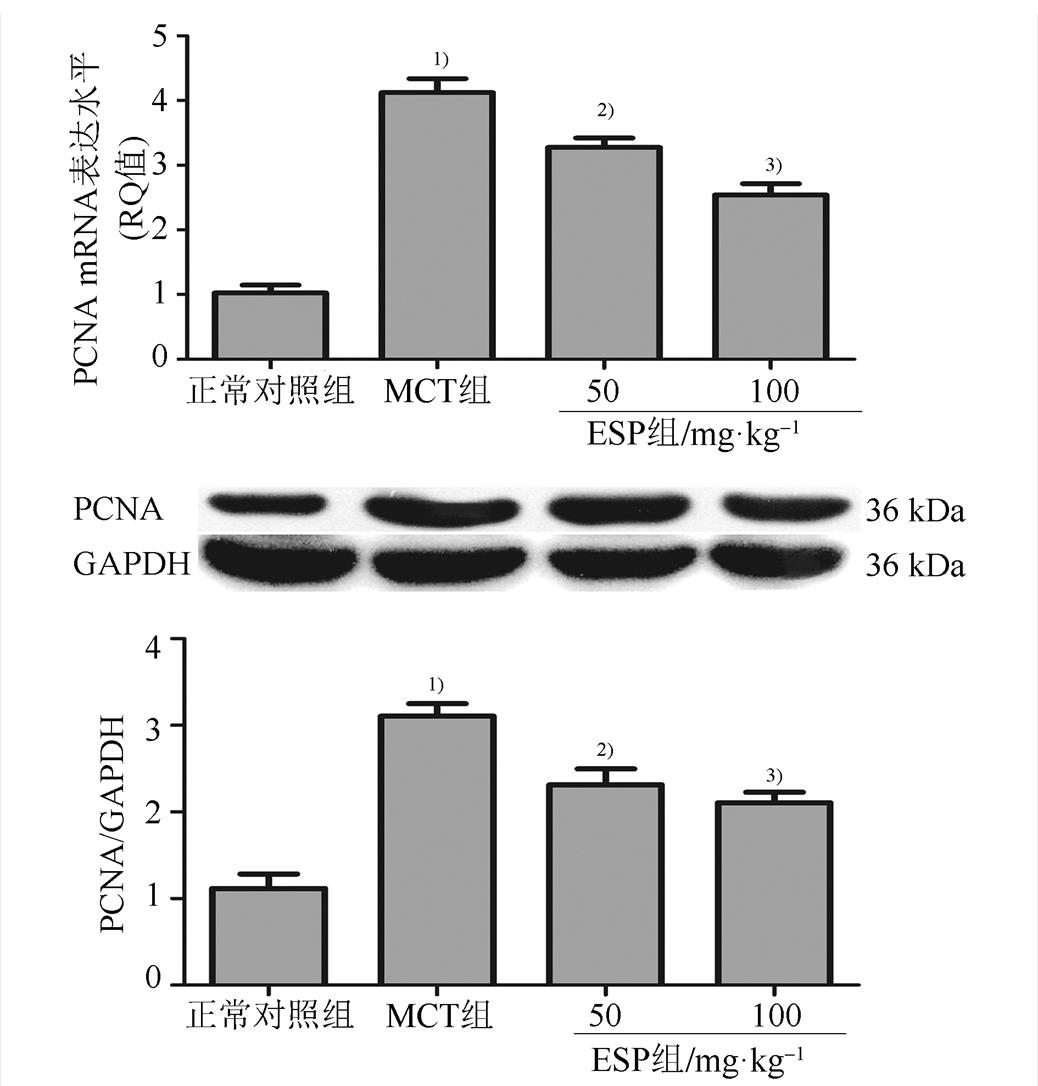
图3 EPS对MCT诱导的PAH大鼠肺动脉PCNA mRNA及蛋白表达的影响(n=8, )
)
与正常对照组比较,1)P<0.01;与MCT组比较,2)P<0.05,3)P<0.01。
Fig. 3 Effect of EPS on PCNA mRNA and protein expression of pulmonary arteries in MCT-induced PAH rats(n=8, )
)
Compared with the normal control group,1)P<0.01; compared with MCT group,2)P<0.05,3)P<0.01.
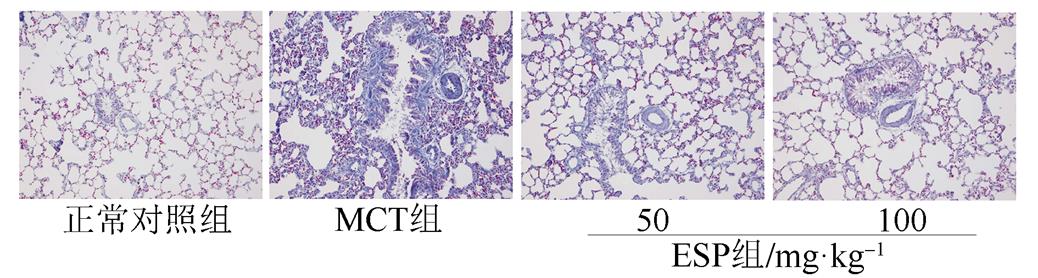
图4 EPS对MCT诱导的PAH大鼠肺动脉胶原沉积的影响(Masson染色,100×)
Fig. 4 Effect of EPS on collagen accumulation of pulmonary arteries in MCT-induced PAH rats (Masson’s trichrome stain,100×)
2.5 EPS对PAH大鼠肺动脉TGF-β1表达的影响
与正常对照组相比,MCT组肺动脉TGF-β1 mRNA及蛋白表达水平明显升高(P<0.01)。与MCT组相比,不同剂量EPS组给药4周后TGF-β1 mRNA及蛋白表达水平均不同程度降低(P<0.05或P<0.01)。结果见图6。
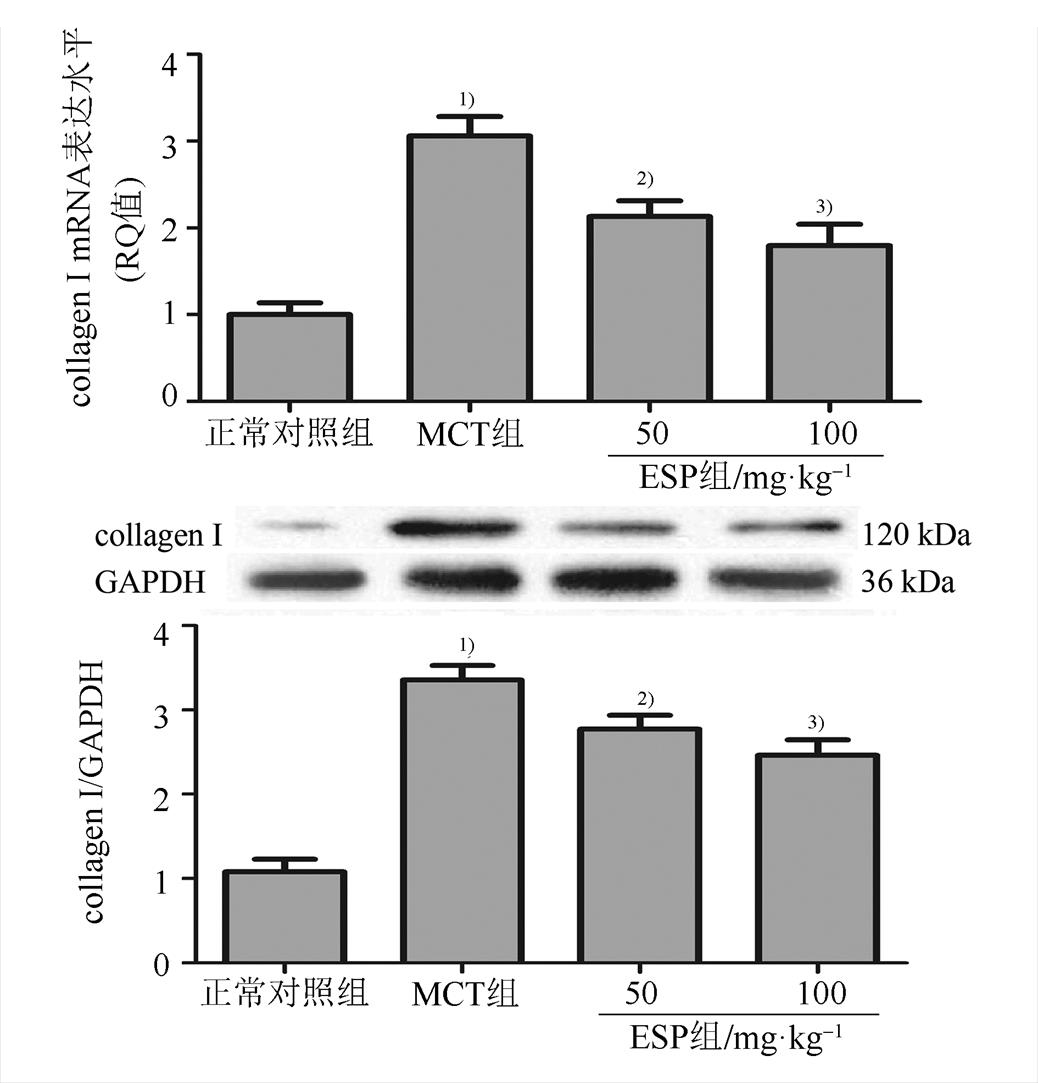
图5 EPS对MCT诱导的PAH大鼠肺动脉I型胶原mRNA及蛋白表达的影响(n=8,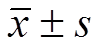 ) 与正常对照组比较,1)P<0.01;与MCT组比较,2)P<0.05,3)P<0.01。
) 与正常对照组比较,1)P<0.01;与MCT组比较,2)P<0.05,3)P<0.01。
Fig. 5 Effect of EPS on collagen I expression of pulmonary arteries in MCT-induced PAH rats(n=8,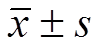 ) Compared with the normal control group,1)P<0.01; compared with MCT group,2)P<0.05,3)P<0.01.
) Compared with the normal control group,1)P<0.01; compared with MCT group,2)P<0.05,3)P<0.01.
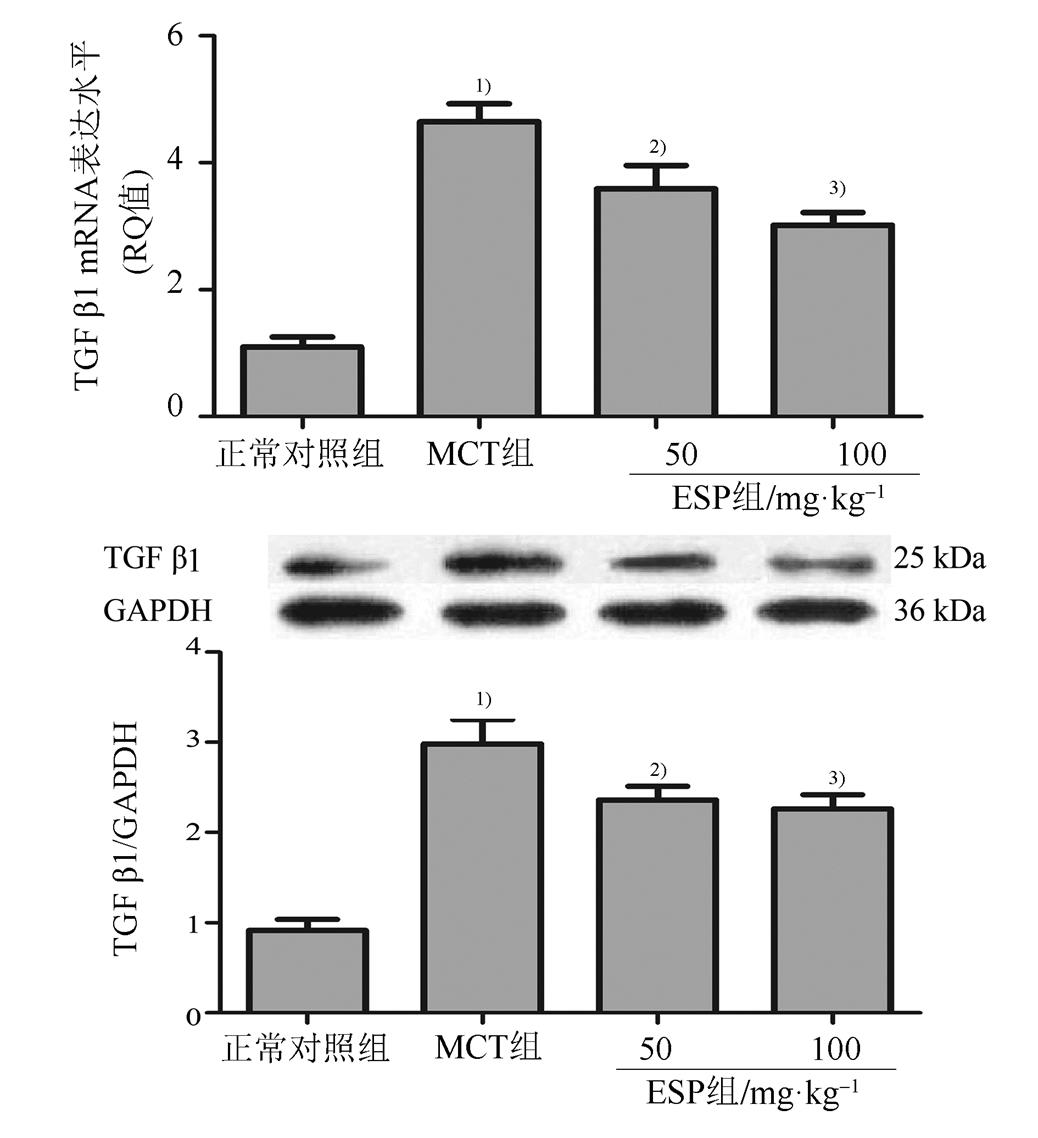
图6 EPS对MCT诱导的PAH大鼠肺动脉TGF-β1 mRNA及蛋白表达的影响(n=8, ) 与正常对照组比较,1)P<0.01;与MCT组比较,2)P<0.05,3)P<0.01。
) 与正常对照组比较,1)P<0.01;与MCT组比较,2)P<0.05,3)P<0.01。
Fig. 6 Effect of EPS on TGF-β1 expression of pulmonary arteries in MCT-inducedPAH rats(n=8, ) Compared with the normal control group,1)P<0.01; compared with the MCT group,2)P<0.05,3)P<0.01.
) Compared with the normal control group,1)P<0.01; compared with the MCT group,2)P<0.05,3)P<0.01.
2.6 EPS对PAH大鼠肺动脉AR表达的影响
经qPCR、Western blot及免疫组化检测发现MCT处理组肺动脉AR mRNA及蛋白表达水平明显升高(P<0.01)。与MCT组相比,不同剂量EPS组给药4周后AR mRNA及蛋白表达水平均不同程度降低(P<0.05或P<0.01)。结果见图7~8。
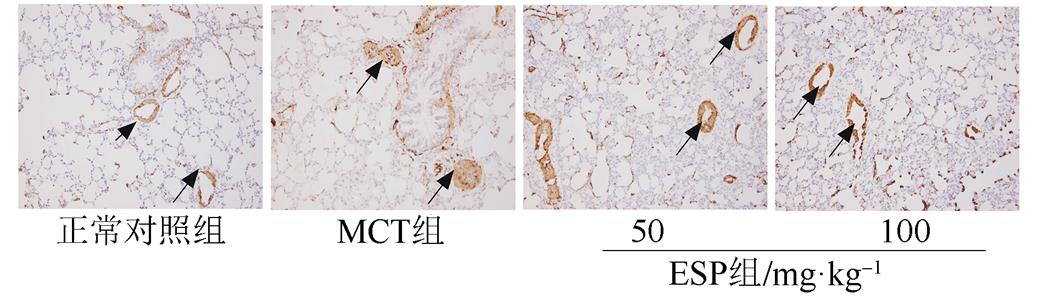
图7 EPS对MCT诱导的PAH大鼠肺动脉AR蛋白表达的影响(免疫组化染色,100×)
Fig. 7 Effect of EPS on AR expression of pulmonary arteries in MCT-induced PAH rats(immunohistochemisty stain,100×)

图8 EPS对MCT诱导的PAH大鼠肺动脉AR mRNA及蛋白表达的影响(n=8,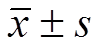 ) 与正常对照组比较,1)P<0.01;与MCT组比较,2)P<0.05,3)P<0.01。
) 与正常对照组比较,1)P<0.01;与MCT组比较,2)P<0.05,3)P<0.01。
Fig. 8 Effect of EPS on AR expression of pulmonary arteries in MCT-induced PAH rats(n=8,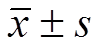 ) Compared with the normal control group,1)P<0.01; compared with the monocrotaline group,2)P<0.05,3)P<0.01.
) Compared with the normal control group,1)P<0.01; compared with the monocrotaline group,2)P<0.05,3)P<0.01.
3 讨论
EPS作为一种AR抑制剂,对糖尿病神经、肾脏和血管并发症具有明显的保护作用。除糖尿病并发症外,最新的研究发现EPS还具有降压、抑制血管平滑肌细胞增殖和血管重构等作用[11]。笔者前期的研究发现EPS可通过抑制AR的表达而减轻博莱霉素诱导的肺纤维化[12]。本研究结果显示EPS连续给药4周后,PAH大鼠的RVSP、mPAP、肺动脉胶原沉积及PCNA、collagen I的表达均显著降低,肺血管重构明显减轻。提示EPS对PAH大鼠具有降低肺动脉压力、减轻肺血管重构的作用。
AR属于NADPH依赖性的醛酮还原酶超家族成员之一,广泛分布于血管、神经、心、肝、肾、肺等组织中[14]。以往的研究表明AR主要参与了糖尿病血管并发症的发生与发展,是糖尿病大血管病变及微循环障碍防治的靶点。最新的研究发现,AR也参与了其他疾病的发生与发展。如文献报道[15]AR参与了肾小球系膜细胞的增殖及细胞外基质的沉积,而抑制AR可以有效防治肾小球肾炎和肾脏纤维化。有研究发现[16],AR在心血管重塑中起着重要的调节作用,抑制AR可以明显减轻自发性高血压大鼠血管和心肌的重构。以上结果提示AR可能在增殖性疾病及心血管疾病中起一定作用。本研究首次发现在PAH大鼠肺动脉中AR的表达明显升高,提示AR可能参与了PAH肺血管重构。
大量研究表明TGF-β1参与细胞的增殖、分化、迁移及凋亡等活动,通过调控多种信号通路促进血管平滑肌细胞增殖及细胞外基质沉积等过程,从而诱导PAH的发生发展[17]。研究发现TGF-β1通过调控p38/MAPK信号通路增加α-平滑肌肌动蛋白(a-smooth muscle actin,α-SMA)的表达,进而促进平滑肌细胞的增殖分化。同时,TGF-β1通过激活PI3K/Akt信号通路而抑制肺动脉平滑肌细胞凋亡,并提高平滑肌细胞的细胞活力[4]。此外,研究表明TGF-β1介导的AR高表达在高糖诱导的内皮细胞损伤和Ang-Ⅱ诱导的血管平滑肌细胞增殖中起着关键的作用[8-9]。本课题组前期研究发现,TGF-β1通过调控AR的表达而促进肺成纤维细胞的增殖[12]。本研究发现,在MCT诱导的PAH大鼠肺动脉中TGF-β1的表达明显上调,同时AR的表达水平也显著升高。因此笔者推测TGF-β1介导AR高表达在PAH肺血管重构中起着重要作用。给予EPS 4周后,PAH大鼠肺动脉TGF-β1和AR表达水平均显著降低。这些结果表明EPS可能通过抑制TGF-β1介导的AR高表达,对PAH大鼠肺血管重构产生一定的保护作用。
综上所述,EPS能够减轻MCT诱导的PAH大鼠肺血管重构,其机制可能与其抑制TGF-β1介导的AR高表达有关。但TGF-β1是如何上调AR的表达而参与PAH肺血管重构尚需进一步研究。
REFERENCES
[1] PIETRA G G, CAPRON F, STEWART S, et al. Pathologic assessment of vasculopathies in pulmonary hypertension [J]. J Am Coll Cardiol, 2004, 43(12): 25S-32S.
[2] SAKAO S, TATSUMI K. Vascular remodeling in pulmonary arterial hypertension: multiple cancer-like pathways and possible treatment modalities [J]. Int J Cardiol, 2010, 147(1): 4-12.
[3] YAN Y, WANG X J, LI S Q, et al. Elevated levels of plasma transforming growth factor-β1 in idiopathic and heritable pulmonary arterial hypertension [J]. Int J Cardiol, 2016(222): 368-374.
[4] LIU Y, CAO Y, SUN S, et al. Transforming growth factor-beta1 upregulation triggers pulmonary artery smooth muscle cell proliferation and apoptosis imbalance in rats with hypoxic pulmonary hypertension via the PTEN/AKT pathways [J]. Int J Biochem Cell Biol, 2016, 77(Pt A): 141-154
[5] ANIL K P, BHANUPRAJASH R G. Focus on molecules: aldose reductase [J]. Exp Eye Res, 2006, 85 (6): 739-740.
[6] VEDANTHAM S, ANANTHAKRISHNAN R, SCHMIDT AM, et al. Aldose reductase, oxidative stress and diabetic cardiovascular complications [J]. Cardiovasc Hematol Agents Med Chem, 2012, 10(3): 234-240.
[7] SRIVASTAVA S K, RAMANA K V, BHATNAGAR A. Role of aldose reductase and oxidative damage in diabetes and the consequent potential for therapeutic options [J]. Endocr Rev, 2005, 26(3): 380-392.
[8] OKAYAMA N, OMI H, OKOUCHI M, et al. Mechanisms of inhibitory activity of the aldose reductase inhibitor, epalrestat, on high glucose-mediated endothelial injury: neutrophil- endothelial cell adhesion and surface expression of endothelial adhesion molecules [J]. J Diabetes Complications, 2002, 16(5): 321-326.
[9] LI L, YAN J, HU K, et al. Protective effects of Eucommia lignans against hypertensive renal injury by inhibiting expression of aldose reductase [J]. J Ethnopharmacol, 2011, 139(2): 454-461.
[10] HOTTA N, KAWAMORI R, ATSUMI Y, et al. Stratified analyses for selecting appropriate target patients with diabetic peripheral neuropathy for long-term treatment with an aldose reductase inhibitor, epalrestat [J]. Diabet Med, 2008, 25(7): 818-825.
[11] GREWAL A S, BHARDWAJ S, PANDITA D, et al. Updates on aldose reductase inhibitors for management of diabetic complications and non-diabetic diseases [J]. Mini Rev Med Chem, 2016, 16(2): 120-162.
[12] LI X W, SHEN Y Y, LU Y N, et al. Amelioration of bleomycin-induced pulmonary fibrosis of rats by an aldose reductase inhibitor, epalrestat [J]. Korean J Physiol Pharmacol, 2015, 19(5): 401-411.
[13] PROSPERI E. Multiple roles of the proliferating cell nuclear antigen: DNA replication, repair and cell cycle control [J]. Prog Cell Cycle Res, 1997(3): 193-210.
[14] O'CONNOR T, IRELAND L S, HARRISON D J, et al. Major differences exist in the function and tissue-specific expression of human aflatoxin B1 aldehyde reductase and the principal human aldo-keto reductase AKR1 family members [J]. Biochem J, 1999, 343(Pt 2): 487-504.
[15] OATES P J. Aldose reductase inhibitors and diabetic kidney disease [J]. Curr Opin Investig Drugs, 2010, 11(4): 402-417.
[16] LI Z Y, GU J, YAN J, et al. Hypertensive cardiac remodeling effects of lignan extracts fromEucommia ulmoidesOliv. Bark-a famous traditional Chinese medicine [J]. Am J Chin Med, 2013, 41(4): 801-815.
[17] KAMATO D, BURCH M L, PIVA T J, et al. Transforming growth factor-β signalling: role and consequences of Smad linker region phosphorylation [J]. Cell Signal, 2013, 25(10): 2017-2024.
(本文责编:李艳芳)
Effect of Epalrestat on Pulmonary Vascular Remodeling in Pulmonary Arterial Hypertension Rats
YU Tingting1, ZHANG Qian2, JIANG Lili2, ZUO Dongze2, LI Xianwei2*
(1.Functional Expremental Training Center of Wannan Medical College, Wuhu 241002, China; 2.Department of Pharmacology of Wannan Medical College, Anhui Provincal Engineering Technology Pesearch Center for Polysaccharide Drugs, Wuhu 241002, China)
ABSTRACT:OBJECTIVETo investigate the protective effect of epalrestat on pulmonary vascular remodeling in rats with monocrotaline(MCT)-induced pulmonary arterial hypertension(PAH),and explore whether the effect was related to inhibiting the expression of TGF-β1 and aldose reductase(AR).METHODS Forty-eight rats were randomly divided into four groups, with 12 rats per group, as follows: control group, MCT group, epalrestat 50 mg·kg-1group and epalrestat 100 mg·kg-1group. PAH model was established by subcutaneous injection of MCT at the dose of 60 mg·kg-1. After 4 weeks of continuous gavage, the Cournand catheter with a diameter of 0.5 mm was slowly pushed to the ventricle and pulmonary artery from the right external jugular vein. At the end of experiment, the right ventricular systolic pressure(RVSP) and mean pulmonary artery pressure(mPAP) were monitored by MedLab system.Pathological changes and collagen deposition of pulmonary artery was observed by HE staining and Masson respectively. The aldose reductase(AR) expression in pulmonary artery was measured by immunohistochemistry. The expression of proliferating cell nuclear antigen(PCNA), collagen I, TGF-β1 and ARwere analyzed by qPCR and Western blot.RESULTSEpalrestat treatment for 4 weeks attenuated RVSP, mPAP and pulmonary vascular remodeling of PAH rats. Furthermore, pulmonary arteries collagen accumulation and PCNA and collagen I expression were both significantly suppressed by epalrestat treatment. The expression of TGF-β1 andAR were obviously decreased in pulmonary arteries from PAH rats with epalrestat treatment.CONCLUSIONThese findings demonstrate that epalrestat ameliorates pulmonary vascular remodeling of PAH rats through down-regulating of TGF-β1and AR expression.
KEY WORDS:epalrestat; pulmonary arterial hypertension(PAH); pulmonary vascular remodeling; TGF-β1; aldose reductase
中图分类号:R965.2
文献标志码:A
文章编号:1007-7693(2018)07-0980-06
DOI:10.13748/j.cnki.issn1007-7693.2018.07.007
引用本文:俞婷婷, 张倩, 蒋莉莉, 等. 依帕司他对肺动脉高压大鼠肺血管重构的影响[J]. 中国现代应用药学, 2018, 35(7): 980-985.
基金项目:安徽省高校优秀青年人才支持计划重点项目(gxyqZD2016170);皖南医学院中青年科研基金项目(WK201604)
作者简介:俞婷婷,女,硕士,助理实验师 Tel: (0553)3932480 E-mail: 384746884@qq.com
*通信作者:李先伟,男,博士,副教授 Tel: (0553)3932464 E-mail: wnmclixianwei69@163.com
收稿日期:2017-10-10

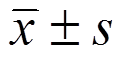 表示,多组均数比较采用单因素方差分析(One-way ANOVA),P<0.05为差异有统计学意义。
表示,多组均数比较采用单因素方差分析(One-way ANOVA),P<0.05为差异有统计学意义。
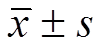 )
)

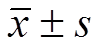 )
)



