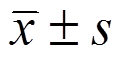 表示,数据进行单因素方差分析后,用SNK-q检验进行各组间均数两两比较分析,P<0.05表示差异有统计学意义。
表示,数据进行单因素方差分析后,用SNK-q检验进行各组间均数两两比较分析,P<0.05表示差异有统计学意义。王新财1,杨和2
(1.湖州市食品药品检验研究院,浙江 湖州 313000;2.浙江工业大学药学院,杭州 310014)
摘要:目的考察葡萄籽原花青素(grape seed procyanidin,GSP)对酒精性肝损伤小鼠的保护作用及其抗炎机制。方法ICR小鼠60只,♂,随机分成正常对照组、模型组(56%乙醇)、水飞蓟素组(56%乙醇+90 mg·kg-1·d-1水飞蓟素)及GSP高、中、低剂量组(56%乙醇+400,200,100 mg·kg-1·d-1GSP)。8周后用分光光度法检测血清中ALT、AST水平,肝MDA含量和SOD、GSH-Px活力;酶联免疫法检测肝NF-κB、TNF-α、IL-1β的含量;HE染色检测肝脏病理改变。结果与模型组比较,GSP可以降低酒精性肝损伤小鼠血清中ALT、AST含量及肝组织中MDA、NF-κB、TNF-α、IL-1β含量(P<0.05),提高SOD、GSH-PX活力(P<0.05),减轻肝脏的病理损伤程度(P<0.05)。结论GSP对酒精性肝损伤小鼠具有保护作用,其机制可能是通过抗氧化和降炎症反应来发挥作用。
关键词:葡萄籽原花青素;酒精性肝损伤;氧化应激;炎症
饮酒对肝脏的损伤较为常见,酒精性肝病是严重危害公共卫生的常见病,保护肝脏越来越引起人们的重视[1]。国内外研究发现,葡萄籽原花青素(grape seed procyanidin,GSP)具有很强的抗氧化、清除自由基的作用,可以缓解肝功能障碍,抑制高血糖、高血压以及癌细胞的侵入和转移,有很强的免疫保护作用[2-4]。邹金发等[5]报道了GSP对酒精性肝损伤小鼠的保护作用,但其机制研究较少,本实验探究GSP对酒精性肝损伤引起炎症反应的影响。
红星二锅头(56%乙醇);GSP(天津尖峰天然产物研究开发有限公司,纯度>95%,批号:201606);水飞蓟素(浙江康乐药业股份有限公司,规格为每片70 mg,批号:20161208);丙氨酸氨基转移酶(alanine aminotransferase,ALT)和天冬氨酸氨基转移酶(aspartate aminotransferase,AST)检测试剂盒(合肥博美生物科技有限责任公司,批号分别为201502,201504);丙二醛(malondialdehyde,MDA,批号:20150813)、总超氧化物歧化酶(superoxide dismutase,SOD,批号:20150811)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px,批号:20160810)、考马斯亮蓝蛋白测定试剂盒(批号:20160715)均购于南京建成生物工程研究所。肿瘤坏死因子-α(TNF-α,批号:20160710)、白细胞介素-1β(IL-1β,批号:20160620)、核转录因子(NF-κB,批号:20160705)试剂盒均购于上海越研生物科技有限公司。
X-22R Centrifuge型高速低温离心机(美国Beckman公司);-80 ℃低温冰箱(中国海尔公司)。752G紫外可见分光光度计紫外光谱分析仪(上海精科);MAX190型紫外可见连续光谱酶标仪(美国分子生物公司);EG-1140C型组织包埋机、DM4000BLED显微镜均购自Leica公司。
健康ICR小鼠60只,♂,平均体质量18~20 g,由上海斯莱克实验动物有限责任公司提供,动物许可证号为SCXK(沪)20120002,质量合格证号为0322143。饲养环境:温度为18~22 ℃,相对湿度为50%~70%,试验前适应性喂养3 d。
根据动物体质量,随机分为正常对照组、模型组、水飞蓟素组(90 mg·kg-1·d-1水飞蓟素)以及GSP高、中、低剂量组(400,200,100 mg·kg-1·d-1)6组,每组10只。用红星二锅头(56%乙醇)按10 ml·kg-1·d-1造模。给药时正常对照组和模型组灌服等量的生理盐水。各组均常规饮水,造模8周后,小鼠眼球取血,然后3 000 r·min-1离心15 min,取上清。肝脏用冰生理盐水冲洗、滤纸吸湿后,加入预冷的生理盐水制成10%匀浆,待用。
样品按试剂盒说明书处理,然后根据指标分析的相关要求进行测定。生化仪测定血清ALT、AST活性,采用发色底物法,用多功能酶标仪测定肝组织SOD、GSH-Px活力和MDA、GSH含量。采用ELISA试剂盒双抗夹心法检测血清中NF-κB、TNF-α、IL-1β水平。蛋白质的测定采用考马斯亮蓝法。
实验数据以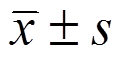 表示,数据进行单因素方差分析后,用SNK-q检验进行各组间均数两两比较分析,P<0.05表示差异有统计学意义。
表示,数据进行单因素方差分析后,用SNK-q检验进行各组间均数两两比较分析,P<0.05表示差异有统计学意义。
与正常对照组比较,模型组小鼠的体质量明显降低(P<0.05),肝脏指数明显增高(P<0.05),表明长期大量饮酒会影响小鼠食欲及对食物的吸收能力。与模型组比较,GSP各剂量组肝质量指数明显降低(P<0.05),体质量增加,高、中剂量组效果显著(P<0.05),表明GSP有改善酒精中毒小鼠食欲和吸收功能的作用,并对肝脏损伤有一定保护作用。结果见表1。
表1 各实验组小鼠体质量和肝质量指数的比较(n=10,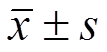 )
)
Tab. 1 Comparisons of liver indices and body weight of mice from each experimental group(n=10,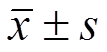 )
)
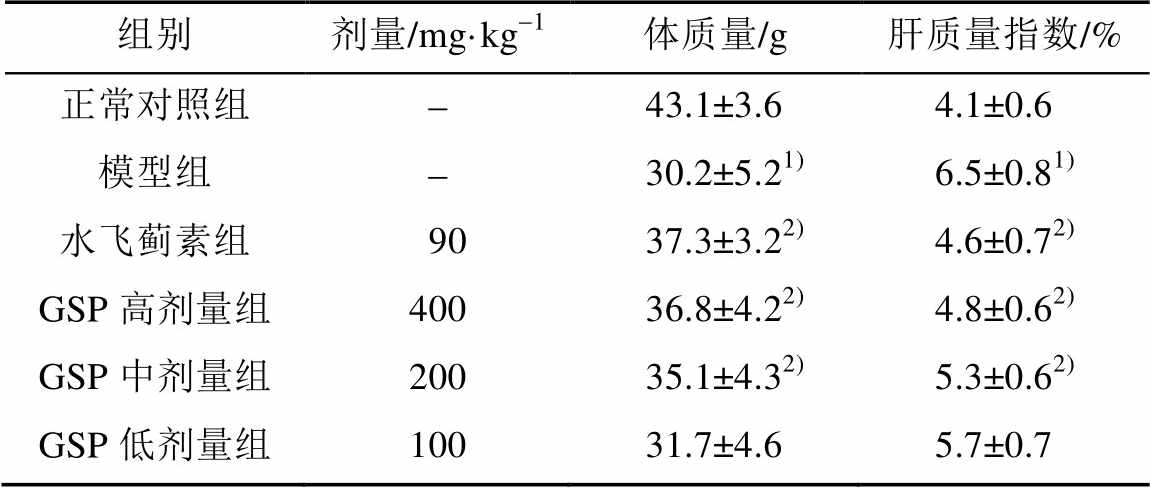
注:与正常对照组比较,1)P<0.05;与模型组比较,2)P<0.05。
Note: Compared with control,1)P<0.05; compared with model,2)P<0.05.
与正常对照组比较,模型组ALT、AST水平显著升高(P<0.05),表明长期给予酒精引起了小鼠肝功能异常。与模型组比较,GSP各剂量组和水飞蓟素组ALT、AST活性显著降低(P<0.05),结果见表2。
表2 酒精性肝损伤小鼠血清ALT、AST活性(n=10,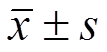 )
)
Tab. 2 The activity of serum ALT and AST in alcohol hepatic injury mouse(n=10,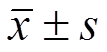 )
)
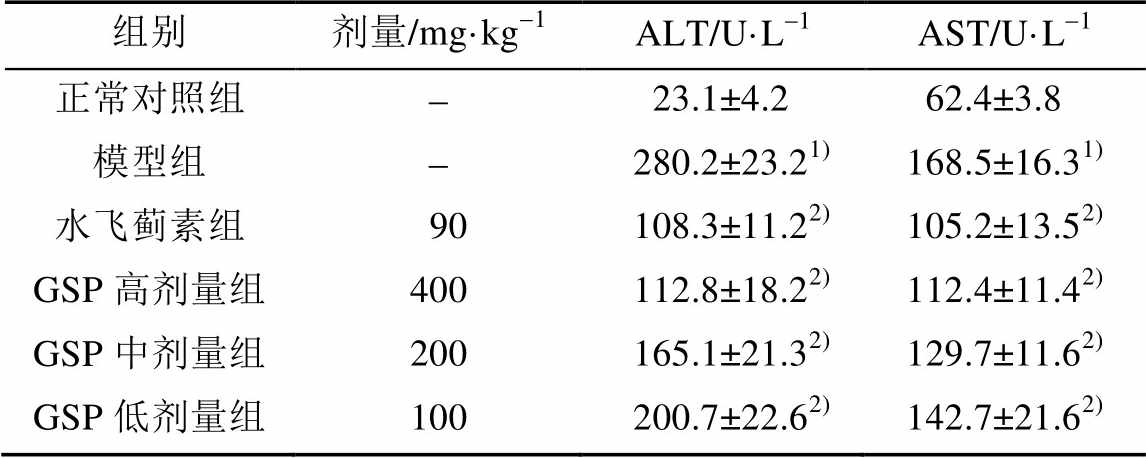
注:与正常对照组比较,1)P<0.05;与模型组比较,2)P<0.05。
Note: Compared with control group,1)P<0.05; compared with model group,2)P<0.05.
与正常对照组比较,模型组GSH含量及SOD、GSH-Px活力明显降低(P<0.05),MDA含量明显增加(P<0.05)。与模型组比较,GSP中、高剂量组和水飞蓟素组GSH含量及SOD、GSH-Px活力明显升高(P<0.05),MDA含量明显降低(P<0.05);GSP低剂量组MDA含量明显降低(P<0.05),SOD活力明显升高(P<0.05),GSH含量及GSH-Px活力没有明显差异,结果见表3。
表3 GSP对酒精性肝损伤小鼠肝匀浆中MDA、GSH含量及GSH-Px、SOD活性的影响(n=10, )
)
Tab. 3 Effect of GSP on the contents of MDA, GSH and the activity of SOD, GSH-Px in alcohol hepatic injury mouse(n=10, )
)
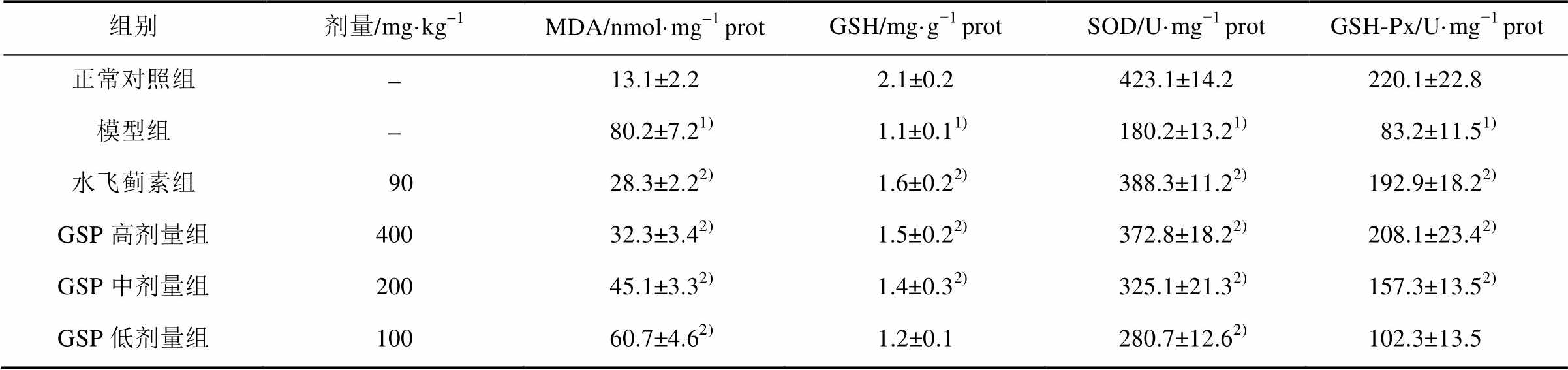
注:与正常对照组比较,1)P<0.05;与模型组比较,2)P<0.05。
Note: Compared with control group,1)P<0.05; compared with model group,2)P<0.05.
与正常对照组比较,模型组肝匀浆NF-κB、TNF-α、IL-1β含量显著升高(P<0.05)。与模型组比较,GSP中、高剂量组和水飞蓟素组NF-κB、TNF-α、IL-1β含量显著降低(P<0.05);GSP低剂量组TNF-α含量显著降低(P<0.05),但NF-κB和IL-1β含量没有统计学差异,结果见表4。
表4 GSP对酒精性肝损伤小鼠肝匀浆中NF-κB、TNF-α、IL-1β含量的影响(n=10, )
)
Tab. 4 Effect of GSP on the contents of NF-κB、TNF-α、IL-1β in alcohol hepatic injury mice(n=10,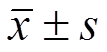 )
)
注:与正常对照组比较,1)P<0.05;与模型组比较,2)P<0.05。
Note: Compared with control group,1)P<0.05; compared with model group,2)P<0.05.
正常对照组小鼠肝细胞形态正常,肝小叶规则,以中央静脉为中心周围肝细胞索呈放射状排列,肝细胞间及汇管区周围无炎性反应细胞浸润。酒精性肝损伤模型组小鼠肝小叶中央区部分肝细胞发生水样变性及脂肪变性,并见少量点灶状坏死,并有炎症细胞浸润。与模型组比较,GSP各剂量组和水飞蓟素组肝脏组织变性及坏死程度均减轻,炎症细胞浸润减少。结果见图1。
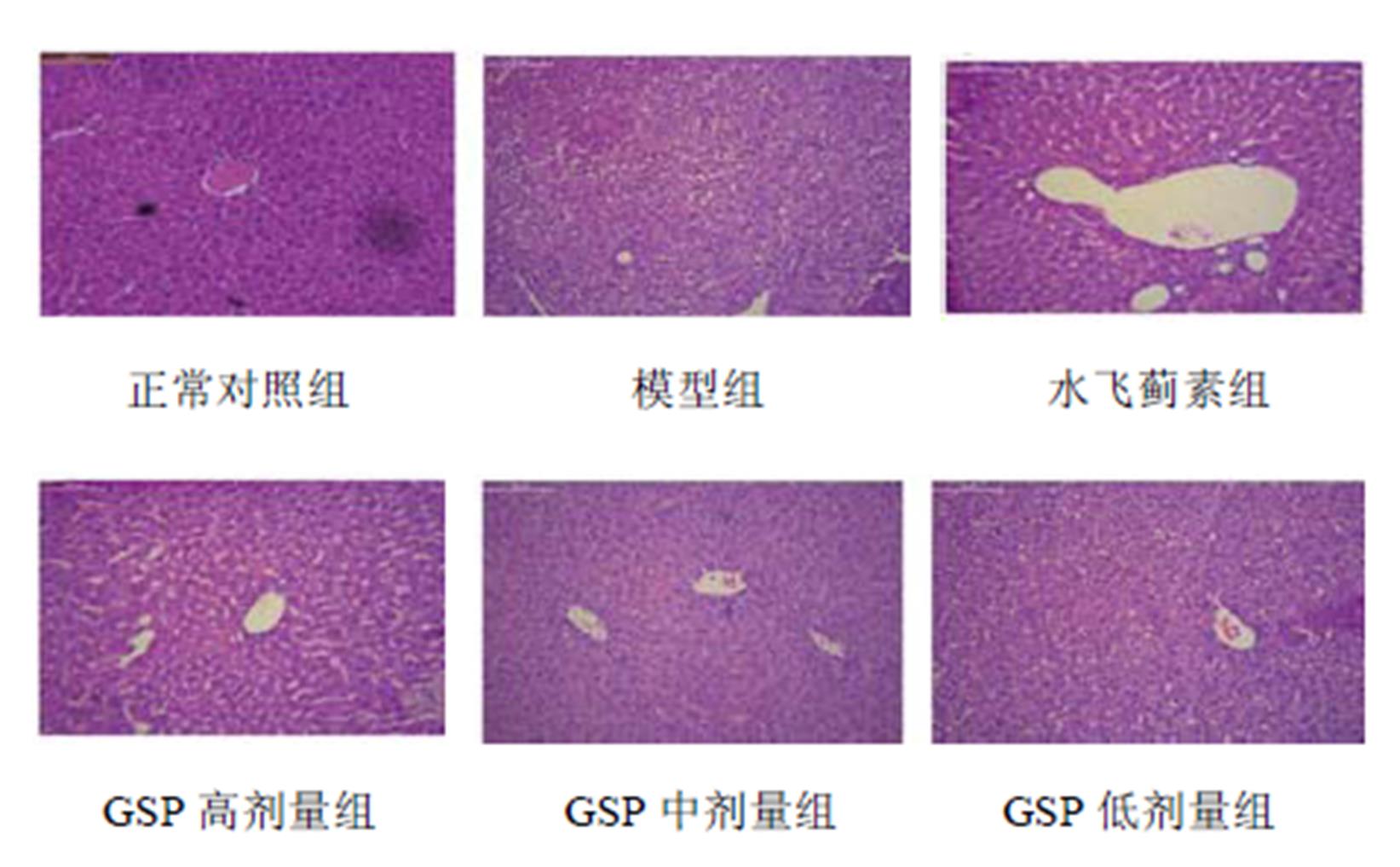
图1 肝脏组织的病理变化(HE,200×)
Fig. 1 Pathological change in the hepatic tissue (HE, 200×)
本次实验采用日常生活中的烈性白酒红星二锅头(56%乙醇)给予ICR小鼠8周,发现小鼠肝功能指标升高,肝组织出现明显的水样变性及脂肪变性,并见少量点灶状坏死,说明成功建立酒精性肝损伤模型。给予酒精性肝损伤小鼠GSP后发现,GSP能改善肝功能指标,降低肝组织的损伤,表现出一定的肝脏保护作用。
肝是负责乙醇代谢的主要器官,而乙醇的去除主要由肝脏进行,乙醇在体内有3条代谢途径,胞浆内的乙醇脱氢酶系、内质网上的微粒体乙醇氧化系统、过氧化小体上的触酶。其中,在内质网上的微粒体乙醇氧化系统,乙醇被氧化成为乙醛,高浓度乙醛会显著损害肝脏利用氧的能力,并加速细胞内的还原型谷胱甘肽耗竭,加剧自由基介导的不良反应和脂质过氧化作用。另外,乙醇代谢中可产生一些副产物,如NADH NAD+增高,可影响正常糖代谢途径,产生氧自由基,引起肝细胞损伤[6-7]。实验中也发现酒精性肝损伤小鼠肝组织的氧化指标MDA明显升高,抗氧化指标(GSH、GSH-Px、SOD)明显降低。基本证实了大量的酒精摄入可引起肝脏出现氧化应激,抗氧化能力减弱。而GSP可以改善这种状况,原因是GSP的类黄酮结构有很强的抗氧化、清除自由基的作用[8]。
酒精引起的氧化损伤还可以继发性激活肝脏炎症反应,导致释放大量炎症介质和细胞因子,氧化损伤活化转录因子NF-κB,NF-κB核转位活化促进靶基因的表达,产生急性期蛋白、酶类、细胞因子、化学因子、黏附因子、生长因子等[9]。TNF-α和IL-1β是由肝Kupffer细胞表达和分泌的主要前炎性细胞因子,能促进其他细胞因子的表达,引起炎症反应和组织损伤[10]。细胞因子和炎症介质可能引起肝细胞凋亡、炎症甚至坏死,进一步增加了肝组织损伤[9]。本实验发现,酒精性肝损伤小鼠肝组织的TNF-α、IL-1β和NF-κB含量增加,病理检查发现,肝组织有大量炎细胞浸润,与前面的报道一致,说明酒精性肝损伤可能与炎症损伤有关。GSP可拮抗这种损伤,在本实验中,GSP降低了肝组织中NF-κB和炎症因子TNF-α、IL-1b水平,减少了组织中的炎细胞的数量。这可能是GSP的抗氧化性质,去除了氧化应激的启动因素,导致炎症因子产生减少,也可能是GSP直接作用炎症的某个环节引起炎症反应降低。Terra等[11]发现,GSP通过抑制NO和前列腺素E2的合成,抑制iNOS mRNA表达及核转录因子NF-κB转位,调节激活的巨噬细胞的炎症反应。
综合所述,GSP对小鼠酒精性肝损伤有较好的保护作用,其作用机制是降低氧化应激和炎症反应,有助于急性酒精性肝损伤疾病的防治。
REFERENCES
[1] PANG X J, HONG Y P. Study on acute alcohol liver injury induced by Jiejiu oral liquid in mice [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2017, 34(11): 1526-1529.
[2] XIONG Y, YANG Y Q, Yang J, et al. Tectoridin, an isoflavone glycoside from the flower of pueraria lobata prevents acute ethanol-induced liver steatosis in mice [J]. Toxicology, 2010, 276(1): 64-72.
[3] LIU Q, XIA Z Y, ZOU D Y, et al. Screening of grape seed proanthocyanidins lowering efficacy site [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2016, 33(11): 1378-1381.
[4] Zhang Z F, Jin J, Shi L G. Protective function of cis-mulberroside A and oxyresveratrol from Ramulusmori against ethanol-induced hepatic damage [J]. Environmental Toxicol Pharmacol, 2008, 26(3): 325-330.
[5] Zou J F, Liu X G, Qi F J, et al. Grape seed procyanidin decreases the acute chemical hepatic injury in mice [J]. Basic Clin Med(基础医学与临床), 2012, 32(10): 1198-1201.
[6] ZHAO Y. Protective effects and mechanism of puerarin on subacute alcoholic liver injury in rats [J]. Clin J Chin Med(中医临床研究), 2016, 20(8): 12-14.
[7] ZHANG B, SHEN X, ZHANG Y, et al. Mechanism of protective effects of procyanidins on liver injury induced by alcohol in mice [J]. J Hygiene res(卫生研究), 2007, 36(3): 295-298.
[8] FRACASSETTI D, COSTA C, MOULA L, et al. Ellagic acid derivatives, ellagitannins, proanthocyanidins and other phenolics, vitamin C and antioxidant capacity of two powder products from camu-camu fruit (Myrciaria dubia) [J]. Food Chem, 2013, 139(1/4): 578-583.
[9] HE X, LIU C Y, YIN J F, et al. Rhaponticum uniflorum inhibits H2O2-induced apoptosis of liver cell via JNK and NF-κB pathways [J]. China J Chin Mater Med(中国中药杂志), 2017, 42(6): 1189-1193.
[10] BELLEZZA I, MIERLA A, GROTTELLI S, et al. Furanodien-6-one fromCommiphora erythraeainhibits the NF-κB signaling and attenuates LPS-induced neuroinflam- mation [J]. Mol Immunol, 2013, 54(3/4): 347-354.
[11] TERRA X, VALLS J, VITRAC X, et al. Grape-seed procyanidins act as anti-inflammatory agents in endotoxin- stimulated RAW 264.7 macrophages by inhibiting NF-kB signaling pathway [J]. J Agric Food Chem, 2007, 55(11): 4357-4365.
(本文责编:曹粤锋)
Protective Effects of Grape Seed Procyanidin on Alcoholic Liver Injury in Mice
WANG Xincai1, YANG He2
(1.Huzhou Institute for Food and Drug Control, Huzhou 313000, China; 2.College of Pharmaceutical Science, Zhejiang University of Technology, Hangzhou 310014, China)
Abstract: ObjectiveTo study the protective effects and anti-inflammation mechanism of grape seed procyanidin(GSP) on alcoholic liver injury in mice.MethodsSixty male ICR mice were randomly divided into six group: normal group. model group (56% alcohol), silymarin group(56% alcohol +90 mg·kg-1silymarin), high, medium, low GSP dose group(56% alcohol+400, 200, 100 mg·kg-1GSP). Eight weeks later, serum alanine aminotransferase(ALT) and aspartate aminotransferase (AST) level, malondialdehyde (MDA) contents, the superoxide dismutase (SOD) and glutathione peroxidase (GSH-Px) activity in liver were measured by spectrophotometry. The contents of NF-κB, TNF-α, and IL-1β in liver were analyzed by ELISA. HE observe the pathological change in the hepatic tissue.ResultsCompared with the model groups, GSP in the treatment group decreased the levels of serum ALT and AST and the contents of MDA, NF-κB, TNF-α, IL-1β (P<0.05), but increased the activity of SOD and GSH-Px in the hepatic tissue.ConclusionGSP can reduce the damage of liver tissue in mice with alcoholic liver injury, by reducing oxidative stress and inflammatory reaction.
Key words:grape seed procyanidin; alcoholic liver injury; oxidative stress; anti-inflammation
中图分类号:R285.4
文献标志码:B
文章编号:1007-7693(2018)07-1054-04
DOI:10.13748/j.cnki.issn1007-7693.2018.07.024
引用本文:王新财, 杨和. 葡萄籽原花青素对酒精性肝损伤小鼠的保护作用[J]. 中国现代应用药学, 2018, 35(7): 1054-1057.
作者简介:王新财,男,硕士,副主任药师 Tel: 0572-2750808 E-mail: wangxincai789@126.com
收稿日期:2017-09-05