心脏手术需要在体外循环下进行,往往手术时间较长,对心肌创伤大,且体外循环通路中血液接触外界的高分子材料,加上心肌恢复血流灌注后引起的缺血-再灌注损伤,均可以引起并加重体内的全身炎症反应综合征(systemic inflammatory response syndrome,SIRS),其中氧化应激反应起了重要的作用[1]。这一过程对心脏损伤最直观的反映就是术后心肌损伤标志物(如肌钙蛋白)的明显升高,部分患者因心肌损伤过重而出现术后低心排综合征,因此如何保护心肌细胞一直是临床医师关注和研究的热点问题之一。右美托咪定(dexmedetomidine,Dex)是临床上应用较多的镇痛镇静药物,常用于需要浅镇静的患者。Dex本质上属于高选择性的α2-受体激动剂,不但具有镇痛、镇静和抗焦虑作用,还具有独特的抗交感神经兴奋作用,而且对呼吸和循环系统影响较小[2]。近年来的研究发现Dex还具有一定的抗氧化应激作用,能够减轻体内的氧化应激反应,从而发挥保护脏器功能的作用[3]。本研究选择浙江省人民医院外科重症监护室(surgical intensive care unit,SICU)自2016年1月1日至2017年6月30日收治的143例因心脏瓣膜病接受心脏手术的成人患者为研究对象,旨在探讨不同剂量 Dex对成人心脏瓣膜术后心肌细胞氧化应激程度和血流动力学的影响,为临床上更好地治疗此类患者提供依据。
1 资料与方法
1.1 研究对象
经医院伦理委员会批准,连续选取笔者所在医院SICU自2016年1月1日至2017年6月30日收治的 143例因心脏瓣膜病接受心脏手术的成人患者为研究对象,本研究采用前瞻性临床随机对照试验。所有患者均符合以下纳入标准:①年龄 18~75岁;②因心脏瓣膜病接受静脉全身麻醉下开胸心脏瓣膜置换手术,术后带气管插管入住SICU;③术前患者神志清醒。排除标准:①有合并急性心肌梗死或其他类型的心脏疾病;②既往有精神疾病史;③术中或术后并发颅内出血或脑梗死或任何可以引起意识障碍的疾病患者;④术中或术后出现心跳骤停者;⑤术后任何原因引起的院内死亡者;⑥合并任何部位感染性疾病;⑦合并肿瘤、血液病或自身免疫性疾病;⑧由于使用镇静药物引起的精神异常者;⑨人类免疫缺陷病毒检测阳性者;⑩合并严重的肝肾功能障碍者。本研究符合医学伦理学标准并经医院伦理委员会批准,所有检测指标和治疗均经患者本人或授权人知情同意。
1.2 研究方法
1.2.1 研究对象分组 将所有患者随机分为对照组(n=45)、低剂量Dex组(低剂量组,n=50)和高剂量Dex组(高剂量组,n=48)。详细记录各组患者年龄、性别、病程、体质量指数(body mass index,BMI)、个人史、合并症、术前心功能分级、术前肺动脉压分级、体温、心率(heart rate,HR)和平均动脉压(mean arterial pressure,MAP)、心指数(cardiac index,CI)、呼吸次数(respiratory rate,RR)、B型脑钠肽(B-type brain natriuretic peptide,BNP)、肌钙蛋白-I(cardiac troponin-I,cTnI)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)、血清白蛋白(albumin,Alb)、血肌酐(serum creatinine,Scer)、外周血白细胞计数(white blood cell,WBC)、血红蛋白(hemoglobin,Hb)、血小板计数(platelet,PLT)、左心室射血分数(left ventricular ejection fraction,LVEF)、体外循环时间(cardiopulmonary bypass time,CPB)和主动脉阻断时间(aortic crossclamp time,ACC)等。
1.2.2 研究方法 所有患者在术前均进行右侧颈内静脉穿刺并留置双腔深静脉导管,左侧桡动脉穿刺直观监测有创血压,另建一路外周静脉通路备用。采用贝朗共识生产的微量泵持续泵入药物。麻醉前30 min肌肉注射吗啡10 mg及盐酸戊乙奎醚1 mg,入室后给予面罩吸氧,持续监测心电图、有创血压及手指氧饱和度。经外周静脉滴注复方氯化钠注射液500 mL,经深静脉导管一次注入咪达唑仑注射液 0.05 mg·kg-1、舒芬太尼 1 μg·kg-1、依托咪酯0.3 mg·kg-1和顺式阿曲库铵0.2 mg·kg-1行麻醉诱导。待患者安静入睡后使用加压面罩使氧饱和度>95%后进行气管插管。麻醉维持用药:舒芬太尼0.6 ng·mL-1血浆靶控输注,丙泊酚注射液 1.5~2.0 μg·mL-1血浆靶控输注,间断静脉推注顺式阿曲库铵0.05 mg·kg-1,术中持续监测镇静深度使得Narcotrend指数在40~50。低剂量组和高剂量组患者在气管插管成功后 10 min分别给予0.3 μg·kg-1或 0.6 μg·kg-1Dex(江苏恩华药业有限公司生产,国药准字H20090248,商品名:艾贝宁,2 mL︰200 μg),在10 min内静脉注射完毕,随后分别以 0.3 μg·kg-1·h-1或 0.6 μg·kg-1·h-1的速度恒速泵入Dex,直到关胸。对照组患者注射等量的生理盐水。
1.2.3 观察指标 分别在体外循环开始前即刻(T0)、手术结束时(T1)、术后6 h(T6)、术后12 h(T12)和术后24 h(T24)这5个时点采集外周血标本5 mL,测定cTnI、超氧化物歧化酶(superoxide dismutase,SOD)和丙二醛(malondialdehyde,MDA)水平,并记录各时点的血流动力学指标,包括 HR、MAP和CI。其中采用电化学发光法监测cTnI,采用硫代巴比妥酸法和黄嘌呤氧化法分别测定血清 SOD和MDA。所有试剂盒均由武汉默沙克生物科技有限公司提供。比较 3组间各时点上述指标差异并分析其临床意义。
1.3 统计学方法
采用SPSS 22.0软件进行统计学分析。计量资料用x± s 表示,组间比较采用单因素方差分析;分类资料比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 3组间一般临床资料比较
3组间年龄、性别、病程、BMI、个人史、合并症、生化指标及术前心功能分级等项目差异无统计学意义,具有可比性,见表1。
2.2 3组间不同时点外周血cTnI水平比较
术前3组间cTnI水平差异无统计学意义,术后各组 cTnI水平均明显升高(与术前相比均P<0.05),在 T6升高至最高点,之后缓慢下降,3组间高剂量组升高幅度最小,其次为低剂量组和对照组,3组间术后各时点cTnI水平均有明显差异(均 P<0.05),见表 2。
2.3 3组间不同时点外周血SOD及MDA水平比较
术前3组间外周血SOD及MDA水平差异无统计学意义,术后各组SOD水平均逐渐降低,在T6降低至最低点,之后缓慢升高,高剂量组降低幅度最小,其次为低剂量组和对照组,3组间术后各时点 SOD 水平均有明显差异(均 P<0.05)。而MDA的变化呈现出与SOD相反的趋势,高剂量组升高幅度最小,其次为低剂量组和对照组,3组间术后各时点 MDA水平均有明显差异(均P<0.05),见表 3。
2.4 3组间不同时点血流动力学比较
术前3组间HR、MAP及CI差异均无统计学意义,术后HR和MAP均降低,CI逐渐升高,但3组间未显示出统计学差异,见表4。
表1 3组患者临床资料比较
Tab. 1 Comparison on clinical data among three groups
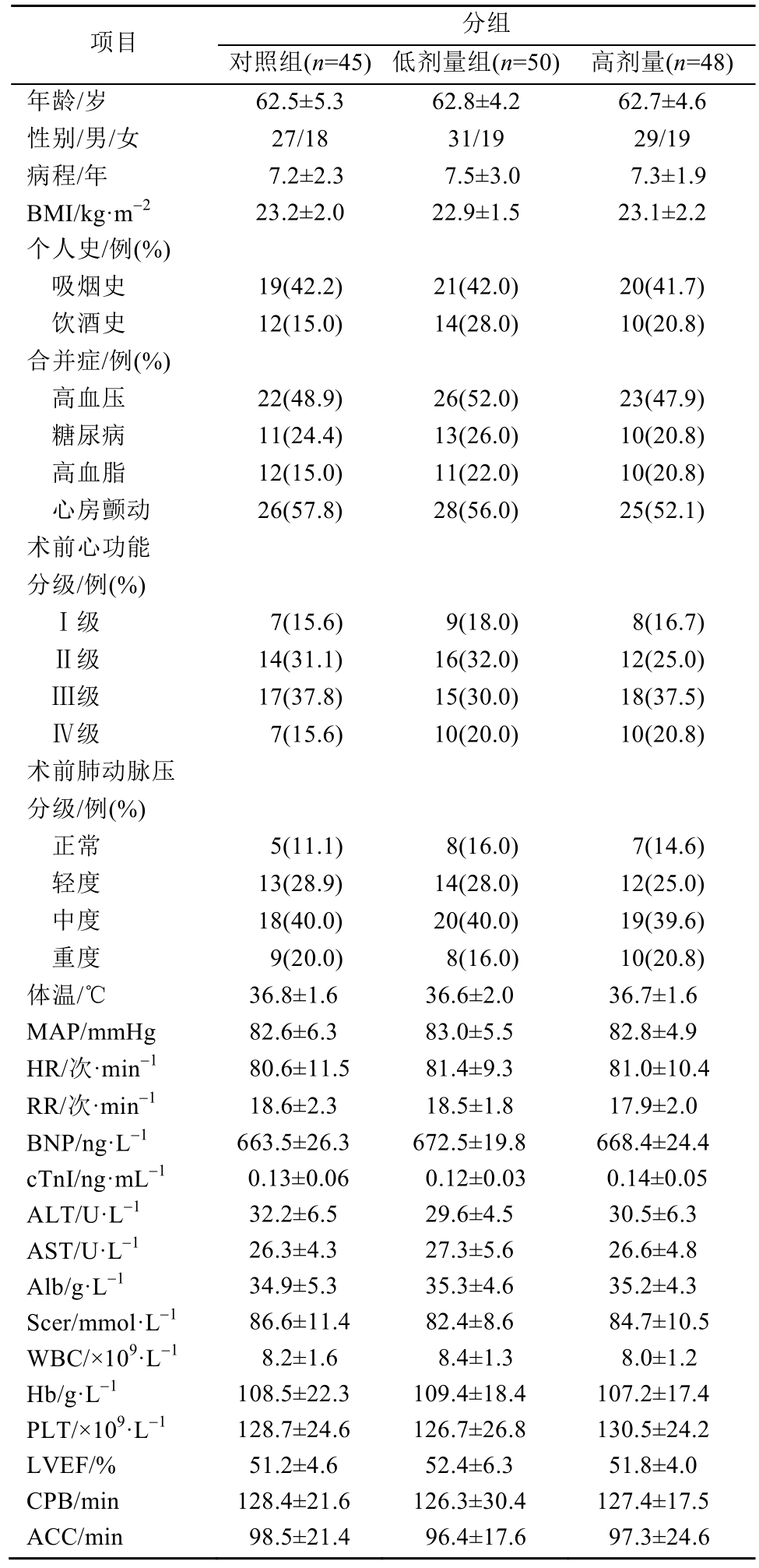
表2 3组间不同时点外周血cTnI水平比较(x± s )
Tab. 2 Comparison of cTnI in peripheral blood at different timing among three groups(x ± s ) ng·mL-1

注:与本组T0相比,1)P<0.05;与同时点对照组相比,2)P<0.05;与同时点低剂量组相比,3)P<0.05。
Note: Compared with T0 group, 1)P<0.05; compared with control group at same time, 2)P<0.05; compared with low-dose group at same time, 3)P<0.05.
表3 3组间不同时点外周血SOD及MDA水平比较(x± s )
Tab. 3 Comparison on SOD and MDA in peripheral blood at different timing among three groups(x± s )

注:与本组T0相比,1)P<0.05;与同时点对照组相比,2)P<0.05;与同时点低剂量组相比,3)P<0.05。
Note: Compared with T0 group,1)P<0.05; compared with control group at same time, 2)P<0.05; compared with low-dose group at same time, 3)P<0.05.
表4 3组间不同时点血流动力学比较(x± s )
Tab. 4 Comparison on hemodynamics at different timing among three groups(x± s )

注:与本组T0相比,1)P<0.05。
Note: Compared with T0 group, 1)P<0.05.
3 讨论
瓣膜置换术是治疗风湿性心脏病的常用术式,术后cTn均会明显升高,考虑存在心肌损伤,其主要机制有以下几条[4-6]:①开胸手术术中对心肌的直接机械性损伤;②术中体外循环过程中,体内血液被引入特殊的高分子材料内,血液与管道的接触激活了体内中性粒细胞、血小板因子及内皮因子等炎症细胞,引起SIRS,严重时引发多器官功能障碍综合征;③缺血-再灌注损伤,手术结束后心肌恢复血流引起大量自由基释放从而造成心肌缺血-再灌注损伤,引发对心肌细胞的二次打击。术后心肌细胞的损伤会引起心输出量的降低,甚至发生术后低心排综合征,大大增加了术后恢复的难度,也是引起心脏术后患者死亡的主要原因之一[7]。
Dex作为一种新型的α2-受体激动剂,具有特殊的抗交感兴奋作用,而且越来越多的研究证实它还具有一定的抗炎症介质作用[8]。Taniguchi等[9]的研究发现对盲肠穿孔致脓毒症大鼠使用 Dex后其血浆中炎症因子(如白细胞介素-6和肿瘤坏死因子-α)水平明显降低,预后结局明显改善。吴志林等[10]的研究中采用不同剂量的Dex对心肌缺血-再灌注大鼠进行预处理,结果发现Dex明显降低大鼠体内血清肿瘤坏死因子-α、白细胞介素-6和 MDA水平,而SOD含量明显增加,从而认为Dex可以通过抑制氧化应激反应来减轻心肌缺血-再灌注损伤,发挥心肌保护作用。李安超[11]的研究显示对于接受开颅手术的高血压性脑出血患者在麻醉诱导前给予 Dex应用能够明显降低患者体内神经元特异性烯醇化酶(neuronspecific enolase,NSE)和S100β蛋白水平,且术中心率明显降低,术后躁动发生率明显低于对照组,具有明显的脑保护作用。
SOD和MDA常用于反映体内氧化应激反应程度,研究已证实其机制主要通过激活蛋白激酶B/哺乳动物雷帕霉素靶蛋白(Akt/mTOR)信号通路从而上调活化 caspase-3和活化聚腺苷二磷酸-核糖聚合酶的表达来实现,在多数文献中被用于评价心肌细胞的氧化应激反应程度[12],因此本研究选择 MDA作为氧化应激反应的量化指标,SOD作为抗氧化应激的指标。结果发现,使用 Dex的患者其体内SOD水平明显升高,MDA水平明显降低,这种变化与cTnI一致,并且在T6表现最为明显。说明在预先使用 Dex后患者体内的氧化应激程度明显降低,抗氧化物质增加,发挥了一定的保护作用。此外,还发现高剂量 Dex组患者的变化程度高于低剂量Dex组,呈现一定的量效关系。
本研究选择临床常见且已获得 HR、MAP和CI作为血流动力学评价的指标,直观地反应患者在术中和术后的血流动力学变化。众所周知,Dex主要的不良反应在于对心血管系统的抑制,尤其是其降低HR和血压的效应,本研究中观察到使用Dex的患者HR和MAP较对照组有一定程度的下降,尤其是在术中和术后6 h内,但是3组间并未显示出统计学差异,未发生一例严重的心动过缓事件,具有良好的安全性。此外,适当控制HR对于维持循环稳定具有利好的一面。符炜等[13]的研究发现对于接受心脏瓣膜手术的患者预先使用不同剂量的Dex后其术后HR明显降低,心脏复跳率明显增加,术后24 h心血管不良事件发生率明显降低,而且高剂量组表现更为明显。大量研究均表明Dex对心脏的保护作用主要通过以下机制实现[13-16]:①特殊的抗交感兴奋作用,主要通过抑制中枢神经系统内的蓝斑核内去甲肾上腺素神经元活性实现,降低了体内儿茶酚胺的生成,从而降低HR并减轻心肌细胞的氧耗,有效减少术后心率增快的发生率,改善心脏术后血流动力学;②预先使用 Dex与心脏的 α2受体结合后可以激活体内的 Ras-MEK1-2-ERK1/2信号通路,上调下游的表皮生长因子等具有保护心肌细胞作用的细胞因子类物质。
综上所述,Dex能够明显减轻心脏术后心肌细胞的氧化应激程度并发挥心肌保护作用,呈现出明显的量效关系,对血流动力学无明显影响,值得在临床中推广应用。
REFERENCES
[1] ZHOU H M, XIAO W P, WANG K R, et al. The protective effect of dexmedetomidine against cerebral ischemic injury of pafients undergoing cardiac valve replacement surgerywith cardiopulmonary bypass [J]. Chin J Exp Surg(中华实验外科杂志), 2013, 30(4): 749-752.
[2] LI Y, WANG S L, YI X Z. et al. Cerebral oxygen metabolism effects of right dexmedetomidine combined with etomidate anesthesia for elderly patients [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2016, 33(2): 212-216.
[3] IBACAEHE M, SANCHEZ G, PEDROZO Z, et al.Dexmedetomidine preconditioning activates pro-survival kinases and attenuates regional ischemia/reperfusion injury in rat heart [J]. Biochim Biophys Aeta, 2012, 1822(4): 537-545.
[4] 汪芳俊, 胡建华, 杨霜, 等. 右美托咪定预充对心脏手术患者体外循环期间血流动力学的影响[J]. 中国药房, 2017,28(2): 204-209.
[5] SHEN J M, SUN Y J, HAN D, et al. Effects of dexmedetomidine on perioperative cardiac adverse events in elderly patients with coronary heart disease [J]. J Cent South Univ(Med Sci)(中南大学学报 医学版), 2017, 42(5):553-557.
[6] DENG S, ZHUANG H B, LIU J H, et al. Clinical efficacy of dexmedetomidine in patients undergoing cardiac valve replacement with cardiopulmonary bypass [J]. Clin J Med Offic(临床军医杂志), 2016, 44(1): 81-84.
[7] ALAM S R, LEWIS S C J, ZAMVAR V, et al. Perioperative elafin for ischaemia-reperfusion injury during coronary artery bypass graft surgery: a randomised-controlled trial [J]. Heart,2015, 101(20): 1639-1645.
[8] HAN Y Y, ZHENG J G, YANG Q H, et al. Effects of dexmedetomidine on the expression of autophagy protein LC3 in operated lung tissues of patients undergoing radical operation for lung cancer [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2018, 35(3): 411-414.
[9] TANIGUCHI T, KIDANI Y, KANAKURA H, et al. Effects of dexmedetomidine on mortality rate and inflammatory responses to endotoxin-induced shock in rats [J]. Crit Care Med, 2004, 32(6): 1322-1326.
[10] WU Z L, ZHU S J, YAO S L, et al. Effects of different dosages of dexmeditomidine pretreatment on myocardial ischemia reperfusion injury and inflammation in rats [J]. Acta Med Univ Sci Technol Huazhong(华中科技大学学报 医学版), 2015, 44(4): 445-447.
[11] LI A C. Effects of dexmedetomidine-induced anesthesia on intraoperative signs and postoperative brain function in patients with hypertensive intracerebral hemorrhage [J]. Chin J Pract Nerv Dis J(中国实用神经疾病杂志), 2017, 20(13):83-85.
[12] SUN X D, YAN Y H, ZHANG Y T, et al. Effects of Xuebijing injection on oxidative stress and early inflammatory factors in rats with sepsis induced liver injury [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2016, 33(10): 1255-1259.
[13] FU W, GU E W, WANG H, et al. Effect of different doses of dexmedetomidine on myocardial injury on cardiopulmonary bypass in patients with rheumatic heart valve replacement surgery [J]. Chongqing Med(重庆医学), 2015, 44(4): 492-494.
[14] ZHANG W, ZHANG W, ZHANG J Q. Effects of PI3K/Akt/HIF-1α signaling pathway in protective effects of dexmedetomidine on lung injury induced by ischemicreperfusion [J]. Chin J Hosp Pharm(中国医院药学杂志), 2016,36(21): 1890-1893.
[15] HE P, LIU Z H, AI L et al. Protective effects of dexmedetomidine on systemic inflammatory response syndrome during cardiopulmonary bypass [J]. China Pharmacist(中国药师), 2017, 20(8): 1387-1390.
[16] ZHANG J Q, ZHANG W. The effects of dexmedetomidine on hemodynamics and myocardial reperfusion injury in patients undergoing cardiac valve replacement surgery [J]. J Clin Anesthesiol(临床麻醉学杂志), 2014, 30(5): 426-429.