大剂量甲氨蝶呤(high dose methotrexate,HD-MTX)疗法是治疗血液系统恶性肿瘤的重要手段[1-2]。而临床使用HD-MTX时会引起胃肠道反应、口腔黏膜炎、肝肾功能损伤及骨髓抑制等不良反应,这些不良反应可能迫使医师更换治疗方案,造成患者治疗效果欠佳甚至死亡[3]。有研究发现[4-5],MTX在临床应用中的不良反应存在明显个体差异。目前关于影响不良反应因素的研究仅局限于对遗传因素或非遗传因素尚不全面的探讨[6]。因此,本研究将以亚甲基四氢叶酸还原酶(5,10-methylenetetrahydrofolate reductase,MTHFR)和多药耐药-1(ABCB1)基因多态性并结合患者一般情况的非遗传因素作为观察指标,全面研究影响MTX不良反应的危险因素,并建立Logistic回归模型来预测应用HD-MTX化疗的淋巴系恶性肿瘤患者发生不良反应的概率,为临床制定MTX个体化用药方案提供参考。
1 资料与方法
1.1 病例资料
收集2014年6月—2016年12月新疆医科大学第一附属医院儿科和血液病中心收住的确诊为淋巴系恶性肿瘤的患者,共纳入 180例,其中男性98例,女性82例;平均年龄(24.65±18.25)岁;儿童(≤14岁)68例,成人(>14岁)112例;汉族:101例,维吾尔族54例,其他民族25例(回族11例,哈萨克族9例,柯尔克孜族2例,蒙古族1例,土家族 1例,锡伯族 1例);MTHFR C677T(CC/CT/TT∶51/93/36),MTHFR A1298C(AA/AC/CC∶118/50/12),ABCB1 C3435T(CC/CT/TT∶53/93/34)。入组标准:形态学、免疫学、细胞遗传学和分子生物学(MICM)标准及世界卫生组织 2008标准诊断[7]为淋巴系恶性肿瘤的患者,经诱导缓解治疗后处于完全缓解状态,接受HD-MTX治疗且重要脏器功能正常,至少完成 1个完整的化疗周期且临床资料完整。排除标准:合并其他恶性肿瘤的患者;与HD-MTX化疗无关的其他治疗导致死亡的患者。本研究经新疆医科大学第一附属医院医学伦理委员会审批通过(批号:20160315-01)。
1.2 治疗方案
参照CALLG2008方案及儿童ALL诊疗建议[8-9]。所有患者均经诱导缓解治疗及巩固治疗后处于完全缓解状态,化疗前无严重的血常规异常和肝肾功能障碍,无感染状态时开始接受 Hyper-CVAD方案、Bonn方案及BFM90方案进行化疗。化疗前 24 h内静脉注射 5%葡萄糖水化及碳酸氢钠碱化,保持尿液pH值≥7.0;HD-MTX化疗使用剂量为1.5~5 g·m-2,持续静脉滴注24 h,开始滴注MTX后36 h用亚叶酸钙(calcium folate,CF)解救,剂量为15 mg·m-2,每6 h给药1次,并依据血药浓度测定结果调整 CF的解救方案,直至MTX 血浆浓度≤0.1 μmol·L-1时停止解救。
1.3 临床资料及毒性反应的记录及评价
记录180例患者临床病例信息:性别、民族、年龄、身高、体质量、体表面积、BMI、MTHFR C677T、A1298C和ABCB1 C3435T基因多态性;治疗信息:MTX剂量强度、化疗方案、化疗前24 h水化量、化疗前24 h血液学和生化常规检查结果;记录患者首次出现某种不良反应对应的信息:若患者在化疗过程中未出现某种不良反应,则记录患者首次进行化疗时对应的信息。
记录每例患者化疗前和化疗后7~28 d血液学和生化常规检查结果,并观察患者皮肤口腔黏膜及胃肠道反应情况;依据《CTCAE Version 4.0抗癌药物常见毒性反应分级标准》及《抗癌药物急性及亚急性毒性反应分度标准(WHO)》进行不良反应分级。
1.4 统计方法
本研究为病例对照研究,计数资料采用χ2分析,计量资料采用两独立样本的t检验或非参数检验进行HD-MTX给药后不良反应的单因素分析;为防止过多可能有意义的因素,调整单因素分析的P值≤0.2及临床上有意义的变量作为自变量,再进行多因素非条件 Logistic回归分析,建立Logistic预测模型,并计算准确度、灵敏度、特异度和受试者工作特征(ROC)曲线下面积(AUC)对模型进行检验。使用SPSS 21.0统计软件,采用双尾检测,P<0.05为具有显著性意义。自变量赋值见表1。
表1 自变量及其赋值
Tab. 1 Independent variables and their assignments

2 结果
2.1 HD-MTX化疗后不良反应发生情况
180例患者不良反应发生情况:骨髓抑制发生率为58.33%,黏膜损伤发生率为53.33%,胃肠道反应发生率为 47.78%,肝功能损伤发生率为42.22%,急性肾损伤发生率为5.56%。
2.2 单因素分析结果
对21个变量逐一进行单因素分析,显示影响肝功能损伤的变量有年龄、性别、化疗方案、化疗前24 h内水化量、化疗前ALT、化疗前AST、化疗前中性粒细胞、化疗前尿酸及 MTX剂量强度;影响骨髓抑制变量有年龄,性别,民族,疗程数,化疗方案,体表面积,化疗前WBC、HB、PLT、ALP、淋巴细胞、尿酸,MTHFR C677T(CC/CT/TT、CC+CT/TT),A1298C(AA/AC/CC、AA/AC+CC)及 MTX剂量强度;影响黏膜损伤变量有疗程数、化疗方案、化疗前24 h内水化量、ABCB1 C3435T(CC+CT/TT)、MTHFR C677T(CC/CT/TT、CC+CT/TT、CC/CT+TT)和 A1298C(AA/AC/CC、AA/AC+CC);影响胃肠道反应变量有性别、民族、化疗方案、MTHFR C677T(CC/CT/TT、CC+CT/TT)、A1298C(AA/AC/CC、AA/AC+CC)及 MTX剂量强度;影响急性肾损伤变量有年龄、民族、化疗前ALT、ABCB1 C3435T(CC/CT/TT)、A1298C(AA/AC/CC、AA/AC+CC)及MTX剂量强度。以上筛选出有意义的变量P均≤0.2。结果见表2。
表2 影响HD-MTX化疗后不良反应单因素分析的P值结果
Tab. 2 Single factor analysis of P value of adverse reactions after HD-MTX chemotherapy

注:1)纳入多因素Logistic回归分析的自变量(单因素分析P≤0.2)。
Note: 1)Independent variable were included in Logistic regression analysis(single factor analysis P≤0.2).
2.3 多因素非条件Logistic回归分析结果
在单因素分析结果上,筛选出P≤0.2及临床上有意义的自变量,采用wald后退法分析肝功能损伤、骨髓抑制、黏膜损伤、胃肠道反应和急性肾损伤的主要影响因素;由于急性肾损伤发生率低及样本量较小,本次研究尚未找到其有意义的影响因素。结果显示肝功能损伤的主要影响因素为年龄、水化量、化疗前ALT和AST;骨髓抑制的主要影响因素为体表面积、MTX剂量强度、化疗前 WBC和 ALP;黏膜损伤的主要影响因素为MTHFR A1298C (AA/AC+CC)及疗程数;胃肠道反应的主要影响因素为 MTHFR A1298C (AA/AC+CC)。结果见表3。
表3 影响 HD-MTX化疗后不良反应的多因素非条件Logistic回归分析结果
Tab. 3 Multivariate Logistic regression analysis of adverse reactions after HD-MTX chemotherapy
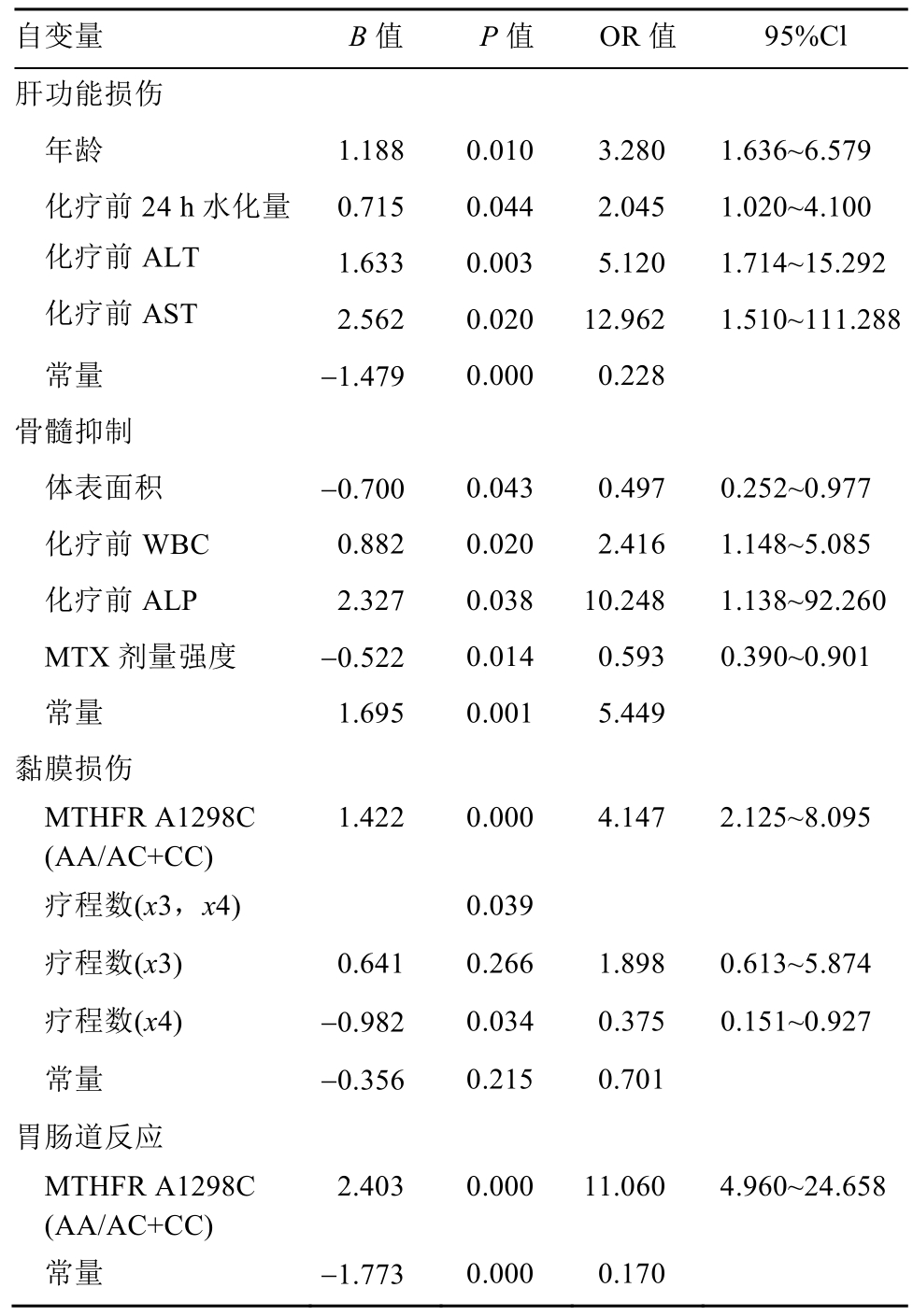
2.4 Logistic预测模型的建立及检验
预测概率公式P=ea/(1+ea);肝功能损伤预测模型 a=-1.479+1.188(年龄)+0.715(化疗前 24 h水化量)+1.633(化疗前ALT)+2.562(化疗前AST),该模型检验:准确度为73.3%,灵敏度为57.9%,特异度为84.6%,ROC曲线下AUC为0.774;骨髓抑制预测模型 a=1.695-0.700(体表面积)+0.882(化疗前 WBC)+2.327(化疗前 ALP)-0.522(MTX剂量强度),该模型检验:准确度为 70.0%,灵敏度为78.1%,特异度为 58.7%,ROC曲线下 AUC为0.762;黏膜损伤预测模型a=-0.356+1.422(MTHFR A1298C)+0.641(x3)-0.982(x4),该模型检验:准确度为70.6%,灵敏度为82.7%,特异度为51.4%,ROC曲线下AUC为0.765;胃肠道反应预测模型a=-1.773+2.403(MTHFR A1298C),该模型检验:准确度为 72.2%,灵敏度为 89.5%,特异度为56.4%,ROC曲线下AUC为0.808。
3 讨论
本研究中肝功能损伤发生率为 42.22%,研究发现其影响因素包括年龄、水化量、化疗前 ALT和AST;其中化疗前AST及ALT异常是引起肝功能损伤的重要危险因素,化疗前AST异常患者比正常患者发生肝功能损伤风险增加约 13倍(OR=12.962),化疗前ALT异常比正常发生肝功能损伤风险增加约5倍(OR=5.120)。有研究报道[10],患者在化疗前若存在病毒性肝炎感染、脂肪性肝炎等肝功能障碍时,常表现为AST和ALT升高,化疗后会加重MTX导致的肝功能损伤程度,提示针对此类患者应待肝功能指标恢复正常再行化疗;儿童患者比成人患者发生肝功能损伤的风险多3倍(OR=3.280),Holmboe等[11]研究发现 MTX 代谢产物 7-OHMTX对肝脏有直接损伤作用,其对肝脏细胞的亲和力要强于其他组织细胞,儿童患者的肝脏器官可能尚未发育完全,其特殊性可能会导致 7-OHMTX在肝内的溶解性下降,延长在体内的作用时间,导致儿童患者肝脏易受损伤,因此在化疗期间应针对儿童患者尽早使用保肝及其他辅助治疗,防止肝损伤发生;儿童或成人患者化疗前24 h水化量<3 000或2 000 mL·m-2发生肝功能损伤的风险是≥3 000或2 000 mL·m-2的2倍(OR=2.045),提示化疗前充分水化量能降低肝功能损伤发生的概率;国内外研究者[12-13]普遍认为ABCB1 C3435T基因多态性与肝功能损伤相关,TT型患者更易发生肝功能损伤,但本研究并未发现其对肝功能损伤的影响,这可能与各基因间相互作用[14]、不同种族间基因型分布频率、治疗方案中MTX剂量、机体的叶酸水平以及环境等错综复杂的因素有关。本研究结果提示对于化疗前AST和ALT异常、化疗前水化量不足及儿童患者应密切观察化疗前与化疗期间的血生化指标,同时定期检查肝功能,若发现异常及时处理。
本研究骨髓抑制发生率为58.33%,位于MTX常见不良反应发生率首位。研究发现其影响因素为体表面积、MTX给药剂量、化疗前WBC和ALP;多因素分析显示化疗前ALP为骨髓抑制的主要影响因素,化疗前ALP异常患者比ALP正常患者发生骨髓抑制风险增加约10倍(OR=10.248),目前关于 ALP升高导致骨髓抑制的机制尚未有相关研究,得此结论可能的原因:①淋巴系恶性肿瘤患者本身ALP值在化疗前可为正常或病理性升高,因此本结论不一定有临床意义;②本研究的 180例患者中,仅12例患者为化疗前ALP异常升高,其中11例发生了骨髓抑制,考虑到样本量的限制,可能是过度放大了此结论,因此需通过扩大样本量进一步验证此结论;MTX给药剂量强度为每增加1 g·m-2,危险程度反而降低约60%(OR=0.593),一般临床认为造成不良反应的危险程度往往跟给药剂量、用药频率及作用时间相关,但有研究表明中性粒细胞减少或血小板减少症并不依赖于MTX给药剂量及 MTX血清浓度[15];Shunsuke等[16]研究表明,对于使用低剂量MTX治疗的类风湿性关节炎患者来说,长时间使用低剂量MTX会增加中性粒细胞减少的严重程度;也可能是由于患者应用MTX剂量过大时,临床有针对性地应用大剂量四氢叶酸钙解救或及时实施预防不良反应的辅助治疗,从而降低不良反应的发生率;化疗前 WBC异常患者比正常患者发生骨髓抑制风险增加约2.5倍(OR=2.416);体表面积较小的患者比体表面积较大的患者不易发生骨髓抑制(OR=0.497);多项研究发现[12,17-18],MTHFR 677TT型患者发生血液学毒性的概率显著高于CC和CT型,但本研究未发现MTHFR C677T与HD-MTX毒性有相关性,与国内廖清船等[19]及国外学者[20]研究结论一致,由于目前MTHFR C677T已被广泛证实与MTX毒性有相关性,因此TT型患者在化疗过程中,医师会在保证 MTX治疗有效性的前提下,有针对性地及时应用 CF解救及其他干预治疗,防止不良反应的发生,从而可能掩盖了MTHFR C677T基因多态性与MTX毒性反应的关系;也可能是由于部分研究者对患者化疗后观察时间长短不同,导致部分患者不良反应记录不完整,从而导致各研究结果不一致。本研究结果提示,对体表面积大、化疗前WBC和ALP异常的患者应密切观察化疗前与化疗期间的血常规,防止化疗后骨髓抑制的发生。
本研究中黏膜损伤和胃肠道反应发生率分别为53.33%和47.78%,研究发现影响这2种不良反应的主要危险因素为 MTHFR A1298C;1298AA型比 AC+CC型患者发生胃肠道反应风险增加 11倍(OR=11.060),发生黏膜损伤的风险增加 4倍(OR=4.147),这与刘晶霞等[18,20]研究结论一致,可能是由于AC/CC型降低了酶活性,从而抑制5,10-亚甲基四氢叶酸还原过程,导致其在体内大量堆积,而5,10-亚甲基四氢叶酸是胸苷酸合成的重要原料之一,参与DNA的合成和修复[21],从而使体内的正常细胞得到及时解救,因此有利于患者对抗MTX的毒性作用,提示携带AA型患者进行化疗时饮食应以清淡易消化的高蛋白食物为主,避免刺激性、坚硬的食物,喝碱性饮料,减少对胃肠道及口腔黏膜的刺激;其次分析结果显示持续化疗≥3次比初次接受化疗的患者发生黏膜损伤的风险降低了约40%(OR=0.375),提示患者进行初次化疗时应提前加强口腔护理以减少口腔黏膜损伤的发生。对于初次化疗未出现黏膜损伤的患者,说明其可能对黏膜损伤有一定耐受性。
本次研究所建立的肝功能损伤、骨髓抑制、黏膜损伤和胃肠道反应的预测模型准确度均>70%,ROC曲线下AUC面积也均>0.75,灵敏度及特异度良好,说明预测模型有一定的临床预测价值,HD-MTX化疗的患者可通过预测模型计算化疗后出现不良反应的概率,当概率>50%,可采用相应干预措施,防止发生不良反应,为MTX临床个体化用药提供理论依据。本研究中急性肾损伤发生率为5.56%,由于其发生率低,发生机制复杂[22],且受样本量限制,本研究未建立其预测模型,还需通过扩大样本量,多中心收集病例,同时增加可影响研究的因素种类,来确定其预测模型。本研究为回顾性研究,样本量小,仅采用回代训练样本对模型进行内部验证,未对模型进行前瞻性的外部验证。多中心、大样本、前瞻性地收集样本,并采用外部验证会使预测模型准确性更高。
REFERENCES
[1] KAPOOR G, SINHA R, ABEDIN S. Experience with high dose methotrexate therapy in childhood acute lymphoblastic leukemia in a tertiary care cancer centre of a developing country [J]. Pediatric Blood Cancer, 2012, 59(3): 448-453.
[2] ASSELIN B L, DEVIDAS M, WANG C, et al. Effectiveness of high-dose methotrexate in T-cell lymphoblastic leukemia and advanced-stage lymphoblastic lymphoma: a randomized study by the Children’s Oncology Group (POG 9404) [J].Blood, 2011, 118(10): 874-883.
[3] SCHMIEGELOW K. Advances in individual prediction of methotrexate toxicity: a review [J]. Br J Haematol, 2009,146(5): 489-503.
[4] BASCH E, PRESTRUD A A, HESKETH P J, et al.Antiemetics: American society of clinical oncology clinical practice guideline update [J]. J Clin Oncol, 2011, 29(31):4189-4198.
[5] RASK C, ALBERTIONI F, BENTZEN S M, et al. Clinical and pharmacokinetic risk factors for high-dose methotrexate-induced toxicity in children with acute lymphoblastic leukemia-agistic regressionanalysis [J]. Acts Oncal, 1998, 37(3): 277-283.
[6] YANG L, XIE R X, WU H, et al. Relationship between ABCB1 genetic polymorphisms and toxicities of methotrexate in patients with non-Hodgkin’s malignant lymphoma [J]. Chin Hosp Pharm(中国医院药学杂志), 2016, 36(22): 1992-1996.
[7] SWERDLOW S H, CAMPO E, HARRIS N L. World Health Organization classification of tumors of haematopoietic and lymphoid tissues [M]. Lyon: IARC Press, 2008: 100.
[8] Hematology Oncology Committee, Chinese Anti-Cancer Association. Chinese guidelines for diagnosis and treatment of acute lymphoblastic leukemia(2016) [J]. Chin J Hematol(中华血液学杂志), 2016, 37(10): 837-845.
[9] 中华医学会儿科学分会血液学组. 《中华儿科杂志》编辑委员会.儿童急性淋巴细胞白血病诊疗建议(第四次修订)[J].中华儿科杂志, 2014, 52(9): 641-644.
[10] WATSON W A, LITOVITZ T L, RODGERS G C, et al.Association of poison control centers toxic exposure surveillance system [J]. Am J Emerg Med, 2005, 23(5):589-666.
[11] HOLMBOE L, ANDERSEN A M, MØRKRID L, et al. High dose methotrexate chemotherapy: pharmacokinetics, folate and toxicity in osteosarcoma patients [J]. British J Clin Pharmacol,2012, 73(1): 106-114.
[12] SUTHANDIRAM S, GAN G G, ZAIN S M, et al. Effect of polymorphisms within methotrexate pathway genes on methotrexate toxicity and plasma levels in adults with hematological malignancies [J]. Pharmacogenomics, 2014,15(11): 1479-1494.
[13] MA C X, SUN Y H, WANG H Y, et al. ABCB1 polymorphisms correlate with susceptibility to adult acute leukemia and response to high-dose methotrexate [J]. Tumor Biol, 2015, 36(10): 7599-7606.
[14] HUANG Z, WANG J X, QIAN J C, et al. Influence of folylpolyglutamate synthetase genetic polymorphism on treatment of methotrexate in acute lymphocytic leukemia patients [J]. Chin Pharm J(中国药学杂志), 2015, 50(17):1536-1540.
[15] KIVITY S, ZAFRIR Y, LOEBSTEIN R, et al. Clinical characteristics and risk factorsfor low dose methotrexate toxicity: a cohort of 28 patients [J]. Autoimmun Rev, 2014,13(11): 1109-1113.
[16] SHUNSUKE M, MICHIHIRO H, TOSHIRO K, et al. Factors associated with myelosuppression related to low-dose methotrexate therapy for inflammatory rheumatic diseases [J].Plos One, 2016, 11(4): e0154744.
[17] CHIUSOLO P, REDDICONTO G, FARINA G, et al. MTHFR polymorphisms’influence on outcome and toxicity in acute lymphoblastic leukemia patients [J]. Leuk Res, 2007, 3(12):1669-1674.
[18] LIU J X, CHEN J P, TAN W, et al. Association between Mthfr gene polymorphisms and toxicity of HDMTX chemotherapy in acute lymphocytic leukemia [J]. J Exp Hematol(中国实验血液学杂志), 2008, 16(3): 488-492.
[19] LIAO Q C, LI X L, LIU S T, et al. Association between the methylenetetrahydrofolate reductase gene polymorphisms and haplotype with toxicity response of high dose methotrexate chemotherapy [J]. Chin J Epidemiol(中华流行病学杂志),2012, 33(7): 735-739.
[20] CHIUSOLO P, GIAMMARCO S, BELLESI S, et al. The role of MTHFR and RFC1 polymorphisms on toxicity and outcome of adult patients with hematological malignancies treated with high-dose methotrexate followed by leucovorin rescue [J].Cancer Chemother Pharmacol, 2012, 69(3): 691-696.
[21] PAKAKASAMA S, KANCHANAKAMHAENG K,KAJANACHUMPOL S, et al. Genetic polymorphisms of folate metabolic enzymes and toxicities of high dose methotrexate in children with acute lymphoblastic leukemia [J].Annal Hematol, 2007, 86(8): 609-611.
[22] YAN N, MA J J, XIA F, et al. Serious acute kidney injury induced by high-dose methotrexate chemotherapy in one patient [J]. Chin J New Drugs Clin Rem(中国新药与临床杂志), 2017, 36(3): 173-175.