高尿酸血症(hyperuricemia,HUA)是以体内嘌呤代谢紊乱、尿酸增高为特征的代谢性疾病。近年来,随着人们生活水平和饮食结构的改变,HUA的发病率也急剧增加,目前已有 1.2亿以上的患者[1-2]。由于大多数 HUA患者前期无任何特异性症状,患者机体内发生的一系列代谢紊乱往往被忽略[3],包括脂肪、氨基酸及糖代谢异常等。研究表明,HUA不仅可能导致痛风,还与高血糖、高血脂、高血压、肥胖、冠心病、肾病等疾病的发生发展关系密切[4-6],其中 HUA与血脂异常的相关性尤为引人关注[7-9],但两者相互作用的机制尚未有明确阐释。苯溴马隆是临床上常用降尿酸药物,可抑制肾小管对尿酸的吸收,增加尿酸的排泄,快速降低血尿酸(serum uric acid,SUA)水平[10]。但苯溴马隆降低 SUA是否会直接或间接改变HUA患者的血脂水平,目前鲜有报道。脂质组学为脂质代谢疾病的预防、控制及诊断,脂质生物标志物、药物靶点的鉴定以及药物的研发提供了有力的手段。因此,本研究从脂质代谢的角度对苯溴马隆干预HUA大鼠作用机制进行深入研究,采用 UPLC-Q-TOF/MS技术检测大鼠血清中小分子内源性脂质代谢物的变化,寻找差异代谢物,分析相关代谢通路,得到苯溴马隆干预HUA的代谢机制网络图,更为系统、全面地揭示其作用机制,探析降低SUA与改善血脂代谢紊乱的相关性。
1 材料
1.1 仪器
Xevo G2-S Q-TOF/MS型超高效液相色谱-四极杆飞行时间质谱联用仪(UPLC-Q-TOF/MS,美国Waters公司);GL-21M型低温高速离心机(上海卢湘仪公司);ZH-2BLENDER型旋涡仪(天津药典标准仪器厂);Milli-Q纯水机(美国Millipore公司)。
1.2 试剂与试药
苯溴马隆(德国赫曼大药厂,批号:1304333);SUA 试剂盒、甘油三酯(Triglyceride,TG)试剂盒(南京建成生物工程研究所,批号:20170316、20170316);D-果糖(AMRESCO);甲酸、醋酸铵、氯仿、乙醇(分析纯,北京化工厂);甲醇、乙腈、异丙醇(色谱纯,美国Fisher Scientific公司);超纯水(自制)。
1.3 动物
SD大鼠,♂,体质量(240±20)g,购自北京维通利华实验动物中心,动物合格证号:SCXK(京)2012-0001。
2 方法
2.1 动物模型的建立
30只SD大鼠适应性饲养5 d后,按体质量随机分为空白组、模型组和苯溴马隆组,每组10只,饲喂普通饲料。模型组和苯溴马隆组饮 10%果糖水,空白组饮去离子水,3组动物均自由饮食,饲料和水(或果糖水)每天更换1次,并记录饮水量,连续造模 3周。同时苯溴马隆组每天灌胃给予2 mg·mL-1苯溴马隆 1 mL,空白组和模型组灌胃给予同体积生理盐水。
造模期间,每隔 7 d眼静脉取血一次,每次1 mL,4 ℃下离心 15 min(4 000 r·min-1),取血清于-80 ℃保存。
2.2 生化指标测定
从-80 ℃冰箱中取出血清,解冻至室温,分别按尿酸试剂盒、TG试剂盒说明书测定各组动物SUA值和TG值。
2.3 脂质代谢组学分析方法
2.3.1 血清样本的前处理 从-80 ℃冰箱中取出血清,解冻至室温,每份血清取80 μL置于1.5 mL离心管中,加入320 μL氯仿-甲醇(3∶1),涡旋2次,每次 15 s,室温下离心 10 min(13 000 r·min-1),取上清液10 μL注入液质联用仪进行分析。取造模21 d的血清样品50 μL于5 mL离心管中,混匀,得质控样品,后续处理同上述方法。
2.3.2 色谱条件 ACQUITY CSH C18色谱柱(2.1 mm×100 mm,1.7 μm),流动相 A为乙腈-水-甲酸(60∶40∶0.1)+10 mmol·L-1甲酸铵,流动相 B为异丙醇-甲醇-甲酸(90∶10∶0.1)+10 mmol·L-1甲酸铵,流速为0.3 mL·min-1,柱温为40 ℃,梯度洗脱(0~3.1 min,40%→43%B;3.1~4.1 min,43%→70%B;4.1~4.3min,70%→73%B;4.3~ 8.0 min,73%→77%B;8.0~8.1 min,77%→40%B;8.1~10.0 min,40%B)。
2.3.3 质谱条件 质谱系统采用电喷雾离子源,采用正、负离子模式检测,扫描范围m/z 50~1 200;毛细管电压:2.5 kV;离子源温度:120 ℃;雾化气温度:450 ℃(正模式),400 ℃(负模式);锥孔气流速:20 L·h-1(正模式),50 L·h-1(负模式)。
2.3.4 潜在生物标记物的发现与鉴定 使用Markerlynx软件(Masslynx V4.1)将被测血样在正、负离子检测模式下获得的原始数据进行数据格式转化,峰识别、峰滤过、峰对齐。最终获得包括质荷比(m/z),保留时间(RT)和峰强度的二维数据阵。应用 80%规则进行匹配后缺失值滤过,即滤掉每个变量组里有 80%以上数据缺失值的变量。应用SIMCA-P 13.0.3软件(Umctrics Sweden)对样品进行分组之前,对数据进行Pareto处理。
标准化数据导入SIMCA-P 13.0.3软件进行多变量数据分析[11],首先采用主成分分析中的无监督的模式识别方法(PCA)进行数据分析,考察各组数据的聚类结果。然后选用有监督的模式识别方法-正交偏最小二乘法判别分析(OPLS-DA)寻找组间观测值的最大差别,鉴定对分类有表征意义的生物标志物。分析结果以二维得分图(Scores plot)和散点图(S-Plot图)形式表示,其中 VIP(variable influence in the projection)值>1.0被认为是该变量对模型有较大的影响,为精确评价这些潜在标志物的变化,对它们在各组的峰面积进行手动积分,然后采用独立样本t检验筛选P<0.05的数据得到有意义的变量[12]。最后将有意义的变量与HMDB(http://www.hmdb.ca/)和 LIPID MAPS(http://www.lipidmaps.org/)等数据库匹配结合,并参照有关文献最终确定潜在生物标记物[13]。
2.3.5 差异代谢物相关代谢通路分析 为了筛选和鉴别出对HUA有显著影响的代谢通路,进一步识别和可视化苯溴马隆对HUA大鼠代谢途径的影响。将已鉴定的差异代谢物输入 MetPA (http://metpa.metabolomics.ca./)数据库,测定差异代谢物与HMDB和KEGG匹配,采用鼠类数据库进行代谢通路富集分析和拓扑分析[14]。通过上述分析对苯溴马隆改善这些受到HUA干扰的代谢通路可能的生物学影响因子进行评估。
3 结果
3.1 生化指标检测结果
与空白组比较,在实验期间模型组的SUA和TG 显著上升(P<0.01),说明造模成功。苯溴马隆干预7 d后,SUA和TG指标开始降低并且逐渐回调到正常水平,这表明苯溴马隆对 HUA的 SUA及TG均有一定降低作用,结果见表1。
3.2 血清样品的代谢轮廓分析
采用 UPLC-Q-TOF/MS技术进行样本分离和数据采集,ESI+、ESI-模式下各组典型的总离子流基峰强度色谱图见图1,可以发现模型组与空白组的轮廓明显不同。为保证数据的可靠性,在数据采集过程中,每间隔 6个样品使用质控样品进样一次,以监测采集系统的稳定性。
3.3 模型构建的多元统计分析结果
为更加形象、确切地说明模型组与空白组之间的差异,对不同造模时间的空白组和模型组得到的数据进行多元统计分析,用PCA和OPLS-DA对Markerlynx导出的数据进行分型,建立PCA模型和OPLS-DA模型,并用参数R2和Q2对模型进行检验。造模 21 d 时,各模型参数 R2>0.4、Q2>0.4,表明所建模型具有很好的预测能力和可靠性,适用于解释2组之间的代谢差异和发现2组之间的差异代谢物。为明确HUA的发病进程,抑制其向其他疾病的转化,建立造模不同时间点的 PCA得分图见图2,图中每个点代表一个样品,样品之间的聚集代表不同时间点特定的代谢模式。在果糖诱导之后,模型组开始的点明显与诱导之前的点偏离,说明果糖诱导大鼠的代谢网络发生了很大的扰动,且造模7 d与空白组存在重叠部分,随着造模时间的延长,模型组越来越远离空白组,因此选择造模21 d数据进行后续分析。S-Plot图中每个点代表样本的特征离子,离中心越远,代表性越强,根据造模 21 d的 OPLS-DA得分图和S-Plot图可知,造模21 d时模型组与空白组得到较好的区分,见图3。
3.4 给药后的多元统计分析结果
苯溴马隆干预21 d后,各组血清样品在ESI+、ESI-模式下获得的数据经过校正和归一化后,最终生成二维数据阵,将处理好的数据导入 SIMCA-P 13.0.3软件,经过中心化和帕累托变换(par-scaled)的预处理,标准化后进行PCA分析,对差异代谢物进一步进行t检验。二维 PCA得分图见图 4,结果显示3组具有区分的趋势。
为区别更多的离子峰进行 PLS-DA分析,结果表明在ESI+模式下R2X=0.697、Q2Y=0.960,ESI-模式下 R2X=0.427、Q2Y=0.896,表明模型具有很好的预测能力和可靠性,结果见图5,模型组、空白组和苯溴马隆组均有很好的分离。
3.5 潜在生物标记物的发现与鉴定
经 PLS-DA分析,相应的载荷图用于潜在生物标记物的筛选,载荷图上的点代表意义与S-Plot图相似。结果显示离原点越远的离子对分类有更大区分能力,即可能是潜在生物标记物,见图6。选 VIP值>1的差异变量(共筛选出110个变量),再采用t检验,剔除P>0.05的数据后,共有44个离子被进一步纳入有意义的变量。经鉴定,这些变量有些是同一种物质。通过物质合并,剩余变量数目进一步减少。筛选通过 VIP值、t检验和HMDB及LIPID MAPS数据库检索后初步得到的生物标记物。
表1 不同造模时间大鼠血清中SUA和TG测定结果的比较(n=9,x± s )
Tab. 1 Comparison of SUA and TG at different modeling time points(n=9,x± s )

注:与空白组比较,1)P<0.05,2)P<0.01;与模型组比较,3)P<0.05,4)P<0.01。
Note: Compared with the blank group, 1)P<0.05, 2)P<0.01; compared with model group, 3)P<0.05, 4)P<0.01.
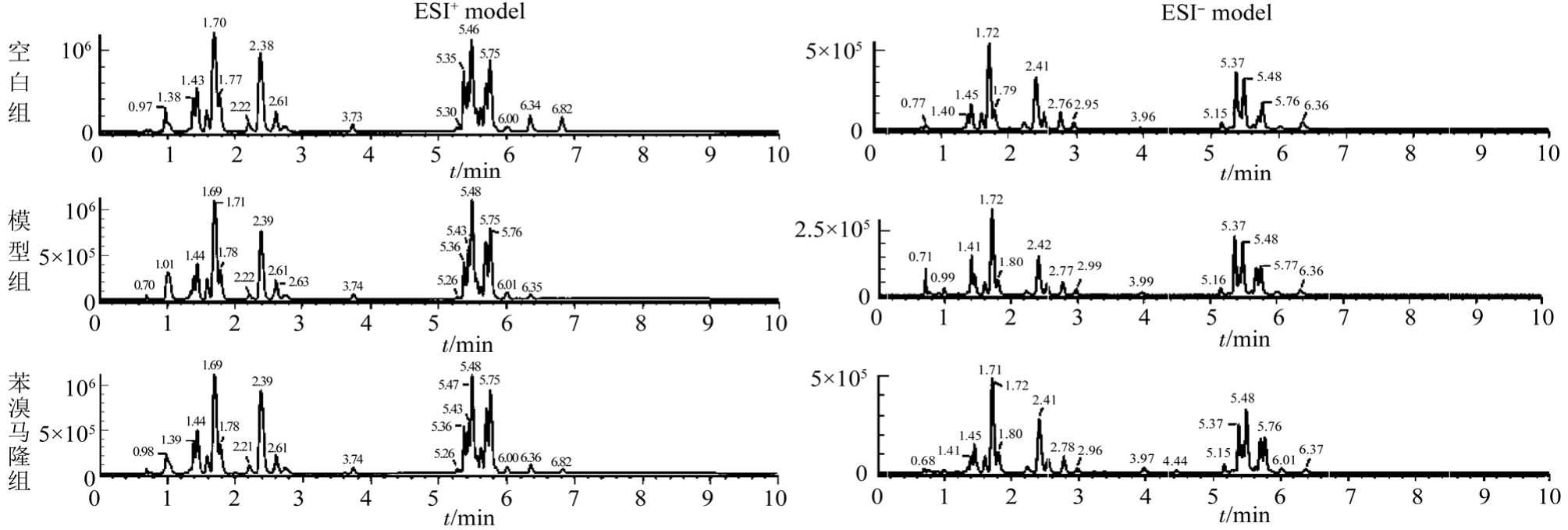
图1 ESI+、ESI-模式下的基峰强度色谱图
Fig. 1 Base peak intensity chromatograms in ESI+ and ESI- model
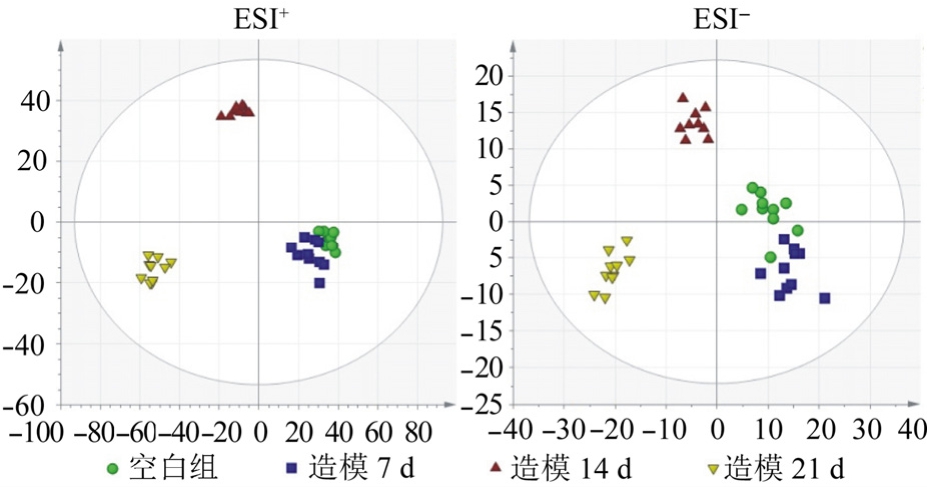
图2 不同造模时间的PCA得分图
Fig. 2 The PCA scores plot on different time points

图3 造模 21 d时空白组与模型组的 OPLS-D得分图和S-Plot图
Fig. 3 The OPLS-DA scores plot and S-Plot on time point 21 d in ESI+ model and ESI- model

图4 血清脂质代谢物的PCA得分图
Fig. 4 The The PCA scores plot of serum lipid metabolite

图5 血清脂质代谢物的PLS-DA得分图
Fig. 5 The OPLS-DA scores plot of serum lipid metabolite

图6 血清脂质代谢物的载荷图
Fig. 6 The Load diagram results of serum lipid metabolite
经鉴定,共获得 20个与苯溴马隆干预治疗HUA相关的潜在生物标记物,包括磷脂酰胆碱(phosphatidylcholine,PC)13个,溶血性磷脂酰胆碱(lysophosphatidylcholine,LPC)3个,鞘脂类(sphingolipids,SM)2个,胆固醇酯类(cholesterol esters,CE)1 个,TG 1 个。PC(16∶0/18∶1)、PC(16∶0/20∶4)、PC(18∶0/22∶6)、PC(18∶1/18∶2)、PC(36∶1)、PC(18∶0/16∶0)、PC(20∶4/16∶0)、PC(20∶3/18∶0)、PC(18∶1/22∶4)、PC(18∶0/22∶6)、PC(16∶0/18∶3)、LPC(16∶1)、TG(14∶1/18∶0/20∶5)在 HUA 大鼠体内显著升高(P<0.05);SM(42∶3)、SM(d18∶1/16∶0)、LPC(16∶0)、LPC(18∶0)、CE(20∶4)在 HUA 大鼠体内明显降低(P<0.05),而上述物质在苯溴马隆干预治疗后开始回到正常水平,说明苯溴马隆在降低SUA水平的同时,可以改善由于HUA导致的大鼠体内脂质紊乱现象,进一步说明尿酸与脂质紊乱存在相关性。这些物质名称以及在模型组、正常组和苯溴马隆组大鼠体内浓度水平的变化情况见表2。
差异的代谢物鉴定以在正离子模式下 m/z 524.433 92为例。在正离子模式下,该代谢物产生m/z 524.433 92 [M+H]+准分子离子峰。在负离子模式下,其产生m/z 568.366 7 [M+HCOO]-准分子离子峰。该代谢物的MS/MS谱显示该代谢物有明显的特征离子(m/z 506.362 09,m/z 184.072 10,m/z 104.106 76),推测其为LPC类化合物。根据其高分辨 MS谱,获得其[M+H]+可能的元素组成为C26H55NO7P+,根据其裂解规律,推测其为LPC(18∶0),与文献[15]中的二级质谱图比对,发现两者具有相同的裂解方式,因此推断其为LPC(18∶0)。该代谢物的(+)ESI-MS谱、MS/MS谱及裂解途径见图7。
表2 苯溴马隆干预21 d后HUA大鼠血清的潜在生物标物
Tab. 2 Identification results of different metabolites and the changes after intervened by benzbromarone 21 d


图7 代谢物LPC(18∶0)的(+)ESI-MS谱、MS/MS谱及裂解途径
Fig. 7 ESI-MS spectra MS/MS spectrometry and cracking pathways of metabolite LPC(18∶0)(+)
3.6 差异代谢物的通路分析
通过代谢途径浓缩和拓扑分析[16-17],分析评估可能的生物扰动的影响途径,结果见图8和表3。表3中给出了相关6条通路分析的详细结果,综合 Raw p、Holm p和 FDR(false discovery rate)和Impact值结果,将代谢通路的重要值界定在0.05,当某一条代谢通路的重要值>0.05时,认为其为潜在的靶标代谢通路。分析结果显示,苯溴马隆治疗果糖诱导HUA大鼠的血清脂质代谢紊乱主要与甘油磷脂代谢通路相关,也可能与类固醇类合成、花生四稀酸代谢相关,但本研究中相关性不明显,可在后续研究中去探析。
表3 MetPA代谢通路分析结果
Tab. 3 The pathway impact with MetPA


图8 苯溴马隆治疗HUA大鼠相关代谢通路分析图
Fig. 8 Analysis of related metabolic pathways in rats with HUA treated by benzbromo Malone
4 讨论
近10多年来,大多数流行病学研究提示高果糖饮食与HUA发病率呈正相关[18]。果糖吸收后,在肝脏被快速磷酸化为 1-磷酸果糖,此过程消耗了大量三磷酸腺苷,并产生大量一磷酸腺苷和肌苷酸,后两者代谢生成次黄嘌呤和黄嘌呤,最终在黄嘌呤氧化酶作用下转化为尿酸。肝脏中富含的黄嘌呤氧化酶是黄嘌呤代谢为尿酸的关键限速酶。有研究发现 10%果糖饮水可明显诱导大鼠SUA水平升高和肝脏中黄嘌呤氧化酶活性增加,提示果糖诱导大鼠HUA模型存在着尿酸产生增加的病理变化[19]。因此,高果糖饮食诱导的代谢综合征动物模型也已被广泛用于HUA相关研究[20-21]。本研究中,给予大鼠 10%果糖溶液连续饮用 7 d后,大鼠SUA、TG开始均明显升高;给予临床治疗HUA常用药物苯溴马隆后,大鼠SUA、TG均明显降低。由此可见,连续饮用 10%果糖溶液可成功诱导大鼠HUA模型,该结果与文献报道基本一致。
在正常的生理条件下,机体内C(16∶0、16∶1、18∶0、18∶1)脂肪酸碳链的量并不大,但是体内代谢紊乱时它们会聚集并产生明显的病理特征。有研究发现HUA使得体内C(16∶0、16∶1、18∶0、18∶1)脂肪酸碳链在甘油磷脂中大量存在,而它们在合成和代谢的过程中会在相关酶的作用下产生脂类代谢物;HUA也可以通过促增殖和促炎作用诱发炎症,导致脂类代谢异常[22]。LPC是PC在磷脂酶A2或者卵磷脂-胆固醇酰基转移酶水解作用下生成的,并产生花生四烯酸等脂肪酸类物质,而体内类花生酸代谢物是炎症相关的重要物质[23]。磷脂含量及脂肪酸类的变化可很好反映疾病状态下体内的脂质代谢紊乱,是反映疾病机制的一个非常重要的生物学指标[24]。本研究表明,模型组的花生四烯酸量显著高于空白组,PC和PE作为花生四烯酸的前体物质,其含量亦增加。而给予苯溴马隆后,SM(42∶3)、SM(d18∶1/16∶0)、LPC(16∶0)、LPC(18∶0)、CE(20∶4)在 HUA 大鼠体内明显降低,说明苯溴马隆不仅可促进尿酸排泄,还可能直接或间接影响HUA大鼠体内脂类物质代谢调节过程,促使HUA大鼠的血脂代谢紊乱趋向正常状态。
另外,本研究发现HUA大鼠体内主要是甘油磷脂类、脂肪酸类等物质异常变化。因此,SUA异常增高者,需注意检测血清脂质及脂肪酸浓度的变化,避免或预防血脂代谢紊乱或高血脂等其他疾病的发生。
REFERENCES
[1] MAO Z M, LI C G. Key problems in the prevention and treatment of hyperurlcemia [J]. Chin J Endocrinol Metab(中华内分泌代谢杂志), 2011, 27(7): 543-547.
[2] 信息速传: 无症状高尿酸需用降酸药[J]. 中国社区医师,2009, 25(13): 31.
[3] GONCALVES J P, OLIVEIRA A, SEVERO M, et al. Crosssectional and longitudinal associations between serum uric acid and metabolic syndrome [J]. Endocrine, 2012, 41(3):450-457.
[4] LIAO Y Q. Hyperuricemia and its clinical significance of laboratory tests [J]. Clin Lab J(临床检验杂志), 2013, 2(2):334-339.
[5] KUWABARA M. Hyperuricemia, cardiovascular disease, and hypertension [J]. Pulse(Basel), 2016, 3(3/4): 242-52.
[6] BORGHI C, ROSEI E A, BARDIN T, et al. Serum uric acid and the risk of cardiovascular and renal disease [J]. J Hypertens, 2015, 33(9): 1729-1741.
[7] FIEHN O. Combining genomics, metabolome analysis, and biochemical modeling to understand metabolic networks [J].Comp Funcr Genomics, 2001, 2(3): 155-168.
[8] MA W F, MA Z G, WANG W S, et al. Liquid chromatography mass spectrometry-based research on plasma metabonomics of patiens with hypeiuricemia [J]. Chongqing Med(重庆医学),2013, 42(2): 176-179.
[9] YANG Q C. Metabonimics characteristics of hyperuricemia and common TCM constitution type in middle-aged and old people [D]. Guangzhou: Guangzhou Univ Chin Med, 2013.
[10] MATHERS L, BAILEY M. Enzyme deletions and essential fatty acid metabolism in cultured cells [J]. J Biol Chem, 1975,250(3): 1152-1153.
[11] HUA Y L. Study the metabolite and metabolic pathways of inflammation induce by LPS and intervention of Angelica sinensis volatile oil [D]. Lanzhou: Gansu Agricultural University, 2014.
[12] 陈新谦, 金有豫, 汤光. 新编药物学[M]. 第 17版, 北京:人民卫生出版社. 2011: 211-212.
[13] SUN H , YANG Z Q, LI B H, et al. Study on metabonomic data parallel processing based on LC/MS [J]. J Chin Mass Spectr Soc(质谱学报), 2015, 36(6): 535-542.
[14] TANG X H, XU G L, LI B T, et al. Metabonomics study on the urine in rat treated by water extract of Zanthoxylumschinifolium siebet zucc [J]. Chin J Exp Med Formul(中国实验方剂学杂志), 2010, 16(5): 127-131.
[15] YANG L N, WEN J, SUN Y, et al. Metabonomic study on the anti-liver injury effect of Si-Ni-San on rats by using UPLC-MS/MS [J]. Acta Pharm Sin, 2014, 49(3): 368-373.
[16] A J Y. Analysis of metabolomic data: principal component analysis [J]. Chin J Clin Pharmacol Ther(中国临床药理学与治疗学), 2010, 15(5): 481-489.
[17] ZHOU T, LI J Y, MA Y, et al. Metabolic pathway analysis and application based on the database and integrated tool of omics[J]. J Int Pharm Res(国际药学研究杂志), 2015, 42(5):587-592, 600.
[18] BOMBACK A S, DEREBAIL V K, SHOHAM D A, et al.Sugar-sweetened soda consumption, hyperuricemia, and kidney disease [J]. Kidney Int, 2010,77(7): 609-616.
[19] CHEN G, JIA P. Effect of allopurinol on serum level of uric acid and intestinal expression of glucose transporters in rats with fructose-induced hyperuricemia [J]. Chin Pharmacol Bull(中国药理学通报), 2017, 33(4): 469-474.
[20] LIU X Q, ZHANG B, LIN Z J, et al. Pathogenesis of hypertriglyceridemia with hyperuricemia and hyperglycemia induced by high fructose [J]. Chin J Pathophysiol(中国病理生理杂志), 2009, 25(4): 651-655.
[21] DONG X Q. Protection of rhein on kidney injury in fructoseinduced hyperuricaemia rats [J]. Strait Pharm J(海峡药学),2016, 28(3): 42-44.
[22] VANCE J E, VANCE D E. Metabolic insights into phospholipid function using gene-targeted mice [J]. J Biol Chem, 2005(280): 10877-10880.
[23] 陈靖刚, 于俊青, 舒勤, 等. 老年人高尿酸血症与代谢综合征相关因素研究进展[J]. 河北医药, 2012, 34(3): 432-434.
[24] 袁鹰, 王正春, 王秀美. 血清游离脂肪酸对高尿酸血症代谢的影响[J]. 山东医药, 2006, 46(31): 53-54.