黄酮类化合物在天然产物中分布广泛,是植物体内非常重要的次级代谢产物,具有抗氧化、抗炎、抗肿瘤、抗菌、抗病毒、抗动脉粥样硬化以及降压等多种生理活性[1-4]。黄芩素-7-甲醚(化学名:5,6-二羟基-7-甲氧基黄酮;英文名:negletein)是黄芩素的七位羟基甲基化产物,具有与黄芩素相同的生物活性,但其代谢稳定性和水溶性等药动学参数均较黄芩素有所提高[5]。
研究表明,黄芩素-7-甲醚具有抗炎[6]和神经保护[7]的作用。本课题组前期从大苞雪莲提取分离得到黄芩素-7-甲醚,体外活性筛选实验结果表明黄芩素-7-甲醚对缺氧损伤所致的 PC12细胞活力下降和乳酸脱氢酶(lactate dehydrogenase,LDH)漏出均有明显的抑制作用[8]。本研究进一步探讨黄芩素-7-甲醚对缺氧PC12细胞的保护作用及机制,为黄芩素-7-甲醚的缺氧损伤防治研究提供理论和实验依据。
1 仪器与试剂
1.1 仪器
MCO-15AC二氧化碳细胞培养箱(美国Thermo Revco公司);Spectramax i3多功能酶标仪(美国Molecular Devices公司);JY92-2D超声波细胞粉碎仪(宁波新芝生物科技股份有限公司);BP210S电子天平(荷兰赛多利斯有限公司);TH4-200倒置相差显微镜(日本 Olympus公司);Microfuge 22R 台式微量冷冻离心机(美国Beckman Coulter公司);ABI 7300实时定量PCR仪(美国 Applied Biosystems)。
1.2 细胞株
大鼠肾上腺嗜铬细胞瘤单克隆细胞系 PC12细胞购自上海中科院细胞库。
1.3 药物与试剂
黄芩素-7-甲醚按照本实验室报道的方法制备[8];芦丁(陕西慈缘生物技术有限公司,批号:20121106);MTT(批号:20130301)和 ECL 超敏发光液(批号:20170705)购自 Sigma公司;活性氧(reactive oxygen species,ROS,批号:20130902)、LDH(批号:20130619)、丙二醛(malondialdehyde,MDA,批号:20130625)、超氧化物歧化酶(superoxide dismutase,SOD,批号:20130705)和过氧化氢酶(catalase,CAT,批号:20131112)检测试剂盒均购于南京建成生物工程研究所;RNAiso Plus(批号:AK8303)、PrimeScriptTM RT reagent Kit(批号:DRR037A)、SYBR Premix EX Taq(Perfect Real time)(批号:AK4401)以及Nrf2、血红素氧合酶-1 (heme oxygenase-1,HO-1)和GAPDH引物均由宝生物工程(大连)有限公司提供;Nrf-2(批号:170114)和 HO-1(批号:GR123437-12)兔单克隆抗体购自Abcam公司;β-actin小鼠单克隆抗体(批号:170114)、山羊抗小鼠IgG/辣根酶标记抗体(批号:171792)和辣根标记山羊抗兔 IgG(批号:171651)购自北京中杉金桥生物技术有限公司。
2 方法
2.1 PC12细胞的培养
采用含有10%胎牛血清、100 U·mL-1青霉素和 100 U·mL-1硫酸链霉素的 DMEM培养基,于5% CO2、饱和湿度、37 ℃条件下在三气培养箱中培养,每隔48 h更换新的培养液。细胞大约铺满80%皿底后传代。
2.2 MTT测定细胞活力
将对数生长期的PC12细胞接种于96孔板中,计数后将接种密度调整为 1×105·mL-1,每孔100 μL,置于三气培养箱中正常培养24 h。更换培养基,加入 0.01,0.1,1,10,100 μmol·L-1的黄芩素-7-甲醚预处理细胞1 h,每个浓度设6个复孔,分别在常氧,5% CO2和95% N2的缺氧条件下培养48 h,弃上清,用无菌的PBS漂洗1次,每孔加入 20 μL MTT(终浓度为 0.5 g·L-1),继续培养 4 h后每孔加入100 μL DMSO,振荡10 min至蓝色晶体完全溶解,在570 nm波长下测定吸光度(λ),筛选黄芩素-7-甲醚的最佳药物浓度。
2.3 LDH、MDA和抗氧化酶活力测定
细胞接种于90 mm培养皿中,随机分为正常对照组、缺氧模型组、芦丁组和黄芩素-7-甲醚组,缺氧处理同“2.2”项下方法。实验结束后,收集100 μL培养基上清液,根据LDH试剂盒说明书测定LDH活性。然后弃去培养基,并用冷的PBS漂洗1次,1 000×g离心5 min收集细胞,加入0.5 mL PBS进行匀浆,将匀浆 8 000×g低温(4 ℃)离心15 min后取上清,根据试剂盒说明书测定MDA、SOD和CAT水平。
2.4 细胞内ROS测定
将对数生成期的PC12细胞接种于96孔板中,缺氧处理结束后,弃掉培养基,用无菌的PBS清洗一遍,加入含有100 μmol·L-1 DCFH-DA无血清培养基,37 ℃下孵育30 min,预先原位装载DCFH探针,采用酶标仪以488 nm激发波长,525 nm发射波长,检测各孔荧光值。胞内ROS水平用正常对照组百分比表示。
2.5 RT-PCR
采用RNAiso Plus试剂提取细胞总RNA,并将其逆转录为cDNA。然后进行荧光定量PCR扩增,反应体系为20 μL,扩增条件为95 ℃预变性30 s,随后进入以下40个循环:95 ℃反应30 s,60 ℃退火31 s。使用GAPDH作为内参,引物序列如下:Nrf2, Forward 5'-GAGACGGCCATG ACTGAT-3',Reverse 5'-GTGAGGGGATCGATG AGTAA-3';HO-1,Forward 5'-AGGTGCACATCCG TGCAGAG-3',Reverse 5'-TCCAGGGCCGTATAG ATATGGTACA-3';GAPDH,Forward 5'-GCACAG TCAAGGCTGAGAATG-3',Reverse 5'-ATGGTGG TGAAGACGCCAGTA-3'。结果以 2-ΔΔCt表示。
2.6 Western blot
采用 RIPA裂解液裂解细胞,提取总蛋白,BCA法测定蛋白含量。蛋白样品中加入 4×蛋白上样缓冲液,100 ℃沸水煮 15 min,制备好的蛋白样品存于-20 ℃备用。进行Western blot时,取30 μg样品上样,采用5% SDS-PAGE浓缩胶,10%SDS-PAGE分离胶进行分离,湿法将蛋白转至PVDF膜上,用5%脱脂牛奶封闭2 h后,加入一抗,包括Nrf2(1∶500)、HO-1(1∶500)和β-actin(1∶1 000),4 ℃过夜,用TBST缓冲液漂洗3次,每次10 min。加入二抗,除β-actin蛋白使用山羊抗小鼠IgG/辣根酶标记抗体(1∶2 000稀释),其余均用辣根标记山羊抗兔IgG(1∶5 000稀释),室温孵育2 h,化学发光法显色,Tanon-4200SF全自动数码凝胶图像分析系统曝光,灰度值用 Image-Pro Plus 6.0软件扫描测定。
2.7 统计学处理
实验数据均用x± s 表示,并采用 SPSS 19.0统计软件对数据中各组之间进行one-way ANOVA统计学分析,P<0.05表示差异有统计学意义。
3 结果
3.1 黄芩素-7-甲醚对正常PC12细胞活力的影响
与正常对照组相比(细胞存活率为 100%),黄芩素-7-甲醚各浓度处理组 PC12细胞活力差异均无统计学意义,表明黄芩素-7-甲醚在该浓度范围内对PC12细胞无毒性作用,结果见图1A。
3.2 黄芩素-7-甲醚对缺氧PC12细胞活力的影响
与正常对照组相比(细胞存活率为 100%),缺氧模型组PC12细胞活力显著下降(P<0.01),仅为62.26%,表明缺氧环境明显抑制了 PC12细胞活力。与缺氧模型组比较,经黄芩素-7-甲醚预处理后,各组活力均显著升高(P<0.05或P<0.01),并呈现出一定的剂量依赖性。当黄芩素-7-甲醚终浓度为1 µmol·L-1时,细胞存活率最高,表明在该浓度下,黄芩素-7-甲醚对缺氧PC12细胞保护作用最强,因此后续实验均在该浓度下进行。结果见图1B。

图1 黄芩素-7-甲醚对正常和缺氧PC12细胞活力的影响(n=6,x± s )
与正常对照组相比,1)P<0.01;与缺氧模型组相比,2)P<0.05,3)P<0.01。
Fig. 1 Effect of negletein on cell viability of PC12 cell in normoxic and hypoxia condition(n=6,x± s )
Compared with normal control group, 1)P<0.01; compared with hypoxia model group, 2)P<0.05, 3)P<0.01.
3.3 黄芩素-7-甲醚对缺氧PC12细胞LDH漏出的影响
与正常对照组比较,缺氧模型组培养基中LDH活性显著升高(P<0.01)。与缺氧模型组比较,黄芩素-7-甲醚组培养基中 LDH活性显著降低(P<0.01),说明黄芩素-7-甲醚能够维持细胞膜的完整性,减轻缺氧对PC12细胞的损伤,结果见图2。

图2 黄芩素-7-甲醚对缺氧 PC12细胞 LDH漏出的影响(n=6,x± s )
与正常对照组相比,1)P<0.01;与缺氧模型组相比,2)P<0.01。
Fig. 2 Effect of negletein on hypoxia-induced LDH leakage in PC12 cells(n=6,x± s )
Compared with normal control group, 1)P<0.01; compared with hypoxia model group, 2)P<0.01.
3.4 黄芩素-7-甲醚对缺氧 PC12细胞 MDA 和ROS水平的影响
与正常对照组比较,缺氧模型组细胞中MDA和 ROS水平显著升高(P<0.01)。与缺氧模型组相比,黄芩素-7-甲醚组细胞中MDA和ROS水平显著降低(P<0.01),结果见图3。
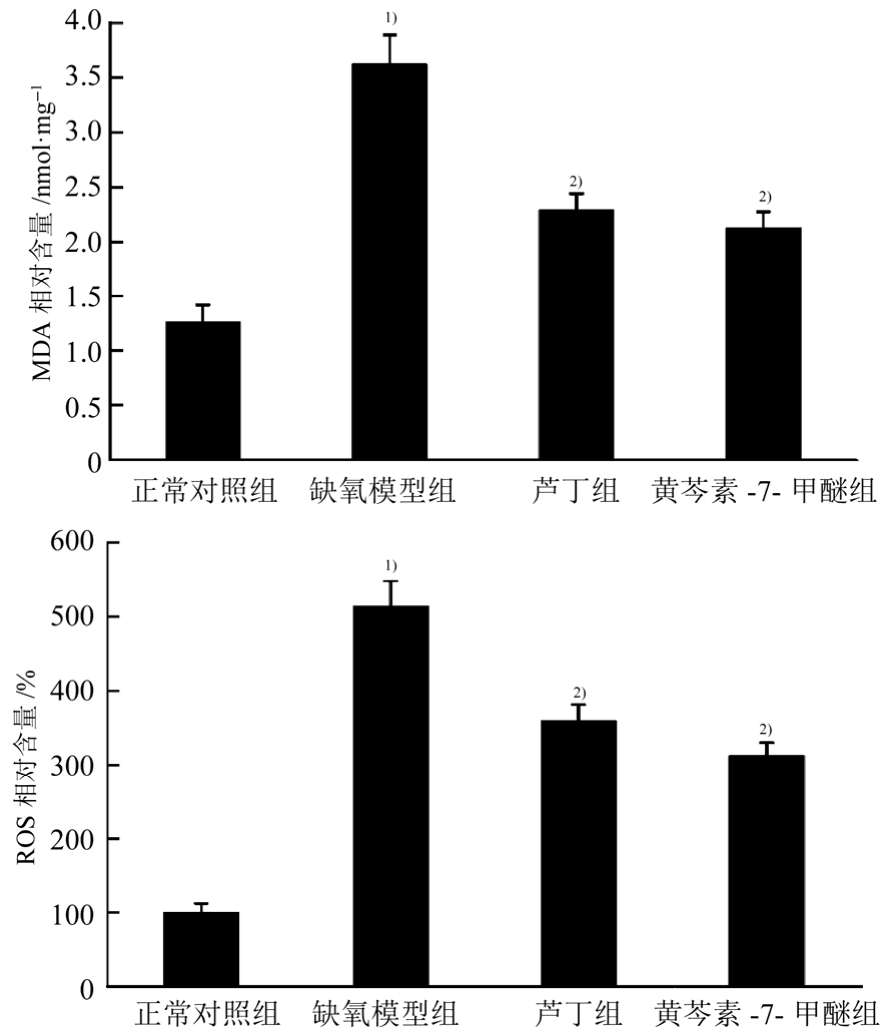
图3 黄芩素-7-甲醚对缺氧PC12细胞中MDA和ROS含量的影响(n=6,x± s )
与正常对照组相比,1)P<0.01;与缺氧模型组相比,2)P<0.01。
Fig. 3 Effect of negletein on MDA content and ROS level in PC12 cells under hypoxia(n=6,x± s )
Compared with normal control group, 1)P<0.01; compared with hypoxia model group, 2)P<0.01.
3.5 黄芩素-7-甲醚对缺氧 PC12细胞抗氧化酶活力的影响
与正常对照组比较,缺氧模型组细胞中 SOD和 CAT活性显著降低(P<0.01),而黄芩素-7-甲醚预处理能够逆转这些变化,显著提高抗氧化酶的活力(P<0.01)。结果见图4。
3.6 黄芩素-7-甲醚对缺氧 PC12细胞内 Nrf2和HO-1 mRNA表达的影响
与正常对照组比较,缺氧模型组细胞中 Nrf2和HO-1 mRNA的表达显著提高(P<0.01),而黄芩素-7-甲醚能够进一步提高Nrf2和HO-1 mRNA的活性(P<0.01)。结果见图5。
3.7 黄芩素-7-甲醚对缺氧 PC12细胞内 Nrf2和HO-1 蛋白表达的影响
与正常对照组比较,缺氧模型组细胞中 Nrf2和HO-1蛋白的表达显著提高(P<0.01),而黄芩素-7-甲醚能够进一步提高Nrf2和HO-1蛋白的表达(P<0.01)。结果见图 6。

图4 黄芩素-7-甲醚对缺氧PC12细胞中SOD和CAT活性的影响(n=6,x± s )
与正常对照组相比,1)P<0.01;与缺氧模型组相比,2)P<0.01。
Fig. 4 Effect of negletein on the activity of SOD and CAT in PC12 cells under hypoxia(n=6,x± s )
Compared with normal control group, 1)P<0.01; compared with hypoxia model group, 2)P<0.01.
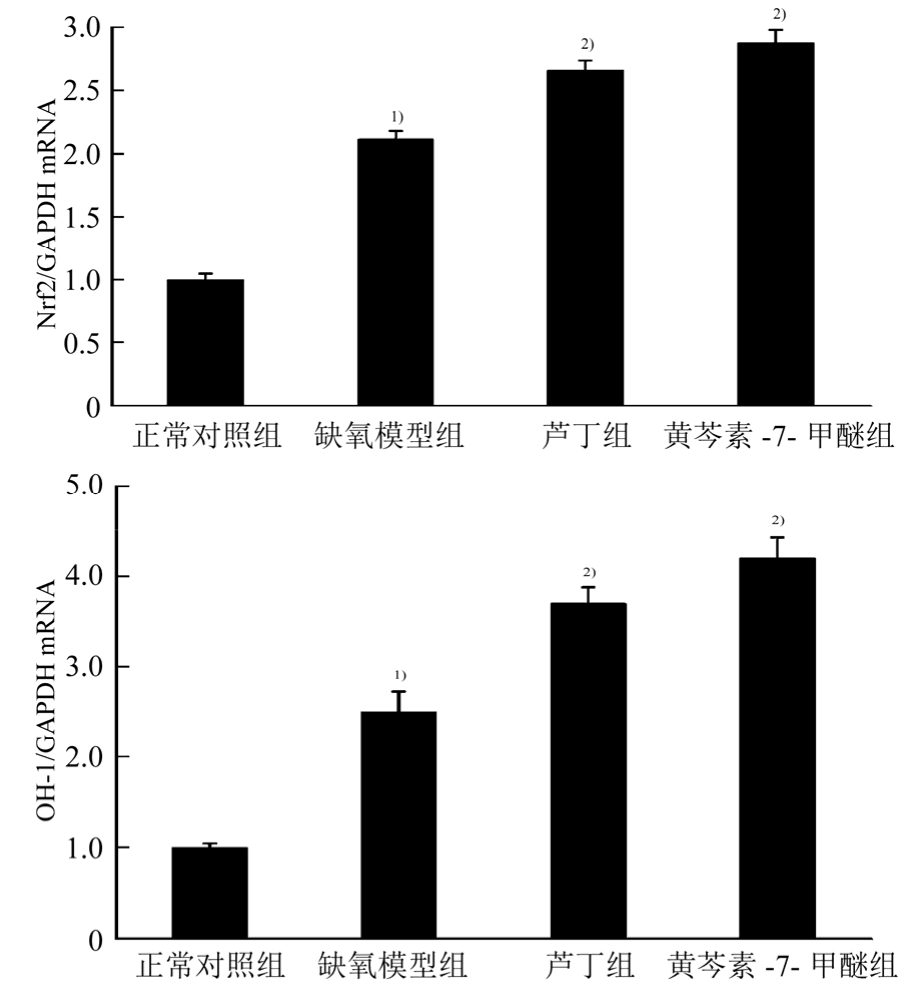
图5 黄芩素-7-甲醚对缺氧 PC12细胞中 Nrf2和 OH-1 mRNA表达的影响(n=3,x± s )
与正常对照组相比,1)P<0.01;与缺氧模型组相比,2)P<0.01。
Fig. 5 Effect of negletein on the mRNA expression of Nrf2 and OH-1 in PC12 cells under hypoxia(n=3,x± s )
Compared with normal control group, 1)P<0.01; compared with hypoxia model group, 2)P<0.01.

图6 黄芩素-7-甲醚对缺氧PC12细胞中Nrf2和OH-1蛋白表达的影响(n=3,x± s )
与正常对照组相比,1)P<0.01;与缺氧模型组相比,2)P<0.05,3)P<0.01。
Fig. 6 Effect of negletein on the protein expression of Nrf2 and OH-1 in PC12 cells under hypoxia(n=3,x± s )
Compared with normal control group, 1)P<0.01; compared with hypoxia model group, 2)P<0.05, 3)P<0.01.
4 讨论
氧气是需氧生物产生能量的物质基础,当氧气供应不足或者不能满足机体需求时就会造成缺氧。大脑是机体耗氧量最大的器官之一,占体质量2%的大脑,其耗氧量却占了总耗氧量的23%,这就使中枢神经系统对缺氧极为敏感,是最易遭受缺氧损伤的器官[9]。PC12细胞是大鼠肾上腺髓质嗜铬瘤细胞,在细胞形态、结构和功能上具有与神经元细胞相似的特性,在体外研究缺氧/缺血诱导神经元损伤方面应用广泛[10]。芦丁是一种天然黄酮类化合物,具有抗氧化、抗炎、抗病毒等多种生物活性,课题组前期研究发现,芦丁对缺氧PC12细胞具有优异的保护作用[11]。本实验建立缺氧PC12细胞损伤模型,结果显示,缺氧能够显著降低PC12细胞活力,使细胞膜的通透性增大、细胞内LDH外漏,导致培养基中LDH的活性升高。芦丁和黄芩素-7-甲醚预处理能逆转缺氧导致的细胞增殖活性下降,减少LDH漏出,维持细胞膜的完整性,对缺氧PC12细胞具有明显保护作用。
ROS和 MDA是氧化应激的主要产物,是细胞遭受氧化应激损伤的标志物[12]。实验结果表明,缺氧导致PC12细胞内产生大量的ROS,进而攻击DNA、脂质和蛋白质等生物大分子,影响细胞的结构和功能;同时与细胞膜中不饱和脂肪酸发生脂质过氧化反应,升高 MDA水平。而黄芩素-7-甲醚能够降低 ROS和 MDA含量,缓解缺氧对PC12细胞的氧化应激损伤,推测黄芩素-7-甲醚的保护作用与缓解机体氧化应激有关。
正常生理状态下,抗氧化酶如SOD、CAT等能够有效地清除机体产生的ROS。SOD能够通过提供氢原子配体将其还原生成过氧化氢,进而被CAT催化还原生成水。二者共同作用维持细胞内自由基稳态[13]。缺氧条件下产生大量ROS不仅破坏了细胞内的自由基稳态,同时还降低抗氧化酶的活性[14],进一步加剧细胞损伤。经黄芩素-7-甲醚干预后,缺氧PC12细胞中SOD和CAT活性较缺氧模型组显著升高,提示黄芩素-7-甲醚可能通过提高细胞内抗氧化酶的活性而发挥其抗缺氧作用。
SOD、CAT等抗氧化酶表达水平主要受到核因子 2(NF-E2)相关因子(Nrf2)的调控[15]。Nrf2属于碱性亮氨酸拉链(bZIP)蛋白家族成员,是调节抗氧化应激反应的重要核转录因子。正常情况下,Nrf2与 keap1结合,活性较低,氧化应激能够使Nrf2与 keap1解离进入细胞核,通过与抗氧化反应元件(antioxidant response elements,ARE)结合,调控 Nrf2-ARE信号通路下游抗氧化蛋白(CAT、SOD和 GSH-Px等)和Ⅱ相解毒酶[HO-1、醌氧化还原酶 1(NQO1)、谷氨酰半胱氨酸连接酶(GCL)等],维持机体细胞内氧化还原状态平衡和降低氧化应激造成的损伤[16]。HO-1是由 Nrf2通路调控的重要抗氧化酶,能够催化血红素降解为胆红素、CO和铁离子,具有明显的抗炎和抗氧化作用[17]。为了阐明黄芩素-7-甲醚对抗氧化酶活性调节作用是否与 Nrf2/HO-1信号通路有关,本研究对Nrf2及其下游 HO-1的表达情况进行了考察。结果发现,缺氧导致PC12中Nrf2、HO-1的mRNA和蛋白的表达显著升高,而黄芩素-7-甲醚预处理可以进一步促进Nrf2、HO-1的mRNA和蛋白的表达。上述实验证明,黄芩素-7-甲醚提高缺氧PC12细胞中抗氧化酶活性是通过激活Nrf2/HO-1途径实现的。
综上所述,黄芩素-7-甲醚对缺氧PC12细胞具有优异的保护作用,其作用机制与其清除过量ROS,抑制脂质过氧化,通过Nrf2/HO-1途径调节抗氧化酶活性,缓解氧化应激有关。
REFERENCES
[1] HOSTETLER G L, RALSTON R A, SCHWARTZ S J.Flavones: food sources, bioavailability, metabolism, and bioactivity [J]. Adv Nutr, 2017, 8(3): 423-435.
[2] HUANG Y T, CHI Z L, WANG S M, et al. Research progress on Licorice flavonoids and their antitumor activities [J]. Chin J New Drugs(中国新药杂志), 2017, 26(13) :1532-1537.
[3] CHANG S P, YU X, LIANG Z Y, et al. Optimization of extraction technique of total flavonoids in polygonum chinense by response surface methodology [J]. Pharmacy Today(今日药学), 2016, 26(1): 36-38.
[4] FANG H, ZHANG Y, LI J, et al. Protective effect of total flavones from Salix caprea flowers against myocardial ischemia-reperfusion injury in rats [J]. Chin J New Drugs(中国新药杂志), 2016, 25(8): 949-953.
[5] HE G H, GAO Y, LI C L, et al. A convenient and efficient approach to synthesize negletein from baicalin [J]. Tetrahedron Lett, 2016, 57(18): 2001-2005.
[6] SINGH B, SIDIQ T, JOSHI P, et al. Anti-inflammatory and immunomodulatory flavones from Actinocarya tibetica Benth[J]. Nat Prod Res, 2013, 27(23): 2227-2230.
[7] BANERJEE P, SAHOO A, ANAND S, et al. Multiple mechanisms of iron-induced amyloid beta-peptide accumulation in SHSY5Y cells: protective action of negletein[J]. Neuromol Med, 2014, 16(4): 787-798.
[8] JING L L, HE L, FAN P C, et al. Chemical constituents of saussurea involucrata with anti-hypoxia activity [J]. Chem Nat Compound, 2016, 52(3): 487-489.
[9] ERECIŃSKA M, SILVER I A. Tissue oxygen tension and brain sensitivity to hypoxia [J]. Respir Physiol, 2001, 128(3):263-276.
[10] CHEN P Y, HO Y R, WU M J, et al. Cytoprotective effects of fisetin against hypoxia-induced cell death in PC12 cells [J].Food Funct, 2015, 6(1): 287-296.
[11] 姚娟. 芦丁的抗缺氧作用及其分子机制研究[D]. 兰州: 兰州大学, 2012.
[12] CZERSKA M, MIKOŁAJEWSKA K, ZIELIŃSKI M, et al.Today's oxidative stress markers [J]. Med Pr, 2015, 66(3):393-405.
[13] DROGE W. Free radicals in the physiological control of cell function [J]. Physiol Rev, 2002, 82(1): 47-95.
[14] YANG B, XU Y, HU Y, et al. Madecassic acid protects against hypoxia-induced oxidative stress in retinal microvascular endothelial cells via ROS-mediated endoplasmic reticulum stress [J]. Biomed Pharmacother,2016(84): 845-852.
[15] SOBOČANEC S, ŠARIĆ A, MAČAK ŠAFRANKO Ž, et al.The role of 17β-estradiol in the regulation of antioxidant enzymes via the Nrf2-Keap1 pathway in the livers of CBA/H mice [J]. Life Sci, 2015(130): 57-65.
[16] WU Z H, MA Y F, ZHAO L, et al. Role of Nrf2-ARE pathway in oxidative stress injury and its relationship with other signaling pathways [J]. Anim Husb Feed Sci(畜牧与饲料科学), 2016, 37(3): 42-48.
[17] MIN K J, LEE J T, JOE E H, et al. An IκBα phosphorylation inhibitor induces heme oxygenase-1(HO-1) expression through the activation of reactive oxygen species (ROS)-Nrf2-ARE signaling and ROS-PI3K/Akt signaling in an NF-κB-independent mechanism [J]. Cell Signal, 2011, 23(9): 1505-1513.