聚乙二醇 1000维生素 E琥珀酸酯(D-α-tocopheryl polyethylene glycol 1000 succinate,TPGS)是一种水溶性维生素E,由维生素E琥珀酸酯(vitamin E succinate,VES)的游离羧基与聚乙二醇 1000(polyethylene glycol 1000,PEG 1000)一端的羟基酯化而成。由于两端同时具有疏水及亲水基团,TPGS是一种良好的非离子型表面活性剂,已作为药用辅料收载于美国药典,近年来在药物制剂中广泛应用,可用作增溶剂[1-2]、乳化剂[3]、吸收促进剂[4]、增塑剂[5]、药物载体(如脂质体、混合胶束、纳米粒)[6-8]等。
TPGS中除主要成分 TPGS单酯(TPGS monoester,TME)外,还存在 TPGS双酯(TPGS diester,TDE),以及游离的 α-生育酚(α-tocopheryl,TCP)、VES、PEG1000等。TDE是由于PEG 1000两端的羟基均被VES酯化,使两端均存在疏水基团,导致其表面活性作用较TME明显降低,且理化性质差异较大,因此TPGS中TDE、VES、TCP、PEG 1000的含量是控制TPGS质量的重要指标。对照品外标法是测定已知组分含量的最佳方法,但未见有TME及TDE的对照品出售。目前制备液相色谱法作为一种直观快速的分离制备手段,已在复杂组分的分离纯化中被大量应用[9-13]。本实验拟采用制备液相色谱分离制备TPGS中的TME、TDE,并建立 HPLC及 HPLC-ELSD的方法检测TPGS中的TME、VES、TCP、TDE及PEG 1000含量。TME、TDE结构见图1。

图1 TME和TDE的结构式
A-TME;B-TDE。
Fig. 1 Structure of TME and TDE
A-TME; B-TDE.
1 仪器与试剂
Agilent SD-1制备型液相色谱仪、Agilent 1200液相色谱仪、Agilent 1100液相色谱仪(配有Alltech 2000ES ELSD检测器)均购自美国Agilent公司;UPLC-Q-TOF液质联用仪(Waters公司);AVANCE-400核磁共振仪(Bruker公司);Heidolph Laborota 4001 旋转蒸发仪(德国Heidolph公司);XA205 型电子分析天平(瑞士梅特勒公司)。
TPGS(瑞源生物科技有限公司,批号20111103,20111104,20111105);VES 对照品(阿拉丁试剂,批号:F1510019;纯度:99.6%),TCP对照品(美国Supelco公司,批号:LB85173V;纯度:99.2%);PEG 1000对照品(分析纯,光复精细化工研究所,批号:20120413;纯度:99.0%);乙腈、异丙醇、乙醇(色谱纯,美国Merck公司);甲酸(分析纯,天津市康科德科技有限公司);水为超纯水。
2 方法与结果
2.1 TME与TDE的制备
2.1.1 制备液相色谱条件 色谱柱:DAC-HB50 C18动态轴向压缩色谱柱(50 mm×250 mm,10 μm);流动相:纯化水为流动相A,乙醇为流动相 B;梯度洗脱(0~10 min,60%→95%B;10~15 min,95%B;15~20 min,95%→100%B;20~40 min,100%B;40~41 min,100%→60%B;41~55 min,60%B);流速:75 mL·min-1;柱温:室温;检测波长:285 nm;进样量:5 mL。
2.1.2 供试品溶液的制备 取TPGS适量,用乙醇溶解并稀释制成约 100 mg·mL-1的溶液,摇匀即得。
2.1.3 TME和TDE的制备 精密量取制备供试品溶液5 mL注入Agilent SD-1制备型液相色谱仪,按“2.1.1”项下条件进行梯度洗脱,收集相应色谱峰处馏分,然后在40~46 ℃下旋转蒸发去除溶剂,即得。
2.2 制备获得对照品的结构确证
2.2.1 质谱 TME对照品:ESI-MS m/z 772.474 4[M+2H]+信号最强,相邻信号质荷比差值为 44,等于相差1个单体PEG的质量,计算得TME分子量为1 540.948 8。TME为VES(分子量为530.78)与PEG 1000聚合而成,与检测结果相符。
TDE对照品:ESI-MS m/z 1 007.157 7 [M+2H]+信号最强,相邻信号质荷比差值为 44,等于相差1个单体 PEG的质量,计算得 TDE分子量为2 012.315 4。TDE为VES与PEG 1000以2∶1的比例聚合而成,与检测结果相符。
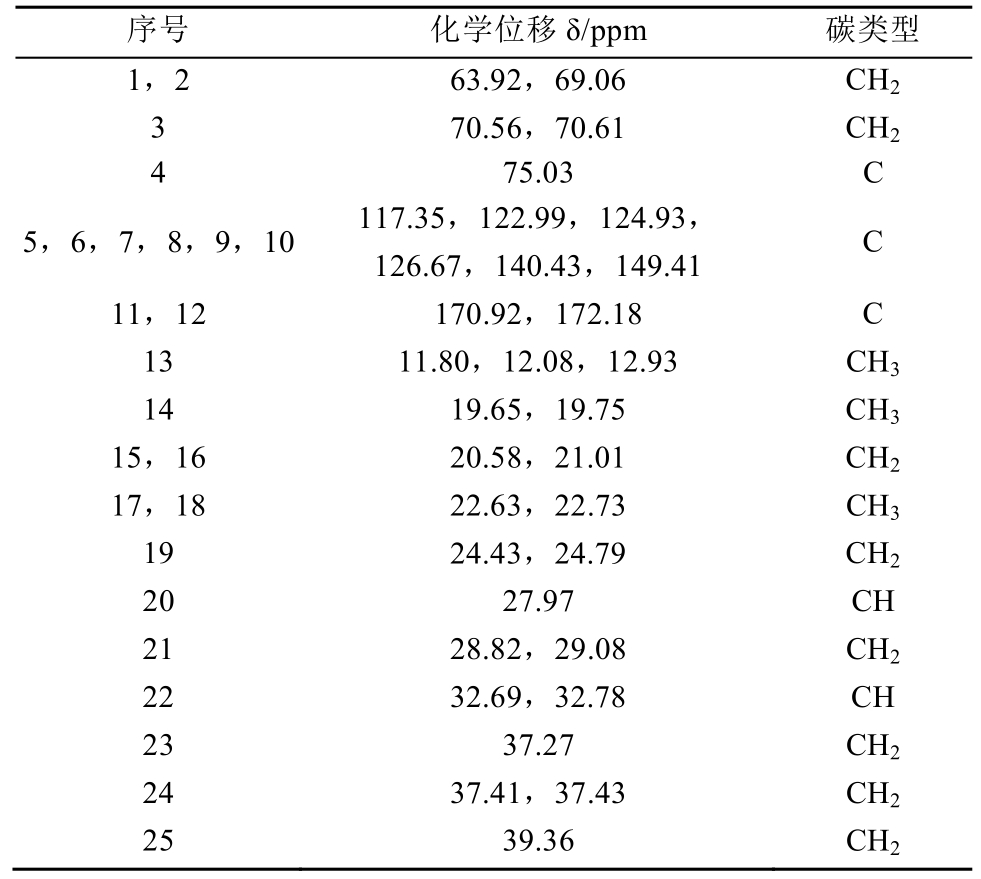
2.2.2 核磁共振光谱 将制备得到的 TME、TDE对照品测定1H-NMR、13C-NMR、DEPT(135°)。谱图见图2~3,信号归属见表1~4。

图2 1H-NMR 数据分析
A-TME;B-TDE;C-TME氢谱;D-TDE氢谱。
Fig. 2 1H-NMR spectrum data analysis
A-TME;B-TDE;C-1H-NMR spectrum of TME;D-1H-NMR spectrum of TDE.
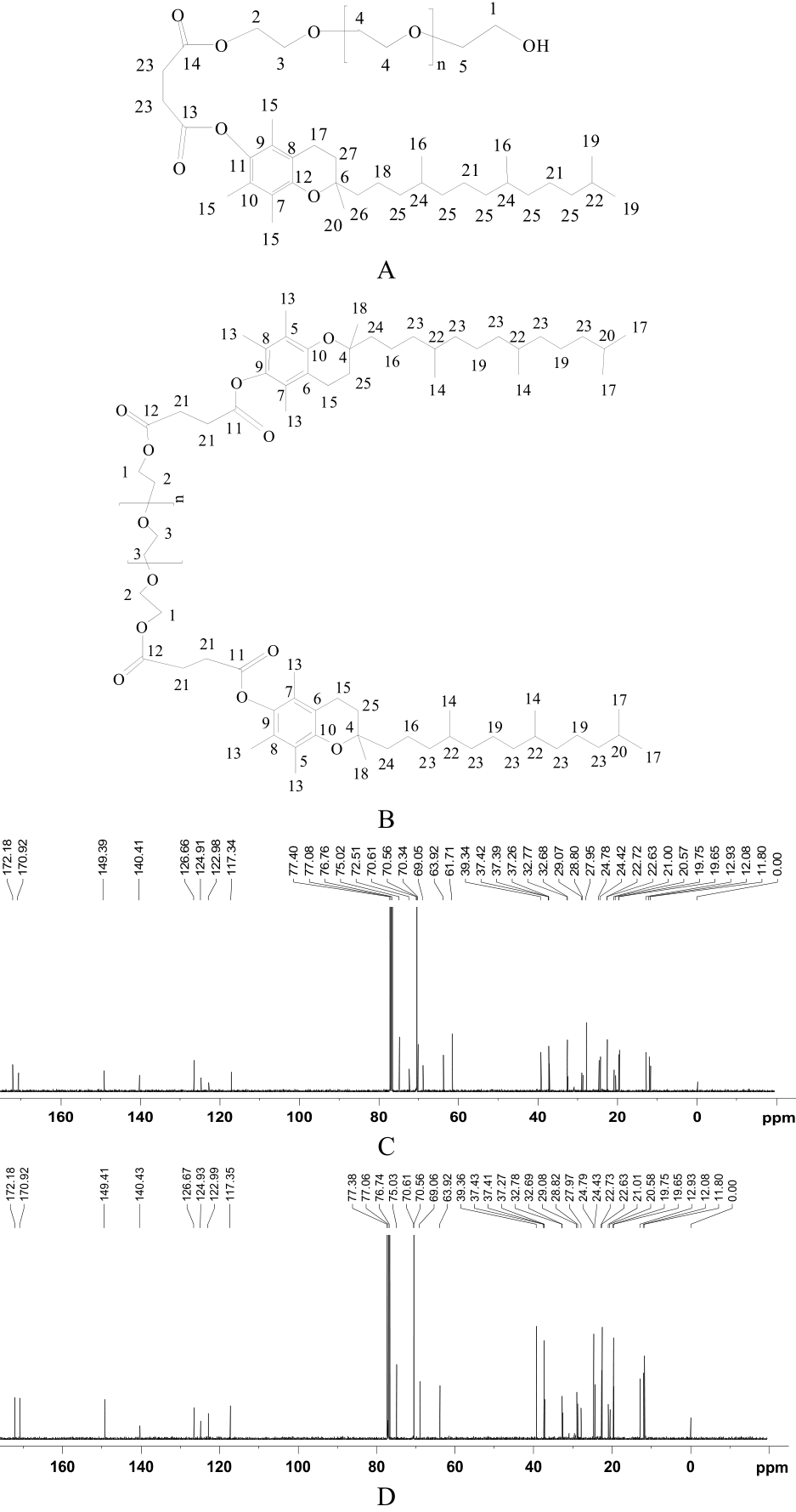
图3 13C-NMR 数据分析
A-TME;B-TDE;C-TME碳谱;D-TDE碳谱。
Fig. 3 13C-NMR spectrum data analysis
A-TME;B-TDE;C-13C-NMR spectrum of TME;D-13C-NMR spectrum of TDE.
表1 1H-NMR 数据及信号归属(TME)
Tab. 1 Data of 1H-NMR and signal attribution(TME)

表2 1H-NMR 数据及信号归属(TDE)
Tab. 2 Data of 1H-NMR and signal attribution(TDE)

表3 13C-NMR 数据及信号归属(TME)
Tab. 3 Data of 13C-NMR and signal attribution(TME)

表4 13C-NMR 数据及信号归属(TDE)
Tab. 4 Data of 13C-NMR and signal attribution(TDE)
1H-NMR图中,TME在δ 2.622~2.753处具有活泼氢的信号,TDE中则没有;TDE中由VES引入的质子数是TME中的2倍。
13C-NMR图中,TME中与-OH相连的 2个CH2在δ 61.71、72.51处有信号,在TDE中由于结构完全对称,这2个CH2的信号分别与对称位置的CH2信号峰重叠。
2.3 TME和TDE对照品纯度测定及TME、VES、TCP、TDE含量测定
2.3.1 色谱条件 色谱柱:Waters XBridge C8色谱柱(4.6 mm×250 mm,5 μm);流动相:0.1%甲酸溶液为流动相A,乙腈-异丙醇(1∶1)为流动相B,梯度洗脱(0~7 min,65%→100%B;7~13 min,100%B;13~13.5 min,100%→65%B;13.5~18 min,65%B);流速:1.0 mL·min-1;柱温:35℃;检测波长:285 nm;进样量:20 μL。
2.3.2 溶液制备 ①TME供试品溶液:精密称取TME适量,用乙腈溶解并稀释制成 6 mg·mL-1的溶液,摇匀即得。②TDE供试品溶液:精密称取TDE适量,用乙腈溶解并稀释制成3 mg·mL-1的溶液,摇匀即得。③对照品溶液:精密称取TME、VES、TCP、TDE的对照品适量,加乙腈溶解并稀释制成各含约 3,0.09,0.09,0.6 mg·mL-1的混合溶液,摇匀即得。④供试品溶液:精密称取TPGS供试品30 mg,置10 mL量瓶中,加乙腈溶解并稀释至刻度,摇匀即得。
2.3.3 TME和 TDE对照品纯度测定 TME及TDE供试品溶液分别按“2.3.1”项下色谱条件测定,采用面积归一化法计算,得到TME的纯度为99.1%,TDE的纯度为99.8%,色谱图见图4。

图4 TME,VES,TCP,TDE含量测定高效液相色谱图
A-TME供试溶液;B-TDE供试溶液;C-供试品溶液;D-对照品溶液;1-TME;2-VES;3-TCP;4-TDE。
Fig. 4 HPLC chromatograms of determination of TME,VES,TCP,TDE
A-TME solution; B-TDE solution; C-sample solution; D-standard solution; 1-TME; 2-VES; 3-TCP; 4-TDE.
2.3.4 专属性 将对照品溶液与供试品溶液按“2.3.1”项下条件进样测定,色谱图见图4。结果表明TPGS中各组分分离良好,专属性能够满足测定要求。
2.3.5 线性关系和范围 分别精密称取 TME,VES,TCP,TDE对照品 750,22.5,22.5,150 mg,置50 mL量瓶中,加乙腈溶解并稀释至刻度,摇匀,作为线性储备溶液。精密量取线性储备溶液适量,加乙腈稀释,制成 TME质量浓度分别为149.4,373.4,1 493,2 240,2 987,4 481 μg·mL-1,VES质量浓度分别为4.550,11.37,45.50,68.25,90.99,136.5 μg·mL-1,TCP 质量浓度分别为 4.466,11.16,44.66,66.99,89.32,134.0 μg·mL-1,TDE质量浓度分别为 30.52,76.30,305.2,457.8,610.4,915.6 μg·mL-1的系列混合溶液。按“2.3.1”项下条件进样测定,以质量浓度X(μg·mL-1)为横坐标,峰面积Y为纵坐标,进行线性回归,得到TME的回归方程为Y=1.432 7X+25.196,r=0.999 8,VES的回归方程为Y=4.178 6X-0.135 6,r=1.00 0,TCP的回归方程为Y=7.279 4X-3.165 9,r=1.00 0,TDE的回归方程为Y=2.032 7X-4.99 7,r=0.999 5,结果表明各组分在质量浓度范围内线性关系良好。
2.3.6 检测限和定量限 将对照品溶液逐级稀释,按“2.3.1”项下条件进样测定,取信噪比10∶1为定量限,信噪比3∶1为检测限。结果表明TME,VES,TCP,TDE的定量限分别为7.468,0.909 9,0.446 6,6.104 μg·mL-1,检测限分别为 2.240,0.182 0,0.134 0,1.221 μg·mL-1。
2.3.7 仪器精密度试验 将对照品溶液按“2.3.1”项下条件连续进样6次,测得TME,VES,TCP,TDE峰面积的 RSD(n=6)分别为 0.05%,0.26%,0.14%,0.05%,表明仪器精密度良好。
2.3.8 重复性试验 取 TPGS(批号:20111103)样品,按“2.3.2”项下方法平行配制 6份供试品溶液,按“2.3.1”项下条件进样测定。TME,VES,TCP,TDE的平均含量(n=6)分别为82.0%,0.04%,0.19%,12.3%,RSD(n=6)分别为0.46%,1.32%,0.60%,0.46%,表明方法重复性良好。
2.3.9 回收率试验 精密称取TME,VES,TCP,TDE对照品62.5,22.5,22.5,75.0 mg,置50 mL量瓶中,加乙腈溶解并稀释至刻度,摇匀,作为回收率储备液。另取 TPGS(批号:20111103)约30 mg,置10 mL量瓶中,共称取12份,分别加入回收率储备液1,2,3,8 mL,作为4个浓度水平,每个浓度水平平行配制 3份,加乙腈溶解并稀释至刻度,摇匀,按“2.3.1”项下条件进样测定,TME以第1,3,4浓度水平计算平均回收率,VES,TCP,TDE以第1,2,3浓度水平计算平均回收率。TME,VES,TCP,TDE 的平均回收率(n=9)分别为98.8%,98.4%,99.7%,99.3%,RSD分别为1.41%,0.37%,1.32%,1.31%。
2.3.10 稳定性试验 将供试品溶液在常温下放置,分别于0,2,4,6,8,12,24 h依法取样测定,测得TME,VES,TCP,TDE峰面积的RSD分别为0.46%,1.82%,1.07%,1.15%,表明供试品溶液在24 h内稳定。
2.3.11 样品测定 取 3批供试品分别依法测定TME,VES,TCP,TDE的含量,结果见表5。
2.4 PEG 1000含量测定
2.4.1 色谱条件 色谱柱:Waters XBridge C8色谱柱(4.6 mm×250 mm,5 μm);流动相:0.1%甲酸溶液为流动相A,乙腈-异丙醇(1∶1)为流动相B,梯度洗脱(0~4 min,45%B,4~5 min,45%→100%B,5~12 min,100%B,12~12.1 min,100%→45%B,12.1~17 min,45%B);流速:1.0 mL·min-1;柱温:35 ℃;进样量:8 μL;蒸发光散射检测器条件(高温不分流模式):漂移管温度 90.4 ℃,载气流速2.3 L·min-1。
2.4.2 溶液制备 ①对照品溶液:精密称取PEG 1000对照品适量,加乙腈溶解并稀释制成约含0.06,0.3,0.6 mg·mL-1的溶液,摇匀,作为对照溶液1~3。②供试品溶液:精密称取TPGS供试品30 mg,置10 mL量瓶中,加乙腈溶解并稀释至刻度,摇匀即得。
2.4.3 专属性 将对照品溶液,供试品溶液按“2.4.1”项下条件进样测定,色谱图见图5。结果表明专属性良好。

图5 PEG 1000测定高效液相色谱图
A-对照品溶液;B-供试品溶液;1-PEG 1000;2-TME;3-TDE。
Fig. 5 HPLC chromatograms of determination of PEG 1000
A-standard solution;B-sample solution;1-PEG 1000;2-TME;3-TDE.
2.4.4 线性和范围 精密称取 PEG 1000对照品150 mg,置50 mL量瓶中,加乙腈溶解并稀释至刻度,摇匀,作为线性储备溶液。精密量取线性储备溶液适量,加乙腈稀释,制成PEG 1000质量浓度分别为 9.065,18.13,60.44,120.9,181.3,302.2,483.5,604.4 μg·mL-1的系列溶液。按“2.4.1”项下条件进样测定,以质量浓度(μg·mL-1)的对数X为横坐标,峰面积的对数Y为纵坐标,进行线性回归,PEG 1000回归方程为Y=1.738 8X+2.151 3,r=0.999 5,结果表明PEG 1000在9.065~604.4 μg·mL-1内线性关系良好。
2.4.5 检测限和定量限 将对照品溶液 1逐级稀释,按“2.4.1”项下条件进样测定,取信噪比10∶1为定量限,信噪比 3∶1为检测限。结果表明PEG 1000 的定量限为 9.065 μg·mL-1,检测限为4.533 μg·mL-1。
2.4.6 仪器精密度试验 将对照品溶液1按“2.4.1”项下条件连续进样6次,测得PEG 1000峰面积的RSD(n=6)为0.67%,表明仪器精密度良好。
2.4.7 重复性试验 取 TPGS(批号:20111103)样品,平行配制 6份供试品溶液,按“2.4.1”项下条件进样测定,PEG 1000的平均含量(n=6)为4.99%,RSD(n=6)为1.17%,表明方法重复性良好。2.4.8 回收率试验 精密称取 PEG 1000对照品150 mg,置100 mL量瓶中,加乙腈溶解并稀释至刻度,摇匀,作为回收率储备液。另精密称取TPGS(批号:20111103)150 mg置50 mL量瓶中,称取9份,分别加入回收率储备液1,5,10 mL,作为3个浓度水平,每个浓度水平平行配制3份,加乙腈溶解并稀释至刻度,摇匀,按“2.4.1”项下条件进样测定,计算平均回收率。PEG 1000的平均回收率(n=9)为98.2%,RSD为0.87%。
2.4.9 稳定性试验 将供试品溶液在常温下放置,分别于0,2,4,8,12,24 h依法取样测定,测得PEG 1000峰面积的RSD为1.09%,表明供试品溶液在24 h内稳定。
2.4.10 样品测定 取 3批供试品分别依法测定PEG 1000的含量,结果见表5。
表5 样品中5种成分含量测定结果(n=3)
Tab. 5 Results of determination of five components(n=3)

3 讨论
3.1 TME,TDE制备方式及洗脱液选择
TPGS的纯化[14]与其中单双酯的分离[15]可见文献报道,但均使用正相体系硅胶柱层析,很难得到高纯度的TME与TDE。本实验使用反相制备液相色谱仪,考察了乙腈-异丙醇-水,乙腈-乙醇-水和乙醇-水等洗脱体系,结果显示,在同等上样量时使用乙醇-水梯度洗脱得到的TME,TDE纯度最高,且该洗脱体系对环境较为友好。
TPGS中主要成分为TME,TDE含量相对较少,若直接分离制备TDE对照品,制备效率较低。可将 TPGS与VES按约 1∶1的比例反应,或将PEG 1000与VES按约1∶2的比例反应,得到TDE含量较高的供试品,然后再分离制备TDE对照品,可提高收率,降低成本,且环保低碳。
3.2 检测器及参数选择
TME,VES,TCP,TDE分别在285,293 nm处有最大紫外吸收,为使 4种成分在同一条件下有最大吸收,最终选择 285 nm作为检测波长。PEG 1000无紫外吸收且不易挥发,选择高温不分流模式的 ELSD检测器,根据流动相组成确定ELSD检测器的初始参数为漂移管温度91.4 ℃,载气流速 2.5 L·min-1,逐步降低温度和流速考察样品的检测情况,在基线噪声符合要求的情况下得到待测组分的最大峰面积,最终确定漂移管温度 90.4 ℃,载气流速 2.3 L·min-1。
3.3 色谱柱选择
考察了 5根不同型号的色谱柱(SHISEIDO CAPCELL PAK C18,Agilent ZORBAX Eclipse XDB-C18,Waters XBridge Shield RP18,Waters XBridge C8,Agilent ZORBAX Eclipse XDB-C8),规格均为4.6 mm×250 mm,5 μm,结果显示Waters XBridge C8色谱柱在获得良好分离度的同时拥有最佳的检测灵敏度,色谱图见图6。
3.4 流动相选择
选择乙腈、甲醇、乙腈-乙醇(1∶1)、乙腈-异丙醇(1∶1)等有机相分别与 0.1%甲酸进行梯度洗脱,结果显示乙腈-异丙醇(1∶1)与 0.1%甲酸梯度洗脱时,各组分分离度均>2.0,柱效相对最优,含量较低组分(VES,TDE,TCP)能够得到最佳的检测灵敏度。
3.5 耐用性考察
比较了不同柱温(30,35,40 ℃),不同流速(0.9,1.0,1.1 mL·min-1)对样品检测的影响,结果显示各组分的分离度均>2.0,含量结果 RSD均<5.0%,方法的耐用性良好,适用于TPGS中5种成分的含量测定。

图6 色谱柱考察高效液相色谱图
A-Waters XBridge C8色谱柱;B-Waters XBridge Shield RP18色谱柱;C-Agilent ZORBAX Eclipse XDB-C18色谱柱;D-SHISEIDO CAPCELL PAK C18色谱柱;E-Agilent ZORBAX Eclipse XDB-C8色谱柱;1-TME;2-VES;3-TCP;4-TDE。
Fig. 6 HPLC chromatograms of choosing columns
A-Waters XBridge C8 column; B-Waters XBridge Shield RP18 column; C-Agilent ZORBAX Eclipse XDB-C18 column; D-SHISEIDO CAPCELL PAK C18 column; E-Agilent ZORBAX Eclipse XDB-C8 column; 1-TME; 2-VES; 3-TCP; 4-TDE.
REFERENCES
[1] CHRISTIANSEN A, BACKENSFELD T, WEITSCHIES W.Effects of non-ionic surfactants on in vitro triglyceride digestion and their susceptibility to digestion by pancreatic enzymes [J]. Eur J Pharm Sci, 2010, 41(2): 376-382.
[2] YANG X G, LI L B. Mixed micelles made of pluronic/PEG-PE/TPGS for solubilization of camptothecin [J].Chin Pharm J(中国药学杂志), 2009, 44(10): 762-765.
[3] SONG N, LIU WM, TU Q, et al. Preparation and in vitro properties of redox-responsive polymeric nanoparticles for paclitaxel delivery [J]. Colloids Surf B Biointerfaces, 2011,87(2): 454-463.
[4] ZHU Y N, WANG M, WANG L L, et al. Preparation of colchicine ethosomes containing TPGS and in vitro transdermal permeation [J]. Chin Tradit Herb Drugs(中草药),2015, 46(24): 3655-3660.
[5] GUO Y, LUO J, TAN S, et al. The applications of Vitamin E TPGS in drug delivery [J]. Eur J Pharm Sci, 2013, 49(2):175-186.
[6] ZHANG Z, TAN S, FENG S S. Vitamin E TPGS as a molecular biomaterial for drug delivery [J]. Biomaterials, 2012,33(19): 4889-4906.
[7] HU C, LIANG K, AN R, et al. Tissue distribution of TPGS modified artesunate liposome and its metabolites in rats [J].China J Chin Mater Med(中国中药杂志), 2018, 43(2):325-331.
[8] CAO N, FENG S S. Doxorubicin conjugated to D-alpha-tocopheryl polyethylene glycol 1000 succinate(TPGS): conjugation chemistry, characterization, in vitro and in vivo evaluation.[J]. Biomaterials, 2008, 29(28): 3856-3865.
[9] YANG F, ZHANG Y, ZHANG J L, et al. Preparation and identification of the doxycycline hyclate impurity eluted right after the main component described in ChP 2015 [J]. Chin J Pharm Anal(药物分析杂志), 2017, 37(4): 695-701.
[10] ZHAO D M, WANG W, LIU K, et al. Preparation of torachrysone-8-O-β-D-glucopyranoside reference substance from Polygoni Cuspidati Rhizoma et Radix by semi-preparative HPLC [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2016, 33(6): 727-730.
[11] MOHAN A, HARIHARAN M, VIKRAMAN E, et al.Identification and characterization of a principal oxidation impurity in clopidogrel drug substance and drug product [J]. J Pharm Biomed Anal, 2008, 47(1): 183-189.
[12] ASAKAWA D, IIMURA Y, KIYOTA T, et al. Molecular size fractionation of soil humic acids using preparative high performance size-exclusion chromatography [J]. J Chromatogr A, 2011, 1218(37): 6448-6453.
[13] MA T, ZHANG Q L, DING C X. Application of pH-zone-refining counter-current chromatography to separation of alkaloids [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2014, 31(12): 1539-1544.
[14] CHANG Y Z, YANG Y W, REN Q L, et al. Separation and purification of TPGS by silica gel column chromatography [J].Food Fermind(食品与发酵工业), 2010(12): 195-199.
[15] 杜广盛, 李德馨, 魏振平. 田口实验设计法优化TPGS单酯与双酯的柱层析分离工艺[J]. 化学试剂, 2014, 36(1): 79-82.