青霉素适用A组及B组溶血性链球菌、肺炎链球菌、对青霉素敏感金黄色葡萄球菌等革兰阳性球菌所致的各种感染,如血流感染、肺炎、脑膜炎、扁桃体炎、中耳炎、猩红热、丹毒、产褥热等。青霉素也用于治疗草绿色链球菌和肠球菌属所致的心内膜炎(与氨基糖苷类联合);梭状芽孢杆菌所致的破伤风、气性坏疽、白喉、流行性脑脊髓膜炎、鼠咬热、梅毒、钩端螺旋体病、樊尚(Vincent)咽峡炎、放线菌病等[1]。青霉素毒性虽低,但过敏反应较常见,在各种抗感染药物中居首位,严重的不良反应——过敏性休克(Ⅰ型变态反应)的发生率为 0.004%~0.015%,若不及时抢救,病死率高[1]。因此患者在使用青霉素类药物之前必须进行青霉素皮试[2-3],以确保患者用药安全[4]。已发表的文献大多针对青霉素与各类输液的配伍质量稳定性开展[5-6],对产品使用说明书制定的合理性以及临床用药指导作用描述较少。浙江金华康恩贝生物制药有限公司生产的青霉素皮试剂2 500单位(相当于1.5 mg)用0.9%氯化钠溶液5 mL[7-8]直接定量溶解配制,取0.1 mL对患者进行皮试,药物剂量浓度控制准确,使用方便。本实验对青霉素皮试剂与0.9%氯化钠溶液配伍的稳定性进一步进行研究,为产品说明书的制定提供科学依据[9],以期更好地指导临床用药 。
1 仪器与试剂
Agilent 1260高效液相色谱仪(美国Agilent公司);XP-105DR电子天平(瑞士梅特勒公司)。
青霉素对照品(中国药品生物制品检定所,批号:130437-201306;纯度:93.1%);青霉素皮试剂(浙江金华康恩贝生物制药有限公司,批号:GC1701001-1,GC1701001-2,GC1701002-3;规格:每瓶2 500单位);0.9%氯化钠溶液(双鹤药业,批号:161014XQ,规格:250 mL︰2.25 g);甲醇、乙腈、磷酸均为色谱纯,购自美国默克公司;磷酸二氢钾(分析纯,国药集团);水为超纯水。
2 方法
2.1 检测方法
2.1.1 有关物质的检测方法 以中国药典2015年版二部青霉素钠[10]的有关物质检测方法为基础,结合青霉素皮试剂的实际剂量,制定皮试剂的有关物质测定方法:取青霉素皮试剂10瓶,精密加入水10 mL,溶解并定量,稀释制成每1 mL约含1.5 mg的溶液,作为供试品溶液;精密量取1 mL,置100 mL量瓶中,用水稀释至刻度,作为自身对照溶液。
色谱条件:Kromasil C18色谱柱(250 mm×4.6 mm,5 μm);以 0.5 mol·L-1磷酸二氢钾溶液(用磷酸调 pH 至 3.5)-甲醇-水(10︰30︰60)为流动相A,以0.5 mol·L-1磷酸二氢钾溶液(用磷酸调pH至3.5)-甲醇-水(10︰50︰40)为流动相 B;流速为1.0 mL·min-1;柱温为35 ℃;检测波长为225 nm。先以流动相A-B(70∶30)等度洗脱;待青霉素峰洗脱完毕后立即进行梯度洗脱:0~20 min,70%A→0%A;再以流动相100%B等度洗脱15 min。取青霉素对照品约2 mg,加水1 mL使溶解,摇匀,制成每1 mL中约含2 mg青霉素钠的溶液,取40 μL注入液相色谱仪,记录色谱图应与标准图谱一致。取对照溶液40 μL注入液相色谱仪,调节检测灵敏度,使主成分色谱峰的峰高约为满量程的 20%。精密量取上述供试品溶液与自身对照溶液各40 μL,分别注入液相色谱仪,记录色谱图。供试品溶液的色谱图中如有杂质峰,各杂质峰面积的和不得超过自身对照溶液主峰面积的1.0%。
2.1.2 含量测定方法 依据青霉素皮试剂国家药品标准[11]规定进行含量测定。
色谱条件与系统适用性试验:Kromasil C18色谱柱(250 mm×4.6 mm,5 μm);0.05 mol·L-1磷酸二氢钾溶液-乙腈(75︰25)为流动相;流速为1.0 mL·min-1;柱温为35 ℃;检测波长为230 nm。理论板数按青霉素钠峰计算应≥2 000。
测定方法:取本品 10瓶,分别精密加入水5 mL,摇匀,取出所有溶液,混匀,配置成每1 mL含0.3 mg青霉素钠的溶液,作为供试品溶液,精密量取10 μL注入液相色谱仪,记录色谱图;另取青霉素对照品适量,精密称定约30 mg置100 mL量瓶中,加水溶解并定量稀释制成每1 mL中约含0.30 mg青霉素钠的溶液,作为对照溶液。按外标法以峰面积计算出每瓶的含量,并求出10瓶的平均含量,即得。其结果乘以 1.065 8,即为试品中C16H17N2NaO4S的含量。
注:在配伍试验时用 0.9%的氯化钠溶液替代水来制备供试品溶液。
2.2 测试液制备
2.2.1 有关物质测试液制备 取青霉素皮试剂 10瓶,用10 mL 0.9%氯化钠溶液洗出内容物,混匀,配制成每1 mL含1.5 mg青霉素钠的溶液,作为供试品溶液。
2.2.2 含量测试液制备 取青霉素皮试剂10瓶,分别精密加入5 mL 0.9%氯化钠溶液,摇匀,取出所有溶液,混匀,配制成每1 mL含0.3 mg青霉素钠的溶液,作为供试品溶液。
2.3 配伍时间考察
将“2.1”项下配置的有关物质和含量供试品溶液放置2~8 ℃环境中,分别于0,2,4,6,8,10,16,20,24 h取样,按“2.1”项下色谱条件检测含量、有关物质,考察各指标的变化情况。
将“2.1”项下配制的有关物质和含量供试品溶液放置于(25±5)℃环境中,分别于0,2,4,6,8,10 h取样,按“2.1”项下色谱条件检测含量、有关物质,考察各指标的变化情况。
3 结果
取在 2~8 ℃环境中存放不同时间段后的测试液,按“2.1”项下方法检测,显示在2~8 ℃保存条件下青霉素皮试剂含量在24 h内略有下降;有关物质在24 h内有上升趋势,但并未产生新的杂质,且小于标准规定的1.0%。数据汇总结果见表1,典型图谱见图1。
取在室温 25 ℃环境中存放不同时间段后的测试液按“2.1”项下方法检测,青霉素皮试剂配液在室温25 ℃条件下保存,含量在10 h内有所下降;有关物质在4 h内有上升趋势,但未超出标准,4 h后上升趋势明显且超出标准范围,但并未产生新的杂质。数据汇总结果见表 2,典型图谱见图1。
表1 2~8 ℃环境下保存的样品检测结果
Tab. 1 Results of sample determination stored at 2~8 ℃

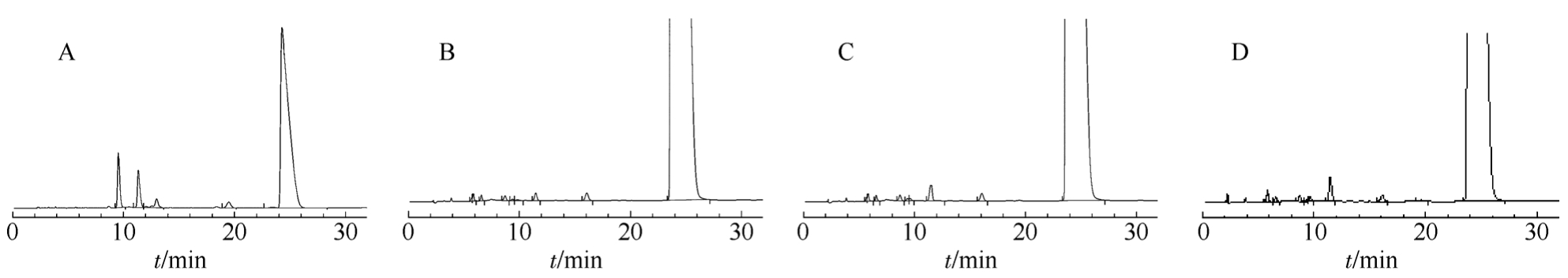
图1 高效液相色谱图
A-系统适用性;B-有关物质(0 h);C-有关物质(2~8 ℃,24 h);D-有关物质(25 ℃,4 h)。
Fig. 1 HPLC chromatograms
A–system suitability; B–related substances (0 h); C–related substances (2-8 ℃, 24 h); D–related substances(25 ℃, 4 h).
表2 25 ℃环境下保存的样品检测结果
Tab. 2 Results of sample determination stored at 25 ℃

结果显示,青霉素皮试剂有关物质在 0.9%氯化钠注射液中随着时间的推移呈上升趋势:在25 ℃室温条件下存放,4 h后杂质总量接近1.0%,但符合企业内控标准;8 h后已经接近2.0%,明显超出企业内控标准(1.0%)。在2~8 ℃低温条件下,24 h杂质总量仍<1.0%,结果明显优于室温条件下存放。青霉素皮试剂含量有下降趋势:在室温25 ℃存放的条件下,8 h内的变化≤2.0%;在2~8 ℃低温条件下,24 h内的变化≤2.0%,结果明显好于室温条件下存放。结果表明,青霉素皮试剂与0.9%氯化钠注射液的配伍稳定性与存放的环境温度和存放时间条件均有相关性。
4 讨论
根据3个批次青霉素皮试剂与0.9%氯化钠注射液的配伍稳定性考察结果,可知青霉素皮试剂的配伍稳定性与存放的时间和温度均相关;严格控制存放时间和低温保存都有利于青霉素皮试剂溶液的稳定性。在实际临床应用中,建议将配制好的药液,如在室温下存放,时间不宜超过4 h;如在2~8 ℃环境中存放可供24 h内使用。故建议企业适时修订青霉素皮试剂的使用说明书,在说明书的用法用量中注明存放条件和使用要求,以确保药物的疗效和用药的安全性。
REFERENCES
[1] 中华人民共和国临床用药须知: 化学药和生物制品卷[M].2010年版. 北京: 中国医药科技出版社, 2011: 624-628.
[2] 谭玲, 车宁. 药物皮试知识概述[J]. 中国临床医师, 2005,33(2): 46-47.
[3] 邓少娟. 不同溶媒对青霉素皮试结果的影响[J]. 现代中西医结合杂志, 2006, 15(4): 466-466.
[4] 刘萍. 青霉素皮试安全问题的探讨[J]. 中国保健营养(中旬刊), 2012, 22(5): 463.
[5] 王艳, 韩莹旻. HPLC法考察青霉素类抗菌药物配伍稳定性概述[J]. 实用药物与临床, 2011, 14(6): 516-518.
[6] 路永生. 注射用青霉素钠在配制和使用过程中的稳定性研究[J]. 中国现代药物应用, 2014, 8(15): 165-166.
[7] YUAN B, ZHANG L, YUAN L. Research on the stability of penicillin skin reagent [J]. Heilongjiang Med J(黑龙江医药),2003, 16(1): 28-29.
[8] 梁卫. 不同厂家青霉素皮试剂质量的实验研究[J]. 广西中医学院学报, 2000, 17(4): 61-63.
[9] 张莉. 谈青霉素类药物皮试研究分析[J]. 医学信息, 2016,29(11): 332-333.
[10] 中国药典. 二部[S]. 2015: 596-597.
[11] 国家药品标准. WS-10001(HD-0332)-2002[S].