急性脑梗死(acute cerebral infarction,ACI)是由于各种原因所致的局部脑组织区域血液供应障碍,导致脑组织缺血、缺氧性病变坏死,进而产生临床上对应的神经功能缺失表现[1]。因具有高发病率、高病残率和高死亡率的特点,多年来一直被临床重视。ACI的发病因素有血液成分因素、机械因素、血液灌流因素、血管病变因素,其中血管病变因素最重要的是炎症因素。研究表明,许多前炎性介质、炎性细胞及其分泌的细胞因子均参与脑梗死后缺血性损伤的病理生理过程[2],因此如何有效减轻卒中后炎性反应,从而降低发病率、病残率及死亡率,一直是临床研究的热点。强化降脂是指将极高危患者低密度脂蛋白胆固醇(LDL-C)水平降至<70 mg·dL-1,高危患者 LDL-C降至<100 mg·dL-1,中等高危患者LDL-C水平降低30%~40%。强化降脂治疗因其调脂、减轻炎症反应和稳定动脉粥样硬化斑块的作用,目前已在脑血管疾病的预防和治疗中占有重要地位[3]。有研究发现,ACI患者实施强化降脂治疗后可有效抗炎,促进患者神经功能及日常生活能力恢复[4]。雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是丝氨酸/苏氨酸蛋白激酶,能感受细胞中的氨基酸、生长因子、能量及环境压力等信号,通过下游效应蛋白调控翻译起始因子,从而调控蛋白质的合成[5]。有研究发现,mTOR信号通路具有阻止神经细胞凋亡、促进神经细胞再生及促进血管再生的功能[6]。因此本研究拟评价强化降脂治疗对ACI患者血清mTOR和Tau蛋白水平的影响。
1 资料与方法
1.1 一般资料
本研究获象山县红十字台胞医院医学伦理评审委员会批准,所有患者家属签署知情同意书。选取象山县红十字台胞医院2016年5月—2017年5月收治的ACI患者120例,年龄40~60岁,性别不限,体质量50~80 kg。所有患者均符合 ACI诊断标准[7],并经头颅CT或MRI证实,均于脑梗死发病后 1周内就诊。采用随机数字表法将所有入选患者分为对照组和观察组(n=60)。排除标准:2月内服用过他汀类药物;脑梗死后继发出血;合并心脏病、自身免疫性疾病、全身感染性疾病、恶性肿瘤、蛛网膜下腔出血;妊娠期、哺乳期妇女;对降脂类药物过敏的患者。
1.2 方法
2组患者均进行抗血小板集聚、降低颅内压力、保护脑神经、纠正高血糖及高血压等常规治疗。并且对照组口服常规剂量阿托伐他汀(河南天方药业股份有限公司,批号:170410117),每天1次,每次10 mg;观察组口服强化剂量阿托伐他汀,每天1次,每次40 mg。2组患者治疗连用口服阿托伐他汀3周。用药1周后开始检查患者肝肾功能及心肌酶,如果肝功能转氨酶超过正常值的 3倍退出实验,如果出现肌肉酸痛、横纹肌溶解等其他不良反应,则需要立即退出实验。
1.3 观察指标
ACI患者治疗前、治疗后第3天、治疗后第7天、治疗后第14天和治疗后第21天抽取静脉血5 mL,尽快分离血清,-70 ℃低温保存待测。检测前冻融,采用双抗体夹心 ELISA法测定血清mTOR、Tau、NF-κB和IL-6蛋白表达,试剂盒均由武汉华美生物工程有限公司提供,仪器为芬兰热电雷勃HB63-MK3全自动酶标仪。操作严格按说明书进行,结果由酶标仪分析所得。
1.4 神经功能改善程度评判
采用美国国立卫生研究院脑卒中量表(NIHSS)评估神经功能缺损情况:0~1分,正常或近乎正常;1~4分,轻度卒中/小卒中;5~15分,中度卒中;15~20分,中-重度卒中;21~42分,重度卒中[8]。由经过正规培训的神经专科医师负责评分并录入。发病后治疗前、治疗后第 3天、治疗后第 7天、治疗后第14天和治疗后第21天分别评分1次。
1.5 统计学处理
采用SPSS 19.0统计学软件进行分析,计量资料以x± s 表示,随机区组设计的计量资料采用单因素方差分析,重复测量设计的计量资料采用重复测量设计的方差分析,计数资料比较采用χ2检验,等级资料比较采用秩和检验,P<0.05为差异有统计学意义。
2 结果
对照组有 2例发生肝转氨酶超过正常值的 3倍(患者分别于2016年7月10日和2017年1月25日退出实验);观察组有1例发生肌肉酸痛(患者于2016年9月25日退出实验),有1例发生肝转氨酶超过正常值的3倍(患者于2017年3月11日退出实验)。
2.1 患者一般情况的比较
患者一般情况差异无统计学意义,具有可比性,结果见表1。
2.2 ELISA 法检测患者血清 mTOR、Tau、NF-κB、IL-6蛋白表达的比较
与对照组比较,观察组患者治疗后各时点血清中 mTOR、Tau、NF-κB、IL-6蛋白表达显著降低(P<0.05)。与治疗前相比,观察组治疗后各时间点血清中mTOR、Tau、NF-κB、IL-6蛋白表达显著降低(P<0.05),结果见表2。
2.3 神经功能改善程度(NIHSS评分)比较
与对照组比较,观察组患者治疗后各时点NIHSS评分显著降低(P<0.05)。与治疗前相比,观察组治疗后各时间点 NIHSS评分显著降低(P<0.05),结果见表 3。
3 讨论
他汀类药物近年来广泛用于治疗各种心脑血管疾病,有很好的应用前景。除了能够降脂、抗氧化及抗炎,对缺血性脑卒中的治疗亦有显著作用[9]。2001年美国国家胆固醇教育计划首次提出强化他汀降脂后,经过多年的临床实验表明,他汀类药物可以稳定、逆转易损斑块,从而减少了急性脑血管事件的发生,为临床治疗脑卒中提供了新方向[10]。
表1 2组患者患者一般情况的比较(n=58,x± s )
Tab. 1 General comparison of patients in two groups(n=58,x± s )

表2 2组患者各时点血清中mTOR、Tau蛋白表达的比较(n=58,x± s )
Tab. 2 Comparison of the expression of mTOR and Tau protein in serum of two groups of patients(n=58,x± s )
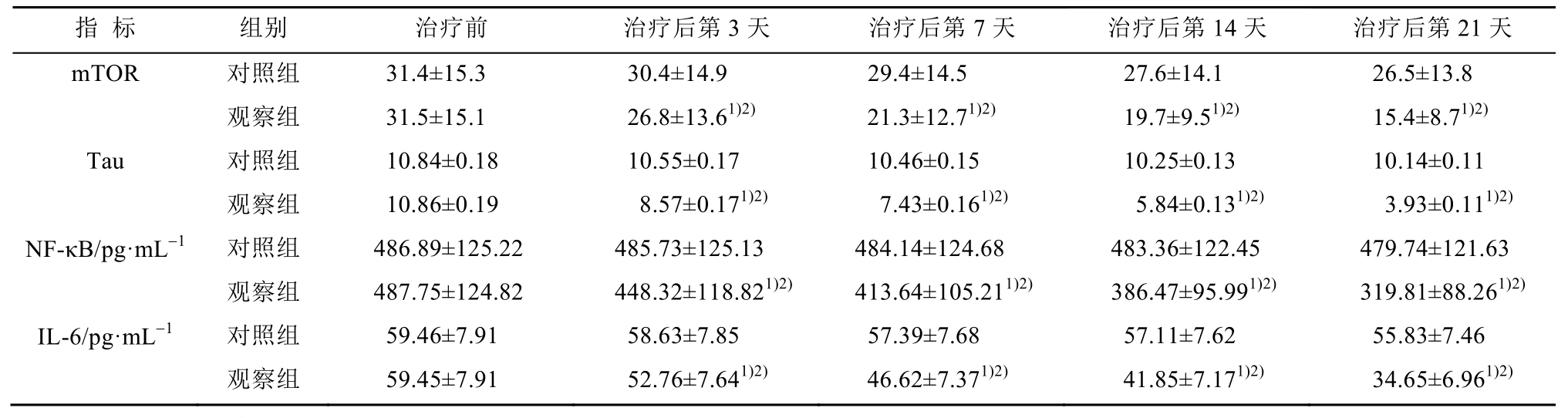
注:与对照组比较,1)P<0.05,与治疗前相比,2)P<0.05。
Note: Compared with control group, 1)P<0.05; compared with before treatment, 2)P<0.05.
表3 2组患者各时点神经功能改善程度(NIHSS评分)的比较(n=58,x± s )
Tab. 3 Comparison of the degree of improvement of neurological function(NIHSS score) of patients in two groups(n=58,x± s )

注:与对照组比较,1)P<0.05,与治疗前相比,2)P<0.05。
Note: Compared with control group, 1)P<0.05; compared with before treatment, 2)P<0.05.
哺乳动物mTOR是近年来发现的一个进化上十分保守的蛋白激酶,属于磷脂酰肌醇 3激酶(PI3K)蛋白激酶类家族。mTOR最主要的生理功能是调节蛋白质的合成、调控细胞的生长与增殖;加快细胞周期G1期-S期的转换,促进细胞增殖;它还可以整合氨基酸、ATP所激发的信号通路,借以调控细胞生长增殖和细胞周期[11],通过影响蛋白质合成、基因转录等生物学过程,调节细胞的生长、增殖、凋亡、自噬等[12]。Tau蛋白是神经元内的一种微管相关蛋白,对维持微管稳定有重要作用。有研究发现,炎症应激状态下,mTOR信号通路可能是胆固醇沉积的关键[13]。因此,本研究选择观察患者血清中mTOR及Tau蛋白水平。
NF-κB是重要的促炎转录因子,并且在所有核细胞内表达,参与多种炎性因子转录的调控[14]。NF-κB属于极早期急性转录调控因子,对炎性反应具有早期的调控作用,可以在早期减轻炎性反应对脑的损害[15]。炎性因子、细胞因子、钙超载等因素均可以激活NF-κB的大量表达,大量NF-κB的表达和激活又可诱导及促进细胞因子、黏附分子、炎性酶类的表达以及钙超载,形成炎性反应的恶性循环,释放出的炎性介质和有害物质均可以破坏血脑屏障和神经元,最后致脑组织水肿和神经细胞的损伤,引起中枢神经功能的紊乱[16]。在NF-κB的众多下游靶基因中,IL-6是炎性反应链锁中一个重要的细胞因子,有研究发现激活NF-κB活性,可刺激IL-6等炎性因子大量产生,造成大量炎性细胞的浸润,而炎性因子又进一步使NF-κB活化,加重炎症反应[17]。因此,本研究选择观察患者血清中NF-κB和IL-6的变化。
本研究结果表明,与对照组相比较,强化降脂组患者在治疗后第3天、第7天、第14天和第21天血清mTOR、Tau蛋白、NF-κB和IL-6蛋白含量下降,治疗后第3天、第7天、第14天和第21天NIHSS评分显著下降。与治疗前相比,强化降脂组患者治疗后第3天、第7天、第14天和第21天血清mTOR、Tau蛋白、NF-κB和IL-6蛋白含量下降,治疗后第3天、第7天、第14天和第21天NIHSS评分显著下降。对照组患者各时间点血清 mTOR、Tau蛋白、NF-κB和IL-6蛋白含量及NIHSS评分有下降趋势,但差异无统计学意义,表明强化降脂可显著减少急性脑梗死患者的血清炎性反应,具有更强的抗炎作用,可提高易损斑块的稳定性,其机制可能如下:大剂量的阿托伐他汀可阻断类异戊二烯前体的产生,阻止细胞信号传递物质异戊二烯化,下调PPAR活性,抑制下游 AMP蛋白酶(AMPK)的活性[18],从而抑制TSC1-TSC2的磷酸化,减弱 Rheb的活性,降低mTOR的功能[19],从而减少 GSK-3β的磷酸化,导致 Tau蛋白磷酸化减少,此外有研究发现阿托伐他汀还可下调sCD40L、减少CD40/CD40L相互作用发挥抗炎作用[20]。mTOR活性下降可抑制NF-κB信号通路转导[21]。有研究发现,阿托伐他汀可明显降低NF-κB和炎性因子的表达[22]。由此推断阿托伐他汀可通过抑制mTOR和Tau蛋白活性下调NF-κB信号通路,从而减少急性脑梗死患者炎症反应。
综上所述,强化降脂治疗能显著减少急性脑梗死患者炎症反应,提高易损斑块的稳定性,其机制与降低患者血清mTOR和Tau蛋白水平有关。
REFERENCES
[1] WANG T, GONG Y, SHI Y, et al. Feasibility of dual-low scheme combined with iterative reconstruction technique in acute cerebral infarction volume CT whole brain perfusion imaging [J]. Exp Ther Med, 2017, 14(1): 163-168.
[2] AMANTEA D, MICIELI G, TASSORELLI C, et al. Rational modulation of the innate immune system for neuroprotection in ischemic stroke [J]. Front Neurosci, 2015, 9(147): 1-20.
[3] HUANG L L. Effect of short-term pravastatin for treatment of congestive heart failure on inflammatory factors [J]. Chin J Nosocomiol(中华医院感染学杂志), 2012, 22(8): 1619-1621.
[4] JIANG Y D, XIAN Y J, YANG S J, et al. Clinical observation on trealment of 108 cases of acute cerebral infraetion of intensive liqid lowering [J]. Sichuan Med J(四川医学), 2015,36(4): 464-466.
[5] PARK J H, YOON J, PARK B. Pomolic acid suppresses HIF1α/VEGF-mediated angiogenesis by targeting p38-MAPK and mTOR signalingcascades [J]. Phytomedicine, 2016,23(14): 1716-1726.
[6] 付乐, 黄亮. mTOR信号通路在缺血性脑损伤中的作用及机制[J]. 中华急诊医学杂志, 2015, 24(1): 108-112.
[7] 中华神经外科学会. 脑血管疾病分类及各类脑血管疾病诊断要点[J]. 中华神经科杂志, 1996, 26(6): 376.
[8] HUANG X Q, FAN C Q, JIA J P, et al. Clinical and imaging characteristic of stroke patients with zero on the NIHSS [J].Stroke Nerv Dis(卒中与神经疾病), 2013, 20(6): 342-344.
[9] JIA W, ZHOU L. Effect of 20 mg/day atorvastatin:recurrent stroke survey in Chinese ischemic stroke patients with prior in tracranial hemorrhage [J]. J Clin Neurol, 2013, 9(3): 139-143.
[10] SHISHEHBOR M H, BRENNAN M L, AVILES R J, et al.Statins promote potent systemic antioxidant effects through specific inflammatory pathways [J]. Circulation, 2003, 108(4):426431.
[11] ZHANG W, SHAO X. Isoflurane promotes Non-Small cell lung cancer malignancy by activating the Akt-mammalian target of rapamycin (mTOR) signaling pathway [J]. Med Sci Monit, 2016 , 29(22): 4644-4650.
[12] ASSAD D X, ELIAS S T, MELO A C, et al. Potential impact of mTOR inhibitors on cervical squamous cell carcinoma: A systematic review [J]. Oncol Lett, 2016, 12(5): 4107-4116.
[13] ZHAO S, YE Q, LI T, et al. Experiment of THP-1 macrophage foam-cell formation through mTOR signal pathway activation induced by inflammatory stress [J]. Chin Pharmacol Bull(中国药理学通报), 2016, 32(8): 1105-1109.
[14] VUONG T T, RØNNING S B, SUSO H P, et al. The extracellular matrix of eggshell displays anti- inflammatory activities through NF-κB in LPS-triggered human immune cells [J]. J Inflamm Res, 2017, 4(10): 83-96.
[15] LI X, BI G N. Nuclear factor NF-κB and cerebral ischemic preconditioning [J]. Int J Geriatrics(国际老年医学杂志), 2010,31(5): 226-230.
[16] PRADILLO J M. ROMERA C, HURTADO O, et al. TNFR upregulation mediates tolerance after brain ischemic preconditioning [J]. J Cereb Blood Flow Meta, 2005, 25(2):193-203.
[17] IKENO H, APEL M, ZOUBOULIS C, et al. L-Ascorbyl-2-phosphate attenuates NF-κB signaling in SZ95 sebocytes without affecting IL-6 and IL-8 secretion [J]. Arch Dermatol Res, 2015, 307(7): 595-605.
[18] SONG L, YANG Y J, DONG Q T, et al. Atorvastatin protects swine bone marrow mesenchymal stem cells from apoptosis through AMPK but not PI3K/Akt pathway [J]. Chin J Cardiol(中华心血管病杂志), 2011, 39(11): 1033-1038.
[19] ZHANG M, WU J, WANG W, et al. Effect of AMPK in rat vascular smooth muscle cell proliferation through the mTOR pathway [J]. J Shandong Univ Health Sci(山东大学学报医学版), 2010, 48(6): 17-21.
[20] SUN H B, NING D X, LI Z L, et al. The Effects of atorvastatin on sCD40L level and prognosis in patients with acute coronary syndrome [J]. J Chin Physician(中国医师杂志), 2005, 7(7):900-902.
[21] LI L C, JIN G Y, ZHENG M Y, et al. Roles of PKC-δ/mTOR/NF-κB signaling pathway in airway remodeling of asthma mouse model [J]. Immunol J(免疫学杂志), 2013, 29(7):588-592.
[22] DU L L, WANG Z H. Effect of atorvastatin on NF-κB/IκB signal pathway and inflammation factor expression in rabbit atherosclerosis [J]. Chin Pharmacol Bull(中国药理学通报),2005, 21(11): 1392-1395.