仙茅为石蒜科植物仙茅 Curculigo orchioides Gaertn.的干燥根茎,具有补肾阳、强筋骨、祛寒湿之功效。用于阳痿精冷、筋骨痿软、腰膝冷痛、阳虚冷泻[1]。药理学研究显示仙茅具有清除氧自由基、增强免疫、延缓生殖系统老化、抗骨质疏松、补肾壮阳、保肝、保护心血管系统等作用[2]。其化学成分主要包括木脂素类、酚及酚苷类、皂苷类、黄酮类、甜味蛋白及多糖类等[3]。目前,多用仙茅苷和仙茅苷乙作为仙茅的质控指标[4-5],然而一两个成分不能表征中药复杂的体系,很难全面控制仙茅的内在质量,不能对其真伪优劣作出评价[6]。
中药指纹图谱作为现代中药质量控制和鉴别的新技术,为整体评价中药质量提供了新思路。马鹏、潘馨等[7-8]曾对仙茅正丁醇提取部位的指纹图谱进行研究,而本研究采用甲醇提取不同极性成分,能更全面地反映仙茅的指纹特征信息。快速溶剂萃取(accelerated solvent extraction,ASE)法是在高温和高压条件下进行萃取的一种新型前处理方法,其操作简单、快速,大大缩短了萃取时间。本实验研究了ASE的样品前处理方法,建立仙茅中仙茅苷定量测定方法,并利用不同产地的20批仙茅药材建立了HPLC指纹图谱,为全面控制仙茅质量提供参考依据。
1 仪器与试药
Thermo Fisher Scientific Ultimate 3000高效液相色谱仪、Thermo Syncronis C18色谱柱(100 mm×3 mm,3 μm)、ASE 350快速溶剂萃取仪(Thermo公司);XA205DU电子分析天平(梅特勒-托利多)。
对照品仙茅苷(中国食品药品检定研究院,批号:110771-200904;含量:99.6%);乙腈为色谱纯;其余试剂均为分析纯。
仙茅药材均为市售品,经广西梧州食品药品检验所黄蘅副主任中药师鉴定为石蒜科植物仙茅Curculigo orchioides Gaertn.的干燥根茎,来源及批号见表1。
表1 样品来源及批号
Tab. 1 Sample source and batch number
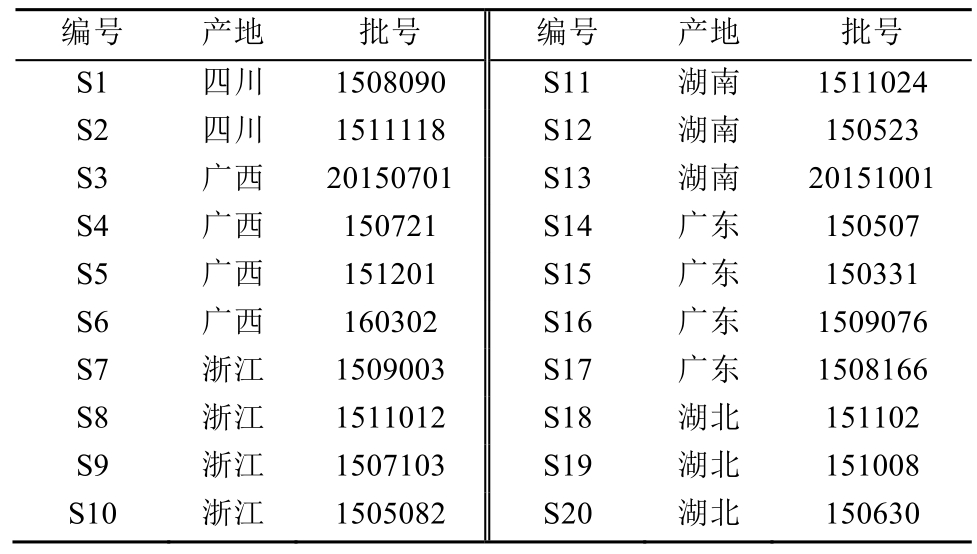
编号 产地 批号 编号 产地 批号S1 四川 1508090 S11 湖南 1511024 S2 四川 1511118 S12 湖南 150523 S3 广西 20150701 S13 湖南 20151001 S4 广西 150721 S14 广东 150507 S5 广西 151201 S15 广东 150331 S6 广西 160302 S16 广东 1509076 S7 浙江 1509003 S17 广东 1508166 S8 浙江 1511012 S18 湖北 151102 S9 浙江 1507103 S19 湖北 151008 S10 浙江 1505082 S20 湖北 150630
2 方法与结果
2.1 色谱条件
色谱柱:Thermo Syncronis C18(100 mm×3 mm,3 μm)。流动相:乙腈(A)-0.1%磷酸(B)。梯度洗脱(0~5 min,5%A;5~15 min,5%→10%A;15~20 min,10%→15%A;20~30 min,15%→25%A;30~35 min,25%→35%A;35~35.1 min,35%→5%A;35.1~40 min,5%A);体积流量为0.5 mL·min-1,检测波长为285 nm,柱温为40 ℃,进样量为5 μL。在上述色谱条件下,仙茅苷对照品和供试品中其他色谱峰分离良好,理论板数按仙茅苷峰计≥5 000。色谱图见图1。
2.2 对照品溶液的制备
精密称取仙茅苷对照品10.24 mg,置25 mL量瓶中,加甲醇溶解并定容,制成浓度为0.408 0 mg·mL-1的对照品储备液。
2.3 供试品溶液的制备
取仙茅药材粉末(过三号筛)约1 g,精密称定,与1 g硅藻土混合均匀,移入到装有滤膜的10 mL萃取池中,再加入适量硅藻土,轻轻振摇使之与池口在同一水平线上,拧紧萃取池上盖,按快速溶剂萃取仪优化好的参数(萃取溶剂甲醇、萃取温度100 ℃、静态萃取时间5 min、冲洗体积100%、循环 2次)萃取,萃取结束后,把萃取液转移于25 mL量瓶中,用甲醇稀释至刻度,摇匀,滤过,取续滤液,即得。
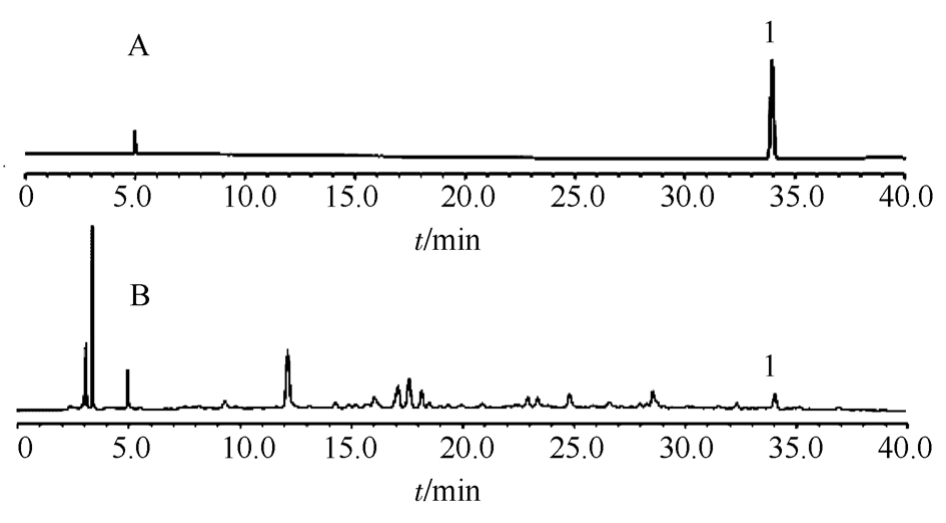
图1 高效液相色谱图
A-对照品;B-仙茅样品;1-仙茅苷。
Fig. 1 HPLC chromatograms
A-reference substance; B-Curculigins Rhizoma; 1-curculigoside.
2.4 ASE正交试验的设计
参考中国药典2015年版以及仙茅中成分测定的相关文献[4-5,9-10],本研究采用甲醇为萃取溶剂,以仙茅苷的量为测定指标,采用L9(33)正交试验设计对快速溶剂萃取效率影响较大的因素(萃取温度、静态萃取时间、循环次数)进行优化,因素水平见表2。正交优化结果显示,影响仙茅中仙茅苷提取效率的各因素主次顺序为萃取温度>静态萃取时间>循环次数,静态萃取时间和循环次数对实验结果影响不显著,结果见表3。综合考虑时间和提取效率等因素,优化的最佳提取工艺组合:萃取温度100 ℃;静态萃取时间5 min;循环萃取2次。
表2 因素水平表
Tab. 2 Table of factors and levels
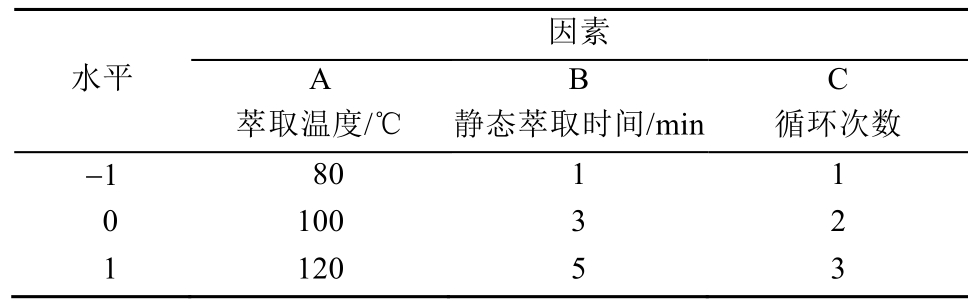
因素水平A萃取温度/℃B静态萃取时间/min C循环次数-1 80 1 1 0 100 3 2 1 120 5 3
2.5 方法学考察
2.5.1 线性关系考察 精密吸取“2.2”项下对照品储备液0.1,0.2,0.5,1,2,3 mL,置于10 mL量瓶中,加甲醇至刻度,摇匀。分别精密吸取上述对照品溶液各5 μL,注入高效液相色谱仪,按“2.1”项下色谱条件测定,记录峰面积。以浓度(mg·mL-1)为横坐标(X),峰面积为纵坐标(Y),绘制标准曲线,仙茅苷的回归方程为 Y=3 980.445 6X-2.285 6(r=0.999 8),线性范围为 20.4~612.0 ng。
表3 L9(33)正交试验设计表及结果(n=3)
Tab. 3 Designs table and results of L9(33) orthogonal test(n=3)
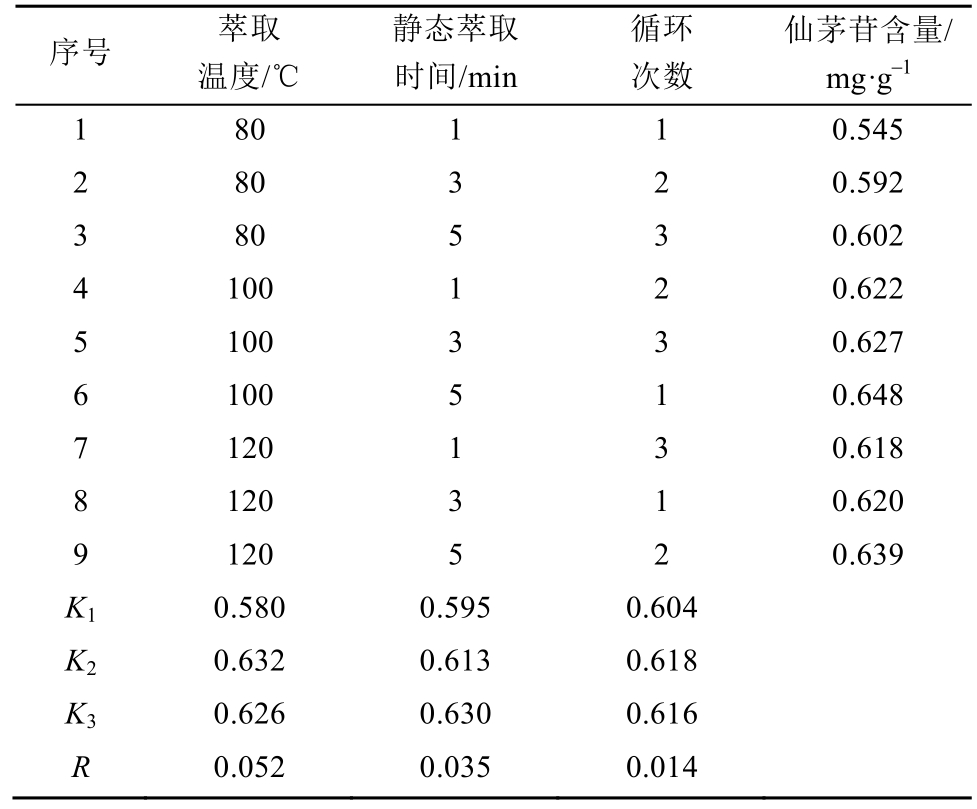
序号 萃取温度/℃静态萃取时间/min循环次数仙茅苷含量/mg·g-1 1 80 1 1 0.545 2 80 3 2 0.592 3 80 5 3 0.602 4 100 1 2 0.622 5 100 3 3 0.627 6 100 5 1 0.648 7 120 1 3 0.618 8 120 3 1 0.620 9 120 5 2 0.639 K1 0.580 0.595 0.604 K2 0.632 0.613 0.618 K3 0.626 0.630 0.616 R 0.052 0.035 0.014
2.5.2 仪器精密度试验 取同一样品(S9),按“2.3”项下方法制备供试品溶液,按“2.1”项下色谱条件洗脱,连续进样 6次,记录色谱图,考察各共有峰的相对保留时间和相对峰面积 RSD。结果相对保留时间 RSD<0.6%,相对峰面积RSD<0.9%,说明仪器精密度好。
2.5.3 重复性试验 取同一样品(S9),按“2.3”项下方法制备供试品溶液6份,按“2.1”项下色谱条件洗脱,分别进样,记录色谱图,考察各共有峰的相对保留时间和相对峰面积的 RSD。结果显示相对保留时间 RSD<0.4%,相对峰面积RSD<2.2%,说明重复性好。
2.5.4 稳定性试验 取同一样品(S9),按“2.3”项下方法制备供试品溶液,按“2.1”项下色谱条件洗脱,分别在0,2,4,8,12,24 h进样,记录色谱图,考察各共有峰的相对保留时间和相对峰面积的 RSD。结果显示相对保留时间RSD<0.9%,相对峰面积RSD<1.5%,表明样品在24 h内稳定。
2.5.5 加样回收率试验 取已测定的仙茅样品(S9)9 份,每份 0.5 g,精密称定,编号 1~3、4~6、7~9号分别精密加入0.408 mg·mL-1仙茅苷0.8,1.0,1.2 mL,按“2.3”项下方法制备供试品溶液,按“2.1”项下色谱条件进行测定,计算平均回收率,平均回收率为99.12%,RSD为1.98%。
2.6 指纹图谱共有模式的建立及相似度评价
2.6.1 指纹图谱共有模式的建立 取20批不同批次仙茅样品按“2.3”项下方法制备,各取5 μL,按“2.1”项下色谱条件进行测定,得到HPLC指纹图谱,运用国家药典委员会中药色谱指纹图谱相似度评价系统(2.0版)软件,对保留时间0~38 min内的峰进行分析,选择分离度高、重复性好的色谱峰作为共有指纹峰,共标定 15个共有峰,20批样品的色谱叠加图见图2。仙茅的HPLC指纹图谱共有模式样品指纹图谱见图3,其共有峰面积占总峰面积的 80%以上,符合共有峰的要求。以仙茅苷(14号峰)为参照峰(S),计算各色谱峰保留时间和保留峰面积与同一图谱中S峰的保留时间和保留峰面积比值,得到的相对保留时间和相对峰面积,结果见表4~5。
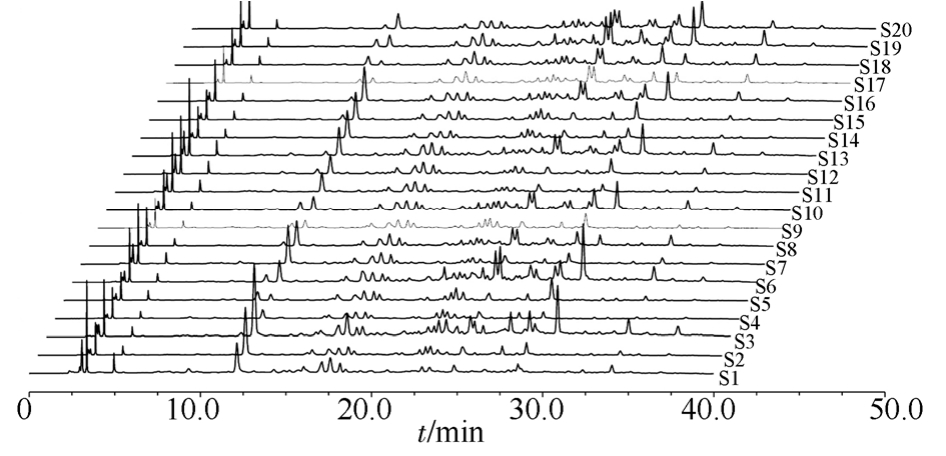
图2 20批仙茅HPLC指纹图谱
Fig. 2 HPLC of fingerprint of 20 batches of Curculigins Rhizoma

图3 仙茅的HPLC指纹图谱共有模式
14号峰仙茅苷为参比峰。
Fig. 3 The common HPLC fingerprint of Curculigins Rhizoma
Curculigoside as reterence is represented by peak 14.
2.6.2 相似度评价及分析 采用国家药典委员会中药色谱指纹图谱相似度评价系统(2.0版)软件,以样品(批号:1507103)作为参照图谱,利用中位数法进行多点校正生成对照指纹图谱,各批样品与对照指纹图谱进行比较,计算各批仙茅药材的指纹图谱相似度,结果见表6。由相似度评价结果可以看出,各批仙茅药材与对照指纹图谱间的相似度均>0.9,表明药材质量相对稳定。
表4 20批仙茅指纹图谱共有峰相对保留时间
Tab. 4 Relative retention time of common peaks in 20 batches of Curculigins Rhizoma
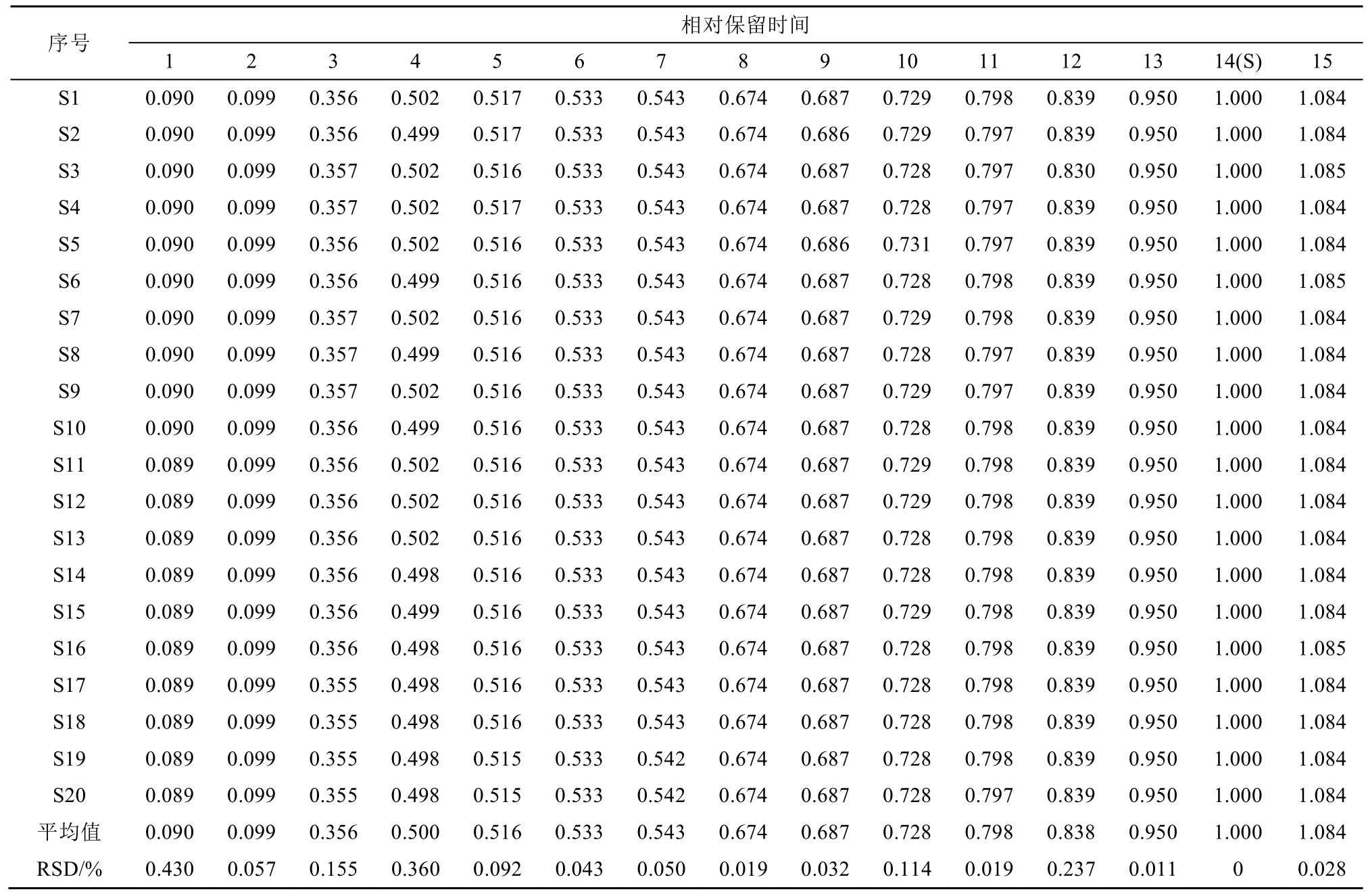
序号相对保留时间1 2 3 4 5 6 7 8 9 10 11 12 13 14(S) 15 S1 0.090 0.099 0.356 0.502 0.517 0.533 0.543 0.674 0.687 0.729 0.798 0.839 0.950 1.000 1.084 S2 0.090 0.099 0.356 0.499 0.517 0.533 0.543 0.674 0.686 0.729 0.797 0.839 0.950 1.000 1.084 S3 0.090 0.099 0.357 0.502 0.516 0.533 0.543 0.674 0.687 0.728 0.797 0.830 0.950 1.000 1.085 S4 0.090 0.099 0.357 0.502 0.517 0.533 0.543 0.674 0.687 0.728 0.797 0.839 0.950 1.000 1.084 S5 0.090 0.099 0.356 0.502 0.516 0.533 0.543 0.674 0.686 0.731 0.797 0.839 0.950 1.000 1.084 S6 0.090 0.099 0.356 0.499 0.516 0.533 0.543 0.674 0.687 0.728 0.798 0.839 0.950 1.000 1.085 S7 0.090 0.099 0.357 0.502 0.516 0.533 0.543 0.674 0.687 0.729 0.798 0.839 0.950 1.000 1.084 S8 0.090 0.099 0.357 0.499 0.516 0.533 0.543 0.674 0.687 0.728 0.797 0.839 0.950 1.000 1.084 S9 0.090 0.099 0.357 0.502 0.516 0.533 0.543 0.674 0.687 0.729 0.797 0.839 0.950 1.000 1.084 S10 0.090 0.099 0.356 0.499 0.516 0.533 0.543 0.674 0.687 0.728 0.798 0.839 0.950 1.000 1.084 S11 0.089 0.099 0.356 0.502 0.516 0.533 0.543 0.674 0.687 0.729 0.798 0.839 0.950 1.000 1.084 S12 0.089 0.099 0.356 0.502 0.516 0.533 0.543 0.674 0.687 0.729 0.798 0.839 0.950 1.000 1.084 S13 0.089 0.099 0.356 0.502 0.516 0.533 0.543 0.674 0.687 0.728 0.798 0.839 0.950 1.000 1.084 S14 0.089 0.099 0.356 0.498 0.516 0.533 0.543 0.674 0.687 0.728 0.798 0.839 0.950 1.000 1.084 S15 0.089 0.099 0.356 0.499 0.516 0.533 0.543 0.674 0.687 0.729 0.798 0.839 0.950 1.000 1.084 S16 0.089 0.099 0.356 0.498 0.516 0.533 0.543 0.674 0.687 0.728 0.798 0.839 0.950 1.000 1.085 S17 0.089 0.099 0.355 0.498 0.516 0.533 0.543 0.674 0.687 0.728 0.798 0.839 0.950 1.000 1.084 S18 0.089 0.099 0.355 0.498 0.516 0.533 0.543 0.674 0.687 0.728 0.798 0.839 0.950 1.000 1.084 S19 0.089 0.099 0.355 0.498 0.515 0.533 0.542 0.674 0.687 0.728 0.798 0.839 0.950 1.000 1.084 S20 0.089 0.099 0.355 0.498 0.515 0.533 0.542 0.674 0.687 0.728 0.797 0.839 0.950 1.000 1.084平均值 0.090 0.099 0.356 0.500 0.516 0.533 0.543 0.674 0.687 0.728 0.798 0.838 0.950 1.000 1.084 RSD/% 0.430 0.057 0.155 0.360 0.092 0.043 0.050 0.019 0.032 0.114 0.019 0.237 0.011 0 0.028
表5 20批仙茅指纹图谱共有峰相对峰面积
Tab. 5 Relative peak area of common peaks in 20 batches of Curculigins Rhizoma

序号相对峰面积1 2 3 4 5 6 7 8 9 10 11 12 13 14(S) 15 S1 1.554 2.157 4.817 1.984 2.324 1.070 0.859 0.679 0.710 1.077 0.9200 1.270 0.411 1.000 0.258 S2 0.521 1.413 8.580 2.514 1.878 1.807 0.909 2.082 1.526 2.832 1.470 2.997 0.394 1.000 0.397 S3 1.300 0.712 5.513 1.103 1.812 0.494 0.644 0.790 1.146 1.202 0.982 1.138 0.345 1.000 0.757 S4 0.849 4.068 5.045 3.257 4.122 3.072 1.742 1.528 2.334 5.207 2.703 3.088 0.665 1.000 0.668 S5 0.545 1.195 1.415 2.656 2.576 1.936 1.396 2.413 1.927 2.139 1.236 4.118 0.529 1.000 0.289 S6 1.320 0.750 3.705 1.332 0.790 0.501 0.837 2.265 1.071 2.058 0.802 1.520 0.367 1.000 0.410 S7 1.067 1.634 6.164 1.982 1.953 1.214 0.420 0.776 0.722 1.686 0.586 1.716 0.351 1.000 0.216 S8 0.175 0.701 2.617 1.206 1.339 0.666 0.806 1.420 0.522 1.686 1.187 1.057 0.425 1.000 0.186 S9 0.643 1.807 2.649 3.617 3.260 2.512 1.769 3.078 2.936 3.108 1.726 4.490 0.598 1.000 0.417 S10 0.366 0.837 4.658 1.691 1.243 0.851 0.551 0.961 1.031 2.002 0.873 1.908 0.469 1.000 0.313 S11 1.075 2.270 4.390 2.635 2.661 1.449 0.518 0.916 0.867 2.052 0.607 1.837 0.460 1.000 0.203 S12 1.076 1.739 3.216 2.241 2.389 1.359 0.639 1.087 1.062 1.580 0.524 2.222 0.446 1.000 0.175 S13 0.855 1.080 2.388 1.429 1.203 0.631 0.886 1.188 0.534 1.038 0.914 0.942 0.425 1.000 0.280 S14 0.628 1.902 9.935 3.299 2.592 2.211 1.136 2.366 1.785 3.534 1.964 3.273 0.502 1.000 0.540 S15 0.489 1.259 6.747 2.573 2.259 1.855 1.132 2.272 1.578 2.446 1.439 3.745 0.467 1.000 0.343 S16 1.283 0.874 4.323 1.631 1.056 0.828 0.421 0.757 1.193 2.358 0.958 1.823 0.235 1.000 0.450 S17 0.922 0.717 4.636 1.204 1.382 0.599 0.281 0.470 0.468 1.140 0.423 0.877 0.216 1.000 0.173 S18 1.138 1.586 4.427 1.130 1.354 0.618 0.365 0.502 0.601 0.821 0.855 1.318 0.228 1.000 0.134 S19 1.148 1.552 4.813 1.008 0.946 1.397 0.188 0.140 0.373 1.193 0.856 1.097 0.357 1.000 0.212 S20 0.308 0.999 2.250 1.827 1.194 0.812 0.436 0.630 1.082 1.578 1.078 1.772 0.245 1.000 0.418平均值 0.583 1.363 3.965 2.116 1.917 1.244 0.687 1.216 1.173 2.037 0.950 2.110 0.347 1.000 0.342 RSD/% 40.56 53.84 45.47 39.76 44.79 56.78 56.68 62.23 57.16 51.17 49.31 52.80 29.55 0 49.23
表6 20批仙茅药材相似度评价结果
Tab. 6 Similarities of 20 batches of Curculigins Rhizoma

序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 对照谱S1 1.000 0.903 0.912 0.943 0.928 0.967 0.992 0.9240.9770.9460.9730.9310.9060.9130.9430.911 0.994 0.986 0.947 0.937 0.943 S2 0.903 1.000 0.986 0.965 0.932 0.906 0.912 0.9220.9860.9640.9210.9080.9910.9420.9470.951 0.940 0.967 0.981 0.993 0.904 S3 0.912 0.986 1.000 0.903 0.918 0.943 0.928 0.9530.9420.9610.9210.9430.9570.9880.9790.961 0.923 0.945 0.900 0.912 0.940 S4 0.943 0.965 0.903 1.000 0.956 0.984 0.912 0.9080.9780.9460.9510.9220.9450.9380.9100.956 0.904 0.971 0.984 0.986 0.913 S5 0.928 0.932 0.918 0.956 1.000 0.900 0.912 0.9340.9720.9210.9170.9280.9460.9170.9240.923 0.942 0.907 0.924 0.923 0.958 S6 0.967 0.906 0.943 0.984 0.900 1.000 0.952 0.9750.9510.9430.9830.9730.9450.9760.9180.953 0.928 0.945 0.915 0.942 0.947 S7 0.992 0.912 0.928 0.912 0.912 0.952 1.000 0.9010.9220.9130.9070.9230.9420.9340.9480.909 0.943 0.972 0.924 0.934 0.977 S8 0.924 0.922 0.953 0.908 0.934 0.975 0.901 1.0000.9170.9280.9340.9240.9350.9720.9240.907 0.903 0.918 0.944 0.942 0.973 S9 0.977 0.986 0.942 0.978 0.972 0.951 0.922 0.9171.0000.9120.9030.9180.9760.9710.9240.934 0.927 0.908 0.934 0.957 0.941 S10 0.946 0.964 0.961 0.946 0.921 0.943 0.913 0.9280.9121.0000.9340.9060.9130.9080.9820.936 0.938 0.986 0.908 0.935 0.958 S11 0.973 0.921 0.921 0.951 0.917 0.983 0.907 0.9340.9030.9341.0000.9770.9460.9180.9230.943 0.941 0.906 0.973 0.921 0.966 S12 0.931 0.908 0.943 0.922 0.928 0.973 0.923 0.9240.9180.9060.9771.0000.9100.9730.9140.900 0.941 0.934 0.912 0.975 0.907 S13 0.906 0.991 0.957 0.945 0.946 0.945 0.942 0.9350.9760.9130.9460.9101.0000.9170.9720.906 0.982 0.913 0.945 0.956 0.911 S14 0.913 0.942 0.988 0.938 0.917 0.976 0.934 0.9720.9710.9080.9180.9730.9171.0000.9210.934 0.907 0.911 0.943 0.954 0.938 S15 0.943 0.947 0.979 0.910 0.924 0.918 0.948 0.9240.9240.9820.9230.9140.9720.9211.0000.919 0.911 0.943 0.907 0.925 0.907 S16 0.911 0.951 0.961 0.956 0.923 0.953 0.909 0.9070.9340.9360.9430.9000.9060.9340.9191.000 0.953 0.907 0.924 0.966 0.973 S17 0.994 0.940 0.923 0.904 0.942 0.928 0.943 0.9030.9270.9380.9410.9410.9820.9070.9110.953 1.000 0.917 0.911 0.907 0.945 S18 0.986 0.967 0.945 0.971 0.907 0.945 0.972 0.9180.9080.9860.9060.9340.9130.9110.9430.907 0.917 1.000 0.904 0.928 0.934 S19 0.947 0.981 0.900 0.984 0.924 0.915 0.924 0.9440.9340.9080.9730.9120.9450.9430.9070.924 0.911 0.904 1.000 0.944 0.987 S20 0.937 0.993 0.912 0.986 0.923 0.942 0.934 0.9420.9570.9350.9210.9750.9560.9540.9250.966 0.907 0.928 0.944 1.000 0.947对照谱 0.943 0.904 0.940 0.913 0.958 0.947 0.977 0.9730.9410.9580.9660.9070.9110.9380.9070.973 0.945 0.934 0.987 0.947 1.000
2.7 仙茅苷量的测定
取上述20批仙茅样品,每批3份,按“2.3”项下方法制备供试品溶液,按“2.1”项下色谱条件进样分析,计算仙茅苷的量,结果见表7。
表7 20批仙茅中仙茅苷测定结果(n=3)
Tab. 7 Determination results of 20 batches of Curculigins Rhizoma(n=3) mg·g-1

样品编号 仙茅苷 样品编号 仙茅苷S1 0.479 S11 0.565 S2 0.276 S12 0.852 S3 1.057 S13 0.304 S4 0.968 S14 1.038 S5 0.118 S15 0.818 S6 0.285 S16 0.195 S7 0.862 S17 0.282 S8 0.424 S18 0.565 S9 0.656 S19 0.639 S10 0.201 S20 0.764
3 讨论
3.1 色谱柱的选择
比较了 3个不同厂家 C18色谱柱 Thermo Syncronis C18(100 mm×3 mm,3 μm)、Agilent Zorbax Rapid Resolution HT SB-C18(100 mm×3 mm,1.8 μm)、phenomenex Kinetex XB-C18(100 mm×4.6 mm,2.6 μm)对样品的分离效果,在同等的梯度洗脱条件下,Thermo Syncronis C18的分离效果较好。上述 Agilent色谱柱的开发理念在于缩短UPLC分析时间,phenomenex色谱柱的含碳量为10%,而Thermo这款色谱柱的含碳量高达16%,金属杂质量较低。反相色谱柱含碳量越高,说明硅胶上键合有机相越多,溶质的 K值越大,保留越强,分离度越高。保留强可能造成拖尾等峰畸变,但通过有效控制金属杂质量来保证硅胶纯度起到了防止拖尾的作用。本研究采用了 Thermo Syncronis C18色谱柱,色谱分离和峰形都达到了较好的效果。
3.2 检测波长的选择
供试品溶液在200~400 nm进行全波长扫描,并对各波长下的色谱图进行分析比较。结果表明,在285 nm下各特征峰数量较多,峰形较好,各峰分离良好,因此选择285 nm为指纹图谱测定波长。20批药材指纹图谱中,共标定了15个共有峰,共有峰面积占总峰面积的 80%以上,非共有峰中发现仅10批样品存在保留时间为24.75和29.86 min的峰,且峰面积相差较大,说明不同产地的仙茅药材在成分上稍有差异。
本研究利用ASE 350快速溶剂萃取系统萃取样品,并优化了ASE的萃取条件,中国药典2015年版仙茅中仙茅苷含量测定的提取需回流2 h,在本实验中仅用了 15 min,大大缩短了提取时间,提取效率高,仪器操作简单方便,安全性好,自动化程度高且环保,提取液无需过滤浓缩,可用于仙茅药材的综合质量评价。
REFERENCES
[1] 中国药典. 一部[S]. 2015: 102.
[2] 杨光义, 叶方, 潘红, 等. 仙茅药理作用和临床应用研究概述[J]. 中国药师, 2011, 14(7): 1039-1041.
[3] CHENG Z Q, LIU X X, YI X H, et al. Research progress on chemical constituents of Genus curculigo [J]. J Guilin Coll Edu(桂林师范高等专科学校学报), 2012, 23(3): 163-169.
[4] ZENG Q, JI H. Simultanous determination of curculigoside and curculigoside B in the rhizome of Curculigo orchioides from different regions by HPLC-DAD [J]. J Pharm Pract(药学实践杂志), 2010, 28(3): 196-198.
[5] WANG Y, LIU L, XUN J L, et al. Simultaneous determination of phenolic glycosides in Curuligins Rhizoma by HPLC [J].China Pharm J(中国药学杂志), 2012, 47(5): 375-379.
[6] ZHU M, CHEN B L, SHI S M. Application of fingerprint technology on traditional Chinese medicine in Chinese phamacopoeia (2015 edition) volume Ⅰ [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2016, 33(5): 611-614.
[7] MA P, LI L Y, YU Q, et al. Studies on HPLC fingerprints of curculigo orchioides from different regions [J]. China Pharmacy(中国药房), 2011, 22(39): 3692-3694.
[8] PAN X. Studies on the fingerpoint of Rhizoma Curculiginis [J].Strait Pharm J(海峡药学), 2003, 15(4): 36-37.
[9] LI L Y, MA P, YU Q, et al. Quality standards of Curculigo orchioides [J]. China Pharmacy(中国药房), 2011, 22(43):4068-4071.
[10] 唐正平, 李秀兰, 周晓非, 等. 高效液相色谱法测定仙茅超微饮片中仙茅苷的含量[J]. 湖南中医药杂志, 2002, 18(4):52.
Contents Determination of Curculigoside and Fingerprint Chromatograms of Curculiginis Rhizoma by ASE-HPLC









