近年来,糖尿病患者日趋增多,且随着糖尿病患者病程的持续,其胰岛β细胞数量逐渐减少,胰岛β细胞功能呈进行性下降。细胞凋亡是胰岛β细胞数量减少的最终形式,而胰岛 β细胞衰竭所致的胰岛素分泌不足是血糖升高的主要原因,这表明调节胰岛β细胞衰竭机制是治愈2型糖尿病的关键。c-Jun氨基端激酶(c-Jun N-terminal kinase,JNK)作为一类促凋亡激酶,参与了死亡受体通路、线粒体凋亡通路、内质网通路及氧化应激介导的胰岛β细胞凋亡。由此,JNK信号通路可作为调控胰岛 β细胞凋亡的一个重要节点,选择性抑制JNK的活性或抑制 JNK上下游某个信号分子,极有可能为糖尿病在临床上的治疗提供一个新途径。
1 JNK的结构和活性调节
1.1 JNK的结构
JNK属于丝裂原活化蛋白激酶(mitogenactivated protein kinases,MAPKs)超家族[1],对细胞的生长、分化和凋亡具有调节作用。JNK具有JNK1、JNK2和 JNK3 3种分子形式,分别由MAPK8、MAPK9和MAPK10基因编码,隶属丝氨酸/苏氨酸蛋白激酶。JNK1和JNK2在机体内诸多组织中广泛表达,而JNK3仅存在于脑、心脏、睾丸中。另外,应激状态下JNK1优先磷酸化c-jun,调高JNK转录活性,激活应激通路;而JNK2仅仅在正常情况下表达。
1.2 JNK活性调节
一般而言,JNK定位于胞浆,JNK信号通路通过三级酶促级联反应而激活,即MAPK激酶的激酶(MAPK kinase kinase,MAPKKK)-MAPK激酶(MAPK kinase,MAPKK)-MAPK[2]。当细胞受到高糖高脂、炎症、镉等重金属离子、G-蛋白耦联受体以及胰岛淀粉样多肽[3]等外界刺激后,MAPKK通过双磷酸化JNK Ⅷ区苏氨酸Thr-183、酪氨酸Tyr-185位点激活JNK。活化的JNK与c-Jun氨基末端结合后转移至细胞核,使后者磷酸化增强,促进了基因表达和蛋白质合成,发挥相应的生物学效应[4]。除此之外,JNK还能激活核内其他转录因子,如 c-myc、基质金属蛋白酶Ets相似蛋白(ELK-1)、转录激活因子 2(ATF-2)、p53等,进一步的研究发现还包括细胞质中的凋亡调节蛋白Bcl-2、Bcl-xL、Bim、BAD等。在大多数情况下,JNK发挥促凋亡作用。
2 JNK信号通路与细胞凋亡
细胞凋亡是基因调控下细胞正常的死亡过程。JNK信号通路作为调节细胞凋亡的一个重要节点,在细胞凋亡过程中发挥重要作用。应激情况下,JNK能介导各种细胞外刺激诱导的细胞凋亡,并参与多种细胞凋亡的过程,因此与多种疾病有着直接或间接的联系。
在阿尔兹海默症患者脑内,会出现异常增多的老年斑,其主要成分是 β淀粉样蛋白,可以直接激活 JNK诱导神经细胞死亡[5];与正常细胞相比,在霍奇金淋巴瘤细胞中JNK的活性会明显升高,这说明JNK可能与肿瘤的形成有很大关联,其机制可能与 JNK的激活促进细胞增殖有关[6];JNK在促进心肌细胞凋亡过程中主要是激活线粒体途径介导细胞凋亡[7];而 JNK对肝细胞的促凋亡作用,不仅激活了线粒体途径,还激活了死亡受体途径[8];JNK对胰岛β细胞的促凋亡机制主要有 2种,一种是通过死亡受体途径上调促凋亡蛋白的表达;另一种是作用于线粒体途径。
3 JNK信号通路与胰岛β细胞凋亡
研究表明,JNK能多途径调节胰岛 β细胞的功能[9]。如细胞因子白介素-1(IL-1β)可特异性激活JNK信号通路,造成胰岛β细胞死亡[10],其中,JNK的激活具有钙离子(Ca2+)依赖性。除此之外,JNK对氧化应激也具有调节介导作用。在糖尿病小鼠中,自由基聚集诱发的氧化应激可激活 JNK信号通路, 诱使胰岛素基因转录因子(PDX-1)转移至胞浆抑制其表达,使用 JNK抑制剂 SP600125可使 JNK活性降低。
目前,JNK介导 β细胞凋亡的信号通路有 3条:一是通过调节下游凋亡相关蛋白的表达而介导的死亡受体途径;二是通过直接调节细胞质内凋亡蛋白家族的活性(如BH-3 only,Bcl-2等)而介导的线粒体途径;三是通过内质网未折叠蛋白反应而介导的内质网应激(endoplasmic reticulum stress,ERS)凋亡途径。表面上这3条信号通路是分开的,事实上这 3条信号通路并不完全独立,它们之间通过特定的分子进行交流。
3.1 死亡受体途径:JNK→Fas/FasL→caspase-8→β细胞凋亡
活化后的JNK会激活死亡配体 FasL,并与受体 Fas结合,促使 caspase-8前体(半胱天冬酶 8)断裂并激活,从而启动 caspase家族促凋亡级联反应,启动死亡受体通路[11],见图1。与传统观点相悖的是Fas/FasL结合干预并不参与NOD小鼠糖尿病过程;据报道[12],细胞内Fas/FasL结合干预具有凋亡时限性,早期凋亡发挥防御功能,晚期凋亡发挥致死性作用。有研究表明[13],在胰淀素转基因胰岛中,使用 JNK抑制剂后 Fas和 Fadd mRNA水平分别减少74%和48%,这说明JNK对死亡受体途径的调节至关重要。IL-1β介导HIAPP引起Fas上调,激活caspase-8诱导β细胞凋亡,这表明caspase-8是死亡受体通路激活的必经之路[14]。
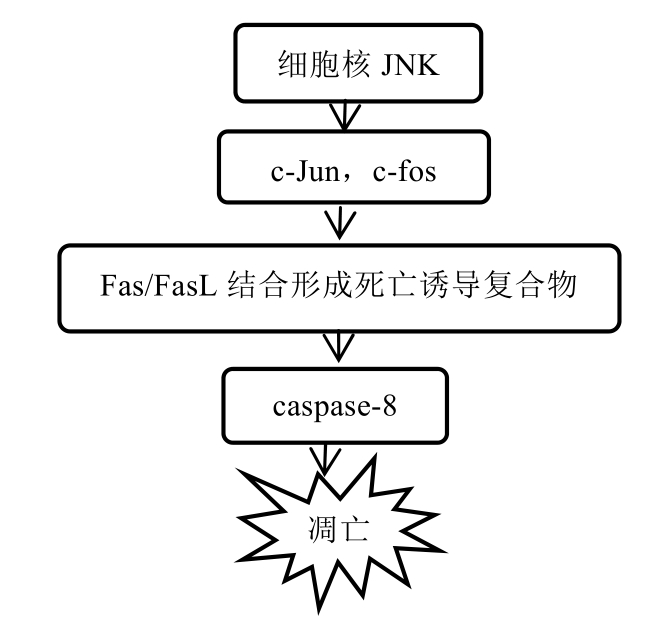
图1 JNK介导的死亡受体途径
Fig. 1 JNK mediated death receptor pathway
Fas不仅是JNK的作用位点,也是NF-κB的靶基因位点。和其他类型细胞相比,NF-κB在胰岛β细胞中发挥促凋亡效应。核转录因子 NF-κB在细胞因子集合干扰下,通过上调死亡受体 Fas启动死亡受体途径诱导β细胞凋亡。其中,IL-1β比TNF-α更快激活NF-κB,胰岛β细胞比其他细胞更早地激活 NF-κB,通过调节下游相关死亡受体的表达介导β细胞凋亡[15]。
3.2 线粒体凋亡途径:JNK→Bim→Bax→Cyt-C→caspase-9→caspase-3 →细胞凋亡
线粒体具有类似发电站的强大功能,不仅是细胞能量和代谢的中心,同时又参与细胞氧化损伤。在不同刺激源的干预下,活化的JNK可作用于下游凋亡相关蛋白引起线粒体不同程度的损伤。细胞质中活化的 JNK 可进入细胞核激活c-Jun、p53等转录因子诱导胰岛β细胞凋亡;也可以通过直接磷酸化Thr167位点[16],或者直接激活Bax,活化的Bax从细胞质迅速转入到线粒体外膜使其通透性转变孔过度开放,造成Cyt-C、线粒体促凋亡蛋白(Smac)等促凋亡因子释放至细胞质与凋亡诱导因子结合变为Cyt-C-Apaf1- procaspase-9凋亡体复合物,触发 caspase级联反应,诱导胰岛β细胞的凋亡。Bax是线粒体途径中的重要促凋亡蛋白,同时也是一个可抑制靶点[17],见图2。
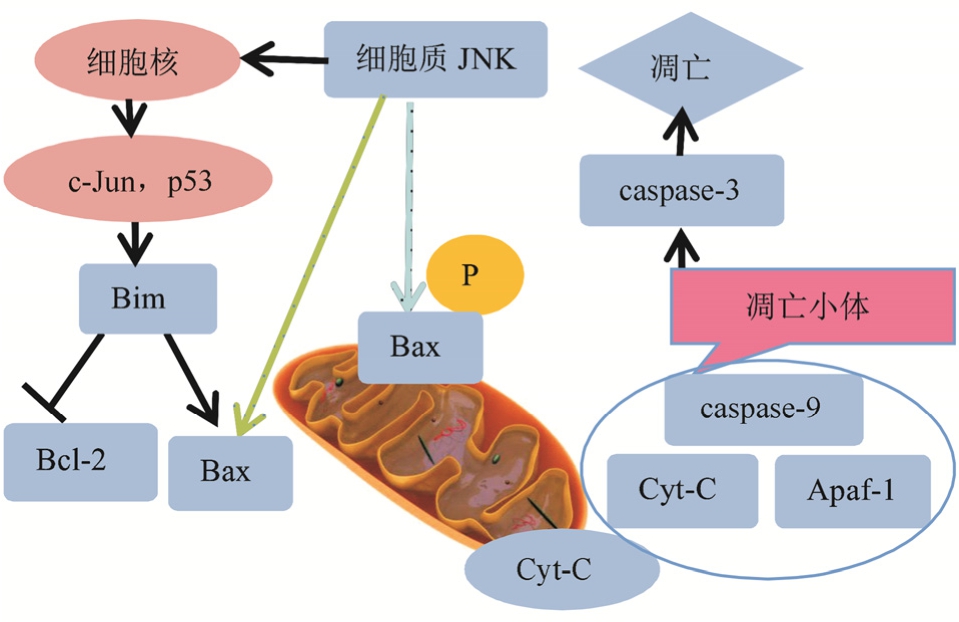
图2 JNK介导的线粒体途径
Fig. 2 JNK mediated mitochondrial pathway
在高糖作用下,胰岛β细胞系RIN-5F细胞中促炎性因子表达上升,活性氧(reactive oxygen species,ROS)浓度增高,Bax磷酸化表达增强诱导细胞凋亡[18]。近些年对Bcl-2/Bax凋亡蛋白比例的研究不断深入,据报道[19],当凋亡蛋白的比例接近于 1时,提示蛋白表达处于相对平衡,细胞处于存活状态;当凋亡蛋白的比例<1时,提示蛋白表达处于激活状态,细胞进入凋亡状态。在胰岛β细胞系MIN6细胞中,高糖和铁浓度上升后会引起 Bcl-2/Bax比例下降,引起细胞凋亡数量增多[20]。GLP-1类似物在STZ诱导或高糖刺激下通过下调Bcl-2/Bax比例缓解细胞凋亡[21]。
3.3 ERS反应性凋亡途径:ERS→CHOP,IRE1-JNK,caspase-12→细胞凋亡
3.3.1 ERS ERS一般指细胞受到外界刺激因素刺激后内环境发生紊乱的一种病理状态。适度的ERS会改善内质网稳态,过度的ERS会引起内质网内环境紊乱,促进 β细胞凋亡增多,从而触发糖尿病的发生、发展。
3.3.2 ERS通路 β细胞具有高度发达的内质网,对应激压力尤为敏感。一般情况下,内质网跨膜蛋白内质网肌醇需求激酶 1(inositol- requiring enzyme-1,IRE1)、双链 RNA依赖性蛋白激酶样内质网激酶(PRKR-like endoplasmic reticulum kinase,PERK)、激活转录因子 6 (activating transcription factor 6,ATF6)、N末端与分子伴侣重链结合蛋白(immunoglobulin heavy chain binding protein,Bip)连接,正常处于未激活状态,可以感知ERS信号并将其传入胞质和胞核,使细胞在应激下得以生存。细胞受到外界刺激后,Bip与跨膜蛋白分离,并与UPR连接,通过触发ERS通路诱导胰岛β细胞凋亡。据报道,ATF6可能具有抗凋亡作用[22]。细胞中 ATF6基因敲除后,细胞内UPR信号强度增加,缓解应激的同时胰岛β细胞数量增加,说明 ATF6很可能是一个重要的抑制靶点[23]。
ERS时,C/EBP同源蛋白(C/EBP homologous protein,CHOP)表达增强,通过调节 Bcl-2蛋白以及ROS介导β细胞凋亡[24]。 CHOP诱导表达的内质网氧化物蛋白(endoplasmic oxidoreductin1 like protein,ERO1α)能激活内质网钙离子通道,使钙离子释放至胞浆增多,钙离子作为应激因素通过调节Bcl-2蛋白介导胰岛β细胞凋亡[25];这提示Bcl-2凋亡蛋白介入ERS CHOP通路的原因可能是钙离子过度释放。另外,ERS诱导 CHOP及下游靶基因 ERO1α的高表达,会使内质网腔呈高度氧化状态,诱发一系列炎症反应介导胰岛β细胞凋亡[26]。过度的ERS通过激活IRE1,诱使caspase-12磷酸化激活,最终引起β细胞凋亡[27];此外,活化的 IRE1也可结合 TRAF2或形成 IRE1-TRAF2-ASK1复合物从而激活JNK信号通路介导胰岛β细胞凋亡。IRE1α基因被敲除后[28],JNK磷酸化水平下降,提示IRE1α是JNK信号通路激活必不可少的因素之一。泛素 D(UBD)可以调节 IRE1α- JNK通路,作为一种负反馈信号调控IRE1α- JNK,减少JNK磷酸化,减少胰岛β细胞凋亡,发挥抗凋亡作用[29]。在胰岛素抵抗小鼠模型中,持续的高糖高脂通过增强CHOP表达及激活IRE1α-JNK信号通路诱导β细胞凋亡。
在胰岛β细胞凋亡过程中,caspase-3作为ERS通路的活化终点,提示ERS激活信号很可能被传递到线粒体上,说明内质网通路和线粒体通路在诱导 β细胞凋亡过程中可能存在一定联系。ERS通路和线粒体凋亡通路在介导 β细胞凋亡时表面上互不依赖,事实上在介导 β细胞凋亡过程中会产生“串扰”现象。有很多实验现象表明[30],在细胞凋亡的早期,细胞质中钙离子的持续升高会激活JNK,活化的JNK通过磷酸化Bax诱导β细胞凋亡。同时,活化的JNK会进一步促进钙离子释放,引起线粒体膜通透性增加,从而激活线粒体凋亡通路[31];另外,钙离子浓度升高会直接激活ERS通路,通过caspase-12和CHOP 2条路径共同介导β细胞凋亡[32]。钙离子作为线粒体单向传递体在ERS通路和线粒体凋亡通路之间穿梭,虽然这 2个器官之间交流的具体成分并不清楚,但钙离子似乎是联系这2个器官交流的重要靶点。提示钙离子可能是连接内质网通路和线粒体通路的重要中枢。ERS诱导β细胞凋亡通路见图3。

图3 ERS诱导β细胞凋亡通路
Fig. 3 ERS induces beta cell apoptosis pathway
4 JNK介导的氧化应激途径
ROS族作为线粒体产能的重要原料,与细胞凋亡密切相关。糖尿病状态下,高血糖、糖基化终末产物通过酶或非酶途径使自由基产生增多,诱发氧化应激[33]。氧化应激一般可通过凋亡信号调节激酶 1(apoptosis signal-regulating kinase1,ASK1)、Src酪氨酸激酶等蛋白通路激活 JNK,活化的JNK通过招募TRAF2与信号转导及转录激活蛋白(signal transducer and activator of transcription 3,STAT3)造成线粒体氧化损伤,增加线粒体细胞膜通透性,激活 caspase级联反应介导β细胞凋亡[34]。其中,STAT3是一种重要的抗凋亡因子,STAT3缺失的小鼠对氧化应激更为敏感,凋亡率更高。研究表明,氧化应激引起的 JNK活化可调节细胞中增强子结合蛋白(4EBP-1)的表达和磷酸化,有研究发现[35]增加4EBP-1活性会促进β细胞在氧化应激下的存活,此过程有 IRS- PI3 K-Akt-mTOR通路的参与。另外,JNK信号通路还可以介导 Toll样受体4(toll like receptor 4,TRL4)途径发挥促凋亡作用。 Shen等[36]的研究表明,胰岛β细胞在棕榈酸(palmitic acid,PA)干预下可通过 TRL4依赖途径激活 JNK,诱导β细胞凋亡,使用 JNK抑制剂可降低 JNK表达,同时抑制 PA诱导的细胞凋亡。说明TRL4-JNK信号通路也是诱导胰岛β细胞凋亡的一个重要途径。JNK介导的氧化应激通路见图4。

图4 JNK介导的氧化应激通路
Fig. 4 JNK mediated oxidative stress pathway
5 结语
目前,对JNK信号通路介导细胞凋亡的研究愈来愈深,越来越多的JNK调节因子和下游作用底物也相继出现,这使人们对JNK的认识又更深一步,在病理研究中奠定了良好的基础作用。细胞内JNK的活化既是一种生长信号,也是一种促凋亡信号,而决定细胞最终命运的是JNK被何种上游刺激源激活以及与何种下游分子结合作为底物。在细胞凋亡中,JNK介导的凋亡机制和途径也不一样,如在调节神经、肝、癌细胞凋亡中,有的可激活死亡受体途径,有的会激活线粒体途径。JNK对与细胞凋亡有直接或间接关系的疾病具有重要调节作用,因此需要更深入探究JNK信号通路与细胞凋亡及疾病的发生机制,从而提供更多治疗方法。
REFERENCES
[1] COUTO D, FREITAS M, PORTO G, et al. Polyacrylic acid-coated and non-coated iron oxide nanoparticles induce cytokine activation in human blood cells through TAK1, p38 MAPK and JNK pro-inflammatory pathways [J]. Arch Toxicol,2015, 89(10): 1759-1769.
[2] TOMITA T. Apoptosis in pancreatic β-islet cells in Type 2 diabetes [J]. Bosn J Basic Med Sci, 2016, 16(3): 162-179.
[3] WANG J, PAN C, WANG Y, et al. Genome-wide identification of MAPK, MAPKK, and MAPKKK gene families and transcriptional profiling analysis during development and stress response in cucumber [J]. BMC Genomics, 2015, 16(1): 386-406.
[4] 江震, 沈喜妹, 杨立勇, 等. c-Jun氨基末端激酶信号通路与胰岛 β细胞凋亡[J]. 福建医科大学学报, 2016, 50(5):345-348.
[5] AKHTER R, SANPHUI P, DAS H, et al. The regulation of p53 up-regulated modulator of apoptosis by JNK/c-Jun pathway in β-amyloid-induced neuron death [J]. J Neurochem,2015, 134(6): 1091-1103.
[6] LEVENTAKI V, DRAKOS E, KARANIKOU M, et al. c-JUN N-terminal kinase (JNK) is activated and contributes to tumor cell proliferation in classical Hodgkin lymphoma [J]. Human Pathol, 2014, 45(3): 565-572.
[7] AOKI H, KANG P M, HAMPE J, et al. Direct activation of mitochondrial apoptosis machinery by c-Jun N-terminal kinase in adult cardiac myocytes [J]. J Biol Chem, 2002, 277(12):10244-10250.
[8] JIAO F, ZHANG Q, MO W, et al. Salidroside pretreatment attenuates apoptosis and autophagy during hepatic ischemia-reperfusion injury by inhibiting the mitogen-activated protein kinase pathway in mice [J]. Drug Des Devel Ther, 2017(11): 1989-2006.
[9] LUNDH M, BUGLIANI M, DAHLBY T, et al. The immunoproteasome is induced by cytokines and regulates apoptosis in human islets [J]. J Endocrinol, 2017, 233(3):369-379.
[10] BROZZI F, NARDELLI T R, LOPES M, et al. Cytokines induceendoplasmic reticulum stress in human, rat and mouse beta cells via different mechanisms. [J]. Diabetologia, 2015,58(10): 2307-2316.
[11] 李岚, 王东. Fas/FasL介导的胰岛β细胞凋亡的研究进展[J].医学综述, 2011, 17(8): 1124-1126.
[12] MORAGIRAL C, WONG F, PANOSA A, et al. Early overexpression of FAS in beta cells protects NOD mice from autoimmune diabetes (BA6P.119) [J]. J Immunology, 2015,194(1 Suppl): 114-122.
[13] SUBRAMANIAN S L, HULL R L, ZRAIKA S, et al. cJUN N-terminal kinase (JNK) activation mediates islet amyloid-induced beta cell apoptosis in cultured human islet amyloid polypeptide transgenic mouse islets [J]. Diabetologia,2012, 55(1): 166-174.
[14] PARK Y J, WOO M, KIEFFER T J, et al. Caspase-8在淀粉样蛋白诱导人类和小鼠胰岛 β细胞凋亡中的作用[J]. 中国糖尿病杂志, 2014, 6(11): 139-140.
[15] ORTIS F, CARDOZO A K, CRISPIM D, et al.Cytokine-induced proapoptotic gene expression in insulin-producing cells is related to rapid, sustained, and nonoscillatory nuclear factor-kappaB activation [J]. Mol Endocrinol, 2006, 20(8): 1867-1879.
[16] YU D M, AN S, YANG Y, et al. The role of JNK kinase in apoptosis and its relationship with cancer [J]. Chin Pharmcol Bull(中国药理学通报), 2015, 31(12): 1641-1645.
[17] MARIMUTHU P, SINGARAVELU K. Deciphering the crucial residues involved in heterodimerization of bak peptide and anti-apoptotic proteins for apoptosis [J]. J Biomol Struct Dyn, 2017, 2(5): 1-12.
[18] ALSHATWI A A, SUBASHBABU P. Aloe-emodin protects RIN-5F (Pancreatic beta-cell) cell from glucotoxicity via regulation of pro-inflammatory cytokine and downregulation of bax and caspase 3 [J]. Biomol Ther, 2016, 24(1): 49-56.
[19] RENAULT T T, TEIJIDO O, ANTONSSON B, et al.Regulation of Bax mitochondrial localization by Bcl-2 and Bcl-x(L): keep your friends close but your enemies closer [J].Int J Biochem Cell Biol, 2013, 45(1): 64-67.
[20] FUENTES M, ANDREWS M. Effects of high iron and glucose concentrations over the relative expression of Bcl2,Bax, and Mfn2 in MIN6 cells [J]. Biol Trace Elem Resh, 2013,153(1): 390-395.
[21] GABALLAH H H, ZAKARIA S S, MWAFY S E, et al.Mechanistic insights into the effects of quercetin and/or GLP-1 analogue liraglutide on high-fat diet/streptozotocin-induced type 2 diabetes in rats [J]. Biomed Pharmacother, 2017(92):331.
[22] XIANG Z Y, LIN S M, REN S, et al. Progress on effects of endoplasmic reticulum stress and inflammation on apoptosis of beta cells in type 2 diabetes [J]. Prog Veter Med(动物医学进展), 2016, 37(6): 91-94.
[23] TEODORO T, ODISHO T, SIDOROVA E, et al. Pancreatic β-cells depend on basal expression of active ATF6α-p50 for cell survival even under nonstress conditions [J]. Am J Physiol Cell Physiol, 2012, 302(7): C992-1003.
[24] LI Y, GUO Y, TANG J, et al. New insights into the roles of CHOP-induced apoptosis in ER stress [J]. Acta Biochim Biophys Sin, 2015, 47(2): 629-640.
[25] GUO G, MENG Y, TAN W, et al. Induction of apoptosis coupled to endoplasmic reticulum stress through regulation of CHOP and JNK in bone marrow mesenchymal stem cells from patients with systemic lupus erythematosus [J]. J Immunol Res,2015(2015): 1837-1838.
[26] NEMCOVA-FURSTOVA V, BALUSIKOVA K, SRAMEK J,et al. Caspase-2 and JNK activated by saturated fatty acids are not involved in apoptosis induction but modulate ER stress in human pancreatic β-cells [J]. Cell Physiol Biochem, 2013,31(2/3): 277-289.
[27] CUI W, MA J, WANG X, et al. Free fatty acid induces endoplasmic reticulum stress and apoptosis of β-cells by Ca2+/calpain-2 pathways [J]. Plos One, 2013, 8(3): e59921.
[28] BROZZI F, NARDELLI T R, LOPES M, et al. Cytokines induce endoplasmic reticulum stress in human, rat and mouse beta cells via different mechanisms [J]. Diabetologia, 2015,58(10): 2307-2316.
[29] BROZZI F, GERLO S, GRIECO F A, et al. Ubiquitin D regulates IRE1/JNK-dependent apoptosis in pancreatic beta cells [J]. J Biol Chem, 2016, 4(9): 1-35.
[30] WANG L J, TIAN K C, WU W W, et al. Recent advances on the signal transduction pathways of apoptosis [J]. China Anim Husbandry Veter Med(中国畜牧兽医), 2011, 38(10):132-135.
[31] WANG Q, ZHANG H, ZHAO B, et al. IL-1beta caused pancreatic beta-cells apoptosis is mediated in part by endoplasmic reticulum stress via the induction of endoplasmic reticulum Ca2+ release through the c-Jun N-terminal kinase pathway [J]. Mol Cell Biochem, 2009, 324(1/2): 183-190.
[32] 李娟, 陈庄. Caspase家族与2型糖尿病胰岛β细胞凋亡的关系[J]. 中外医学研究, 2016, 14(4): 154-155.
[33] ZHANG W G, HAN G, WANG B, et al. Effect of curcumin solid dispersion on oxidative stress in diabetic rats [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2010, 27(1): 13-15.
[34] PRAUSE M C, BERCHTOLD L A, URIZAR A I, et al.TRAF2 mediates JNK and STAT3 activation in response to IL-1β and IFNγ and facilitates apoptotic death of insulin-producing β-cells [J]. Mol Cell Endocrinol, 2015, 420:24-36.
[35] OMINAGA R, YAMAGUCHI S, SATAKE C, et al. The JNK pathway modulates expression and phosphorylation of 4E-BP1 in MIN6 pancreatic beta-cells under oxidative stress conditions[J]. Cell Biochem Func, 2010, 28(5): 387-393.
[36] SHEN X, YANG L, YAN S, et al. Fetuin A promotes lipotoxicity in β-cells through the TLR4 signaling pathway and the role of pioglitazone in anti-lipotoxicity [J]. Mol Cell Endocrinol, 2015(412): 1-11.