脑缺血再灌注损伤(cerebral ischemiareperfusion injury,I/R)严重危害患者的身体健康,有较高的致死致残率。其发病机制复杂,与氧化损伤、炎症损伤、兴奋性氨基酸毒性、钙超载等多种机制相关[1]。I/R发生后,神经元的损伤、凋亡严重影响患者愈后及未来的生存质量。神经元的凋亡与氧化应激关系密切,抗氧化治疗可以降低氧化应激带来的损伤,从而降低神经元的凋亡[2]。
刺芒柄花素(formononetin,FOR)是红车轴草的主要有效成分,属于异黄酮类成分。FOR具有多种药理活性,如抑制肿瘤、抗氧化、抗高血压及雌激素样作用[3]。有研究发现,FOR对缺血再灌注损伤的肾脏具有保护作用,其机制与抗氧化有关[4]。FOR在I/R中的作用还未曾有文献报道,因此本研究根据FOR对I/R的保护作用进行研究,并探讨其可能的机制。
1 材料
1.1 动物
50只健康成年 SD大鼠,♂,体质量(250±20)g,SPF级,购自重庆医科大学动物实验中心,实验动物许可证号:SYXK(渝)2012-0001,本批次大鼠合格证号:0001813,SPF级饲养条件。
1.2 药物和试剂
FOR(陕西慈缘生物技术有限公司,批号:20160423;含量≥98%),将FOR溶解于蒸馏水中,配成25 mg·mL-1的溶液,备用;NO及NOS试剂盒(南京建成生物工程研究所,批号分别为20151112、20160105);caspase-3,Bcl-2、Bax 及β-actin抗体(美国Cell Signaling Technology公司,批号:20160220、20160304、20160328)。
1.3 仪器
DB096型大鼠跳台(安徽正华);ELx808型酶标仪(美国 BioTek公司);170-1870型凝胶成像系统(美国 Bio-Rad公司);AL104型电子天平(Mettler-Toledo公司);DYCZ-24DN型Western blot垂直电泳仪(北京六一生物科技有限公司)。
2 方法
2.1 分组与干预
将大鼠随机分为假手术组、I/R组、FOR高、中、低剂量组(100,50,20 mg·kg-1),每组10只。FOR各组于造模前每日分别灌胃 100,50和20 mg·kg-1的FOR溶液,连续灌胃7 d,每日1次,同时假手术组和I/R组灌胃相应体积的蒸馏水。
2.2 大鼠I/R模型的制备
4%的水合氯醛腹腔注射麻醉大鼠,仰卧固定于鼠板上,颈部除毛,参考文献[5]的MCAO法,将大鼠颈中剪1 cm长切口,分离右侧颈总、颈外和颈内动脉。分离后用手术线将颈总动脉扎紧,再将颈外动脉Y型分离处用手术线扎紧。在颈总动脉上开一V型小口,将准备好的线栓从颈总动脉缓慢插入颈内动脉,感到阻力后停止,再将线栓捆绑固定颈内动脉内,缝合伤口。大鼠脑缺血2 h后,拔出线栓,待恢复血供 24 h。假手术组除不插入线栓外,其余方法同。
2.3 神经功能评分
再灌注24 h后,经Longa 5分评分法对大鼠进行神经功能评分。无神经功能障碍,活动正常者记0分;左前肢无法完全伸直者记1分;爬行时向左转圈者记2分;爬行时向左倾倒者记3分;不能行走,意识丧失者记4分。
2.4 跳台法检测学习记忆能力
将大鼠放入跳台箱中,适应2 min。通入40 V的交流电,从大鼠跳入安全平台开始计时,到大鼠从安全平台跳下为止,这段时间记录为大鼠潜伏期。同时,记录300 s内大鼠跳出安全平台后被电击的次数,记为错误次数。所有大鼠于再灌注24 h后进行跳台实验。
2.5 病理组织形态
3.5 %的水合氯醛以 10 mL·kg-1腹腔注射麻醉,迅速断头取脑,放入 10%甲醛的固定液中,石蜡包埋标本,切片厚度为5 μm,进行HE染色,显微镜下观察大鼠海马区域神经细胞的病理组织形态。
2.6 NO含量水平及NOS活性的检测
将行为学评分后的大鼠断头取血,于 4 ℃静置1 h得血清。严格按照NO及NOS试剂盒说明书的步骤进行检测。
2.7 Western blot法检测 caspase-3,Bcl-2、Bax蛋白表达的情况
大鼠断头取脑后,将大脑制成匀浆,严格按照蛋白提取试剂盒的操作步骤,提取脑组织全蛋白,测定浓度。SDS-PAGE凝胶分离蛋白,经PVDF膜转膜,再用脱脂牛奶进行1 h的封闭。分别加入鼠抗caspase-3、Bcl-2和Bax多克隆抗体(1︰250),孵育过夜,温度为4 ℃,用TBST洗涤3次,每次10 min,洗涤后加入经HRP标记的羊抗兔二抗(1︰500),孵育2 h,再由TBST液洗涤3次,各10 min。完毕后条带经Bio-RAD凝胶分析仪进行图像扫描分析,灰度值用Quantity One进行测定。caspase-3、Bcl-2和Bax与β-actin的灰度值各自的比值表示caspase-3、Bcl-2和Bax蛋白相对表达量。
2.8 统计学分析
实验数据结果以x± s 表示,用SPSS 20.0软件进行分析,组间比较采用 t检验,P<0.05为差异有统计学意义。
3 结果
3.1 大鼠神经功能评分及学习记忆检测结果
假手术组大鼠无神经功能缺损,行为正常;模型组大鼠表现出明显的神经功能损伤症状。与模型组比较,FOR高、中、低剂量组神经功能损伤明显降低。模型组和FOR高、中、低剂量组潜伏期较假手术组明显缩短,错误次数较假手术组明显增多(P<0.01)。与模型组相比,FOR高、中、低剂量组潜伏期明显延长,错误次数显著减少(P<0.05 或 P<0.01)。结果见表 1。
表1 各组大鼠神经功评分及学习记忆的检测结果(n=10,x± s )
Tab. 1 Results of nerve work score and step-down test of rats in each group(n=10,x± s )

注:与假手术组比,1)P<0.01;与模型组比较,2)P<0.05,3)P<0.01。Note: Compared with the sham group, 1)P<0.01; compared with the model group, 2)P<0.05, 3)P<0.01.
3.2 NO水平及NOS活性的检测结果
与假手术组相比,其他各组 NO水平显著升高,NOS活性显著增加(P<0.01);与模型组相比,FOR高、中、低剂量组NO水平显著降低,NOS活性显著降低(P<0.01),结果见表2。
表2 各组大鼠 NO含量水平及 NOS活性的检测结果(n=10,x± s )
Tab. 2 The content of NO and the detection of NOS activity in rats of each group(n=10,x± s ) U·gprot-1

注:与假手术组比,1)P<0.01;与模型组比较,2)P<0.01。
Note: Compared with the sham group, 1)P<0.01; compared with the model group, 2)P<0.01.
3.3 病理组织形态结果
模型组细胞的结构和形态异常居多,可观察到细胞肿胀,核固缩。与模型组相比,FOR高、中、低剂量组的脑组织形态显著改善,见图1。
3.4 caspase-3、Bcl-2及Bax蛋白的表达情况
与假手术组相比,各组caspase-3和Bax蛋白表达显著升高(P<0.01),Bcl-2表达显著降低(P<0.01);与模型组相比,FOR高、中、低剂量组caspase-3和Bax蛋白表达显著降低(P<0.01),Bcl-2表达显著增加(P<0.01)。结果见表3和图2。
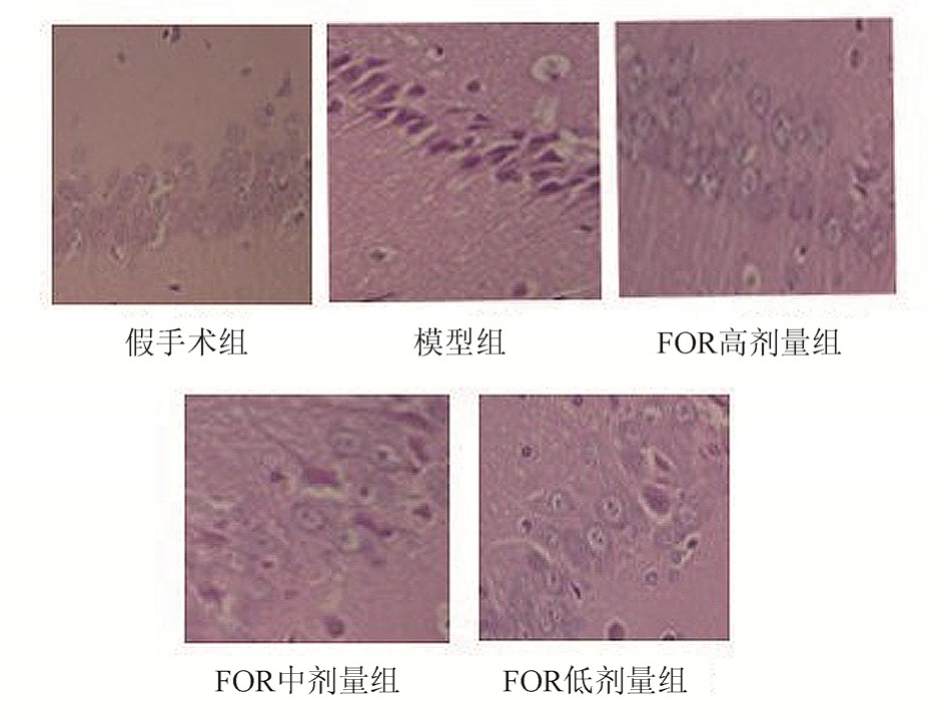
图1 各组大鼠的脑组织HE染色结果(400×)
Fig. 1 HE staining results of brain tissue in each group(400×)
表3 各组大鼠 caspase-3、Bcl-2及 Bax蛋白表达水平的检测结果(n=10,x± s )
Tab. 3 Expression of caspase-3, Bcl-2 and Bax protein in rats of each group(n=10,x± s )

注:与假手术组比,1)P<0.01;与模型组比较,2)P<0.01。
Note: Compared with the sham group, 1)P<0.01; compared with the model group, 2)P<0.01.

图2 FOR各组大鼠caspase-3、Bcl-2及Bax蛋白表达的Western blot图
Fig. 2 Caspase-3, Bcl-2 and Bax protein expression of FOR rats in each group by Western blot
4 讨论
脑血管疾病日益威胁着人类的健康,已成为人类三大致死病因之一,其中I/R在脑血管疾病中约占 75%。脑缺血损伤的致死、致残率都很高,临床上却没有特效药物,因此,开发I/R的保护药物具有重要意义。线栓法是复制缺血性脑血管疾病的经典方法,该方法具有多种优点:不开颅、创伤小、缺血及再灌时间可控、死亡率低等。在本实验中,运用该方法造模死亡率只有4%,本课题组均在第一时间重新造模进行了实验对象的补充。本研究的目的更侧重于FOR作用机制方面的研究,设置假手术组、模型组及不同剂量的 FOR组已经能完成本研究的目的,因此没有设置阳性对照,但若研究重点更关注药物疗效,则应加设阳性对照组。I/R后,大鼠表现主要为学习记忆力减退、肢体障碍、昏迷、死亡等,可通过神经功能评分来判断造模是否成功,也可以评估药物对神经元的保护作用。由于I/R后大鼠的学习记忆能力会减退,因此可以用跳台法检测大鼠的学习记忆能力。本实验结果表明,FOR可以显著降低 I/R大鼠的神经行为学评分,延长大鼠跳台的潜伏期,减少错误次数,表明FOR显著提升I/R大鼠的学习记忆能力。
在I/R的发生和发展中,NO发挥着毒性和保护的双重作用,低浓度时 NO具有扩张血管的作用,可抑制血小板的聚集,从而改善组织的缺血状况,减轻缺血损伤;在高浓度时,NO具有诱导神经细胞凋亡的作用[6]。NO很不稳定,存在时间很短,由于NO是由NOS催化产生,因此对NOS活性进行检测具有重要的参考意义[7]。I/R后,NOS会过度激活产生大量NO,引起神经毒性,从而导致神经元凋亡[8]。通过本实验发现,FOR能显著降低I/R大鼠的NO含量和NOS活性,这可能是FOR发挥神经保护作用的机制之一。
caspase是特异性凋亡信号转导分子,当caspase被激活后可对细胞执行凋亡程序。caspase-3是caspase家族中最关键的凋亡蛋白酶,对凋亡程序的启动起着重要作用[9]。在神经元的凋亡过程中,Bcl-2也发挥着重要作用,Bcl-2作用于caspase-3的上游,且是caspase-3的底物,因此caspase-3和Bcl-2共同调节着细胞的凋亡过程[10]。当 Bcl-2高表达的时候,能抑制细胞的凋亡,而Bax过度表达时,则促进细胞的凋亡[11]。通过本实验研究发现,FOR能显著抑制caspase-3和Bax蛋白的表达,促进 Bcl-2蛋白的表达,说明 FOR具有显著抑制神经元凋亡的作用。
综上所述,FOR能显著降低 I/R大鼠的神经功能评分、提高大鼠的学习记忆能力,改善脑组织的病理形态,发挥一定的神经保护作用,其机制可能与降低 NO水平并抑制 NOS活性,抑制caspase-3和Bax蛋白的表达,促进Bcl-2蛋白的表达有关。
REFERENCES
[1] WU C X, LIU R, DU G H, et al. Relationship between endoplasmic reticulum stress and cerebral ischemia reperfusion injury [J]. Chin Pharmacol Bull(中国药理学通报),2013, 29(5): 601-605.
[2] ZHONG F F, WU C L, SUN X F, et al. Effects of Buyang Huanwu decoction combined with edaravone on the apoptosis of neuron and expression of Bcl-2 and Bax following cerebral ischemia-reperfusion in mice [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2016, 33(11): 1392-1396.
[3] JIE F Y, XUE C K, SHEN K, et al. Effect of formononetin on the expression of estrogen receptor β in aortic arch of castrated rat [J]. China Pharm(中国药师), 2011, 14(9): 1250-1252.
[4] 田心, 常盼, 周亚光, 等. 刺芒柄花素对高糖诱导的小鼠系膜细胞炎症因子调控及增殖的影响[J]. 中成药, 2017, 39(5):1052-1056.
[5] LONGA E Z, WEINSTEIN P R, CARLSON S, et al.Reversible middle cerebral artery occlusion without craniectomy in rats [J]. Stroke, 1989, 20(1): 84-91.
[6] GAO Z J, MIN J, WU X C, et al. Repression of neuronal nitric oxide (nNOS) synthesis by MTA1 is involved in oxidative stress-induced neuronal damage [J]. Biochem Biophys Res Commun, 2016, 479(1): 40-47.
[7] ATANASOVA D Y, DIMITROV N D, LAZAROV N E.Expression of nitric oxide- containing structures in the rat carotid body [J]. Acta Histochem, 2016, 118(8): 770-775.
[8] JIANG Z J, WANG C Y, XIE X, et al. Schizandrin amelioratesovariectomy-induced memory impairment,potentiates neurotransmission and exhibits antioxidant properties [J]. Br J Pharmacol, 2015, 172(10): 2479-2492.
[9] D'AMELIO M, SHENG M, CECCONI F. Caspase-3 in the central nervous system: beyond apoptosis [J]. Trends Neurosci,2012, 35(11): 700-709.
[10] CHEN X, SUN J X, JIANG C W, et al. Research progress on Bcl-2, caspase-3 and Alzheimer’s disease [J]. Clin Med Eng(临床医学工程), 2013, 20(9): 1177-1179.
[11] HUANG Y R, JIN Y L, LI N, et al. Effects of acupoypmy,electroacupuncture or round-sharp acupuncture needle interventions on expression of Bcl-2, Bax, Caspase-3 protein of rectusfemoris in rabbits with knee ostarthritis [J].Acupuncture Res(针刺研究), 2014, 39(2): 100-123.