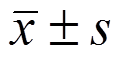 或中位数M(四分位数间距IQR)描述。分类变量的假设检验采用Chi-square或Fisher’s exact test,连续性变量的假设检验采用Student’s test或Mann-Whitney U test。所有检验均为双侧检验,P<0.05认为差异有统计学意义。
或中位数M(四分位数间距IQR)描述。分类变量的假设检验采用Chi-square或Fisher’s exact test,连续性变量的假设检验采用Student’s test或Mann-Whitney U test。所有检验均为双侧检验,P<0.05认为差异有统计学意义。蒋淑莹,张春红,胡卢丰,张秀华*
(温州医科大学附属第一医院,浙江 温州 325000)
摘要:目的探讨接受利奈唑胺治疗住院患者发生相关性血液毒性的危险因素。方法采用单中心、观察性、回顾性研究。收集78例接受利奈唑胺治疗且监测血药浓度的住院患者的临床资料,多因素Logistic回归分析其相关危险因素。结果Logistic回归分析显示利奈唑胺疗程[OR=1.296(1.094~1.53),P=0.003],肾小球滤过率估计值<30 ml·min-1·(1.73 m2)-1[OR=11.582(1.870~71.729),P=0.008]是白细胞减少症的显著危险因素;利奈唑胺首次谷浓度[OR=1.178(1.052~1.318),P=0.005],基础血白蛋白值< 30 g·L-1[OR=4.175(1.315~13.254),P=0.015]是血小板减少症的显著危险因素。结论利奈唑胺相关性白细胞减少症呈时间依赖,相关性血小板减少症呈浓度依赖,患者在治疗期间应密切监测血常规,情况许可下建议监测血药浓度,行个体化治疗。
关键词:利奈唑胺;血液毒性;白细胞减少症;血小板减少症;危险因素
利奈唑胺(linezolid,LZD)是FDA批准上市的第一个噁唑烷酮类抗菌药物,主要针对G+菌,用于治疗耐万古霉素肠球菌感染,社区、院内获得性肺炎,复杂性、非复杂性皮肤和皮肤软组织感染[1-2]。LZD口服生物利用度高(近100%),组织渗透性强,能透过完整的解剖屏障,可用于治疗机体深部感染,基于该药独有的理化特性和药动学特征,受到临床的广泛青睐[3-4]。但目前限制其临床使用的一个主要问题是不良反应事件,近年来血液毒性已有相关报道[2,5-7],其中血小板减少症常见,白细胞减少症少见,在相关危险因素的确定中各研究间存在较大差异,且国内针对白细胞减少症的研究及报道相对较少。本次回顾性研究,对住院患者LZD治疗期间发生白细胞减少症、血小板减少症的相关危险因素进行评估,旨在为临床安全用药提供一定参考。
本研究为单中心、观察性、回顾性研究,收集温州医科大学附属第一医院2012年4月—2016年7月因临床需要接受LZD治疗且行治疗药物监测(therapeutic drug monitoring,TDM)的住院患者的临床资料。排除标准如下:年龄<18岁;利奈唑胺疗程<4 d;恶性肿瘤;基础血三系值(首日给予LZD时)低于正常下限值。
收集住院患者LZD治疗期间以下临床数据:年龄、性别、基础疾病、感染类型、利奈唑胺用药情况、首次血药谷浓度、首日给予LZD时的血生化指标等。肾小球滤过率估计值(estimated glomerular filtration rate,eGFR)采用MDRD简化公式计算:eGFR [ml·min-1·(1.73 m2)-1]=186×(血肌酐)-1.154×(年龄)-0.203(女性,则公式乘以系数0.742)。肾功能不全定义为eGFR<80 ml·min-1·(1.73 m2)-1。肝功能不全定义为丙氨酸氨基转移酶(ALT)>2倍正常上限值(ULN)和/或天冬氨酸氨基转移酶(AST)>2 ULN。
稳态条件下,在下一剂给予之前收集LZD使用患者的静脉血样(谷浓度),HPLC测定血药浓度[8]。线性范围0.25~50 mg·L-1;最低检测限0.05 mg·L-1;日内、日间变异系数均<10%。
本实验经院伦理委员会批准同意。因是回顾性研究分析,故免除签署知情同意书。
对于血三系基础值正常的患者,血液毒性定义为血小板(血小板减少症)和/或白细胞(白细胞减少症)计数较基础值下降≥30%。对于血三系基础值>ULN的患者,血液毒性定义为较ULN下降≥30%。
应用SPSS 21.0版统计软件,采用Kolmogorov-Smirnov法检验数据是否呈正态分布。定量变量用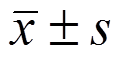 或中位数M(四分位数间距IQR)描述。分类变量的假设检验采用Chi-square或Fisher’s exact test,连续性变量的假设检验采用Student’s test或Mann-Whitney U test。所有检验均为双侧检验,P<0.05认为差异有统计学意义。
或中位数M(四分位数间距IQR)描述。分类变量的假设检验采用Chi-square或Fisher’s exact test,连续性变量的假设检验采用Student’s test或Mann-Whitney U test。所有检验均为双侧检验,P<0.05认为差异有统计学意义。
按入排标准纳入有效病例78例,其中男性53例,女性25例,平均年龄(66.8±12.9)岁,肝、肾功能不全患者分别为17例、49例,临床科室主要分布在内科。LZD平均疗程12.0 d(9.0~15.3 d),首次谷浓度平均值为10.87 mg·L-1(3.98~13.52)mg·L-1,其中77例经静脉给药,用药原因主要是皮肤软组织感染,其次为肺部感染。各项临床特征见表1。
表1 患者的临床特征
Tab. 1 Clinical characteristics of patients

78例住院患者中,有22例(28.2%)被评估为发生LZD相关性白细胞减少症。研究显示,除了LZD疗程[15.0(12.8~19.3)∶11.0(9.0~14.8);P<0.001)这一因素外,未见白细胞减少症发生与否在其余因素下存在统计学差异(表2)。然而,发生白细胞减少症患者组具有较高的LZD首次谷浓度,eGFR<30 ml·min-1·(1.73 m2)-1的患者组发生白细胞减少症的概率更高,虽然差异无统计学意义。多因素Logistic回归分析显示LZD疗程[OR=1.296(1.094~1.53),P=0.003;eGFR<30 mL·min-1·(1.73 m2)-1;(OR=11.582(0.870~ 1.729),P=0.008)是白细胞减少症的独立危险因素,基础血白细胞[OR=0.740(0.595~0.919),P=0.006]是独立保护因素,结果见表3。
表2 发生LZD相关性血液毒性与未发生患者组间临床指标的比较
Tab. 2 Clinical characteristics of patients who did or did not develop Linezolid-related hematological toxicity

注:1)Pearson Chi-square test;2)Mann-Whitney test;3)Fisher exact test。
Note:1)Pearson Chi-square test;2)Mann-Whitney test;3)Fisher exact test.
78例住院患者中,有43例(55.1%)被评估为发生LZD相关性血小板减少症。其中,分别有16例(37.2%)、21例(48.8%)发生在LZD治疗头7 d、8~14 d。如表2所示,发生血小板减少症和未发生患者2组间比较,结果显示基础血白蛋白[28.2(25.5~32.4)∶32.1(28.0~36.9),P=0.032]、LZD首次谷浓度[11.51(6.78~15.89)∶5.11(2.59~9.58),P<0.001]、肾功能不全[33(76.7%)∶16(45.7%),P= 0.005]、eGFR<30 ml·min-1·(1.73 m2)-1[18(41.9%)∶4(11.4%),P=0.005] 4项指标的差异具有统计学意义;此外,发生血小板减少症患者组的年龄较大,基础PLT较低,虽然差异无统计学意义。多因素Logistic回归分析显示基础血白蛋白<30 g·L-1[OR=4.175(1.315~13.254),P=0.015]、LZD首次谷浓度[OR=1.178(1.052~1.318),P=0.005]是血小板减少症的独立危险因素,结果见表3。
表3 LZD相关性血液毒性的多因素logistic回归分析
Tab. 3 Multivariate logistic regression analyses of the risk factors for Linezolid-related hematological toxicity

图1为基础血白蛋白<30 g·L-1与≥30 g·L-1患者组的血小板减少症发生率Kaplan-Meier法估计结果,2组血小板减少症的中位发生时间分别为11 d和15 d。log-rank检验c2=10.801,P=0.001,2组曲线差别有统计学意义,基础血白蛋白<30 g·L-1组患者血小板减少症发生率显著高于≥30 g·L-1组患者,且出现血小板减少症的时间更早。
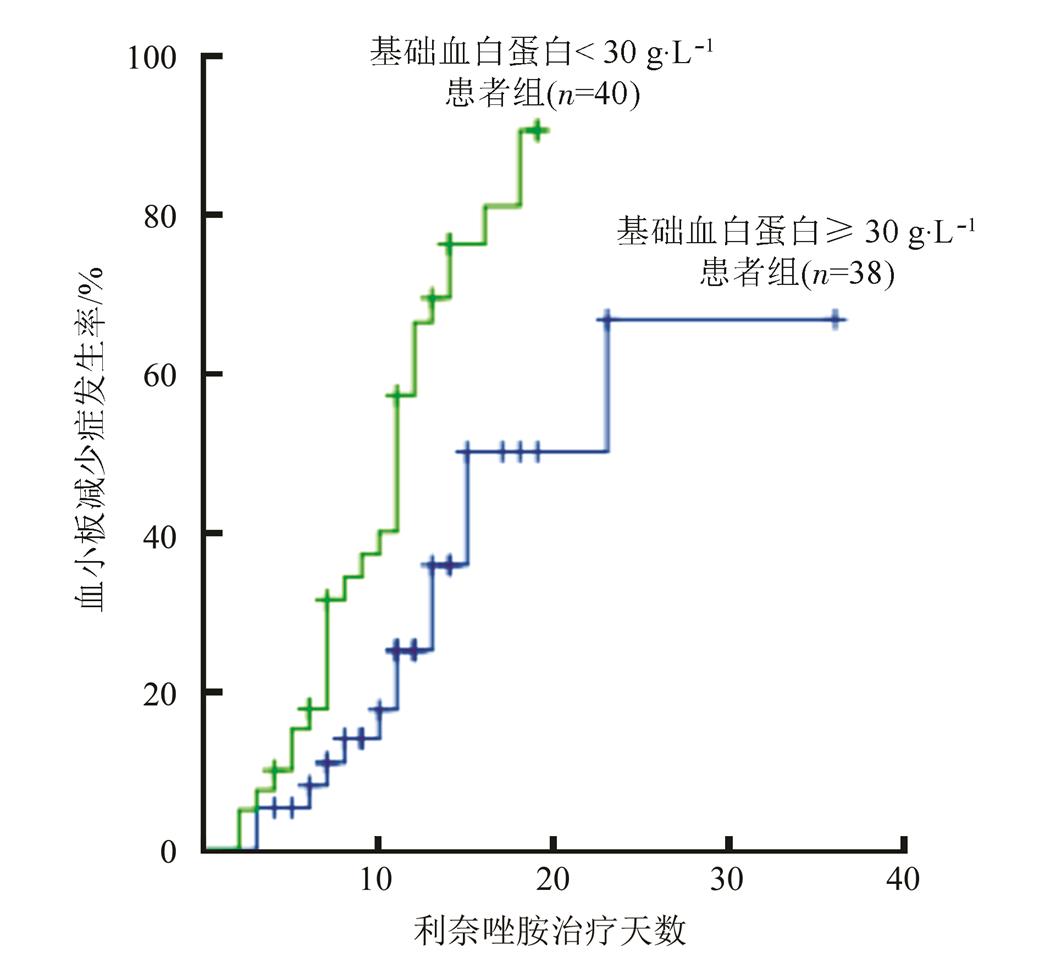
图1 基础血白蛋白< 30 g·L-1与≥ 30 g·L-1患者组的血小板减少症发生时间的Kaplan-Meier曲线
Fig. 1 Kaplan-Meier curves of the time from initiation of linezolid therapy to development of thrombocytopenia for two groups with or without baseline ALB <30 g·L-1
纳入研究的78例住院患者在LZD治疗期间被评估为发生白细胞减少症、血小板减少症的分别占28.2%、55.1%,发生率远高于药品说明书。其中,血小板减少症治疗早期发生率高,超过三分之一发生在治疗1周内,与文献报道相似[9]。提示临床LZD治疗过程中的血常规监测在治疗早期也应引起关注。目前,LZD相关性血液毒性的发生机制未完全阐明,可能与可逆的骨髓抑制有关[10-11],另Bernstein等[12]则支持免疫介导的血小板破坏所致血小板减少症的发生机制。关于本研究的血液毒性发生率与药品说明书存在差异,可能原因:①对该不良反应定义不同;②研究方案、研究对象严重程度及是否联合、多剂量给药设计有关。
该药药品说明书提示[2],肾功能不全患者LZD体内药动学参数不会发生显著改变,无须根据肾功能调整给药剂量。但已有研究结果发现[6-7,9,13],肾功能不全患者接受LZD治疗发生血液毒性的风险明显增加。本研究结果同样显示,LZD相关性白细胞减少症、血小板减少症在肾功能受损的患者中发生更频繁。其原因可能与肾损伤患者血药浓度增高[9,13-15],使之处于高暴露剂量有关,也可能与LZD的2种主要代谢产物体内蓄积有关[9]。
有研究表明LZD血药浓度与血液毒性存在相关性[5,9],其中,多项回归模型分析进一步显示LZD相关性血小板减少症可能呈浓度依赖[16-19]。本研究在证实之前文献研究的观点的同时,还发现发生血液毒性的患者在首次TDM评估时已具有较高的LZD谷值,提示早期监测血药谷浓度或许可预测血液毒性不良反应的发生趋势。因此,建议条件许可的情况下,住院患者(尤其是肾功能不全患者)在LZD治疗早期即可行TDM且加强血常规监测频率,基于TDM浓度监测结果同时结合患者临床实际情况调整给药剂量,变被动监测为主动预测,以期能降低不良反应的发生率。
此外,本研究发现LZD相关性白细胞减少症与用药疗程显著相关,疗程每增加1个单位,白细胞减少症的风险增加1.296倍,而基础血白细胞是其保护因素。提示疗程较长、基础血白细胞较低的患者更应提高对该不良反应的关注。同时,结果显示低蛋白血症患者使用LZD发生血小板减少症的风险显著增加,且发生时间更早。
此次研究,选择LZD疗程≥4 d的病例,主要是确保所测得的谷浓度为稳态状态下的数值,同时更有利于有充足时间观察住院患者在该药治疗期间血常规的动态变化趋势,便于开展研究。
综上所述,LZD在临床实际应用中,发生血小板减少症不良反应较常见;与此同时,白细胞减少症发生率也较高,值得重视。研究结果提示白细胞减少症呈时间依赖性,血小板减少症呈浓度依赖性。建议,临床上接受LZD治疗患者应加强血常规监测的同时,可通过TDM监测优化个体化治疗,确保疗效的同时减少不良事件发生、改善患者耐受情况,尤其是长疗程、肾功能不全、基础血三系偏低、低蛋白血症的患者群体。
但本研究存在以下局限性:①因未能获取每位患者的体重、身高,故影响因素研究未纳入体重、体质指数(BMI)及采用C-G公式评估肾功能的eGFR;②尚未对LZD相关性贫血及三者合并发生的危险因素进行分析,这也是本研究组下一步的研究方向。后续将开展多中心大样本的前瞻性随机试验研究。
REFERENCES
[1] Vinh D C, Rubinstein E. Linezolid: a review of safety and tolerability [J]. J Infect, 2009, 59(Suppl 1): S59-74.
[2] US Food and Drug Administration. linezolid product labeling [DB/OL]. USA, 2015 [2016-06-07]. http://www.accessdata. fda.gov/drugsatfda_docs/label/2015/206473s000lbl.pdf.
[3] Stein G E, Wells E M. The importance of tissue penetration in achieving successful antimicrobial treatment of nosocomial pneumonia and complicated skin and soft-tissue infections caused by methicillin-resistant Staphylococcus aureus: vancomycin and linezolid [J]. Curr Med Res Opin, 2010, 26(3): 571-588.
[4] Peppard W J, Johnston C J, Urmanski A M. Pharmacologic options for CNS infections caused by resistant Gram-positive organisms [J]. Expert Rev Anti Infect Ther, 2008, 6(1): 83-99.
[5] Pea F, Viale P, Cojutti P, et al. Therapeutic drug monitoring may improve safety outcomes of long-term treatment with linezolid in adult patients [J]. J. Antimicrob. Chemother, 2012, 67(8): 2034-2042.
[6] Cattaneo D, Orlando G, Cozzi V, et al. Linezolid plasma concentrations and occurrence of drug-related haematological toxicity in patients with gram-positive infections [J]. Int J Antimicrob Agents, 2013, 41(6): 586-589.
[7] Hanai Y, Matsuo K, Ogawa M, et al. A retrospective study of the risk factors for linezolid-induced thrombocytopenia and anemia [J]. J Infect Chemother, 2016, 22(8): 536-542.
[8] Zang X H, Hu L F, Wang Z Q. Determination of Linezolid in Human Plasma by HPLC [J]. Chin Pharm J(中国药学杂志). 2010, 58(18): 1417-20.
[9] Nukui Y, Hatakeyama S, Okamoto K, et al. High plasma linezolid concentration and impaired renal function affect development of linezolid-induced thrombocytopenia [J]. J Antimicrob Chemother, 2013, 68(9): 2128-2133.
[10] Flanagan S, McKee E E, Das D, et al. Nonclinical and pharmacokinetic assessments to evaluate the potential of tedizolid and linezolid to affect mitochondrial function [J]. Antimicrob Agents Chemother, 2015, 59(1): 178-185.
[11] Wasserman S, Meintjes G and Maartens G. Linezolid in the treatment of drug-resistant tuberculosis: the challenge of its narrow therapeutic index [J]. Expert Rev Anti Infect Ther, 2016, 14(10): 901-915.
[12] Bernstein W B, Trotta R F, Rector J T, et al. Mechanisms for linezolid-induced anemia and throm- bocytopenia [J]. Ann Pharmacother, 2003, 37(4): 517-520.
[13] Tsuji Y, Hiraki Y, Matsumoto K, et al. Thrombocytopenia and anemia caused by a persistent high linezolid concentration in patients with renal dysfunction [J]. J. Infect. Chemother, 2011, 17(1): 70-75.
[14] Pea F, Cojutti P G, Baraldo M. A 10-year experience of therapeutic drug monitoring (TDM) of Linezolid in a Hospital-wide population of patients receiving conventional dosing: is there enough evidence for suggesting TDM in the majority of patients [J]. Basic Clin Pharmacol Toxicol, 2017, 121(4): 303-308.
[15] Morata L, De la C C, Gomez-Cerquera J M, et al. Risk factors associated with high linezolid trough plasma concentrations [J]. Expert Opin Pharmacother, 2016, 17(9): 1183-1187.
[16] Dong H Y, Xie J, Chen L H, et al. Therapeutic drug monitoring and receiver operating characteristic curve prediction may reduce the development of linezolid-associated thrombocytopenia in critically ill patients [J]. Eur J Clin Microbiol Infect Dis, 2014, 33(6): 1029-1035.
[17] Hiraki Y, Tsuji Y, Hiraike M, et al. Correlation between serum linezolid concentration and the development of thrombocytopenia [J]. Scand J Infect Dis, 2012, 44(1): 60-64.
[18] Boak L M, Rayner C R, Grayson M L, et al. Clinical Population Pharmacokinetics and Toxicodynamics of Linezolid [J]. Antimicrob Agents Chemother, 2014, 58(4): 2334-2343.
[19] Song T, Lee M, Jeon H S, et al. Linezolid Trough Concentrations Correlate with Mitochondrial Toxicity-Related Adverse Events in the Treatment of Chronic Extensively Drug-Resistant Tuberculosis [J]. EBioMedicine, 2015, 2(11): 1627-1633.
(本文责编:蔡珊珊)
Risk Factors of Linezolid-related Hematologic Toxicity
Jiang Shuying, Zhang Chunhong, Hu Lufeng, Zhang Xiuhua*
(The First Affiliated Hospital of Wenzhou Medical University, Wenzhou 325000, China)
ABSTRACT: OBJECTIVETo investigate the risk factors of linezolid-related hematologic toxicity in hospital patients.METHODSIn this single center, observational retrospective study, main clinical characteristics of 78 inpatients undergoing therapeutic drug monitoring during linezolid therapy were reviewed. The risk factors of linezolid-related hematologic toxicity were confirmed by multivariate Logistic regression analyses.RESULTSIn logistic regression analyses, the significant risk factors of linezolid-related leukopenia including duration of linezolid therapy [OR=1.296(1.094-1.53),P=0.003], estimated glomerular filtration rate <30 ml·min-1·(1.73 m2)-1[OR=11.582(1.870-71.729),P=0.008]; the first trough concentration of linezolid [OR=1.178(1.052-1.318),P=0.005], baseline serum albumin <30 g·L-1[OR=4.175(1.315-13.254),P=0.015] were found to be significant risk factors for linezolid-related thrombocytopenia.CONCLUSIONleukopenia is a time-dependent toxicity with linezolid, thrombocytopenia is a concentration-dependent toxicity. Patients should be closely monitored for blood routine throughout linezolid treatment. Therapeutic drug monitoring and individualized therapy may be recommended, if condition permits.
KEY WORDS:linezolid; hematologic toxicity; leukopenia; thrombocytopenia; risk factor
中图分类号:R969.4
文献标志码:B
文章编号:1007-7693(2018)05-0741-05
DOI:10.13748/j.cnki.issn1007-7693.2018.05.025
收稿日期:2017-11-28
引用本文:蒋淑莹, 张春红, 胡卢丰, 等. 利奈唑胺相关性血液毒性的危险因素分析[J]. 中国现代应用药学, 2018, 35(5): 741-745.
作者简介:蒋淑莹,女,硕士生 Tel: 18267856518 E-mail: 18267856518@163.com
*通信作者:张秀华,女,主任药师 Tel: (0577)55579591 E-mail: wzzhangxiuhua@126.com