表1 患者基本信息
Tab. 1 The baseline characteristics of patients

张轶雯1,2,钟里科1,楼倩雯3,潘宗富1,方罗1,黄萍1,2*
(1.浙江省肿瘤医院药剂科,杭州 310022;2.浙江省头颈肿瘤转化医学研究重点实验室,杭州 310022;3.浙江大学城市学院药学院,杭州 310001)
摘要:目的通过分析HPV阳性与阴性口咽癌患者基因芯片数据,寻找差异基因及其关键通路,区分不同HPV感染状态下口咽癌的分子表达特征基因谱。方法利用GEO数据库中高通量基因芯片数据库筛选出口咽癌患者具有HPV感染状态信息的芯片。采用GO基因功能注释和KEGG通路富集分析,筛选出可表征不同HPV感染状态口咽癌生物特性的特征基因簇和通路,并进行蛋白质相互作用网络可视化分析。结果经差异基因分析后,发现HPV感染状态可影响口咽癌的生物学特征,并显著改变一些重要的肿瘤信号通路,如Wnt信号通路和PI3K-Akt信号通路等。结论本研究利用生物信息学方法,从多种角度定义了口咽癌不同HPV感染状态下的分子表达特征,为口咽癌的精准治疗提供理论依据。
关键词:HPV感染;口咽癌;差异基因;生物信息学分析
口咽癌是临床常见的头颈部恶性肿瘤,且其发病率和死亡率均在逐年增加,严重威胁着人类健康。据国家癌症中心统计,2015年我国新增口咽癌患者约4.8万人,新增死亡患者达2.2万人[1]。
在美国,人乳头状瘤病毒(HPV)相关的口咽鳞状细胞癌发病率持续上升,且呈年轻化趋势[2]。同时,近年来大量临床研究发现HPV阳性和HPV阴性的口咽癌的临床预后存在显著差异[3-4]。其中,具有代表性的RTOG052临床研究入组了Ⅲ期到Ⅳ期既往接受以铂类为基础化疗的口咽癌患者,在疾病进展后研究者又进行了中位时间为4年的随访观察,发现P16基因阳性口咽癌患者的生存率相比于阴性患者显著提高,提示肿瘤HPV状态是疾病进展后总生存率的独立强预测因子,可作为复发或转移性口咽癌患者临床试验的分层因素。目前,HPV感染作为口咽癌的重要致病因素和独立预后因子,已引起了人们的高度关注[5-6]。
HPV病毒为可特异性感染复层鳞状上皮的基底角质细胞,因此可造成头颈部、肛门、阴茎、阴道和上消化道的肿瘤或疣状赘生物。基础研究表明,经HPV感染后,可发生体细胞突变、表观遗传变异和蛋白异常表达等大量分子事件,最终使得其与未感染的口咽癌具有不同的分子病理特征[7-9]。然而,对于不同感染状态口咽癌的全基因组差异网络和蛋白功能簇仍尚待挖掘。
基于HPV在口咽癌发生发展中的重要意义和感染后所导致的上述差异,笔者利用高通量基因表达(Gene Expression Omnibus,GEO)数据库中已知HPV感染状态的芯片数据进行分析。拟通过筛选HPV阳性和阴性口咽癌的差异基因集和差异基因集中的关键通路,以建立区分不同HPV感染状态口咽癌的分子表达特征基因谱,识别关键的分子事件和路径,为口咽癌的精准治疗提供理论依据。
利用NCBI(National Center for Biotechnology Information)平台下的GEO数据库进行芯片筛选,目标芯片需满足如下筛选标准:①患者口咽癌标本,排除细胞株和动物;②入选芯片需具有HPV检测信息;③需为基因表达芯片,各探针具有归一化的表达值;④所纳入需复核芯片质量要求,芯片质量采用R语言(http://bioconductor.org/biocLite.R) affyPLM包对数据集进行回归分析判断。
对所筛选出的芯片进行数据下载及差异基因筛选。利用在线工具GEO2R (https://www.ncbi.nlm. nih.gov/geo/geo2r/)分析各个芯片,选取P<0.05,差异>2倍的基因为候选差异基因探针,并将探针转化为标准基因名称。
选取“1.2”中所筛选出的差异基因,利用DAVID生物信息资源数据库(https://david.ncifcrf. gov/,版本6.8)中在线分析工具,以人源基因为背景进行GO(Gene Ontology)和KEGG(Kyoto Encyclopedia of Genes and Genomes)通路富集,分析可表征不同HPV感染状态口咽癌生物特性的特征基因。
应用Cytoscape 3.5.1(版本6.8)的蛋白相互作用网络分析插件MCODE(Version 1.4.2,Bader Lab,University of Toronto)对构建的生物学网络中的区域进行关联度分析。通过分析网络结构,根据关联积分值,可获得整个网络中可能形成的蛋白质簇和关键节点蛋白,并在Cytoscape中进行可视化显示。
经筛选及芯片质量分析,共筛选出6个符合入选标准的芯片系列,分别为GSE30788,GSE41152,GSE55542,GSE55544,GSE55540和GSE56142[10-12]。对其Matrix文件所提供相关患者基本信息进行分析,共纳入390名患者,基本情况见表1。
表1 患者基本信息
Tab. 1 The baseline characteristics of patients

通过差异基因的功能注释后,分析出差异基因主要集中在细胞外基质的生成、分解和其受体的相互作用,细胞外区域的空间结构及相关分子激活,非钙依赖性的细胞经膜黏附,对激素、pH值和脂肪酸类物质的应答以及跨膜转运等分子行为过程中。
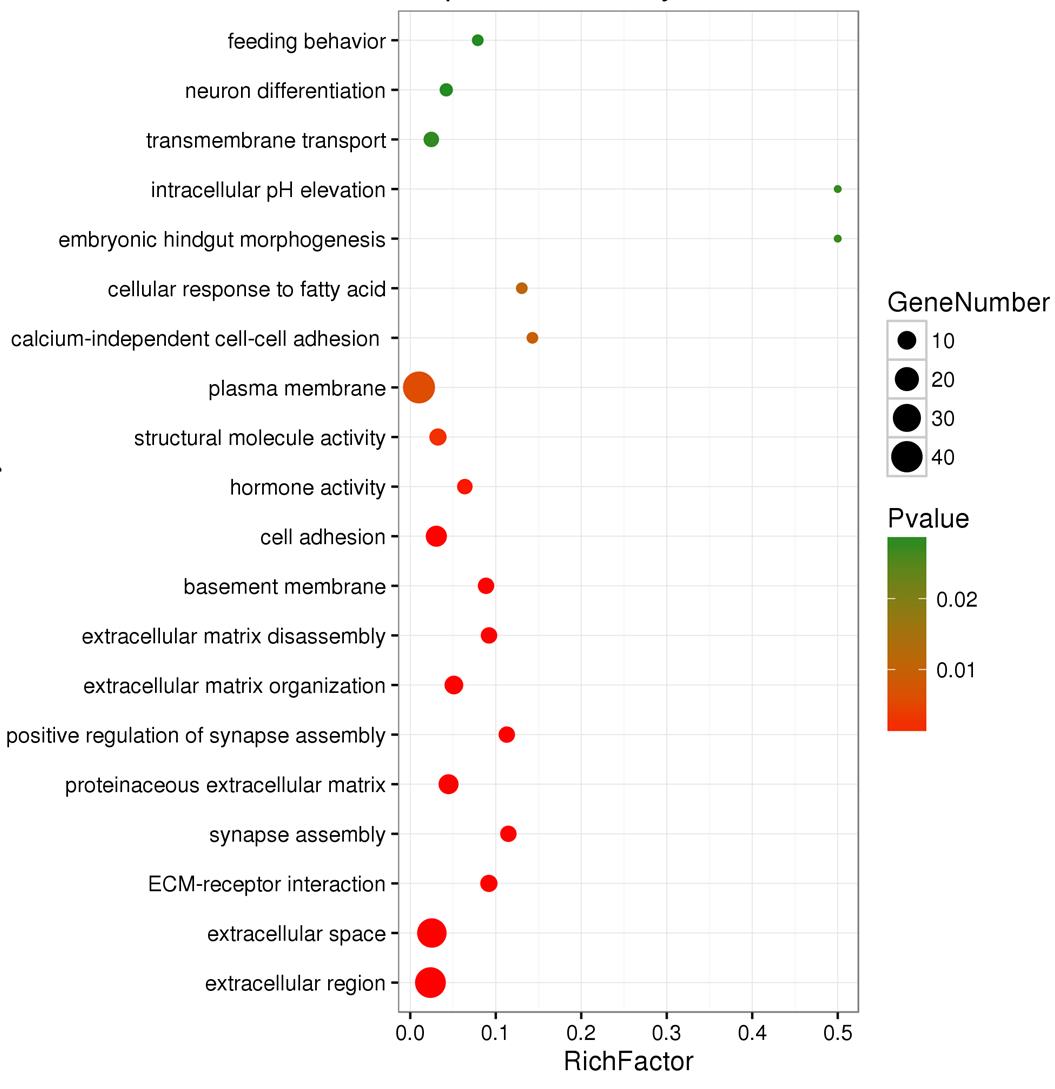
图1 HPV阳性口咽癌差异基因功能注释结果
Fig. 1 The gene functional annotation of HPV-positive oropharyngeal cancer
通过对不同HPV感染状态口咽癌差异基因的通路富集,笔者发现其主要集中在表征肿瘤的相关信号通路,与细胞附着相关的黏着斑形成通路,细胞外受体相互作用,Wnt信号通路和PI3K-Akt信号通路等。结果见图2。
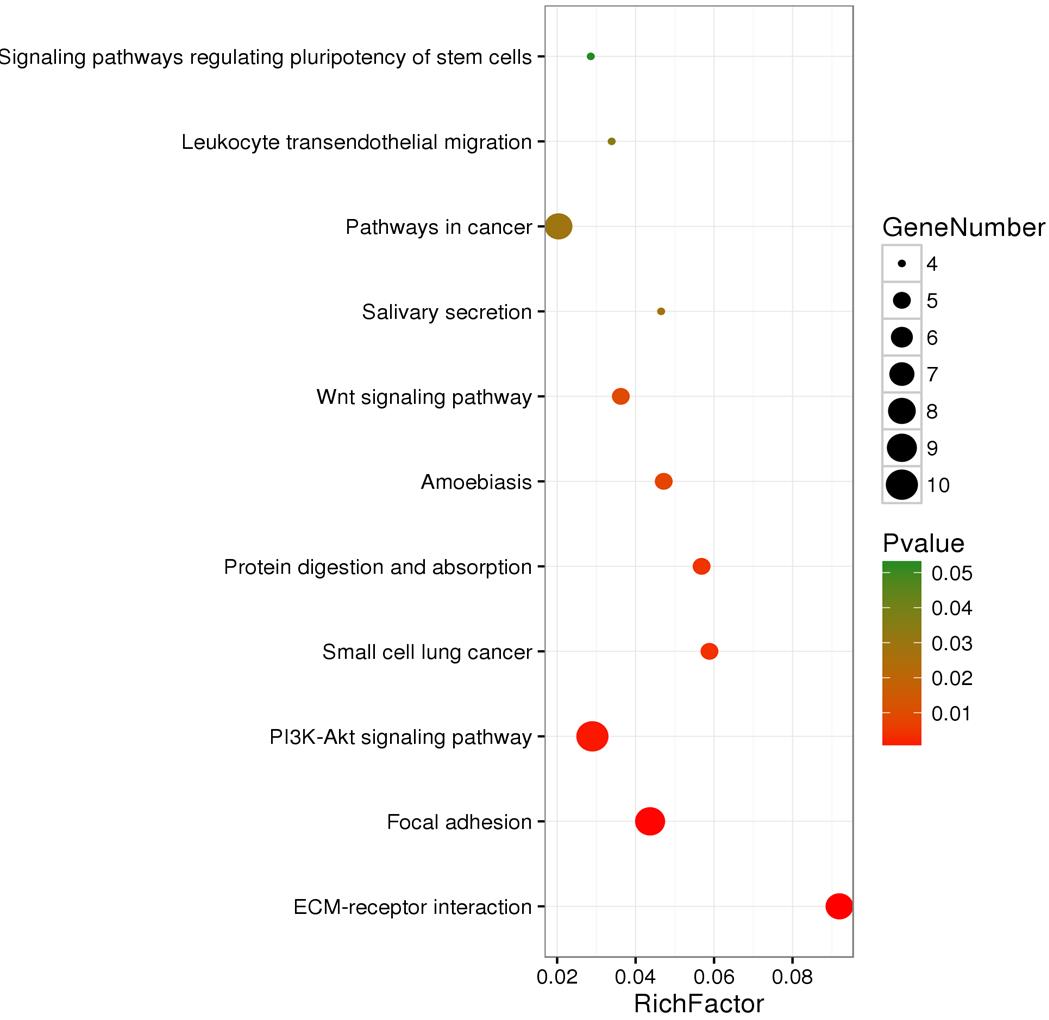
图2 HPV阳性口咽癌差异基因通路富集结果
Fig. 2 The pathway enrichment analysis of HPV-positive oropharyngeal cancer
通过对蛋白-蛋白相互作用进行评分,做出可视化网络,基于前述基因富集通路的蛋白相互作用构建网络,发现其主要聚集于以下3个集群,分别为细胞外基质及胶原形成相关集群,染色体分离和DNA复制集群以及头颈肿瘤所特有的唾液腺高表达相关蛋白。结果见图3。
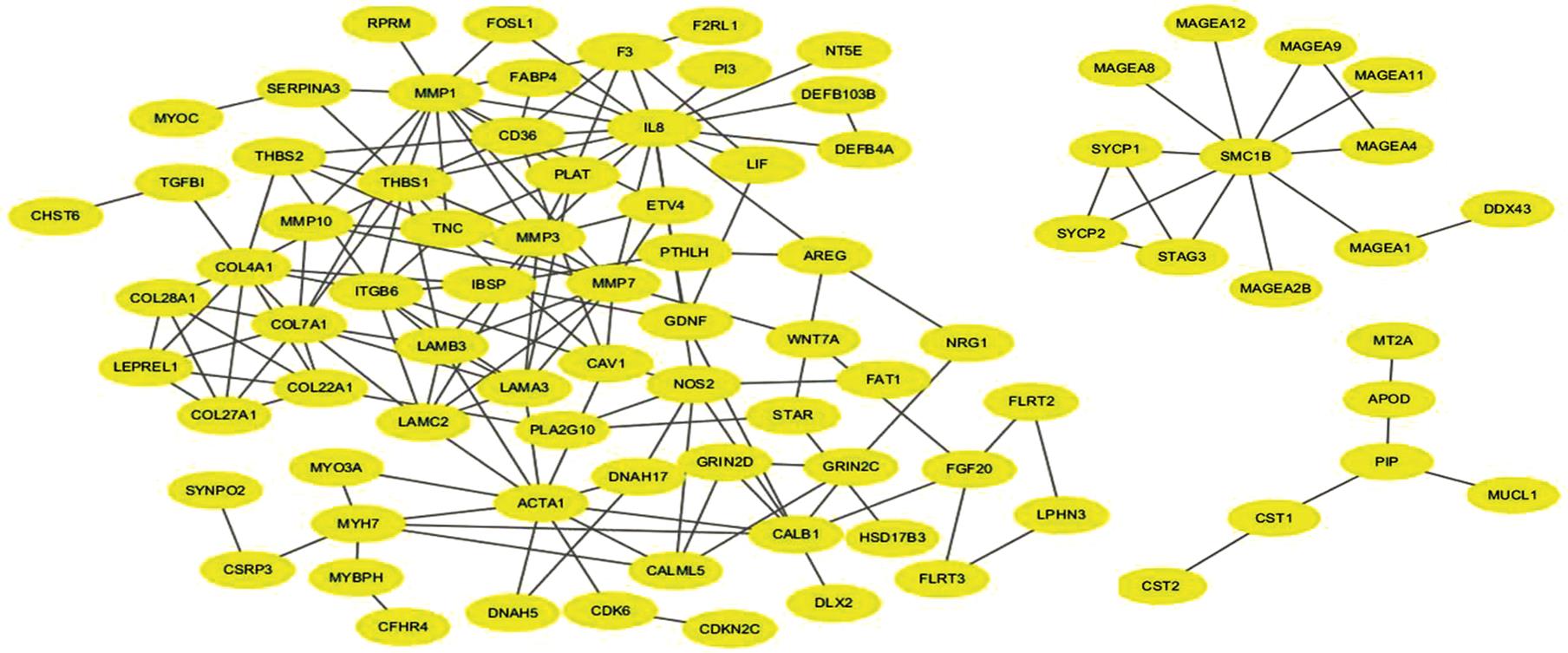
图3 HPV阳性口咽癌蛋白相互作用网络可视化结果
Fig. 3 The visualization analysis of protein interaction network of HPV-positive oropharyngeal cancer
口咽癌作为头颈部常见恶性肿瘤,其发病率呈逐年上升趋势。目前,除遗传、机体易感性等因素外,吸烟、饮酒等致病因素已被确认。近年来,大量临床试验逐渐证实HPV已成为口咽癌的关键因素,其感染状态对患者的治疗和预后具有重要意义。然而,HPV如何参与口咽癌的形成和发展,影响了哪些关键的信号通路,目前尚不明确。
本研究通过GEO数据库检索获得了具有HPV感染信息的患者基因芯片390例,通过分析每例患者的注释信息,根据HPV感染状态将上述患者分为HPV阳性与阴性2组进行比较,通过对基因芯片进行表达谱差异分析,基因功能注释和通路富集,最终筛选出HPV参与口咽癌发生发展过程的重要信号通路,并对其蛋白相互作用进行可视化作图。
本研究发现,不同HPV感染状态对口咽癌在分子特征和生物学行为,尤其是一些肿瘤恶性演进和侵袭转移相关的基因上具有显著影响。一方面,其差异基因在功能上集中在细胞膜外基质,黏着斑形成以及与基质黏附等和侵袭转移相关的过程。细胞外基质(ECM)由结构物质和功能性大分子复合物组成,在细胞和组织结构的功能维持中起着重要作用[13-14]。其特异性相互作用主要由跨膜蛋白介导,其中包括CD36、整合蛋白、糖蛋白或其他细胞表面相关的活性成分。而黏着斑则被认为是肿瘤迁移和耐用的重要标志,其可感受细胞内外的机械变化,通过FAK-p130Cas(黏着斑激酶-p130Cas)信号通路激活下游金属蛋白酶(matrix metalloproteinase,MMP)将信号进行传导[15]。推测在HPV感染后,病毒释放相关因子与上述受体结合,从而改变细胞的生物学行为。
另一方面,HPV感染也可调控Wnt信号通路和PI3K-Akt等经典的肿瘤相关信号通路,这些相互作用直接或间接调控细胞活动,如黏附、迁移、分化、增殖和细胞凋亡[16-18]。上述行为已被证实在肿瘤的恶性演进,上皮-间质转化中具有重要意义。同时,通路富集和蛋白相互作用的结果也验证了前述功能的差异。提示,对于不同感染状态的口咽癌,肿瘤相关的关键通路上可能具有不同的抗肿瘤药物作用靶点。
当然,受数据库数据所限,本研究也存在一定局限性。首先GEO数据库仅提供mRNA水平的数据,其蛋白表达与mRNA转录一致性仍待明确。此外,由于芯片系统检测的局限,往往需要RT-PCR和Western Blot实验在临床样本中进一步验证。因此,HPV阳性口咽癌特征基因仍需更全面的数据支持。
综上所述,本研究利用多种生物信息学方法从不同的角度定义了不同HPV感染状态口咽癌患者分子发病机制的表达特征,证实了HPV的感染状态可在分子水平影响口咽癌的发生发展。本研究结果在基因层面为HPV作为口咽癌患者分型提供了一定的支持,也为口咽癌的精准治疗提供新思路。
REFERENCES
[1] CHEN W, ZHENG R, BAADE P D, et al. Cancer statistics in China, 2015 [J]. CA Cancer J Clin, 2016, 66(2): 115-132.
[2] CHATURVEDI A K, ENGELS E A, PFEIFFER R M, et al. Human papillomavirus and rising oropharyngeal cancer incidence in the United States [J]. J Clin Oncol, 2011, 29(32): 4294-4301.
[3] WILSON D D, CRANDLEY E F, SIM A, et al. Prognostic significance of p16 and its relationship with human papillomavirus in pharyngeal squamous cell carcinomas [J]. JAMA Otolaryngol Head Neck Surg, 2014, 140(7): 647-653.
[4] GEIGER J L, LAZIM A F, WALSH F J, et al. Adjuvant chemoradiation therapy with high-dose versus weekly cisplatin for resected, locally-advanced HPV/p16-positive and negative head and neck squamous cell carcinoma [J]. Oral Oncol, 2014, 50(4): 311-318.
[5] WANG M B, LIU I Y, GORNBEIN J A, et al. HPV-positive oropharyngeal carcinoma: a systematic review of treatment and prognosis [J]. Otolaryngol Head Neck Surg, 2015, 153(5): 758-769.
[6] HUSAIN N, NEYAZ A. Human papillomavirus associated head and neck squamous cell carcinoma: Controversies and new concepts [J]. J Oral Biol Craniofac Res, 2017, 7(3): 198-205.
[7] SY A U, HERNANDEZ B Y, TAREG A, et al. Acceptability and feasibility of a community based participatory research project comparing cytology and urine HPV DNA testing for cervical cancer screening in Yap, Federated States of Micronesia [J]. Cancer Epidemiol, 2017, 50(Pt B): 283-288.
[8] LIU X, KUMAR M, YANG L, et al. BAP1 is a novel target in HPV negative head and neck cancer [J]. Clin Cancer Res, 2017, 24(3): 600-607.
[9] AYALA-CALVILLO E, MOJICA-VÁZQUEZ L H, GARCÍA-CARRANCÁ A, et al. Wnt/β‑catenin pathway activation and silencing of the APC gene in HPV‑positive human cervical cancer‑derived cells [J]. Mol Med Rep, 2017, 17(1): 200-208.
[10] KOSTARELI E, HOLZINGER D, BOGATYROVA O, et al. HPV-related methylation signature predicts survival in oropharyngeal squamous cell carcinomas [J]. J Clin Invest, 2013, 123(6): 2488-2501.
[11] TOMAR S, GRAVES CA, ALTOMARE D, et al. Human papillomavirus status and gene expression profiles of oropharyngeal and oral cancers from European American and African American patients [J]. Head Neck, 2016, 38(Suppl 1): E694-704.
[12] ZENG X X, YELON D. Cadm4 restricts the production of cardiac outflow tract progenitor cells [J]. Cell Rep, 2014, 7(4): 951-960.
[13] HAN B B, LI S, TONG M, et al. Fenretinide perturbs focal adhesion kinase in premalignant and malignant human oral keratinocytes. Fenretinide's chemopreventive mechanisms include ECM interactions [J]. Cancer Prev Res (Phila), 2015, 8(5): 419-430.
[14] LI YY, ZHOU C X, GAO Y. Podoplanin promotes the invasion of oral squamous cell carcinoma in coordination with MT1-MMP and Rho GTPases [J]. Am J Cancer Res, 2015, 5(2): 514-529.
[15] EKE I, CORDES N. Focal adhesion signaling and therapy resistance in cancer [J]. Semin Cancer Biol, 2015(31): 65-75.
[16] KRAUSOVA M, KORINEK V. Wnt signaling in adult intestinal stem cells and cancer [J]. Cell Signal, 2014, 26(3): 570-579.
[17] HOLLAND J D, KLAUS A, GARRATT A N, et al. Wnt signaling in stem and cancer stem cells [J]. Curr Opin Cell Biol, 2013, 25(2): 254-264.
[18] MARTINS F, DE SOUSA S C, DOS S E, et al. PI3K-AKT-mTOR pathway proteins are differently expressed in oral carcinogenesis [J]. J Oral Pathol Med, 2016, 45(10): 746-752.
(本文责编:李艳芳)
Study on the HPV-positive Oropharyngeal Cancer Features Gene Based on GEO Database by Bioinformatics
ZHANG Yiwen1,2, ZHONG Like1, LOU Qianwen3, PAN Zongfu1, FANG Luo1, HUANG Ping1,2*
(1.Department of Pharmacy, Zhejiang Cancer Hospital, Hangzhou, 310022, China; 2.Key Laboratory of Head & Neck Cancer Translational Research of Zhejiang Province,Hangzhou,310022, China;3. School of Pharmacy, Zhejiang University City College, Hangzhou, 310001, China)
ABSTRACT: OBJECTIVETo examine the differentially expressed genes and pathways, and detected the different gene expression profiles by analyze the microarray data of both HPV-positive and HPV-negative oropharyngeal cancer patients.METHODSFirst selected the gene expression profiles of HPV-positive and HPV-negative oropharyngeal cancer patients in GEO database. Then, screened the differentially expressed gene cluster and pathways of HPV-positive and HPV-negative oropharyngeal cancer by GO gene functional annotation and KEGG pathway enrichment analysis, and finally conducted the visualization analysis of protein interaction network.RESULTSHPV infection had affected the biological characteristics of oropharyngeal cancer, and significantly altered some important tumor signaling pathways, such as Wnt and PI3k-Akt signaling pathways.CONCLUSIONThis study has employed bioinformatics method from various perspectives to define the gene expression characteristics of different HPV infection in oropharyngeal cancer, and provides theoretical basis for accurate treatment of oropharyngeal cancer.
KEY WORDS:HPV infection; oropharyngeal carcinoma; differential gene; bioinformatics
中图分类号:R963
文献标志码:A
文章编号:1007-7693(2018)05-0638-04
DOI:10.13748/j.cnki.issn1007-7693.2018.05.004
引用本文:张轶雯, 钟里科, 楼倩雯, 等. 基于GEO数据库的HPV阳性口咽癌特征基因生物信息学研究[J]. 中国现代应用药学, 2018, 35(5): 638-741.
收稿日期:2017-11-14
基金项目:国家自然科学基金(81503165);浙江省医药卫生科技计划项目(2017RC001)
作者简介:张轶雯,女,博士,主管药师 Tel: (0571)88122440 E-mail: zjzyw2003@163.com
*通信作者:黄萍,女,博士,主任药师 Tel: (0571)88122438 E-mail: huangping1841@zjcc.org.cn