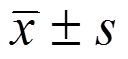 表示,采用方差分析和显著性检验。方差齐时,两两比较采用LSD检验;方差不齐时,采用Tamhance’s T2检验,P<0.05表示差异有统计学意义。
表示,采用方差分析和显著性检验。方差齐时,两两比较采用LSD检验;方差不齐时,采用Tamhance’s T2检验,P<0.05表示差异有统计学意义。杨志军,邓毅*,曼琼,杨秀娟,杨延泽
(甘肃中医药大学,兰州 730000)
摘要:目的研究甘草内生菌代谢物的体内外抗炎作用。方法96孔板中接种巨噬细胞RAW264.7培养,模型组加入1 mg·L-1脂多糖(LPS),各受试药物组分别加入10,20,40 mg·L-1甘草水提液浸膏或内生菌发酵物,2 h后再加入LPS 1 mg·L-1培养,检测NO、IL-1β、PGE2的含量。Wistar大鼠90只,随机分为9组,空白组、模型组、阳性对照组给予生理盐水0.01 mL·g-1,甘草水煎液组给予甘草水煎液0.95 g·kg-1,各内生菌代谢物组给予甘草内生菌发酵物0.95 g·kg-1,每日1次,连续灌胃给药5 d。末次给药后1 h,除空白组外,各组大鼠尾静脉注射1 mg·kg-1体质量LPS,制备急性肺炎模型,空白组注射等量生理盐水,阳性对照组按5 mg·kg-1体质量腹腔注射地塞米松给药。6 h后大鼠股动脉取血,检测外周血白细胞计数及血清中TNF-α、IL-6、IL-10的含量。结果与LPS模型组比较,40 mg·L-1时,甘草浸膏组、5组内生菌代谢物组(JTZB006、JTZB018、JTZB059、JTZB060、JTZB063)巨噬细胞RAW264.7分泌的NO、PGE2、IL-1β的含量显著降低(P<0.05或P<0.01);与同一质量浓度(40 mg·L-1)的甘草浸膏组比较,JTZB006、JTZB060组巨噬细胞RAW264.7分泌的PGE2的含量显著降低(P<0.05)。与模型组比较,阳性对照组、甘草水煎液组、3组内生菌代谢物组(JTZB006、JTZB060、JTZB063)大鼠外周血中白细胞数量及血清中TNF-α、IL-6的含量均显著降低,IL-10的含量显著升高(P<0.05或P<0.01);与甘草水煎液组比较,JTZB006、JTZB060、JTZB063组IL-10的含量显著升高(P<0.05或P<0.01)。结论3株甘草内生菌代谢物(JTZB006、JTZB060、JTZB063)对LPS诱导的炎症模型具有体外及体内抗炎作用。
关键词:甘草;内生菌代谢物;抗炎;RAW264.7;大鼠
植物内生菌是指在某一阶段或整个阶段生活在活体植物组织或细胞内,且没有引起宿主植物明显感染的一类微生物群。自Stierle报道从短叶红豆杉中分离出一株能产生抗癌活性成分紫杉醇的内生真菌后[1],药用植物内生菌及其代谢产物作为天然药物新资源逐渐受到重视。研究证实,在与宿主植物共生进化过程中,内生菌及其次生代谢产物可能具有与宿主植物相似的药理作用[2-3],甘草水提物及多种有效成分均有一定的抗炎作用[4],但甘草内生菌代谢物的抗炎作用迄今鲜有报道。因此,本课题对甘草内生菌代谢物的体内外抗炎作用进行研究。
SPF级Wistar大鼠,♀♂各半,体质量(200± 20)g,由甘肃中医药大学动物实验中心提供,合格证号:SCXK(甘)2015-0002。自由摄食、饮水,喂标准饲料。
DHP-927电热恒温培养箱(上海一恒科学仪器有限公司);MCO-18ATC(UV) CO2培养箱(日本三洋公司);Motic220A荧光倒置显微镜(上海捷辰仪器有限公司);MODEL680-酶标仪(美国伯乐公司)。
小鼠RAW264.7单核巨噬细胞株(货号:KG240,南京凯基生物科技发展有限公司);脂多糖(LPS,美国Sigma);胎牛血清(FBS,美国Hyclone公司,批号:NWL0509)一氧化氮(NO)试剂盒(批号:20150308,南京建成生物工程研究所);白介素-1β(IL-1β)、前列腺素E2(PGE2)、白介素-6(IL-6) ELISA试剂盒(批号分别为201505、201504、201601,上海丰翔生物科技有限公司);肿瘤坏死因子-α(TNF-α)、白介素-10(IL-10) ELISA试剂盒(批号分别为R160506-102a、R160506-121a,欣博盛生物科技有限公司);地塞米松(国药集团容生制药有限公司,批号:1608206)。
从栽培的乌拉尔甘草中分离内生菌,进行初步形态学鉴定,通过预实验初步筛选出8株甘草内生菌(JTZB006、JTZB014、JTZB018、JTZB043、JTZB059、JTZB060、JTZB062、JTZB063)。经分子生物学鉴定,JTZB006、JTZB014、JTZB018为萎缩芽孢杆菌Bacillus atrophaeus,JTZB043为漠海威芽孢杆菌Bacillus mojavensis,JTZB059、JTZB060为枯草芽孢杆菌Bacillus subtilis,JTZB062为厚壁菌门乳杆菌目绿色气球菌Aerococcus viridans,JTZB063为索诺拉沙漠芽孢杆菌Bacillus sonorensis。将300 ml营养肉汤培养基分装于500 ml锥形瓶中,121 ℃灭菌20 min,在双人净化工作台上用接种环挑取活化的甘草内生菌菌种10环,接种于灭菌的营养肉汤培养液中,在25 ℃、200 r·min-1条件下在摇床发酵培养4 d,过滤后在4 ℃、3 000 r·min-1条件下离心15 min,取上清液,60 ℃烘干备用,将其粉末用适量蒸馏水稀释后用于体内抗炎试验。体外抗炎试验时,将烘干的甘草内生菌发酵物粉末用含10% FBS的1640培养基溶解,分别配成10,20,40 mg·L-1甘草内生菌代谢物。
将栽培乌拉尔甘草除去杂质,洗净切厚片,晾干,取适量甘草加10倍量水,煎煮50 min,过滤,再加8倍量水,煎煮40 min,过滤,将2次滤液合并,水浴浓缩为含原药材1 g·mL-1的浓缩液,高压灭菌,<4 ℃环境下储存,用于体内抗炎试验。将制备的甘草水提液浓缩,60 ℃恒温真空干燥器中干燥12 h至恒重,得甘草水提液浸膏(1 g浸膏相当于生药2.5 g),将上述浸膏用含10% FBS的1640培养基溶解,分别配置成10,20,40 mg·L-1甘草水提液浸膏,用于体外抗炎试验。
2.3.1 RAW264.7细胞存活率试验(MTT法)[5]取对数生长期贴壁的小鼠RAW264.7巨噬细胞,胰蛋白酶消化,用含10% FBS的1640培养基制成1×106·mL-1的单细胞悬液,接种于96孔培养板,每孔100 μL,培养箱中培养24 h,弃各孔培养液。空白对照组加含10% FBS的1640培养基培养,各药物组分别加入10,20,40 mg·L-1甘草水提液浸膏及甘草内生菌代谢物,预处理2 h,再加入1 mg·L-1的LPS。每浓度设置4个复孔,继续培养24 h。各孔加入20 μL四甲基偶氮唑(MTT)的生理盐水溶液(浓度5 g·L-1,pH 7.4),培养4 h,弃培养液,每孔再加入二甲基亚砜(DMSO) 150 μL溶解,水平振荡5 min,使甲瓒充分溶解,用酶标仪在波长492 nm处测定吸光值(A),计算细胞存活率:细胞存活率(%)=A药物组/A空白组×100%。
2.3.2 对LPS诱导RAW264.7细胞分泌的NO、IL-1β、PGE2含量的检测[6] 将浓度为1×106·mL-1的RAW264.7单细胞悬液,接种于96孔板,每孔加100 μL,培养至细胞贴壁。分组处理:空白对照组添加1640培养基培养;模型组添加1 mg·L-1LPS培养;甘草浸膏组及内生菌代谢物8组分别加入10,20,40 mg·L-1甘草水提液浸膏或内生菌代谢物,预处理2 h,再加入1 mg·L-1的LPS刺激培养。24 h后,吸取上清液,按试剂盒说明书检测NO、IL-1β、PGE2的含量。
90只SPF级Wistar大鼠随机分为9组,即空白组、模型组、阳性对照组、甘草水煎液组、内生菌代谢物5组(体外抗炎试验有效菌株),每组10只。空白组、模型组、阳性对照组均给予生理盐水0.01 mL·g-1,甘草水煎液组给予甘草水煎液0.95 g·kg-1,各内生菌代谢物组给予甘草内生菌发酵液烘干粉末0.95 g·kg-1,每日1次,连续5 d。末次给药后1 h,除空白组外,各组大鼠按1 mg·kg-1体质量尾静脉注射LPS,制备急性肺炎模型;空白组注射等量生理盐水,阳性对照组按5 mg·kg-1体质量腹腔注射地塞米松。6 h后,用10%水合氯醛对大鼠进行腹腔注射麻醉(剂量为0.003 ml·g-1),麻醉后将大鼠仰卧位固定,脱毛消毒后股动脉取血,抗凝,全血用于检测外周血白细胞计数。另取血,静置1 h,3 000r·min-1离心10 min,ELISA法检测血清中TNF-α、IL-6、IL-10的含量。
采用SPSS 19.0统计软件进行分析,实验数据以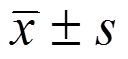 表示,采用方差分析和显著性检验。方差齐时,两两比较采用LSD检验;方差不齐时,采用Tamhance’s T2检验,P<0.05表示差异有统计学意义。
表示,采用方差分析和显著性检验。方差齐时,两两比较采用LSD检验;方差不齐时,采用Tamhance’s T2检验,P<0.05表示差异有统计学意义。
与空白组比较,质量浓度为10,20,40 mg·L-1的各给药组细胞存活率无显著性差异,表明受试药物在这3个浓度时,无明显细胞毒性,因此以10,20,40 mg·L-1作为下一步体外抗炎研究中的给药剂量,结果见表1。
与空白组比较,模型组NO、PGE2、IL-1β的含量显著升高(P<0.01)。与模型组比较,10 mg·L-1时,甘草浸膏组、JTZB063组的NO含量以及JTZB060组的NO、PGE2含量显著降低(P<0.05);20 mg·L-1时,JTZB006组NO、PGE2、IL-1β的含量均显著降低,其余各组个别指标含量降低(P<0.05或P<0.01);40 mg·L-1时,甘草浸膏组、5组内生菌代谢物组(JTZB006、JTZB018、JTZB059、JTZB060、JTZB063)NO、PGE2、IL-1β的含量均显著降低(P<0.05或P<0.01)。与同一浓度(40 mg·L-1)的甘草浸膏组比较,JTZB006、JTZB060组PGE2的含量显著降低(P<0.05)。结果见表1。
3.3.1 对大鼠外周血白细胞数量的影响 与空白组比较,模型组大鼠外周血白细胞数量显著增加(P<0.01);与模型组比较,阳性对照组、甘草水煎液组、3组(JTZB006、JTZB060、JTZB063)内生菌发酵物组大鼠外周血白细胞数量显著降低(P<0.01);JTZB018、JTZB059组大鼠白细胞数量显著高于甘草水煎液组(P<0.05)。结果见表2。
3.3.2 对肺炎模型大鼠炎症相关因子含量的影响 与空白组比较,模型组大鼠血清中TNF-α、IL-6的含量显著升高,IL-10的含量显著降低(P<0.01);与模型组比较,阳性对照组、甘草水煎液组、3组内生菌代谢物组(JTZB006、JTZB060、JTZB063)大鼠血清中TNF-α、IL-6的含量均显著降低,IL-10的含量显著升高(P<0.05或P<0.01);与甘草水煎液组比较,JTZB006、JTZB060、JTZB063组IL-10的含量显著升高(P<0.05或P<0.01)。结果见表3。
炎症是机体应对刺激产生的一种防御反应。静止的单核巨噬细胞产生极少量的炎症因子,LPS刺激巨噬细胞后产生大量炎症因子和炎症介质,引起一系列炎症反应。本研究采用经典的LPS诱导小鼠巨噬细胞RAW264.7建立细胞炎症模型,考察甘草内生菌代谢物的体外抗炎作用。巨噬细胞受到外界LPS刺激时,诱导型NO合成酶(iNOS)大量生成,NO被大量合成,异常升高,促进巨噬细胞产生PGE2、TNF-α和IL-1β等炎症因子和炎症介质,这些因子又激活iNOS,促进机体产生更多的NO,加重炎症反应。在LPS等刺激诱导下,环氧化酶-2大量合成,催化花生四烯酸产生PGE2,PGE2可与缓激肽、白三烯等炎症介质起协同作用,亦能与NO协同发挥致炎生物活性,加剧炎症反应[8]。巨噬细胞被认为是分泌合成IL-1β最主要的来源,IL-1β是炎症反应的促炎介质之一,并能进一步合成并诱导炎症始动因子TNF-α的合成释放,加剧炎症反应。
MTT结果显示,浓度为10,20,40 mg·L-1差异,表明受试药物在这3个浓度时,无明显细胞毒性。因此,选用这3个质量浓度作为体外抗时,各给药组细胞存活率与空白组相比无显著性炎研究剂量。与模型组比较,40 mg·L-1的甘草浸膏组和5组内生菌代谢物组(JTZB006、JTZB018、JTZB059、JTZB060、JTZB063)巨噬细胞RAW264.7分泌的NO、PGE2、IL-1β的含量显著降低(P<0.05或P<0.01),表明甘草水提液浸膏及5组内生菌代谢物具有体外抗炎作用,能显著抑制RAW264.7合成炎症因子NO、PGE2、IL-1β。
表1 对巨噬细胞RAW264.7存活率及分泌炎症因子的影响(n=4,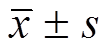 )
)
Tab. 1 Effects on the macrophages survival rate and the secretion of inflammatory factors in RAW264.7 cell(n=4,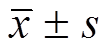 )
)

注:与空白组比较,1)P<0.01;与模型组比较,2)P<0.05,3)P<0.01;与同一质量浓度的甘草浸膏组比较,4)P<0.05,5)P<0.01。
Note: Compared with blank group,1)P<0.01; compared with model group,2)P<0.05,3)P<0.01; compared with the same concentration groups of extractumGlycyrrhiza,4)P<0.05,5)P<0.01.
表2 各组大鼠外周血白细胞计数(n=10,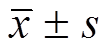 )
)
Tab. 2 Peripheral white blood cell counts of rats in each group(n=10,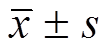 )
)

注:与空白组比较,1)P<0.01;与模型组比较,2)P<0.01;与甘草水煎液组比较,3)P<0.05。
Note: Compared with blank group,1)P<0.01; compared with model group,2)P<0.01; compared withGlycyrrhizawater decoction group,3)P<0.05.
表3 各组大鼠血清中炎症相关因子的含量(n=10,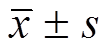 )
)
Tab. 3 The contents of inflammation-associated factors in serum of rats(n=10,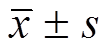 )
)
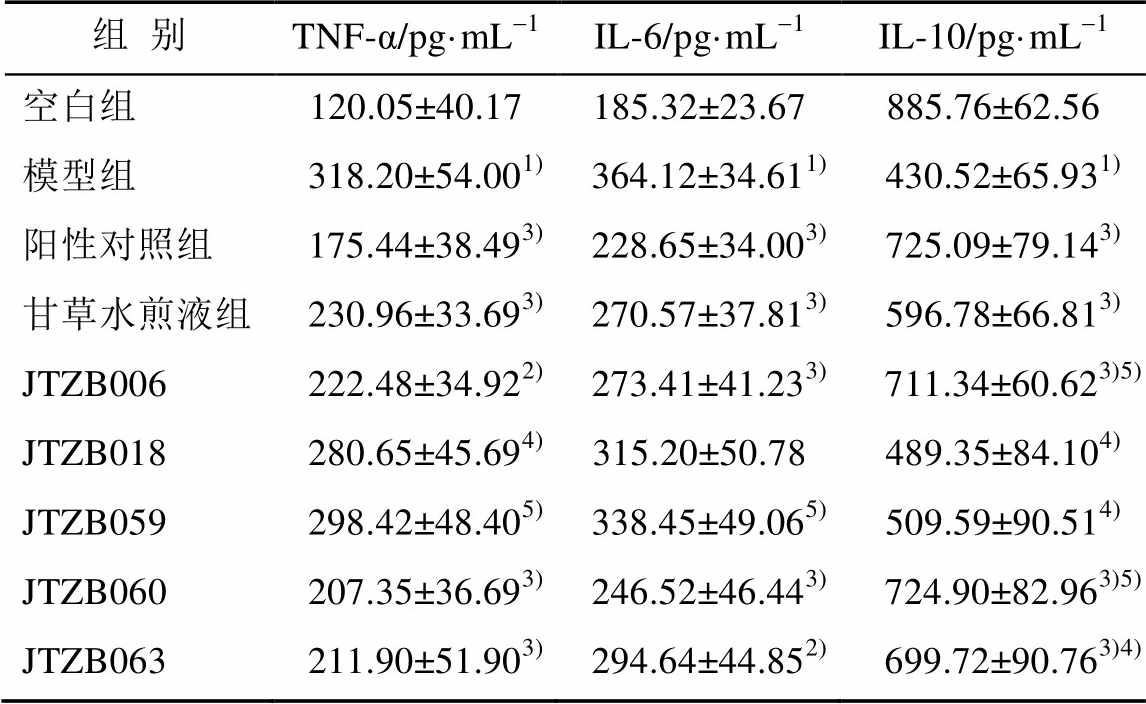
注:与空白组比较,1)P<0.01;与模型组比较,2)P<0.05,3)P<0.01;与甘草水煎液组比较,4)P<0.05,5)P<0.01。
Note: Compared with blank group,1)P<0.01; compared with model group,2)P<0.05,3)P<0.01; compared withGlycyrrhizawater decoction group,4)P<0.05,5)P<0.01.
甘草具有清热解毒、祛痰止咳之功,常用于治疗外感、内伤所致的咳嗽痰多之症。LPS为内毒素的主要活性成分。本研究采用LPS诱导大鼠急性肺炎模型,探讨上述具有体外抗炎作用的5组甘草内生菌代谢物对急性肺炎模型大鼠的干预作用。
急性肺炎早期以渗出、水肿为特点,继而机体白细胞增高,并与血管内皮细胞相互作用,导致炎性白细胞在炎症病灶区域集聚。同时,激活的血管内皮细胞和单核细胞释放大量促炎性因子。TNF-α主要由激活的单核-巨噬细胞分泌产生。炎症反应时,TNF-α大量释放,激活炎症细胞释放大量炎症介质,并作用于血管内皮细胞,促进粘附分子的表达,使血管内皮细胞发生改变,促进炎症介质及炎性细胞因子的产生,形成细胞因子的炎症瀑布连锁效应,引起肺部一系列炎性损害。因此,TNF-α水平是反应肺部感染及病变程度的标志物[9]。IL-6主要由活化的T淋巴细胞、成纤维细胞、肺泡巨噬细胞等多种免疫和非免疫细胞分泌。炎性反应时,IL-6是一种主要的炎性细胞因子。研究表明,IL-6在机体针对革兰阴性菌感染产生的炎症反应中起主要作用,IL-6的含量与肺炎病变程度呈正相关[10],IL-6既可作为反应肺部炎症轻重程度的指标,亦可作为监测药物抗炎疗效的指标[11]。
LPS所致的炎症是一种复杂的防御性免疫体系,由多种细胞、多种因子参与,通过调节促炎和抗炎系统之间的平衡,介入炎症的发生、发展过程。炎症时,抗炎系统亦被激活,IL-10是重要的免疫抑制因子,炎症反应时,IL-10作为抗炎因子,能抑制TNF-α、IL-6等促炎因子的表达,同时IL-10又是细胞因子合成的抑制因子,能抑制活化的淋巴细胞产生细胞因子,IL-10还能抑制单核细胞、巨噬细胞产生致炎介质[12]。因此,IL-10高表达可减轻机体炎症反应,减少胶原的产生,有效控制炎症。
结果显示,与模型组比较,阳性对照组、甘草水煎液组、3组内生菌代谢物组(JTZB006、JTZB060、JTZB063)大鼠外周血中白细胞数量及血清中TNF-α、IL-6的含量均显著降低,IL-10的含量显著升高(P<0.05或P<0.01),表明3株内生菌的代谢物对急性肺炎模型大鼠具有抗炎作用。
综上,3株甘草内生菌代谢物(JTZB006、JTZB060、JTZB063)对LPS诱导的炎症模型具有体外及体内抗炎作用。
REFERENCES
[1] STIERLE A, STROBEL G, STIERLE D. Taxol and taxane production by Taxomyces and reanae, an endophytic fungus of Pacific yew [J]. Science, 1993, 260(5105): 214-216.
[2] KROHN K, FLORKE U. Metabolites from fungi 15. New iso-coumarins from an endophytic fungus isolated from the Cana-dian thistle cirsiumarvense [J]. Nat Prod Lett, 2001, 5(5): 353-361.
[3] MAN Q, DENG Y, YANG Z J, et al. Comparative study on the intervention effects of endophytic bacteria isolated from Glycyrrhizae Radix Et Rhizoma on rats with phlegm turbidity obstructing in the lung [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2017, 34(2): 161-165.
[4] PARK S J, YOUN H S. Suppression of homodimerization of toll-like receptor 4 by isoliquiritigenin [J]. Phytochemistry, 2010, 71(14/15): 1736-1740.
[5] WU Y J, SU J, HUANG P J, et al. Buddleoside prevents TNF-α-induced human aortic endothelial cells inflammatory injury through inhibiting TLR4/IκBα/NF-κB signaling pathway [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2017, 34(5): 637-643.
[6] WANG Y H, ZHU Y P, YANG X D, et al. Screening of endophytic fungi from Curcuma wenyujin with anti- inflammatory and anti-oxidant activities [J]. Drug Evaluation Res(药物评价研究), 2013, 36(2): 90-94.
[7] OU L L, YU X, ZHU Y, et al. Anti- inflammatory effects of Achyranthes aspera on animal models of acute inflammation [J]. West China J Pharm Sci(华西药学杂志), 2012, 27(6): 644-646.
[8] PARK J Y, PLILLINGER M H, ABRAMSON S B. Proatagland in E2 synthesis and secretion: The role of PGE2synthesis [J]. Clin immunol, 2006, 119(3): 229-240.
[9] JERALA R. Structural biology of the LPS recognition [J]. Int J Med Microbiol, 2007, 297(5): 353-363.
[10] SHAO M Y, HUANG P, CHENG R. Interleukin-6 polymorphisms modify the risk of periodontitis: a systematic review and meta-analysis [J]. J Zhejiang Univ Sci B, 2009, 10(12): 920.
[11] CHEN W L, LIU X J. Clinical study on the effects of Huatan zhike mixture on the levels of serum SAA, IL-6, IL-1β and lung function in acute exacerbated chronic obstructive pulmonary disease patients [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2017, 34(3): 432-435.
[12] CHEN Y M, HUANG W J, LI S L, et al. Changes of IFN-γ, IL-6 and TNF-α levels in rats with severe pneumonia [J]. Chin J Pathophysiol(中国病理生理杂志), 2007, 23(3): 492-494.
(本文责编:蔡珊珊)
Anti-inflammatory Effect in the Metabolites of Endophytes fromGlycyrrhiza Uralensis
YANG Zhijun, DENG Yi*, MAN Qiong, YANG Xiujuan, YANG Yanze
(GansuUniversity of Traditional Chinese Medicine, Lanzhou 730000, China)
ABSTRACT: OBJECTIVETo study anti-inflammatory effect of the metabolites of endophytes isolated fromGlycyrrhiza uralensisin vivoandinvitro.METHODSRAW264.7 cells were inoculated onto a 96-well plate. The model group was added with 1 mg·L-1LPS for culture, and each test drug group was added withGlycyrrhizawater extracts or the fermentation products of endophytes (10, 20, 40 mg·L-1) for 2 h of treatment, then LPS (1 mg·L-1) was added for stimulation. Thecontent of nitric oxide (NO), Interleukin-1β (IL-1β) and Prostaglandin E2(PGE2)were measured. ninety Wistar rats were randomly divided into 9 groups, and each group was given the corresponding drug by gavage administration once per day for 5 d. Except the blank group, the other groups were intravenously injected with LPS (1 mg·kg-1) to establish an acute pneumonia model, while the blank group was injected with the same volume of normal saline. After 6 h, blood was collected from rat femoral artery to detect peripheral white blood cell counts and the contents of serum TNF-α, IL-6 and IL-10.RESULTSCompared with LPS model group, when the mass concentration was maintained at 40 mg·L-1, the contents of NO, PGE2and IL-1β were significantly reduced in extractumGlycyrrhizagroup and endophytes fermentation products groups(JTZB006, JTZB018, JTZB059, JTZB060, JTZB063)(P<0.05 orP<0.01). The contents of PGE2in JTZB006, JTZB060 were significantly lower than those of extractumGlycyrrhizagroup at 40 mg·L-1. Compared with model group, the white blood cell counts and the contents of TNF-α and IL-6 were significantly reduced in positive control group,Glycyrrhizawater decoction group, 3 groups of the fermentation products of endophytes. The contents of IL-10 in JTZB006, JTZB060 and JTZB063 significantly higher than those ofGlycyrrhizawater decoction groupin rat serum (P<0.05 orP<0.01).CONCLUSIONJTZB006, JTZB060 and JTZB063 have anti-inflammatory effects in LPS induced inflammatory model.
KEY WORDS: Glycyrrhiza uralensis; the metabolites of endophytes; anti-inflammatory; RAW264.7; rats
中图分类号:R965.2
文献标志码:A
文章编号:1007-7693(2018)05-0633-05
DOI:10.13748/j.cnki.issn1007-7693.2018.05.003
收稿日期:2017-10-22
引用本文:杨志军, 邓毅, 曼琼, 等. 甘草内生菌代谢物的抗炎作用[J]. 中国现代应用药学, 2018, 35(5): 633-637.
基金项目:国家自然科学基金项目(81360633)
作者简介:杨志军,女,博士,副教授 Tel: (0931)8765389 E-mail: yangzhijun1971@yeah.net
*通信作者:邓毅,男,教授,博导 Tel: (0931)8762701 E-mail: dengyi@gszy.edu.cn