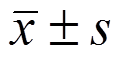 表示,采用t检验进行统计,以P<0.05为差异有统计学意义。
表示,采用t检验进行统计,以P<0.05为差异有统计学意义。柯炜1,叶志华2*
(1.武穴市第一人民医院,湖北 武穴 435400;2.鄂东医疗基团黄石中心医院,湖北 黄石 435000)
摘要:目的观察百里醌对大鼠肾缺血再灌注损伤(ischemia-reperfusion injury,IRI)的保护作用。方法60只健康SD大鼠,♂,随机分成正常组、模型组和百里醌组。模型组和百里醌组大鼠建立肾脏缺血再灌注模型,百里醌组在再灌注同时腹腔注射百里醌(40 mg·kg-1)。HE染色观察肾脏组织病理改变;测定血清指标肌酐(Scr)、尿素氮(BUN)以及肾组织指标丙二醛(MDA)、超氧化物岐化酶(SOD);采用原位缺口末端标记检测肾小管上皮细胞凋亡指数(AI);RT-PCR检测肾脏组织中的caspase-3,Bax和TNF-α和IL-1β的表达情况。结果模型组可见肾小管扩张,肾小管上皮细胞坏死等,经百里醌治疗后明显改善。与模型组相比,百里醌组凋亡指数明显降低(P<0.05)。与正常组比较,模型组SOD活性显著降低(P<0.05),MDA含量、Scr和BUN显著升高(P<0.05);与模型组比较,百里醌组SOD活性显著升高(P<0.05),MDA含量、Scr和BUN显著降低(P<0.05);与正常组比较,模型组中caspase-3、Bax、TNF-α和IL-1β mRNA表达水平明显增高(P<0.05)。和模型组比较,百里醌组中caspase-3、Bax、TNF-α和IL-1β表达明显减低(P<0.05)。结论百里醌可减轻氧化应激水平,发挥抗炎及抗凋亡作用,从而在肾脏IRI过程中发挥保护作用。
关键词:百里醌;缺血再灌注损伤;肾脏
肾缺血再灌注损伤(ischemia-reperfusion injury,IRI)是发生肾功能衰竭的常见原因,通常发生在肾移植、肾部分切除术、肾医源性创伤以及肾血栓性血管等疾病中[1-2]。肾脏发生缺血后,血流量的恢复对于肾脏组织的存活是极其重要的,但同时也会造成额外的肾脏损伤[3]。其病理机制可能与氧化应激、炎症反应、钙离子超载内流和细胞凋亡等多种因素密切相关[4]。百里醌是从黑种夏草种子中提取的具有生物活性成分的单体,具有广泛的药理作用。研究显示,在多种器官的IRI过程中, 百里醌发挥了抗氧化、抗炎及抗凋亡等作用[5-6]。本研究通过建立大鼠肾脏IRI模型,观察百里醌在大鼠肾脏IRI过程中的作用,为肾脏IRI的防治提供新的手段。
百里醌(上海哈森公司,相对分子量:164.2;含量:96%;货号:C12-17854);无水乙醇(美国 Sigma 公司);丙二醛(MDA)、超氧化物岐化酶(SOD)检测试剂盒均购自南京建成生物工程研究所(批号分别为A003-1和A001-1);血肌酐(Scr)、尿素氮(BUN)和LX20型全自动生化分析仪均购自美国贝克曼库尔特公司;原位细胞凋亡检测试剂盒(德国罗氏生物技术有限公司,批号:11684817910);RNA 提取试剂盒及逆转录试剂盒(美国GeneCopoeia 公司,批号:E01010A)。百里醌用无水乙醇溶解并配制成1 mol·L-1的贮存液,-20 ℃冰箱保存。
60只健康SD大鼠(SPF级) ,体质量220~250 g,购自武汉大学实验动物中心,♂,饲养于湖北省人民医院动物实验中心,许可证号:SYXK(鄂)2015- 0027;设施使用证明号:00138020。随机分为正常组、模型组和百里醌组,每组20只。实验前,所有大鼠饲养在恒定温度的房间,自由进食和水。所有大鼠经腹腔注射2%戊巴比妥钠(50 mg·kg-1)麻醉。常规消毒铺巾,取腹正中切口,暴露右侧肾脏并切除,游离左侧肾蒂。正常组:仅游离左侧肾蒂,不给予任何干预措施,暴露45 min后缝合切口。模型组:使用无损伤动脉夹闭左侧肾蒂,45 min后取下动脉夹再灌注,肉眼观察肾脏由暗红色变为鲜红色,说明肾脏再灌注成功,缝合切口关腹。百里醌组:缺血后45 min后,再灌注同时腹腔注射百里醌(40 mg·kg-1)。所有大鼠在灌注后24 h,快速脱颈椎法处死所有大鼠,行腹主动脉取血,室温下3 000 r·min-1离心10 min 后取上清液检测BUN和Cr;快速采集左侧肾脏组织标本。纵向将其切成两半,一半组织固定于4%多聚甲醛用于组织学检查,另一半组织放置液氮中冷冻后转入-80 ℃冰箱保存。
左侧肾脏组织冲洗干净后,置于4%的甲醛溶液中固定,常规石蜡包埋,5 μm厚切片、脱蜡和水化后行HE染色,光镜下观察肾脏组织的形态学改变并评分。分级评分标准<10%为0分,10%~25%为1分,25%~50%为2分,50%~75%为3分,75%~100%为4分。
采集各组的血液标本,用生化分析仪测定各组Scr、BUN含量。将冷冻的肾脏组织匀浆离心(3 500 r·min-1,半径80 mm,10 min),然后收集上清液。MDA含量采用硫代巴比妥酸法测定,SOD活性采用黄嘌呤氧化酶法,操作按照说明书指示进行。
利用末端脱氧核苷酸转移酶介导的dUTP缺口末端标记(TUNEL)法检测细胞凋亡,细胞核染成棕黄色者为阳性细胞,光镜下每张切片选取10个连续不重叠的视野,计算细胞总数和阳性细胞数。凋亡指数(AI)= (阳性细胞数/细胞总数)×100%。
取100 mg 冻存肾脏组织样本,加入Trizol试剂提取总RNA。取1 μg 总RNA逆转录成cDNA,采用PCR基因扩增仪进行扩增。25 μL 反应体系,反应方案依据试剂盒操作步骤。反应条件:逆转录52 ℃ 15 min,94 ℃ 40 s;循环条件:90 ℃ 30 s、54 ℃ 10 s、70 ℃ 45 s,40个循环。引物序列:caspase-3正义链5'-TGGACTGCGGTATTGAGA CA-3',反义链5'-GCGCAAAGTGACTGGATGAA- 3';Bax正义链5'‑TGAACTGGACAACAACATGG AG‑3',反义链5'‑AGCAAAGTAGAAAAGGGCAA CC‑3';TNF-α正义链5'-TGGACTGCGGTATTGA GACA-3',反义链5'-GCGCAAAGTGACTGGAT GAA-3';IL-1β正义链5'‑TGAACTGGACAACAA CATGGAG‑3',反义链5'‑AGCAAAGTAGAAAAG GGCAACC‑3';GAPDH正义链5'‑TGCTATGTTG CCCTAGAC‑3',反义链5'‑GTTGGCATAGAGGT CTTTACGG‑3'。软件分析各组的循环阈值(Ct),最终数据以2-DDCt进行分析,得出各组基因的表达量。
采用SPSS 17.0 统计软件进行方差分析,计量资料以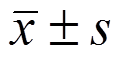 表示,采用t检验进行统计,以P<0.05为差异有统计学意义。
表示,采用t检验进行统计,以P<0.05为差异有统计学意义。
正常组未见明显的组织病理学改变,肾小管上皮细胞无变性坏死;模型组可见肾小管扩张充血,肾小管上皮细胞水肿和坏死;百里醌组可见肾小管上皮细胞损伤较模型组减轻,细胞坏死较少,可见部分肿胀、变性和细胞脱落。正常组、模型组和百里醌组肾脏组织病理损伤评分分别为0.42±0.15,3.78±0.21,1.26±0.19,与模型组相比,百里醌组肾脏组织损伤显著改善,结果见图1。
模型组中MDA、Scr、BUN含量较正常组明显增加,百里醌治疗后MDA、Scr、BUN含量显著降低,组间比较均有统计学意义(P<0.05);与正常组相比,模型组SOD活性明显降低,百里醌治疗后增加了肾脏组织中SOD的活性,组间比较均有统计学意义(P<0.05)。结果见表1。
表1 血清肌酐、尿素氮以及肾组织丙二醛、超氧化物岐化酶测定(n=20,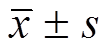 )
)
Tab. 1 Determination of Scr, BUN, MDA and SOD(n=20,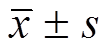 )
)

注:与正常组比较,1)P<0.05;与模型组比较,2)P<0.05。
Note: Compared with normal gorup,1)P<0.05; compared with model group,2)P<0.05.
正常组、模型组和百里醌组的肾小管上皮细胞凋亡指数分别为6.26±0.38,19.43±1.27,9.46± 0.72。正常组可见散在较少的肾小管上皮细胞凋亡;模型组中凋亡细胞明显增加,染色阳性细胞以远端肾小管上皮细胞多见,与正常组相比有统计学意义(P<0.05);百里醌组细胞凋亡较模型组明显减少,差异有统计学意义(P<0.05)。结果见图2。
模型组Bax、caspase-3、TNF-α和IL-1β mRNA表达水平,与正常组比较显著增加;与模型组比较,百里醌治疗后其mRNA表达水平明显降低,组间比较均有统计学意义(P<0.05),结果见图3。
黑种夏草是一种原产于地中海和中东地区常用的生物药材,一直被广泛用于支气管哮喘、湿疹、高血压等疾病的治疗[7]。百里醌是黑种夏草种子提取物中的主要活性成分,最近研究发现百里醌具有多种生物学作用。Galaly等[8]研究发现百里醌可通过激活内皮细胞分泌生长因子,激发平滑肌细胞大量增殖,从而在肝细胞的损伤中发挥抗凋亡及抗炎的作用;Vance等[9]报道了百里醌可通过降低氧化应激的水平,对大鼠肾小管上皮细胞的功能产生保护作用。本实验采用HE染色观察IRI对大鼠肾脏组织学变化的影响,结果显示:肾脏IRI组出现明显的病理学的变化,比如肾小管充血扩张,肾小管上皮细胞水肿和坏死等表现;经百里醌治疗后,肾脏IR引起的组织学损伤明显改善。氧化应激是机体内活性氧自由基(ROS)大量积累的结果,ROS也是器官IRI发展的重要因素。当肾脏血供中断引起缺血发作时,可导致肾脏微循环系统的ROS清除能力明显降低,再灌注时则诱发肾脏产生大量ROS,过量的ROS可与细胞内重要的分子如蛋白质、脂质和核酸等发生反应,破坏了其正常的功能[10-11]。正常情况下,SOD水平反映机体清除氧自由基的效率,其抗氧化能力可改善IRI;MDA是脂质氧化的一种重要产物,通常用于评估氧化应激下细胞损伤的程度。Bun和Scr是人体内代谢的产物,也是评价肾功能常用的指标。各种肾实质性病变,如肾小球肾炎、急慢性肾功能衰竭、肾内占位性和破坏性病变均可使肾小球滤过率下降,导致血液中Bun及Scr升高[12-13]。Gokce等[5]发现了百里醌可明显减少ROS的生成,从而抑制大鼠神经细胞线粒体中的氧化应激水平,在预防神经损伤的氧化应激损伤中具有治疗潜力。本研究表明,百里醌处理后,可明显使IRI肾脏组织中的SOD活性升高,MDA、Scr、BUN含量降低,从而减轻了肾脏氧化应激及功能的损伤。
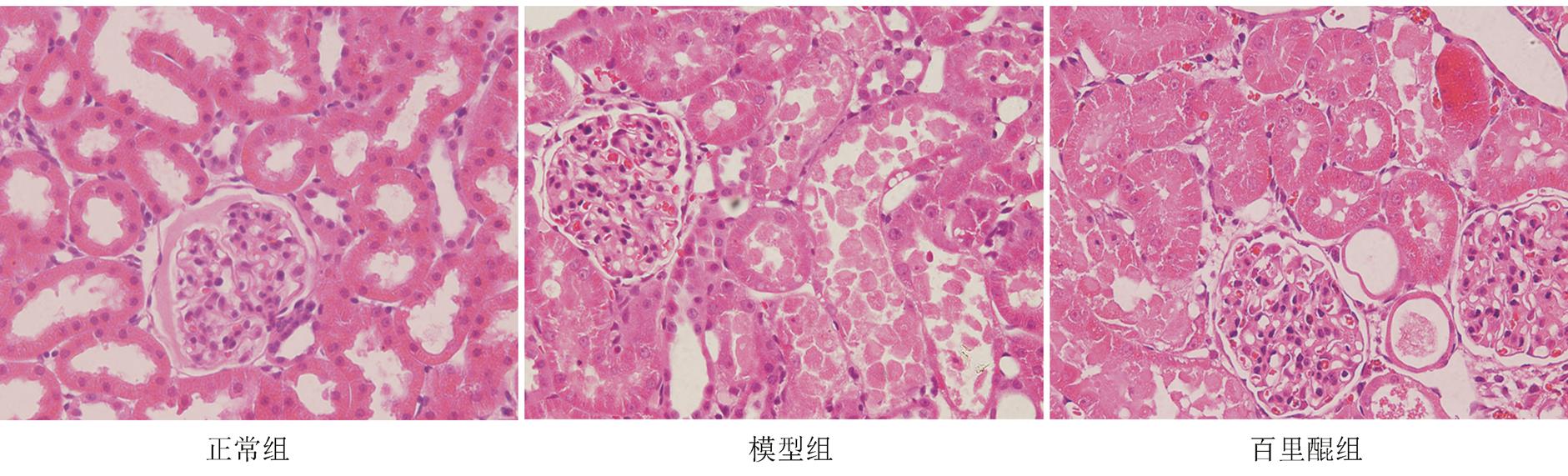
图1 肾脏组织病理学改变(HE,400×)
Fig. 1 Histopathological changes of kidney(HE, 400×)
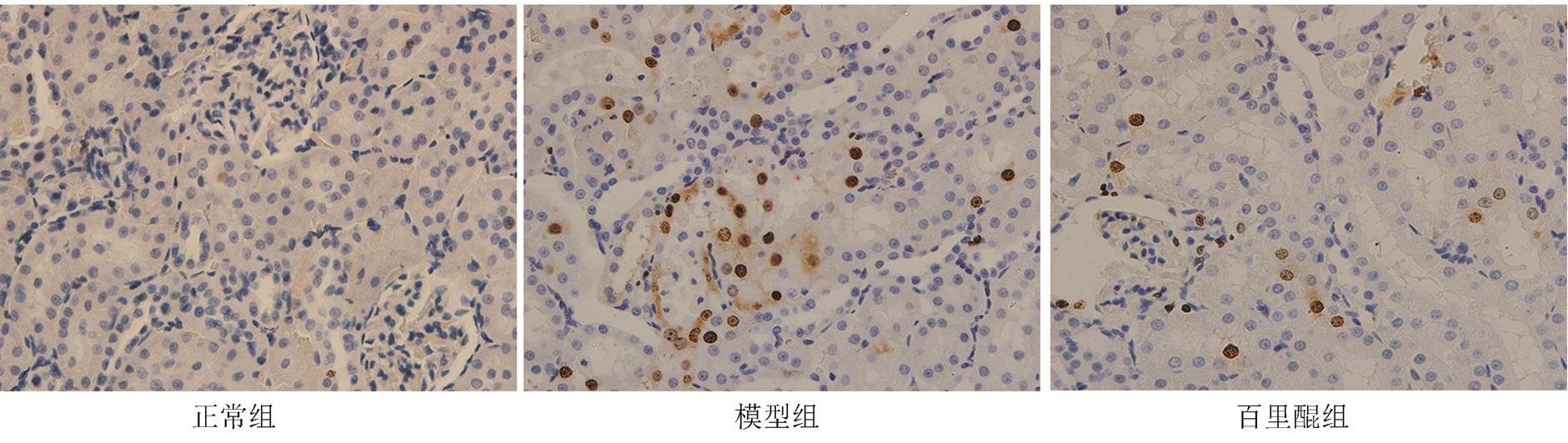
图 2 肾小管上皮细胞凋亡检测(TUNEL,400×)
Fig. 2 Apoptosis in renal tubular epithelial cells(TUNEL, 400×)
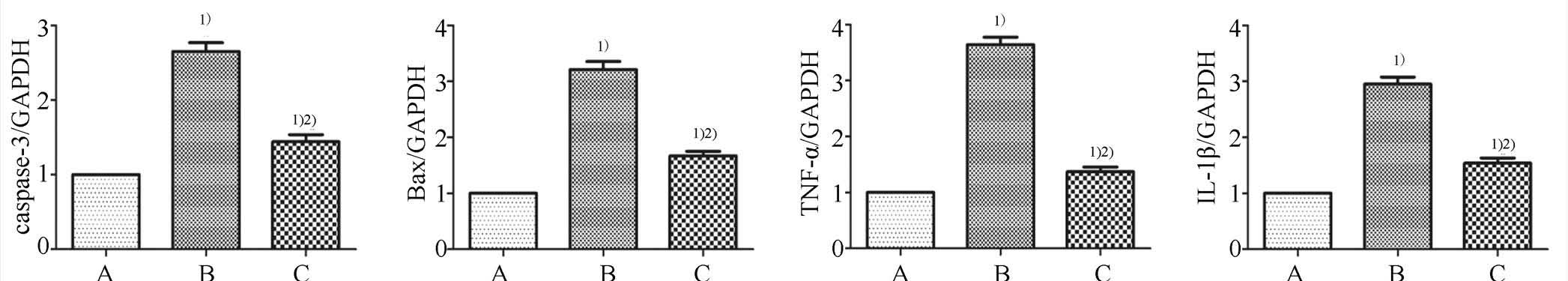
图3 肾脏组织中caspase-3、Bax,TNF-α和IL-1β mRNA的表达水平
A-正常组;B-模型组;C-百里醌组;与正常组比较,1)P<0.05;与模型组比较,2)P<0.05。
Fig. 3 The mRNA expression levels of caspase-3, Bax, TNF-α and IL-1β in renal tissue
A-normal group; B-model group; C-thymoquinone group; compared with normal gorup,1)P<0.05; compared with model group,2)P<0.05.
细胞凋亡被认为是IRI最严重的后果,和最终器官功能损害的程度有密切的关系。IRI时,由于能量的消耗,活性代谢产物的大量产生,激活细胞凋亡途径,引起大量细胞凋亡,致机体发生损伤[14]。研究发现,肾脏IRI时,肾小管上皮细胞凋亡明显增多;同时,caspase-3和Bax被激活,其激活是通过一系列的信号转导通路之间的相互作用决定的,最终引起细胞底物的降解而诱导凋亡,这些影响包括细胞固缩、碎裂,染色质凝聚和DNA片段化等[15-16]。IRI引起的损伤具有复杂的病理过程,炎症也是缺血性损伤发生发展的关键因素。其中,TNF-α和IL-1β是参与的IRI病理过程的重要炎症因子。TNF-α是一种单核因子,它能够增加中性粒细胞的吞噬功能,促进内皮细胞中IL-1的分泌,从而增加组织损伤和炎症反应。IL‑1β是一种免疫源性细胞因子,能在缺血时受到刺激促进自身分泌[17]。本实验IRI模型组中,caspase-3、Bax、TNF-α和IL-1β表达明显高于对照组,其肾小管上皮细胞凋亡指数显著升高;经百里醌治疗后,肾小管上皮细胞凋亡较IRI模型组明显降低。以上实验结果证明百里醌在肾脏IRI中具有抗凋亡及抗炎作用。
综上所述,百里醌可减轻氧化应激水平,发挥抗炎及抗凋亡作用,从而在肾脏IRI过程中发挥保护作用。以上这些发现为我们更好地理解百里醌对泌尿系统疾病治疗的作用提供了依据,无疑将为未来提供新的思路。
references
[1] Barri Y M, Sanchez E Q, Jennings L W, et al. Acute kidney injury following liver transplantation: definition and outcome [J]. Liver Transpl, 2009, 15(5): 475-483.
[2] Yun Y, Duan W G, Chen P, et al. Ischemic postconditioning modified renal oxidative stress and lipid peroxidation caused by ischemic reperfusion injury in rats [J]. Transplant Proc, 2009, 41(9): 3597-3602.
[3] Wang Z S, Liu X H, Wang M, et al. Metformin attenuated the inflammation after renal ischemia/reperfusion and suppressed apoptosis of renal tubular epithelial cell in rats [J]. Acta Cir Bras, 2015, 30(9): 617-623.
[4] Wang L, Liu X, Chen H, et al. Effect of picroside II on apoptosis induced by renal ischemia/reperfusion injury in rats [J]. Exp Ther Med, 2015, 9(3): 817-822.
[5] Gokce E C, Kahveci R, Gokce A, et al. Neuroprotective effects of thymoquinone against spinal cord ischemia-reperfusion injury by attenuation of inflammation, oxidative stress, and apoptosis [J]. J Neurosurg Spine, 2016, 24(6): 949-959.
[6] Abd-Elbaset M, Arafa E A, El S G, et al. Thymoquinone mitigate ischemia-reperfusion-induced liver injury in rats: a pivotal role of nitric oxide signaling pathway [J]. Naunyn Schmiedebergs Arch Pharmacol, 2017, 390(1): 69-76.
[7] Darakhshan S, Bidmeshki P A, Hosseinzadeh C A, et al. Thymoquinone and its therapeutic potentials [J]. Pharmacol Res, 2015(95/96): 138-158.
[8] Galaly S R, Ahmed O M, Mahmoud A M. Thymoquinone and curcumin prevent gentamicin-induced liver injury by attenuating oxidative stress, inflammation and apoptosis [J]. J Physiol Pharmacol, 2014, 65(6): 823-832.
[9] Vance S H, Benghuzzi H, Wilson-Simpson F, et al. Thymoquinone supplementation and its effect on kidney tubule epithelial cellsin vitro[J]. Biomed Sci Instrum, 2008(44): 477-482.
[10] Chatauret N, Badet L, Barrou B, et al. Ischemia-reperfusion: From cell biology to acute kidney injury [J]. Prog Urol, 2014, 24(Suppl 1): S4-S12.
[11] Bayatli F, Akkus D, Kilic E, et al. The protective effects of grape seed extract on MDA, AOPP, apoptosis and eNOS expression in testicular torsion: an experimental study [J]. World J Urol, 2013, 31(3): 615-622.
[12] Jiang D, Wu D, Zhang Y, et al. Protective effects of hydrogen rich saline solution on experimental testicular ischemia-reperfusion injury in rats [J]. J Urol, 2012, 187(6): 2249-2253.
[13] Giribabu N, Karim K, Kilari E K, et al. Phyllanthus niruri leaves aqueous extract improves kidney functions, ameliorates kidney oxidative stress, inflammation, fibrosis and apoptosis and enhances kidney cell proliferation in adult male rats with diabetes mellitus [J]. J Ethnopharmacol, 2017(205): 123-137.
[14] Zhang Z X, Shek K, Wang S, et al. Osteopontin expressed in tubular epithelial cells regulates NK cell-mediated kidney ischemia reperfusion injury [J]. J Immunol, 2010, 185(2): 967-973.
[15] Zheng Y, Zhang X, Zhou J, et al. Effects on the ipsilateral testis during progression of experimental varicocele in rat [J]. Med Sci Monit, 2008, 14(6): R122-R126.
[16] Zhong Z, Hu Q, Fu Z, et al. Increased expression of aldehyde dehydrogenase 2 reduces renal cell apoptosis during ischemia/reperfusion injury after hypothermic machine perfusion [J]. Artif Organs, 2016, 40(6): 596-603.
[17] Kamo N, Ke B, Ghaffari A A, et al. ASC/caspase-1/IL-1beta signaling triggers inflammatory responses by promoting HMGB1 induction in liver ischemia/reperfusion injury [J]. Hepatology, 2013, 58(1): 351-362.
(本文责编:曹粤锋)
Ke Wei1, Ye Zhihua2*
(1.Wuxue the first People’s Hospital, Wuxue 435400, China; 2.Huangshi Central Hospital, Edong Healthcare Group, Huangshi 435000, China)
ABSTRACT: OBJECTIVETo investigate the protective effect of thymoquinone on renal ischemia reperfusion injury in rats.MethodsSixty male SD rats were randomly divided into three groups: normal group, model group and thymoquinone group. Renal ischemia reperfusion model was established in model group and thymoquinone group, thymoquinone (40 mg·kg-1) was injected intraperitoneally followed reperfusion in thymoquinone group. The pathological changes of the kidney were observed by HE staining. MDA, SOD, Scr and BUN content were determined; cell apoptosis index was detected by dUTP nick end labeling. The expression of caspase-3, Bax, TNF-α and IL-1β in renal tissue was detected by RT-PCR.RESULTSModel group showed renal tubular expansion, renal tubular epithelial cell necrosis, thymoquinone treatment significantly improved the above changes. Compared with normal group, apoptosis index in model group significantly decreased(P<0.05). Compared with normal group, SOD activities in model group significantly decreased(P<0.05), MDA content, Scr and BUN significantly increased(P<0.05); compared with model group, SOD activities in thymoquinone group significantly increased(P<0.05), MDA content, Scr and BUN significantly decreased(P<0.05). Compared with normal group, the mRNA expression of caspase-3, Bax, TNF-α and IL-1β were significantly increased(P<0.05). Compared with model group, the expression of caspase-3, Bax, TNF-α and IL-1β decreased in thymoquinone group(P<0.05).CONCLUSIONThymoquinone reduces the level of oxidative stress and inhibit the apoptosis and inflammation. Thus, it plays a protective role in the process of renal ischemia-reperfusion injury.
KEY WORDS:thymoquinone; ischemia reperfusion injury; kidney
中图分类号:R284.5
文献标志码:A
文章编号:1007-7693(2018)05-0688-05
DOI:10.13748/j.cnki.issn1007-7693.2018.05.015
引用本文:柯炜, 叶志华. 百里醌对大鼠肾脏缺血再灌注损伤的保护作用[J]. 中国现代应用药学, 2018, 35(5): 688-692.
收稿日期:2017-09-30
作者简介:柯炜,男,硕士,主治医师 Tel: 13855348212 E-mail: 1315816132@qq.com
*通信作者:叶志华,男,硕士,副主任医师 Tel: 18671419992 E-mail: 416202996@qq.com