基于miRNAs的知母水提物体外抑制胃癌细胞SGC7901增殖作用机制
莫丽1,方晴霞2,余陈欢3,张欢欢3,严洁萍2,吕良忠1,2*
(1.浙江中医药大学药学院,杭州 310053;2.浙江省人民医院药学部,杭州 310014;3.浙江省医学科学院,浙江省实验动物与安全性研究重点实验室,杭州 310013)
摘要:目的 从微小核苷酸(miRNAs)的角度研究知母水提物(aqueous extract fromAnemarrhenae Rhizoma,ARAE)体外抑制SGC7901细胞增殖的作用机制。方法 采用MTT法检测ARAE对SGC7901细胞增殖的影响;采用流式细胞术检测ARAE对SGC7901细胞凋亡的影响;采用高通量测序法检测细胞中miRNAs的表达丰度差异;采用miranda、mirbase和targetscan 3个数据库信息比对,预测差异miRNAs的靶基因,并通过KEGG 分析靶基因的相关功能;采用实时荧光定量PCR法验证主要靶基因的表达变化。结果 ARAE能明显抑制SGC7901细胞的增殖并诱导其凋亡,调节细胞miR-16-5p、miR-20a-5p、miR-26b-5p和miR-15b-5p的表达水平;并提示这些miRNAs所调控的靶基因主要富集于PI3K-Akt、JAK-STAT和MAPK等信号通路。结论 ARAE可能通过调节SGC7901细胞内miRNAs的表达从而抑制SGC7901细胞增殖,并诱导其凋亡。
关键词:知母水提物;SGC7901;微小核苷酸;靶基因
胃癌作为常见的恶性肿瘤,其发病率高居消化道恶性肿瘤之首。化疗是胃癌治疗的主要方式,然而化疗具有不良反应,且化疗后患者容易产生多药耐药,使化疗不能达到理想的治疗效果[1]。由于从植物中提取分离的化合物不但具有作为新药开发的价值,还可为新药结构的设计提供思路[2-3],因此植物来源的抗肿瘤中药引起了越来越多人的重视。
知母(Anemarrhenae Rhizoma),是百合科植物知母Anemarrhena asphodeloides Bge.的干燥根茎,性苦寒,也称毛知母,在中、韩、日等国都有广泛应用。现代研究表明,知母中含药理活性的主要成分包括黄酮类、甾体皂苷类、多糖类及酚酸类等,具有抗炎、抗氧化、抗肿瘤等多种功效[4-5]。知母主要药效成分可通过调节活性氧簇ROS的过度产生及线粒体介导的细胞凋亡途径诱导多种人肿瘤细胞的凋亡[6-7];通过对信号通路转导的调控,知母皂苷AⅢ还可抑制黑色素瘤B16和A375的生长[8],主要涉及的通路有JAK-STAT、TRL4/MAPK和TRL4/NF-κB等信号通路。此外,知母的另一活性成分知母皂苷BⅡ的体外研究表明,其可抑制MAPK和NF-κB的活性,并下调IL-6和TNF-1α等炎症因子的表达[9],具有体外抗炎活性。课题组前期通过高通量药物筛选初步证实,相较于其他中药提取物,知母水提物具有较强的抑制胃癌细胞增殖作用,但其具体的作用机制尚不清楚。
微小核苷酸(miRNAs)是由内源基因编码的非编码单链RNA分子,其长度约为19~24个核苷酸。miRNAs可直接与靶mRNA 3’非翻译区结合,调节靶基因在转录后水平的蛋白质翻译的过程[10]。现研究表明,肿瘤细胞的增殖、分化、自我更新、转移及耐药等过程均涉及多种miRNAs表达的变化,一些miRNAs还发挥了癌基因或抑癌基因的功能[11]。鉴于中药药效物质的多靶点和多途径作用特点,其是否可通过miRNAs途径发挥其抗肿瘤活性的研究尚鲜有报道。因此,本研究采用高通量测序法,观察和验证知母水提物(aqueous extract from Anemarrhenae Rhizoma,ARAE)对人胃癌SGC7901细胞中miRNAs表达丰度的影响;采用生物信息学分析的方法,明确其可能涉及的信号通路,阐明其体外抗胃癌细胞增殖的作用机制。
1 材料
1.1 细胞株
人胃腺癌细胞系SGC7901,由浙江省医学科学院实验动物中心细胞冻存库提供。
1.2 药品与试剂
药材知母由浙江省人民医院中药房提供,经中药师俞佳鉴定为知母Anemarrhena asphodeloides Bge.的干燥根茎。ARAE由浙江省医学科学院药物所提取制备,经HPLC检测知母皂苷BⅡ含量为9.5%;RPMI1640培养基(以色列Biological industies公司,批号:0042016);青霉素-链霉素混合液(美国Biosharp公司,批号:66076128);胎牛血清(FBS,美国Gibco公司,批号:1616964);胰蛋白酶(美国Biosharp公司,批号:65126817);MTT(东京化学工业试剂有限公司,批号:2WXTK);RNAiso Plus(日本Takara公司,批号:AA2105-1);逆转录试剂盒(日本TAKARA公司,批号:AK5801);定量PCR试剂盒(日本TAKARA 公司,批号:A6201A)。
1.3 仪器
Hiseq 2500高通量测序仪(美国Illumina公司);SpectraMaxM4紫外可见分光光度计(上海Molecular Devices公司);Qubit 2.0核酸定量仪(美国Life technologies公司);C1000荧光定量PCR仪(美国BIO-RAD公司);ChemiDoc XRS+化学发光凝胶成像系统(美国BIO-RAD公司)。
2 方法
2.1 细胞增殖试验
待细胞长势良好,弃去原培养基,加适量消化液,消化3 min后加入适量RPMI l640(10% FBS)培养基,重悬细胞并计数,使其终浓度为0.5×105·mL-1,接种于96孔培养板中,每孔接种体积为100 μL,十字晃动后放入培养箱,37 ℃,5% CO2培养。24 h后,实验组加入含不同浓度ARAE的培养基,ARAE浓度为3.5,7,10.5,14 μg·mL-1,设置空白对照组及阳性药10 μg·mL-1顺铂(DDP)对照组。每组设6个平行孔,37 ℃,5% CO2培养。48 h后,取出培养板,每孔加入20 μL MTT溶液(1 mg·mL-1),放回培养箱继续培养,4 h后,取出培养板。3 500 r·min-1离心5 min,弃去板内培养基,每孔加入150 μL DMSO,摇床溶解5 min。用酶标仪测定光密度值,检测波长为490 nm。
2.2 细胞凋亡试验
将细胞铺于6孔板中,待细胞贴壁后,实验组加入含不同浓度ARAE的培养基,ARAE浓度为3.5,7,10.5,14 μg·mL-1,设置空白对照组及阳性药10 μg·mL-1顺铂(DDP)对照组,48 h后,每组收集1×106个细胞到流式管,离心弃上清,PBS离心洗涤2遍。在Annexin V Binding Buffer中重悬细胞,转移细胞悬液至5 mL干净离心管,加入5 μL FITC Annexin V和10 μL碘化吡啶(PI)溶液,室温下避光孵育15 min,利用流式细胞仪检测药物对细胞凋亡的影响。
2.3 miRNAs的提取、高通量测序
取培养48 h的ARAE(7 μg·mL-1) 实验组与空白对照组细胞适量,分别提取总RNA进行高通量测序分析。
2.4 测序结果分析
根据测序结果分析处理,过滤非人类核酸序列及表达丰度极低的序列,筛选出空白对照组、实验组之间表达差异>1.5倍的miRNAs。
2.5 靶基因预测及分析
利用已知的miRNAs数据库(miranda、mirbase和targetscan),预测表达差异>1.5倍的miRNAs所调控的基因,取预测结果的交集作为目标miRNAs的靶基因;采用cytoscape软件,结合以上获取的信息,构建网络关系图;并应用kyoto encyclopedia of genes and genomes(KEGG)对靶基因进行信号通路分析,将表达差异>2倍的miRNAs(miR-26b-5p、miR-20-5P、miR-15b-5p、miR-16-5p)输入KEGG,在Pathways in cancer中查看以上miRNAs所调控的肿瘤相关信号通路,并将以上几个miRNAs都涉及的信号通路作为miRNAs调控的靶基因可能富集的生物学通路。
2.6 qRT-PCR检测靶基因的表达
分别提取空白对照组与给药48 h后ARAE (7 μg·mL-1)实验组细胞的总RNA,逆转录合成cDNA,在PCR扩增后,对相关靶基因Bcl-2、HGF、K-RAS、PDGFR-β、PI3K进行实时荧光定量PCR。基因引物序列见表1。引物合成由上海生工生物工程公司完成。
表1 引物序列
Tab. 1 Primer sequence

基因名称引物序列Bcl-2上游序列:GGTGGGGTCATGTGTGTGG下游序列:CGGTTCAGGTACTCAGTCATCCHGF上游序列:GCTATCGGGGTAAAGACCTACA下游序列:CGTAGCGTACCTCTGGATTGCK-RAS上游序列:TACTGGTGGAGTATTTGATA下游序列:CAAGATTTACCTCTATTGTTPDGFR-β上游序列:TGACCACCCAGCCATCCTTC下游序列:GAGGAGGTGTTGACTTCATTCPI3K上游序列:CAGCACTGCCTCCTAAACCA下游序列:GTCCCGTCTGCTGTATCTCG
2.7 统计处理方法
采用SPSS 17.0统计学分析软件进行统计学处理,组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
3 结果
3.1 ARAE对SGC7901细胞增殖的影响
10 μg·mL-1 DDP作用48 h后对SGC7901细胞增殖的抑制率为50%;而ARAE作用48 h对SGC7901细胞增殖的IC50为6.1 μg·mL-1。以ARAE浓度为横坐标,抑制率为纵坐标,得回归方程y= 0.074 8x+0.353 1(R²=0.875 8),证明在0~14 μg·mL-1的浓度内,ARAE对SGC7901细胞增殖的抑制作用随着给药剂量的增加而增加。结果见图1。
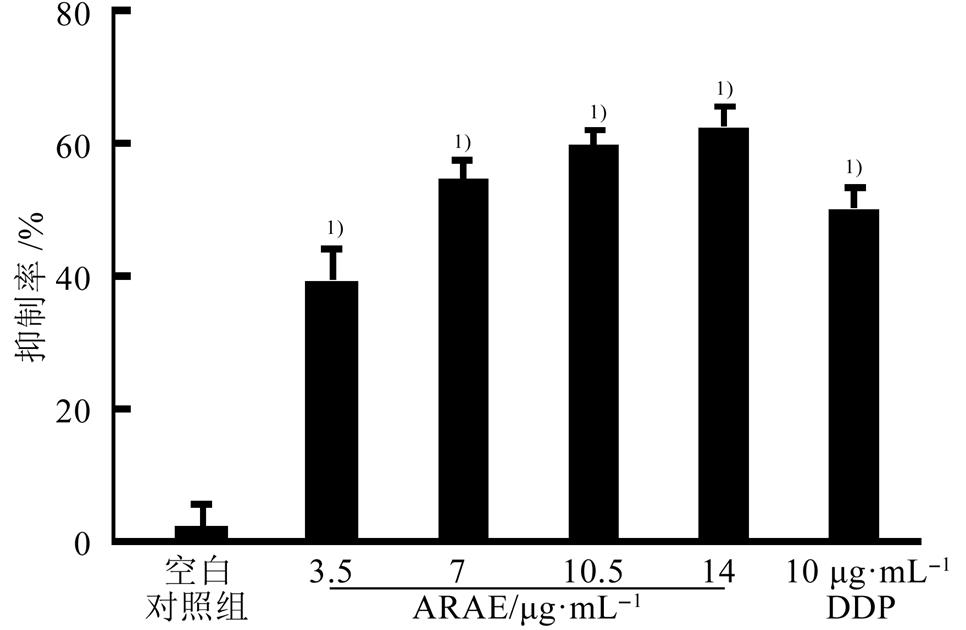
图1 ARAE对SGC7901细胞增殖的抑制作用(n=6, 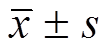 )
)
与空白对照组相比,1)P<0.01。
Fig. 1 The inhibition of ARAE on SGC7901 cell proliferation (n=6, 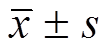 )
)
Compared with the blank control group, 1)P<0.01.
3.2 ARAE对SGC7901细胞凋亡的影响
未加入ARAE处理的细胞凋亡率为7.18%,而不同浓度的ARAE作用48 h后,SGC7901细胞凋亡率从8.24%上升到43.41%,且在0~14 μg·mL-1的浓度范围内,ARAE诱导SGC7901细胞凋亡的作用随着给药剂量的增加而增加。而10 μg·mL-1 DDP作用48 h后,SGC7901细胞的凋亡率为42.61%。结果见图2。
图2 ARAE诱导SGC7901细胞凋亡
Fig. 2 ARAE induced the apoptosis of SGC7901
3.3 ARAE对miRNAs表达的影响
高通量测序结果分析,共鉴定得到29个差异非常显著(P<0.01)的miRNAs。相比空白对照组,ARAE组中共有18种miRNAs的表达上调,6种表达下调;其中,表达丰度>3 000且log2差异倍数>1.5的miRNAs共8个(表2),占miRNAs总体表达丰度的57%,提示ARAE可能主要通过调控上述8个miRNAs的表达进而影响SGC7901细胞的增殖以及诱导细胞凋亡。
3.4 靶基因预测及功能分析
预测筛选出的miRNAs靶基因,预测结果在miranda、mirbase和targetscan数据库有440个靶基因同时重叠。通过cytoscape软件,绘制miRNAs-gene的信号通路调控网络图(图3)。在调控网络图中,miR-26b-5p、miR-20-5P、miR-15b-5p、miR-16-5p调控多个肿瘤相关基因,提示以上几个miRNAs可能为ARAE发挥生物活性所调控的核心miRNAs。
KEGG是经典的生化代谢路径数据库之一,可以模拟构建相关基因的信号通路图。利用KEGG预测miRNAs调控的靶基因可能富集的生物学通路,发现上述差异miRNAs主要参与PI3K-Akt、JAT-STAT及MAPK等信号通路。结果见图4。
表2 关键miRNAs 表达差异情况
Tab. 2 Different expression of several main miRNAs

miRNAslog2差异倍数(ARAE组/空白对照组) miR-16-5p2.77 miR-20a-5p2.55 miR-26b-5p2.16 miR-15b-5p2.03 miR-132-3p1.92 let-7f-5p1.76 let-7a-5p1.71 miR-365b-3p1.55
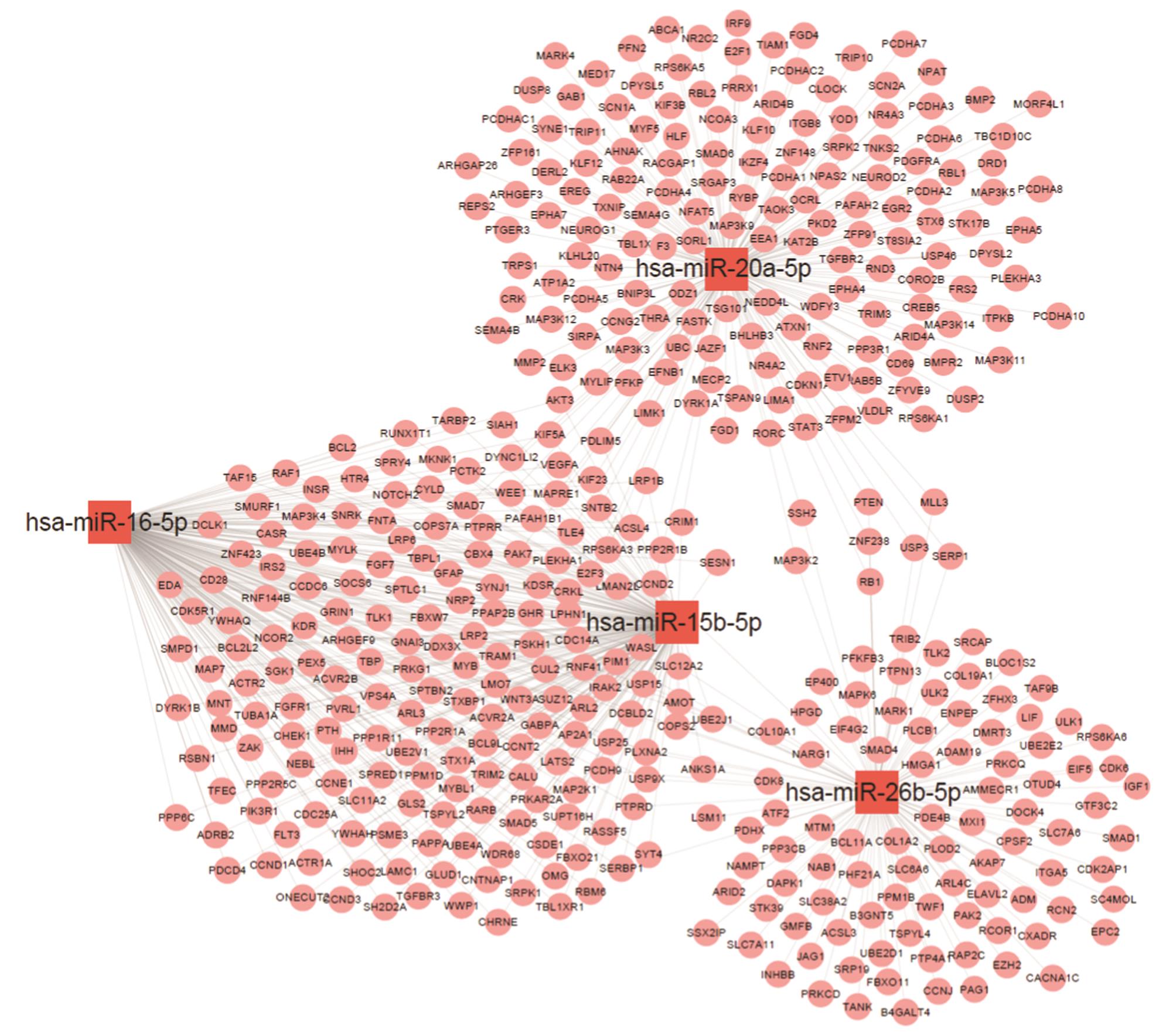
图3 差异表达的miRNAs基因网络调控图
Fig. 3 Gene network of different expressed miRNAs
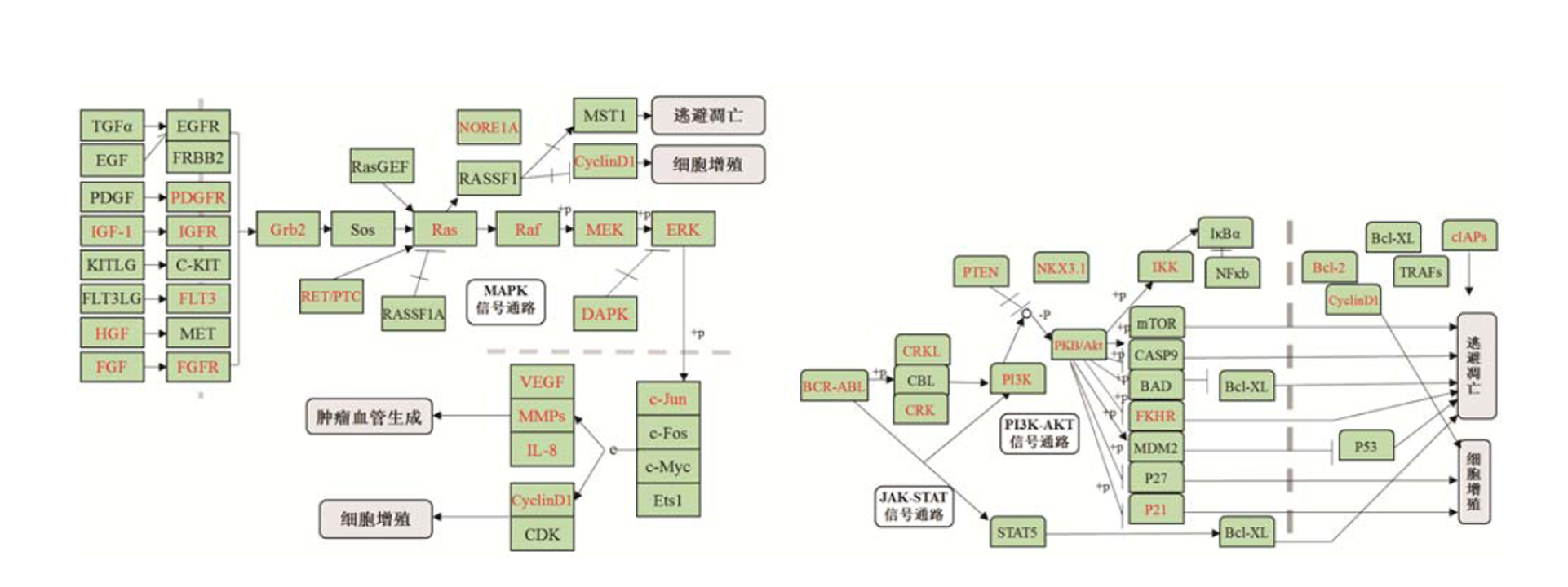
图4 miRNAs调控的信号通路
+p-磷酸化;-p-去磷酸化。
Fig. 4 miRNAs signaling pathway
+p-phosphorylation; -p-dephosphorylation.
3.5 ARAE对相关靶基因表达的影响
结合KEGG信号通路分析结果与miRNAs基因网络调控图,提示ARAE可能作用的靶基因为Bcl-2、HGF、K-RAS、PDGFR-β、PI3K等。作者采用qRT-PCR法对上述靶基因进行相对表达量分析。结果显示ARAE组上述5个靶基因的相对表达量均显著低于空白对照组(P<0.05),其中Bcl-2、HGF、K-RAS和PDGFR-β mRNA相对表达量下调50%左右,提示ARAE可能通过下调JAT-STAT、PI3K-Akt及MAPK通路中的关键基因的转录表达,发挥抑制胃癌细胞增殖,诱导胃癌细胞凋亡的作用。结果见图5。
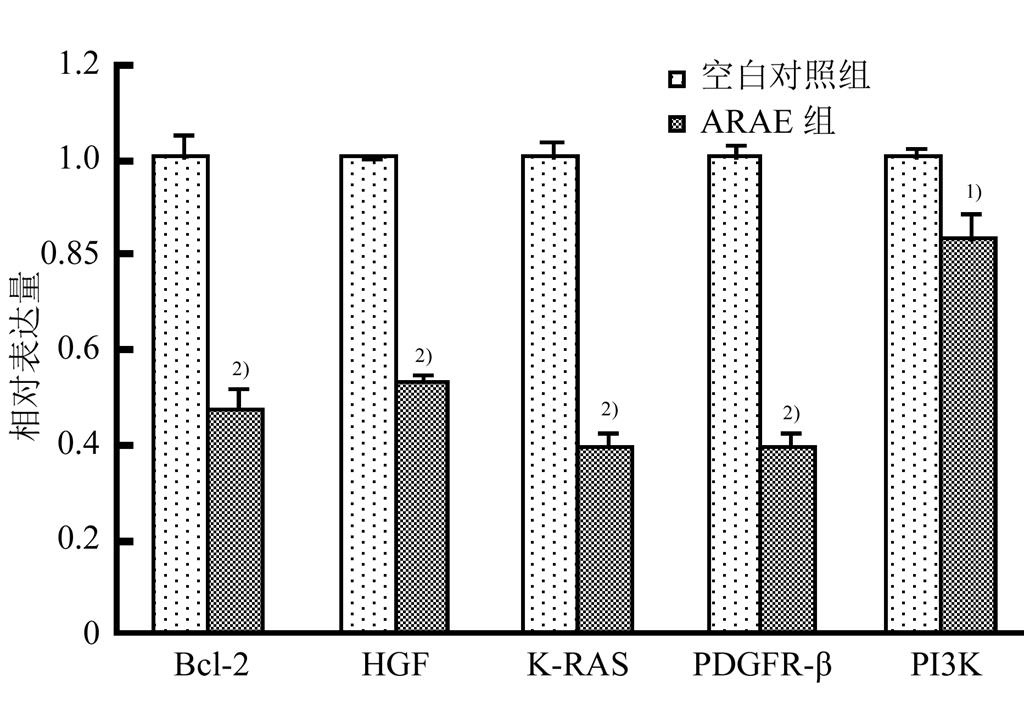
图5 相关靶基因表达情况
与空白对照组相比,1)P<0.05,2)P<0.01。
Fig. 5 Different expression of target genes
Compared with the blank control group, 1)P<0.05, 2)P<0.01.
4 讨论
胃癌的发生是遗传因素与外部环境共同作用的结果,一些抑癌基因、原癌基因、转录因子等在这个过程中也发挥了不同程度的重要作用。同时这些分子的功能也受到包括miRNAs在内的其他分子的调节,共同发挥调控肿瘤生物学行为的作用。大量证据表明,胃癌的发生发展过程与多种miRNAs有关。某些致癌miRNAs(如miR-151、miR-125、let-7等)在胃癌细胞中表达明显升高,通过抑制靶基因PTEN、TP53和e2f1等的表达促进肿瘤的发展[12-13];另一些miRNAs(如miR-20a、miR-26b、miR-15b和miR-365)则作为抑癌基因,可通过抑制某些促癌基因的表达,抑制肿瘤细胞的多药耐药性,并提高化疗敏感性,进而促进肿瘤细胞凋亡[14-16]。本实验采用高通量测序法,共鉴定发现29个表达差异非常显著(P<0.01)的miRNAs参与了ARAE介导的SGC7901细胞增殖抑制作用。其中,miR-16-5p、miR-20a-5p、miR-26b-5p、miR-15b-5p、miR-132-3p、let-7f-5p、let-7a-5p、miR-365b-3p等8个miRNAs在细胞中的表达丰度较高,且在ARAE作用前后表达具有非常显著的差异,可能是ARAE发挥疗效调控的主要因子。通过进一步的生物信息学分析,发现上述8个miRNAs参与调节多个肿瘤相关的信号通路;其中,miR-26b-5p、miR-20-5P、miR-15b-5p、miR-16-5p为ARAE发挥生物活性的核心miRNAs,其主要涉及PI3K-Akt、JAT-STAT及MAPK等通路关键基因的转录翻译。
PI3K-Akt通路与肿瘤细胞的凋亡、肿瘤的生长有关[17]。PI3K即磷酸酰肌醇-3激酶,可以使PIP2转变成PIP3,PIP3激活Akt,而Akt通过磷酸化作用调节其下游蛋白(如NF-κB、Bcl-2等)的表达。JAK-STAT通路参与肿瘤细胞的多个生物学过程,包括肿瘤细胞增殖、分化、凋亡及免疫调节等[18]。MAPK通路作为经典的炎症通路之一,参与调控血管内皮细胞增殖和新血管生成[19]。为进一步验证核心miRNAs靶基因作用效应,本实验采用qRT-PCR法检测ARAE给药前后miRNAs靶基因的表达变化。结果表明,在ARAE作用48 h后,细胞中Bcl-2、HGF、K-RAS、PDGFR-β和PI3K mRNA等表达均显著下调(P<0.05)。提示ARAE通过上调抑癌miRNAs的表达,抑制PI3K-Akt、JAT-STAT及MAPK等通路上癌基因的表达,进而发挥抑制胃癌SGC7901细胞增殖,并诱导细胞凋亡的作用。本实验从miRNAs调控的角度,初步探讨ARAE的抑癌作用机制,为下一步ARAE药效物质及其作用机制分析提供依据。
REFERENCES
[1] Sun W J, Yan L. Gastric cancer: current and evolving treatment landscape [J]. Chin J Cancer, 2016, 35(1): 83-87.
[2] 姚莉, 武兴斌, 秦龙. 蜂斗菜素对人胃癌SGC7901细胞增殖抑制和诱导凋亡作用[J]. 中成药, 2016, 38(10): 2263-2265.
[3] 顾琳慧. 皂苷类成分抗肿瘤机制的研究进展[J]. 中华危重症医学杂志, 2012, 5(5): 344-350.
[4] Sun Y, Wu J, Sun X, et al. Steroids from the rhizome of Anemarrhena asphodeloides and their cytotoxic activities [J]. Bioorg Med Chem Lett, 2016, 26(30): 3081-3085.
[5] ZHAO C C, WU F, ZHANG J Q, et al. Progress in research of pharmacological actions of Anemarrhena asphodeloides [J]. Chin J New Drugs Clin Rem(中国新药与临床杂志), 2015, 12(34): 898-912.
[6] Jung O K, Lee J S, Lee Y J, et al. Timosaponin AⅢ inhibits migration and invasion of A549 human non-small-cell lung cancer cells via attenuations of MMP-2 and MMP-9 by inhibitions of ERK1/2, Src/FAK and β-catenin signaling pathways [J]. Bioorg Med Chem Lett, 2016, 26(16): 3963-3967.
[7] Sy L K, Yan S C, Lok C N, et al. Timosaponin A-Ⅲ induces autophagy preceding mitochondria-mediated apoptosis in HeLa cancer cells [J]. Cancer Res, 2008, 68(24): 10229-10237.
[8] PAN H J, CHEN Z J, ZHANG D D. Effects of timosaponin AⅢ on cell growth of two kinds of melanoma and macrophage activation [J]. China Pharmacist(中国药师), 2015, 18(2): 181-185.
[9] HUO Z H, YIN P, HOU L W, et al. Preparation of timosaponin B-Ⅱnanofiber membranes and preliminary study on its antitumor activity in vitro [J]. Chin J Drug Applicat Monit(中国药物应用与监测), 2014, 11(2): 77-81.
[10] Peng Y, Zhang X J, Ma Q, et al. MiRNA-194 activates the Wnt/b-catenin signaling pathway in gastric Q5 cancer by targeting the negative Wnt regulator, SUFU [J]. Cancer Lett, 2016, 1(11): 1-11.
[11] WANG S N, LV J, ZHANG Q Y, et al. MiRNA and invasion and metastasis of cancer [J]. J Mod Oncol(现代肿瘤医学), 2016, 24(3): 485-487.
[12] Pooja J, Young J J, Alessandro L, et al. MicroRNA-148a reduces tumorigenesis and increases TRAIL- induced apoptosis in NSCLC [J]. Proc Natl Acad Sci USA, 2015, 112(28): 8650-8655.
[13] Zhao X, He W, Li J L, et al. MiRNA-125b inhibits proliferation and migration by targeting SphK1 in bladder cancer [J]. Am J Transl Res, 2015, 7(11): 2346-2354.
[14] Pu Y G, Yi Q Y, Zhao F F, et al. MiR-20a-5p represses multi-drug resistance in osteosarcoma by targeting the KIF26B gene [J]. Cancer Cell Int, 2016, 16(64): 1-15.
[15] Clotaire D Z J, Zhang B, Wei N, et al. MiR-26b inhibits autophagy by targeting ULK2 in prostate cancer cells [J]. Biochem Bioph Res Co, 2016, 472(1): 194-200.
[16] Guo C J, Pan Q, Li D G, et al. MiR-15b and miR-16 are implicated in activation of the rat hepatic stellate cell: An essential role for apoptosis [J]. J Hepatol, 2009, 50(4): 766-778.
[17] Xie Q P, Wen H K, Zhang Q, et al. Inhibiting PI3K-AKT signaling pathway is involved in antitumor effects of ginsenoside Rg3 in lung cancer cell [J]. Biomed Pharmacother, 2016, 5(85): 16-21.
[18] Geng T, Lv D D, Huang Y X, et al. JAK/STAT signaling pathway-mediated immune response in silkworm (Bombyx mori) challenged by Beauveria bassiana [J]. Gene, 2016, 595(1): 69-76.
[19] Sun H Y, Hu K Y, Yin Z S. Inhibition of the p38-MAPK signaling pathway suppresses the apoptosis and expression of proinflammatory cytokines in human osteoarthritis chondrocytes [J]. Cytokine, 2016, 28(90): 135-143.
(本文责编:蔡珊珊)
Aqueous extract fromAnemarrhenae Rhizoma inhibit the proliferation of SGC7901 cells viaregulating miRNAs in vitro
Mo Li1, Fang Qingxia2, Yu Chenhuan3, Zhang Huanhuan3, Yan Jieping2, LYU Liangzhong1,2*
(1.Pharmacy College, Zhejiang Chinese Medical University, Hangzhou 310053, China; 2.Department of Pharmacy, Zhejiang Provincial People’s Hospital, Hangzhou 310014 China; 3.Zhejiang Key Laboratory of Experimental Animal and Safety Evaluation, Zhejiang Academy of Medical Sciences, Hangzhou 310013, China)
ABSTRACT:OBJECTIVE To investigate the effects of aqueous extract fromAnemarrhenae Rhizoma (ARAE) on the proliferation of SGC7901 in vitro based on miRNA regulation. METHODS The inhibition of ARAE on SGC7901 cell proliferation was evaluated by MTT method. And flow cytometry was used to detect the apoptosis of SGC7901 after ARAE treatment. And after ARAE treatment, the different expressions of miRNAs were detected by high-throughput sequencing analysis. Then target genes of differentially expressed miRNAs were analyzed by using miranda, mirbase and targetscan database, while the target functions were considered by KEGG analysis. Those targets were identified by qRT-PCR. RESULTS ARAE could significantly inhibit the proliferation of SGC7901 cells and induced the apoptosis of SGC7901 as well as regulate the expression of miRNAs including miR-16-5p, miR-20a-5p, miR-26b-5p and miR-15b-5p, which were involved in the signaling regulation of PI3K-Akt, JAK-STAT and MAPK pathways. CONCLUSION ARAE could inhibit the proliferation of SGC7901 and induced cell apoptosis in vitro via regulating the expression of miRNAs.
KEY WOEDS: aqueous extract fromAnemarrhenae Rhizoma (ARAE); SGC7901; miRNAs; target genes
中图分类号:R285.5
文献标志码:A
文章编号:1007-7693(2018)05-0678-06
DOI: 10.13748/j.cnki.issn1007-7693.2018.05.013
引用本文:莫丽, 方晴霞, 余陈欢, 等. 基于miRNAs的知母水提物体外抑制胃癌细胞SGC7901增殖作用机制[J]. 中国现代应用药学, 2018, 35(5): 678-683.
收稿日期:2017-09-29
基金项目:浙江省科技计划项目(2014F10033,2015F50065)
作者简介:莫丽,女,硕士生 Tel: (0571)88215491 E-mail: modalii@163.com
*通信作者:吕良忠,男,博士,主任药师 Tel: (0571)88215491 E-mail: lvliangzhong@126.com


 )
)



