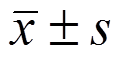 表示,2组间差异比较采用t检验,P<0.05为具有显著性差异,P<0.01为具有极显著性差异。
表示,2组间差异比较采用t检验,P<0.05为具有显著性差异,P<0.01为具有极显著性差异。胡潇1, 任广岩1,唐利华1,郝正亮1,宗磊1,祝骥2,王萃1,卢德赵1*
(1.浙江中医药大学生命科学学院,杭州 310053; 2.浙江中医药大学附属第三医院,杭州 310005)
摘要:目的探讨大气细颗粒物PM2.5对小鼠主动脉Toll样受体(Toll-like receptors,TLRs)信号通路的影响及阿魏酸的干预作用。方法采用气管滴注方法以10,20 mg·kg-1的PM2.5处理小鼠,并用40,80 mg·kg-1的阿魏酸对部分20 mg·kg-1PM2.5处理后的小鼠进行治疗。2周后处死小鼠,血液细胞分析仪检测小鼠血液中炎症细胞水平,ELISA检测血清中IL-1β和IL-6的含量,并用荧光定量PCR检测主动脉中IL-1β和IL-6的mRNA水平,Western blot检测各组小鼠主动脉组织中TLR2、TLR4、MyD88、NF-κB p65蛋白的表达,免疫组化技术观察TLR2和TLR4在小鼠主动脉中的水平。结果PM2.5能提高血液中NEUT、EOS的数量及其在总细胞中的比率,增加血液和主动脉组织中炎症因子IL-1β、IL-6的含量,上调主动脉组织中的TLRs通路相关分子TLR2、TLR4、MyD88、NF-κB p65的表达;而用阿魏酸干预后,血液中白细胞数量、EOS数量、NEUT与EOS的比率明显降低,IL-1β、IL-6水平下降。同时主动脉组织中的TLRs通路相关分子的表达下调。结论PM2.5可能通过TLRs通路诱导小鼠主动脉炎症的产生,而阿魏酸可能通过抑制TLRs通路相关因子的表达而发挥抑制PM2.5诱导的小鼠主动脉炎症的作用。
关键词:阿魏酸;Toll样受体;PM2.5;炎症
近年来,大气细颗粒物对心血管系统危害的研究越来越被重视。多项流行病学调查表明,长期暴露于大气细颗粒物PM2.5中,能显著增加心血管疾病的发病率和死亡率[1-2]。PM2.5诱发心血管疾病与炎症反应密切相关,而Toll样受体(Toll-like receptors,TLRs),特别是TLR2和TLR4,在炎症反应过程中发挥重要作用,它能激活NF-κB,导致IL-1β、IL-6等炎症因子的产生[3]。
阿魏酸是广泛存在于当归、川芎、木贼等中药中的活性成分[4],在抗氧化、抗炎等方面发挥着重要作用[5-6]。研究显示,阿魏酸能通过降低NF-κB的水平减轻LPS诱发的巨噬细胞的炎症反应[7],并且能拮抗PM2.5对大鼠的肺损伤作用[8]。但其在PM2.5诱导的血管炎症中的作用尚未见报道。本研究旨在探究PM2.5诱发小鼠主动脉组织炎症反应以及阿魏酸干预作用的分子机制,为PM2.5诱导的心血管疾病的防治提供新思路和新方法。
7周龄SPF级C57BL/6J小鼠50只,♂,体质量为(18±22)g,购于上海必凯实验动物有限公司,生产许可证号:SCXK(沪)2013-2016。动物饲养于浙江中医药动物实验中心,使用许可证号:SYXK(浙)2013-0184。自由饮食摄水,温度为(24±2)℃,湿度约为50%。
阿魏酸(成都曼思特生物科技有限公司,纯度:99.32%;批号:MUST-17010908);Mouse IL-1β、IL-6 ELISA试剂盒(上海哈林生物有限公司,批号分别为201602、201605);TRIzol®Reagent(Ambion公司,批号:03877);TLR2、TLR4兔多克隆抗体(上海优宁维公司,批号分别为FT20和FT21);骨髓样分化蛋白88(myeloid differentiation protein 88,MyD88)、NF-κB p65鼠单克隆抗体(Santa Cruz公司,批号分别为D0212,B0612);去基因组cDNA第一链合成试剂盒、羊抗鼠IgG、羊抗兔IgG(北京康为世纪生物有限公司,批号分别为30147、10146、10146)。
PM2.5大流量采样仪(美国Thermal Anderson公司);石英纤维滤膜(美国PALL公司);3111 CO2细胞培养箱(美国Thermo Fisher Scientific公司);ADVIA 2120全自动血液细胞分析仪(德国Bayer公司);Step One Plus荧光定量PCR仪(美国ABI公司);Spectra Max190酶标仪(美国Molecular Devices公司);PowerPacTMHCBIO-RAD电泳仪(美国Bio-Rad公司);5427R低温高速离心机(德国Eppendorf公司);JY92-Ⅱ超声波细胞粉碎机(宁波新芝科器研究所);Ti-S倒置显微镜(尼康)。
采样点位于浙江中医药大学生命科学学院5楼,距离地面约15 m,PM2.5大流量采样仪连续采样24 h,空气流量为1.13 m3·min-1,石英滤膜吸附颗粒物。采样结束后,将石英滤膜剪成1 cm2大小,浸泡于去离子水中;超声震荡器震荡3次,每次30 min,洗脱颗粒物;洗提液6层纱布过滤,滤液用真空冷冻干燥机冷冻干燥成干粉;-20 ℃避光保存;使用时紫外灯照射后,用PBS配成5 mg·ml-1的PM2.5母液,使用前超声震荡10 min。
动物适应性喂养1周后,按体质量随机分成5组,每组10只,分别为正常组、PM2.5低浓度组、PM2.5高浓度组、阿魏酸低浓度组、阿魏酸高浓度组。PM2.5高、低浓度组以20,10 mg·kg-1的剂量进行气道滴注,每隔2 d滴注1次,方法参考文献[9]。阿魏酸高、低浓度组均以20 mg·kg-1的PM2.5进行滴注的同时,分别给予阿魏酸80,40 mg·kg-1进行灌胃,每天1次,连续2周。
小鼠经戊巴比妥钠麻醉后,腹主动脉采血,经EDTA-K2抗凝后,全自动血细胞分析仪检测血液中白细胞(white blood cell,WBC)、中性粒细胞(Neutrophil,NEUT)、嗜酸性粒细胞(Eosinophil,EOS)的含量。部分血液静置30 min后,3 000 r·min-1离心20 min,取上层血清,ELISA试剂盒检测血清中炎症因子IL-1β和IL-6的水平。
处死小鼠后,分离小鼠主动脉组织,保存于液氮中,用于RNA和蛋白质的提取。RNA提取参照TRIzol试剂盒说明书进行,分离RNA后,逆转录试剂盒转至cDNA,用于荧光定量PCR的检测;另外,分离主动脉组织后,液氮研磨,加入裂解液后,超声破碎细胞,4 ℃,12 000 r·min-1离心30 min,吸取上清,BCA试剂盒检测蛋白浓度,-80 ℃保存备用。
测定主动脉组织中IL-1β与IL-6 mRNA水平。扩增条件:95 ℃ 10 s、60 ℃ 30 s、72 ℃ 5 s,扩增40个循环。目的基因引物由生工(上海)生物工程股份有限公司合成,引物序列:IL-1β,5’- CGATCGCGCAGGGGCTGGGCGG-3’(forward),5’-AGGAACTGACGGTACTGATGGA-3’(reverse);IL-6,5’-TAGTCCTTCCTACCCCAATTTCC-3’(forward),5’-TTGGTCCTTAGCCACTCCTTC-3’(reverse);β-actin,5’-TTGTCCCTGTATGCCTCTGG-3’(forward),5’-GAGGTCTTTACGGATGTCAACG-3’(reverse)。
取一定量的蛋白样品与上样缓冲液,按比例混合后煮沸5 min,SDS-PAGE电泳80 V恒压3 h,Western blot湿转(0.45 μm的PVDF膜)200 mA恒流2 h,5%脱脂奶粉室温封闭2 h,TBST漂洗3次后分别加入相应一抗,4 ℃孵育过夜,TBST漂洗3次,于37 ℃和二抗反应2 h,TBST漂洗3次后进行ECL显色。用美国Bio-Rad公司的凝胶成像分析系统分析Western blot电泳条带,以内参做对照,计算各处理组目的蛋白的表达情况。
主动脉组织分离后,福尔马林固定,经石蜡包埋切片处理后,消除过氧化物酶活性,并用10%山羊血清封闭,加入一抗孵育并清洗后,孵育二抗,加显色剂,复染、脱水、封片后,在尼康Ti-S倒置显微镜拍照并观察染色情况。
采用GraphPad Prism 5.0软件对数据进行统计分析,结果以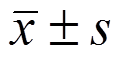 表示,2组间差异比较采用t检验,P<0.05为具有显著性差异,P<0.01为具有极显著性差异。
表示,2组间差异比较采用t检验,P<0.05为具有显著性差异,P<0.01为具有极显著性差异。
在20 mg·kg-1浓度的PM2.5处理小鼠2周后,血液中WBC、NEUT、EOS的数量与正常组相比明显增加(P<0.01或P<0.05),NEUT在总细胞中的比率也明显升高(P<0.05);80 mg·kg-1阿魏酸干预后,血液中WBC和EOS数量明显降低(P<0.01或P<0.05),NEUT与EOS在总细胞中的比率明显下降(P<0.01或P<0.05)。结果见图1。
PM2.5滴注小鼠2周后,血液中炎症因子IL-1β和IL-6的表达量显著升高,且有明显的剂量依赖性,PM2.5高浓度组与正常组对比有极显著差异(P<0.01)。80 mg·kg-1阿魏酸处理后血清中IL-1β和IL-6的表达显著降低(P<0.05或P<0.01)。结果见表1。
表1 血清中IL-1β和IL-6的表达(n=10,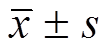 )
)
Tab. 1 The expression of IL-1β and IL-6 in serum(n=10,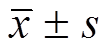 )
)
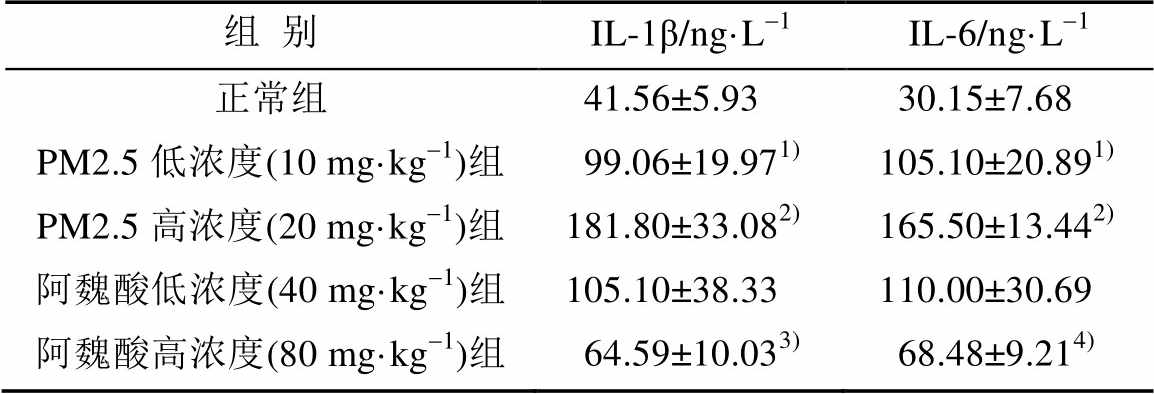
注:与正常组比较,1)P<0.05,2)P<0.01;与PM2.5高浓度组比较,3)P<0.05,4)P<0.01。
Note: Compared with control group,1)P<0.05,2)P<0.01; compared with the high dose PM2.5group,3)P<0.05,4)P<0.01.
PM2.5染毒小鼠2周后,主动脉组织中IL-1β和IL-6的mRNA水平随PM2.5浓度的升高明显升高,PM2.5高浓度组与正常组对比有极显著差异(P<0.01)。而在80 mg·kg-1阿魏酸干预后,IL-1β和IL-6 mRNA水平明显降低(P<0.01或P<0.05)。结果见图2。
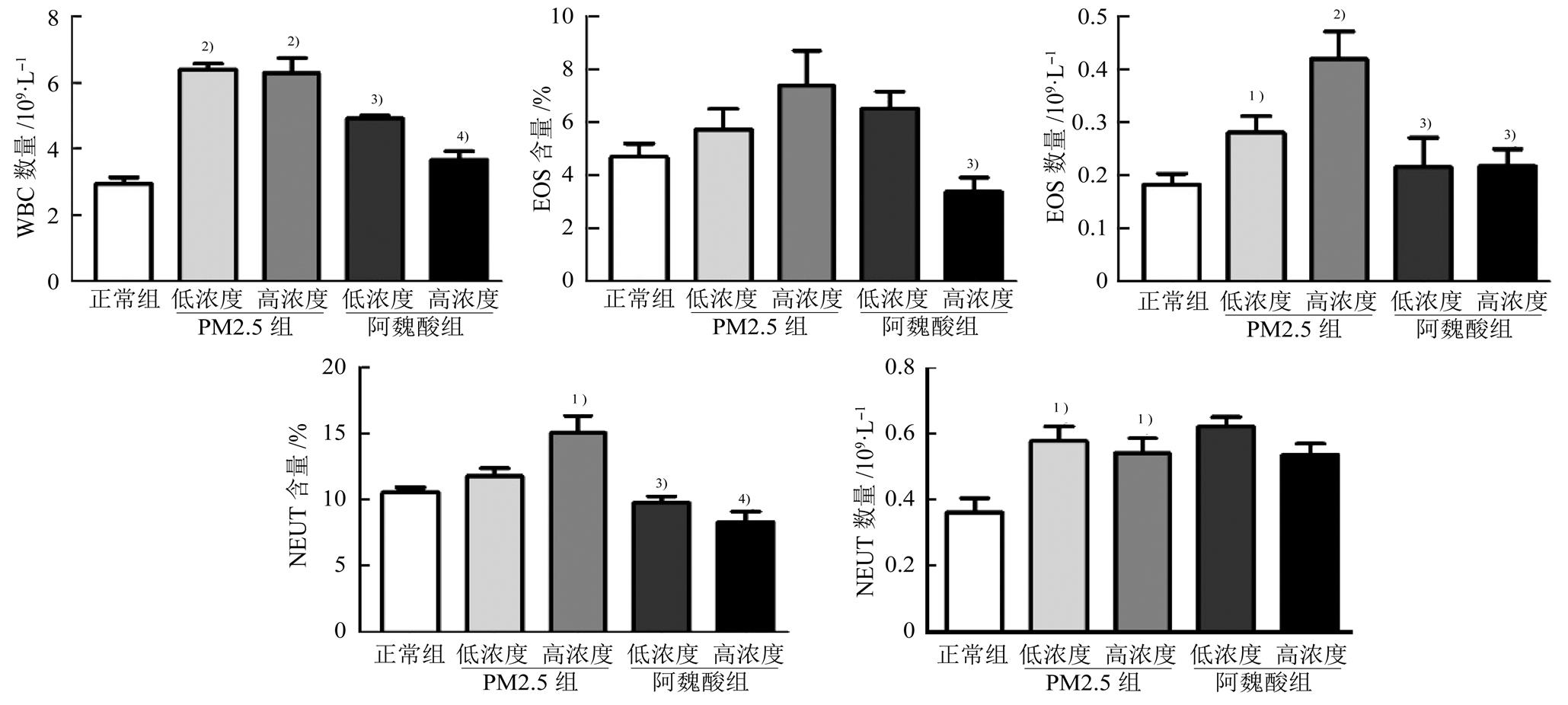
图1 阿魏酸对小鼠血液中炎症细胞的影响(n=10, )
)
与正常组比较,1)P<0.05,2)P<0.01;与PM2.5高浓度组比较,3)P<0.05,4)P<0.01。
Fig. 1 Effects of ferulic acid on inflammatory in mice blood(n=10, )
)
Compared with control group,1)P<0.05,2)P<0.01; compared with the high dose PM2.5group,3)P<0.05,4)P<0.01.
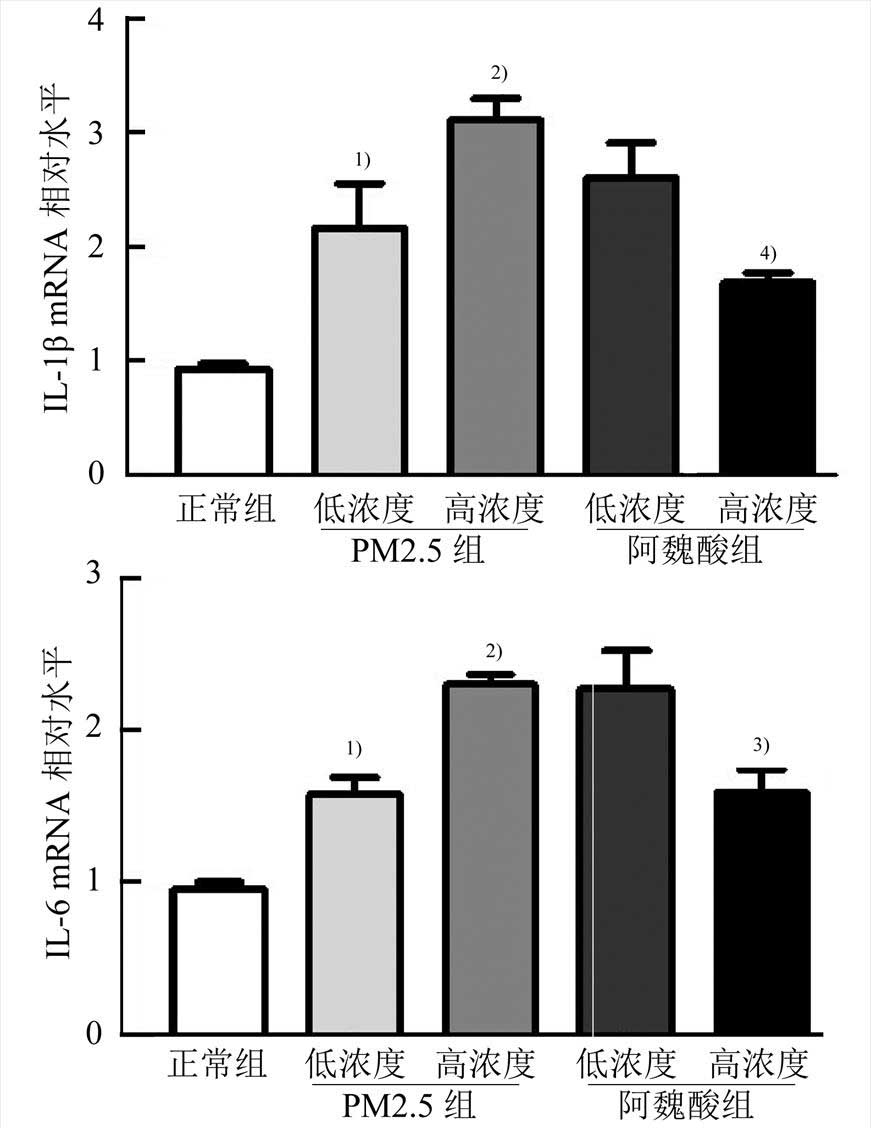
图2 主动脉组织中IL-1β、IL-6的mRNA表达量(n=10, )
)
与正常组比较,1)P<0.05,2)P<0.001;与PM2.5高浓度组比较,3)P<0.05,4)P<0.01。
Fig. 2 The mRNA expression of IL-1β and IL-6 in mice aorta(n=10, )
)
Compared with control group,1)P<0.05,2)P<0.001; compared with the high dose PM2.5group,3)P<0.05,4)P<0.01.
20 mg·kg-1的PM2.5染毒小鼠2周后,主动脉组织中TLRs信号通路相关蛋白(如TLR2、TLR4、MyD88以及NF-κB p65)的表达量明显上升(P<0.05或P<0.01)。而在80 mg·kg-1阿魏酸处理后,TLRs信号通路相关蛋白的表达显著降低(P<0.01)。结果见图3。
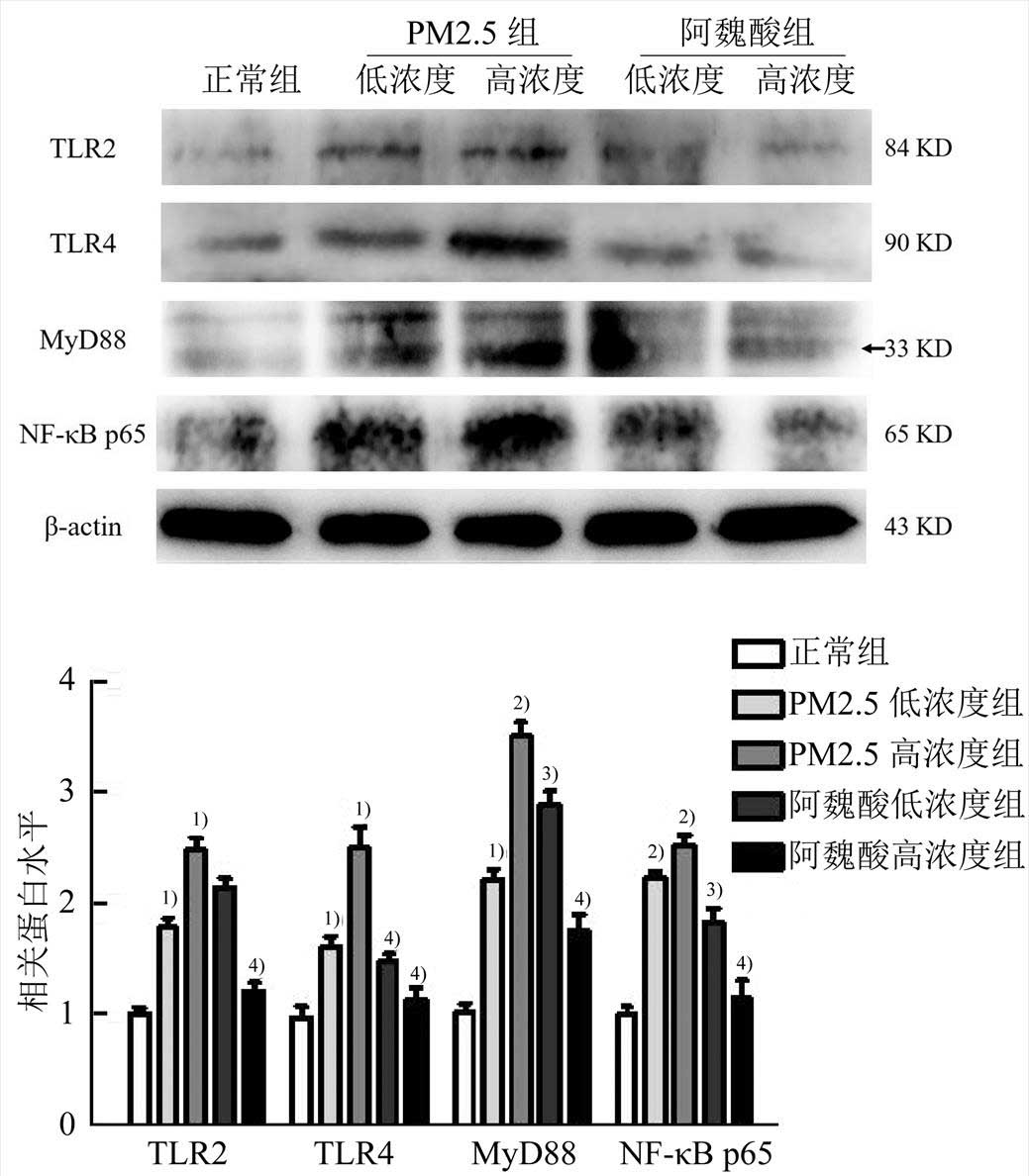
图3 主动脉组织中TLR2、TLR4、MyD88、NF-κB p65的蛋白表达量(n=3,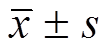 )
)
与正常组比较,1)P<0.05,2)P<0.01;与PM2.5高浓度组比较,3)P<0.05,4)P<0.01。
Fig. 3 The protein expression of TLR2, TLR4, MyD88 and NF-κB p65 in mice aorta(n=3,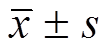 )
)
Compared with control group,1)P<0.05,2)P<0.001; compared with the high dose PM2.5 group,3)P<0.05,4)P<0.01.
TLR2和TLR4的免疫组化染色结果显示,在PM2.5高、低浓度组小鼠的主动脉中TLR2和TLR4的表达量都增加,在高浓度组中染色加深更为明显。而经阿魏酸灌胃处理后,主动脉中TLR2和TLR4的表达量都明显减少,这与Western blot的结果相一致。结果见图4。
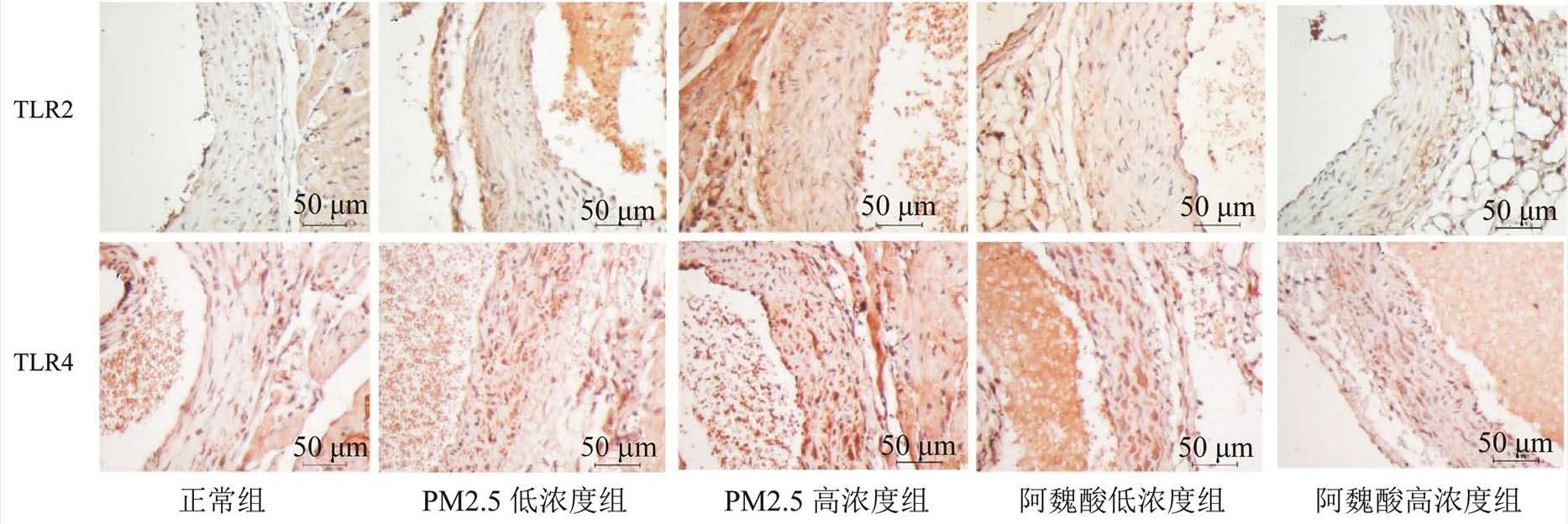
图4 主动脉组织中TLR2和TLR4的免疫组化染色(400×)
Fig. 4 Expression of TLR2 and TLR4 proteins in arota tissues was examined using immunohistochemical staining(400×)
空气中PM2.5的浓度与心血管系统疾病密切相关[10-12],其对心血管疾病的影响已成为一个严重的“公共卫生问题”。有研究显示,大气颗粒物污染可诱发青少年血栓症和纤维蛋白溶解[13-15],降低健康成人的血液凝固时间等[16]。人群暴露于PM2.5中之后,血液中IL-6、IL-1β、TNF-α等炎症因子的含量明显增加[17],这表明PM2.5能引发系统性的炎症反应,在本实验的结果中(图1和表1),暴露于PM2.5中之后,血液中炎症细胞、炎症因子的水平都明显上升,这同样表示PM2.5导致了小鼠循环系统的炎症。
血管内皮细胞在体内分布广泛,是介于血液与血管壁之间的屏障,能分泌多种生物活性物质,具有许多重要的生理功能,在调节血管张力,调控血管平滑肌生长,调节血管内皮细胞与炎症细胞的粘附,抑制血小板聚集等方面起着重要作用[18]。内皮细胞受到损伤后,单核细胞在内皮细胞活化时合成的黏附因子作用下,与内皮黏附后向内皮下间隙迁移,而单核细胞本身也被活化,促进泡沫细胞的形成及平滑肌细胞的增殖,进而加速心血管疾病的进程[19]。Rundell等人研究发现健康成年人在主交通干道附近锻炼30 min便可使内皮依赖性血管舒张功能受损,表明细颗粒物进入人体后可经肺泡进入血液循环系统,直接作用于血管内皮细胞[20]。
PM2.5作用于内皮细胞后,产生氧化应激及炎症反应,从而导致内皮的损伤,是PM2.5诱导心血管疾病的原因之一[21-22],因此血管内皮细胞自身的炎症在心血管疾病的进程中发挥着十分重要的作用。有研究显示,大气污染物暴露于血管内皮细胞后,会激活NF-κB途径,导致细胞中促炎因子的释放[23]。在本实验中,小鼠暴露于PM2.5中之后,炎症因子IL-1β和IL-6在主动脉组织中的mRNA表达量都明显升高(图2),这表明PM2.5不仅诱发了小鼠循环系统中炎症的产生,还导致血管内皮的局部炎症的产生。
TLRs是1型跨膜糖蛋白,主要由胞内区、跨膜区、胞外区三部分组成,细胞内信号区是与白介素受体1(IL-1)高度同源的TIR(Toll-like/IL-1 receptor)区域[24]。TLR受体一旦与配体结合,就会有胞内TIR区域的分子适配器包括MyD88、TIR区域衔接蛋白(TIR region adapter protein,TIRAP)等产生信号级联放大,激活NF-κB信号通路,导致包括IL-1β、IL-6和TNF-α在内的前体炎症因子编码基因的激活[25-26],从而产生炎症。TLR2和TLR4是Toll样受体家族中识别范围最广的成员,在炎症反应过程中扮演重要角色。有证据显示,TLR2和TLR4与心血管疾病密切相关[27-28],在动脉粥样硬化的内皮细胞中TLR1、TLR2和TLR4的表达量都明显升高[29],这表明TLR1、TLR2与TLR4在内皮细胞中的高表达可能是心血管疾病发生发展的关键点。从图3~4中可以看出,小鼠暴露于PM2.5中之后,血管组织中TLR2和TLR4的蛋白表达明显升高,作为TLR2和TLR4下游的MyD88与NF-κB p65的表达也显著上升,这说明PM2.5诱发血管炎症可能是通过激活TLRs信号通路产生的。
阿魏酸能清除自由基,促进清除自由基酶的产生,增加谷胱甘肽转硫酶和醌还原酶的活性,并抑制酪氨酸酶活性,调节人体生理机能[30]。同时,阿魏酸具有明显的抗炎作用,能在神经性炎症[31]、呼吸道炎症[32-33]等多种炎症中发挥抗炎作用。在肝损伤模型中,阿魏酸显著减轻了血清中炎症因子TNF-α、TFN-γ的水平,同时降低了NF-κB p65的表达,这可能是阿魏酸抵抗肝损伤的机制之一[34]。另外,在PM2.5诱导的大鼠肺损伤模型中,阿魏酸能有效抑制血清中MDA的表达、增加SOD的含量,同时降低PM2.5诱导的肺组织中IgE、IL-4、TNF-α等炎症因子以及TLR4的表达,这同样提示了阿魏酸的抗炎机制可能是抑制了Toll样受体以及NF-κB途径[8]。在本研究中,40,80 mg·kg-1的阿魏酸连续灌胃2周后,小鼠血液中炎症细胞以及血清中炎症因子的表达量均明显降低,这与之前的研究是相符的。另外,主动脉组织中的炎症因子IL-1β、IL-6的mRNA的表达也显著减少,这表明阿魏酸抑制了血管组织的局部炎症反应。而血管组织中TLRs通路相关蛋白TLR2、TLR4、MyD88及NF-κB p65的表达显著降低。这提示阿魏酸可能通过抑制TLRs信号通路而发挥减轻PM2.5诱导的血管炎症的作用。
综上所述,PM2.5不仅能引起小鼠循环系统中炎症的产生,还能诱发小鼠血管组织中炎症,其过程可能与激活TLRs信号通路相关,并且TLR2和TLR4均参与了这一过程。阿魏酸具有良好的抗炎效应,其作用机制可能是抑制了TLRs信号通路。这一结论有望为中医药预防和治疗PM2.5引发的心血管疾病提供一定的方向和研究方法。
REFERENCES
[1] McGuinn L A, Ward-Caviness C, Neas L M, et al. Fine particulate matter and cardiovascular disease: Comparison of assessment methods for long-term exposure [J]. Environ Res, 2017(159): 16-23.
[2] Kulick E R, Wellenius G A, Kaufman J D, et al. Long-term exposure to ambient air pollution and subclinical cerebrovascular disease in NOMAS (the northern manhattan study) [J]. Stroke, 2017, 48(7): 1966-1968.
[3] Goulopoulou S, McCarthy C G, Webb R C. Toll-like receptors in the vascular system: sensing the dangers within [J]. Pharmacol Rev, 2016, 68(1): 142-167.
[4] 胡益勇,徐晓玉.阿魏酸的化学和药理研究进展[J].中成药, 2006, 28(2): 253-255.
[5] Ojha S, Javed H, Azimullah S, et al. Neuroprotective potential of ferulic acid in the rotenone model of Parkinson's disease [J]. Drug Des Devel Ther, 2015(9): 5499-5510.
[6] QIAN X, ZHANG L, HUANG W F, et al. Determination of chlorogenic acid and ferulic acid in Gouqigen by HPLC[J]. Pharm Today(今日药学), 2016, 26(6): 415-417.
[7] Navarrete S, Alarcón M, Palomo I. Aqueous extract of tomato (Solanum lycopersicumL.) and ferulic acid reduce the expression of TNF-α and IL-1β in LPS-activated macrophages [J]. Molecules, 2015, 20(8): 15319-15329.
[8] ZHOU Y l, LAO W y, RUAN Y s, et al. Protective effect of ferulic acid on lung injury induced by PM2.5 in rats [J]. Food Sci(食品科学), 2017, 38(1): 244-251.
[9] Bai R, Zhang L, Liu Y, et al. Pulmonary responses to printer toner particles in mice after intratracheal instillation [J]. Toxicol Lett, 2010, 199(3): 288-300.
[10] Franklin B A, Brook R, Arden Pope C. Air pollution and cardiovascular disease [J]. Curr Probl Cardiol, 2015(40): 207-238.
[11] Liu S T, Liao C Y, Kuo C Y, et al. The effects of PM2.5 from asian dust storms on emergency room visits for cardiovascular and respiratory diseases [J]. Int J Environ Res Public Health, 2017, 14(4): E428.
[12] Apte J S, Marshall J D, Cohen A J, et al. Addressing global mortality from ambient PM2.5 [J]. Environ Sci Technol, 2015, 49(13): 8057-8066.
[13] Ghio A, Devlin R. Inflammatory lung injury after bronchial instillation of air pollution particles [J]. Am J Respir Crit Care Med, 2001, 164(4): 704-708.
[14] Ghio A, Hall A, Bassett M, et al. Exposure to concentrated ambient air particles alters hematologic indices in humans [J]. Inhal Toxicol, 2003, 15(14): 1465-1478.
[15] Graff D, Cascio W, Rappold A, et al. Exposure to concentrated coarse air pollution particles causes mild cardiopulmonary effects in healthy young adults [J]. Environ Health Perspect, 2009, 117(7): 1089-1094.
[16] Sangani R G, Soukup J M, Ghio A J. Metals in air pollution particles decrease whole-blood coagulation time [J]. Inhal Toxicol, 2010, 22(8): 621-626.
[17] Pope C A, Bhatnagar A, McCracken J P, et al. Exposure to fine particulate air pollution is associated with endothelial injury and systemic inflammation [J]. Circ Res, 2016, 119(11): 1204-1214.
[18] Gouill E L, Jimenez M, Binnert C, et al. Endothelial nitric oxide synthase(eNOS) knockout mice have defective mitochondrial beta-oxidation [J]. Diabetes, 2007, 56(11): 2690-2696.
[19] 李磊, 戴敏. 动脉粥样硬化血管内皮分泌功能失调与平滑肌细胞增殖[J]. 中国药理学通报, 2010, 26(2): 155-158.
[20] Rundell K W, Hoffman J R, Caviston R, et al. Inhalation of ultrafine and fine particulate matter disrupts systemic vascular function [J]. Inhal Toxicl, 2007, 19(2): 133-l40.
[21] Pope C A, Bhatnagar A, McCracken J P, et al. Exposure to fine particulate air pollution is associated with endothelial injury and systemic inflammation [J]. Circ Res, 2016, 119(11): 1204-1214.
[22] Montiel-Dávalos A, Ibarra-Sánchez M J,Ventura-Gallegos J L, et al. Oxidative stress and apoptosis are induced in human endothelial cells exposed to urban particulate matter [J]. ToxicolIn Vitro, 2010, 24(1): 135-141.
[23] Li R, Ning Z, Majumdar R, Cui J, et al. Ultrafine particles from diesel vehicle emissions at different driving cycles induce differential vascular pro-inflammatory responses: Implication of chemical components and NF-κB signaling [J]. Part Fibre Toxicol, 2010, 7(1): 6-18.
[24] Cole J E, Georgiou E, Monaco C. The expression and functions of toll-like receptors in atherosclerosis [J]. Mediators Inflamm, 2010(2010): 393946. doi: 10.1155/2010/393946.
[25] Ghosh S, Dass J F. Study of pathway cross-talk interactions with NF-κB leading to its activation via ubiquitination or phosphorylation: A brief review [J]. Gene, 2016, 584(1): 97-109.
[26] Noreen M, Arshad M. Association of TLR1, TLR2, TLR4, TLR6, and TIRAP polymorphisms with disease susceptibility [J]. Immunol Res, 2015, 62(2): 234-252.
[27] Roshan M H, Tambo A, Pace N P. The role of TLR2, TLR4, and TLR9 in the pathogenesis of atherosclerosis [J]. Int J Inflam, 2016, 2016: 1532832. Doi: 10.1155/2016/1532832
[28] Chukkapalli S S, Velsko I M, Rivera-Kweh M F, et al. Global TLR2 and 4 deficiency in mice impacts bone resorption, inflammatory markers and atherosclerosis to polymicrobial infection [J]. Mol Oral Microbiol, 2017, 32(3): 211-225.
[29] Edfeldt K, Swedenborg J, Hansson G K, et al. Expression of toll-like receptors in human atherosclerotic lesions: a possible pathway for plaque activation [J]. Circulation, 2002, 105(10): 1158-1161.
[30] Ogiwara T, Satoh K, Kadoma Y, et al. Radical scavenging activity and cytotoxicity of ferulic acid [J]. Anticancer Res, 2002, 22(5): 2711-2717.
[31] Liu Y M, Shen J D, Xu L P, et al. Ferulic acid inhibits neuro-inflammation in mice exposed to chronic unpredictable mild stress [J]. Int Immunopharmacol, 2017(45): 128-134.
[32] Yuan X, Wang Y, Du D, et al. The effects of the combination of sodium ferulate and oxymatrine on lipopolysaccharide-induced acute lung injury in mice [J]. Inflammation, 2012, 35(3): 1161-1168.
[33] Lee C C, Wang C C, Huang H M, et al. Ferulic acid induces Th1 responses by modulating the function of dendritic cells and ameliorates Th2-mediated allergic airway inflammation in mice [J]. Evid Based Complement Alternat Med, 2015(2015): 678487.
[34] Niu C w, Sheng Y c, Zhu E y, et al. Ferulic acid prevents liver injury induced by Diosbulbin B and its mechanism [J]. Bio Sci Trends, 2016, 10(5): 386-391.
(本文责编:蔡珊珊)
Ferulic Acid Inhibits Aortic Inflammation Induced by PM2.5Through Regulating TLRs Signaling Pathway in Mice
HU Xiao1, REN Guangyan1, TANG Lihua1, HAO Zhengliang1, ZONG Lei1, ZHU Ji2, WANG Cui1, LU Dehzao1*
(1.College of Life Science, Zhejiang Chinese Medical University, Hangzhou 310053, China; 2.The Third Affiliated Hospital of Zhejiang Chinese Medical University, Hangzhou 310005, China)
ABSTRACT: OBJECTIVETo investigate the effect of Toll-like receptors (TLRs) signaling pathway on PM2.5-induced inflammation in mice aorta and the intervention of ferulic acid.METHODSMice were treated with 10, 20 mg·kg-1PM2.5 respectively by onsurgical intratracheal instillation. Additionally, mice were concurrently treated with 40, 80 mg·kg-1ferulic acid at the high dose group (20 mg·kg-1PM2.5) for 2 weeks. The categories of inflammatory cells and inflammatory factors in serum were detected by hemathology analyzer. Isolated aortic tissue was isolated and the mRNA expression of IL-1β and IL-6 were determined by RT-PCR. The protein level of TLR2, TLR4, MyD88 and NF-κB p65 were detected by Western blot. The expression of TLR2 and TLR4 in mice aorta was also evaluated by immunohistochemistry.RESULTSThe content and the ratio of NEUT and EOS were increased by PM2.5. The mRNA levels of IL-1band IL-6 were overexpressed in both blood and aortic tissue. Meanwhile, TLRs signaling pathway-related protein such as TLR2, TLR4, MyD88, and NF-kB p65 were also increased in aortic tissue. After the intervention of ferulic acid, the numbers of NEUT, EOS, and the ratio of NEUT and EOS, as well as the level of inflammation factors including IL-6 and IL-1bwere reduced. Moreover, the inhibition TLRs pathway in aortic tissue were also significantly reduced.CONCLUSIONPM2.5 can induce the production of aortic inflammation in mice through TLRs signaling pathway. Moreover, ferulic acid can protect mice from PM2.5-induced aortic inflammation by inhibition TLRs pathway.
KEY WORDS:ferulic acid; Toll-like receptors; PM2.5; inflammatory
中图分类号:R285.5
文献标志码:A
文章编号:1007-7693(2018)05-0642-06
DOI:10.13748/j.cnki.issn1007-7693.2018.05.005
收稿日期:2017-09-17
引用本文:胡潇, 任广岩, 唐利华, 等. 阿魏酸对大气细颗粒物PM2.5诱导的小鼠主动脉炎症的干预作用[J]. 中国现代应用药学, 2018, 35(5): 642-647.
基金项目:浙江省医药卫生科技计划项目(2016KYB224);浙江中医药大学校级科研基金项目(2015ZG17)
作者简介:胡潇,男,硕士生 Tel: (0571)8661313626 E-mail: huxiao_5016@163.com
*通信作者:卢德赵,男,博士,副教授 Tel: (0571)8661313626 E-mail: ludezhao@126.com