表1 四倍体黄芩和二倍体黄芩ISSR分析试验材料信息
Tab. 1 Test material information of tetraploid and diploidScutellaria baicalensis

柴俊雯1,刘玉1,陈红刚1,朱田田1,杜弢1,2,3*
(1.甘肃中医药大学药学院,兰州 730000;2.甘肃省中药质量与标准研究重点实验室,兰州 730000;3.甘肃中医药大学药用植物遗传育种研究所,兰州 730000)
摘要:目的分析研究四倍体黄芩新品系D20和二倍体黄芩之间的遗传差异。方法采用ISSR分子标记技术对四倍体黄芩及二倍体黄芩之间的遗传差异进行研究。结果从100条引物中筛选得到9条ISSR引物用于正式扩增,多态性百分率为84.2%;遗传距离的变异范围是0.086 9 ~ 0.242 9,聚类分析结果将黄芩样本分为两大类,二倍体聚为一类,四倍体聚为另一类。结论四倍体黄芩新品系D20和二倍体黄芩存在明显的遗传差异,ISSR分子标记能有效的揭示材料间的多态性。
关键词:黄芩;二倍体;四倍体;遗传差异;ISSR
黄芩(Scutellaria baicalensisGeorgi)为唇形科植物,其药用部位为干燥根,具有清热燥湿,止血安胎等功效,用于肺热咳嗽、胎动不安等症[1]。黄芩药材主产于我国华北地区,甘肃亦为产区之一[2]。近年来市场上野生黄芩资源匮乏,栽培品质量下降严重,逐渐难以满足临床需求,因此,选育黄芩新品种尤为迫切[3]。中国药科大学高山林教授等采用组织培养的手段成功育出了高产优质的四倍体黄芩新品系D20[4]。其四倍体虽然来源于二倍体,但植株的外部形态及内在品质均有一定差异。
ISSR标记技术已被广泛应用于品种鉴定、多样性分析、指纹图谱的构建等研究中。有学者利用ISSR分子标记技术对果树刺梨及药用植物菘蓝、白术等植物的遗传差异性进行了研究,结果表明其同源四倍体与二倍体之间存在较大的遗传差异[5-7]。目前,对于四倍体黄芩新品系D20和普通二倍体黄芩之间的遗传差异的研究未见报道。本研究采用ISSR分子标记技术,从DNA分子水平分析黄芩二倍体及其同源四倍体遗传结构差异,为探讨黄芩多倍体诱变规律、基因表达调控以及遗传改良提供理论依据。
提取DNA的新鲜叶片采自甘肃中医药大学和政药用植物园黄芩资源圃,由杜弢教授鉴定为唇形科药用植物黄芩(Scutellaria baicalensisGeorgi)。二倍体3个不同小区,四倍体3个不同小区,每个小区10份,30份四倍体黄芩和30份二倍体黄芩,共60份黄芩样本。采集无病虫害新鲜嫩叶,洗净、晾干,置于干燥硅胶中带回实验室,-20 ℃冰箱保存备用,具体编号见表1。
PCR扩增仪(德国Biometra Technologies Sure cycler 8800);凝胶成像系统(美国Bio-Rad);DYY-10型电泳仪(北京市六一仪器厂);电泳槽(北京六一仪器厂);TGL16M型台式高速冷冻离心机(湖南凯达科学仪器有限公司);ZXLD-50KBS型立体压力蒸汽灭菌器(上海精科实业有限公司);WFH-201B紫外透射反射仪(上海精科实业有限公司);水浴锅(江苏环保仪器厂);精密电子天平(上海梅特勒托利多仪器有限公司)。
CTAB、EDTA、Tris、PVP、β-巯基乙醇均来自西安科昊生物工程有限责任公司;RNaseA、A-garose琼脂糖、Gold View核酸染料、TaqDNA聚合酶均来自北京鼎国昌盛生物技术有限责任公司;TBE缓冲液、dNTPs、10×PCR buffer,超纯水均来自西安科昊生物工程有限责任公司;植物基因组DNA提取试剂盒(批号:B409DA0002,上海生工生物工程有限公司);ISSR引物根据British Columbia大学公布的序列设计,由上海生工生物工程有限公司合成;其他化学试剂均为国产分析纯。
取植物新鲜叶片30 mg,加石英砂和少量的PVP充分研磨,采用上海生工生物工程有限公司植物DNA提取试剂盒方法提取样本DNA。提取的DNA于0.8%琼脂糖凝胶电泳检测DNA的完整性,将条带明亮、整齐、无降解的样本适当稀释后保存于-20 ℃冰箱中备用。
首先用10个DNA样品对100个ISSR引物进行筛选,最终选出34个扩增条带清晰的引物用于分析。总反应体系(20 μL)如下,10×PCR Buffer 2.6 μL,Mg2+1.5 mmol·L-1,Taq DNA聚合酶0.4 U,引物1.5 μmol·L-1,dNTPs 0.9 mmol·L-1及DNA模板0.8 μL。
扩增程序:94 ℃预变性4 min,94 ℃变性45 s,(根据不同引物的退火温度)复性45 s,72 ℃延伸2 min,40个循环,72 ℃延伸7 min,4 ℃保存结束反应。
用筛选出的9条ISSR随机引物按其最佳退火温度对60个不同样本基因组DNA逐条进行PCR扩增。反应结束后用1.2%琼脂糖凝胶电泳检测,电泳缓冲液为5×TBE,100 V电压下电泳90 min左右,EB(10 mg·mL-1)染色20 min,在凝胶成像系统下检测并拍照保存。
ISSR数据分析将ISSR扩增产物每个条带视为一个位点,清晰、重复性好、分辨率高的条带用于分析,按条带有或无分别赋值,有带记为“1”,无带记为“0”。按Nei等的方法[8],利用系统分析软件Popgene 32(PHYLIP 3.5版本)计算黄芩材料间的遗传相似系数和遗传距离,按类平均数聚类法(UPGMA)进行聚类,得到UPGMA系统树。
表1 四倍体黄芩和二倍体黄芩ISSR分析试验材料信息
Tab. 1 Test material information of tetraploid and diploidScutellaria baicalensis

在100条ISSR引物中共筛选出条带清晰、重复性好、阴性对照无带的9个随机引物作为正式扩增引物,这9个引物的碱基序列见表2。对30份黄芩二倍体及30份四倍体株系引物进行扩增,大部分扩增片段大小在200~2 000 bp。根据Popgen软件统计结果(表3),所有材料共获得70个扩增位点,其中多态性位点59个;每个引物扩增位点为5~10个,平均7.78个,其中多态性位点5~9个,平均6.55个,多态性比率为84.2%。这说明二倍体黄芩及其同源四倍体间存在较高的遗传差异,且ISSR标记能有效的揭示植物二倍体黄芩及四倍体黄芩间的多态性。
表2 ISSR引物和最佳退火温度
Tab. 2 ISSR primers and optimum annealing temperature

表3 ISSR扩增引物和多态性
Tab. 3 ISSR amplification, primers and polymorphism
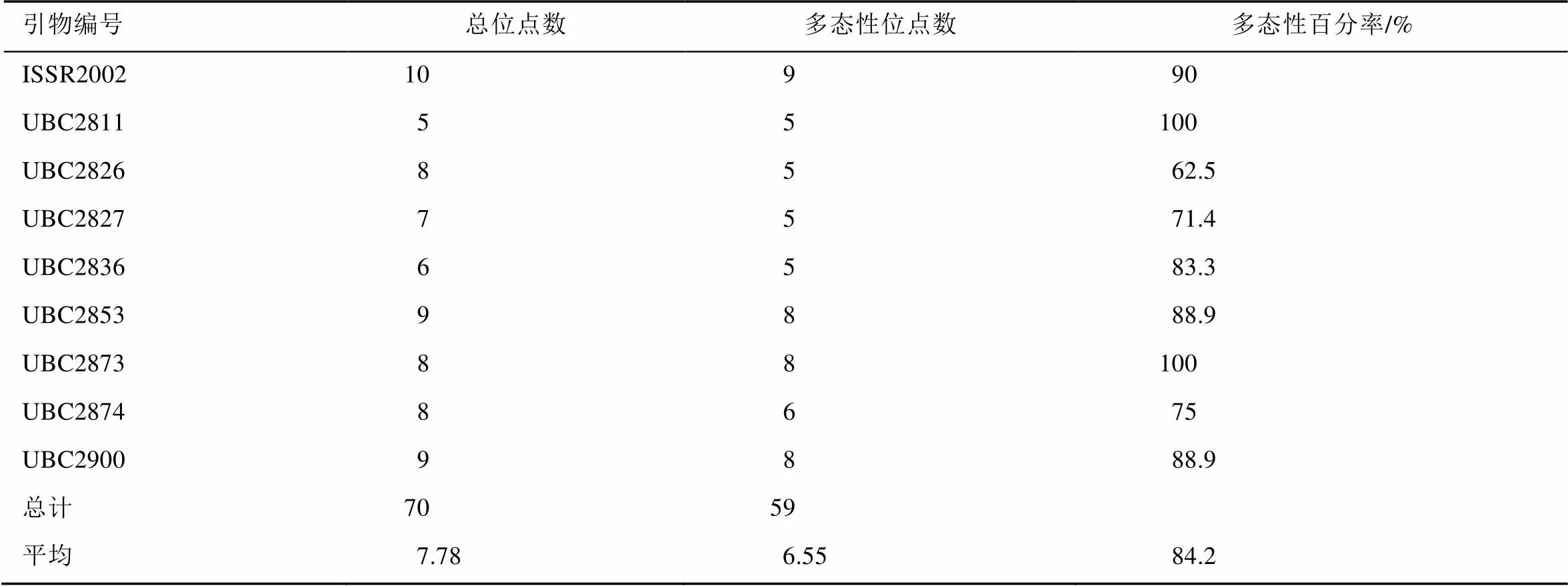
不同的引物得到各自不同的基因组DNA条带,部分引物的ISSR扩增结果见图1。由图1可知,每个引物扩增结果中二倍体和四倍体都有共同的条带,且条带清晰,高低趋势基本一致。部分扩增结果(图1b~e)显示二倍体黄芩与四倍体黄芩株系的DNA条带差异较大,总体来看,二倍体株系的条带普遍多于四倍体,如UBC2900引物扩增结果;也有部分引物扩增结果四倍体株系的条带多于二倍体(图1d~e)。有的引物扩增结果显示二、四倍体间条带数目差异不大,但是存在多态性,如引物UBC2874引物扩增和UBC2826引物扩增结果。
另外,据DNA条带图显示,不同四倍体株系间普遍存在着差异,有的差异比较大,如UBC2874引物(图1e)。不同二倍体株系间也存在着差异,如UBC2826、UBC2827扩增结果(图1g~h)。
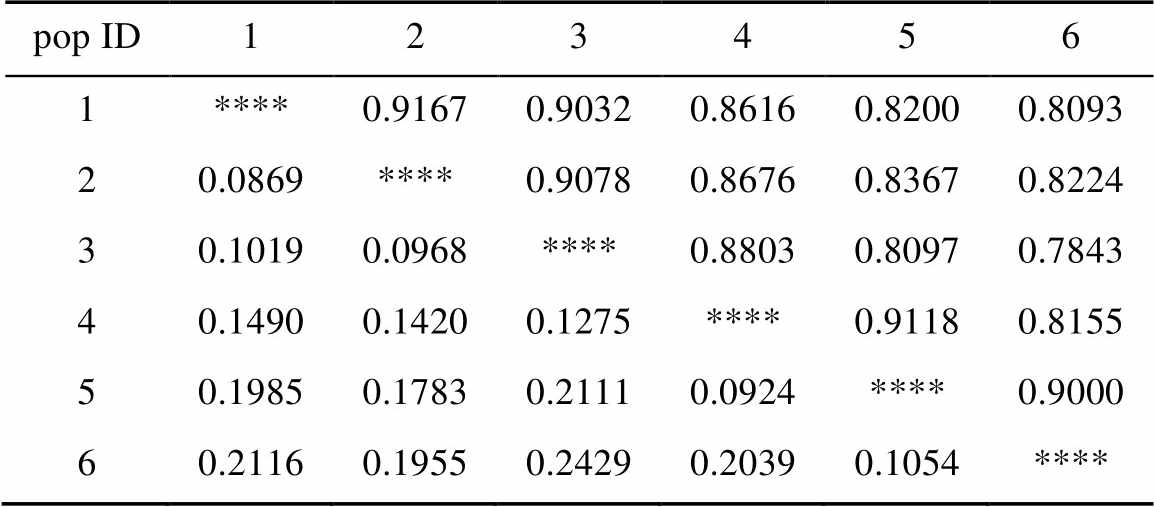
Popgen软件统计结果表明,6个不同小区(二倍体:S1、S2、S3;四倍体:S4、S5、S6)中黄芩间遗传距离的变异范围是0.086 9~0.242 9(表4~5),其中二倍体第三个小区和四倍体第三个小区之间的遗传距离最大,为0.242 9,表明两者之间的亲缘关系最远。二倍体第一个小区和二倍体第二个小区之间的遗传距离最近,为0.086 9,说明二者之间亲缘关系最近。二倍体和四倍体黄芩材料间的遗传距离及相似系数结果见表4。
表4 材料间的遗传相似系数(上)和遗传距离(下)
Tab. 4 Genetic similarity coefficients (upper) and genetic distances between the materials (below)
为了进一步表明各小区间的亲缘关系,利用NTSYS软件构建各小区Nei’s遗传距离UPGMA聚类图,通过聚类图可直接反映6个不同小区中黄芩亲缘关系,结果见图2。聚类图结果表明,在遗传距离0.83处,二倍体3个小区聚为一类,四倍体3个小区聚为另一类;在遗传距离0.855处四倍体第一小区和四倍体第二小区聚在一起,四倍体第三小区聚为一类;在遗传距离0.91处,二倍体第一小区和二倍体第二小区聚在一起,二倍体第三小区归为另一类。

图1 不同引物对二倍体黄芩及四倍体黄芩的ISSR扩增结果
a-ISSR2002;b,c-UBC2900;d~f-UBC2874;g-UBC2826;h-UBC2827;1~30-二倍体黄芩样品;31~60-四倍体黄芩样品;M-marker。
Fig. 1 ISSR amplification of diploid and tetraploid Scutellaria baicalensis Georgi by different primers
a-ISSR2002; b, c-UBC2900; d-f-UBC2874; g-UBC2826; h-UBC2827; 1-30-diploidScutellaria baicalensisGeorgi; 31-60-tetraploid Scutellaria baicalensis Georgi.
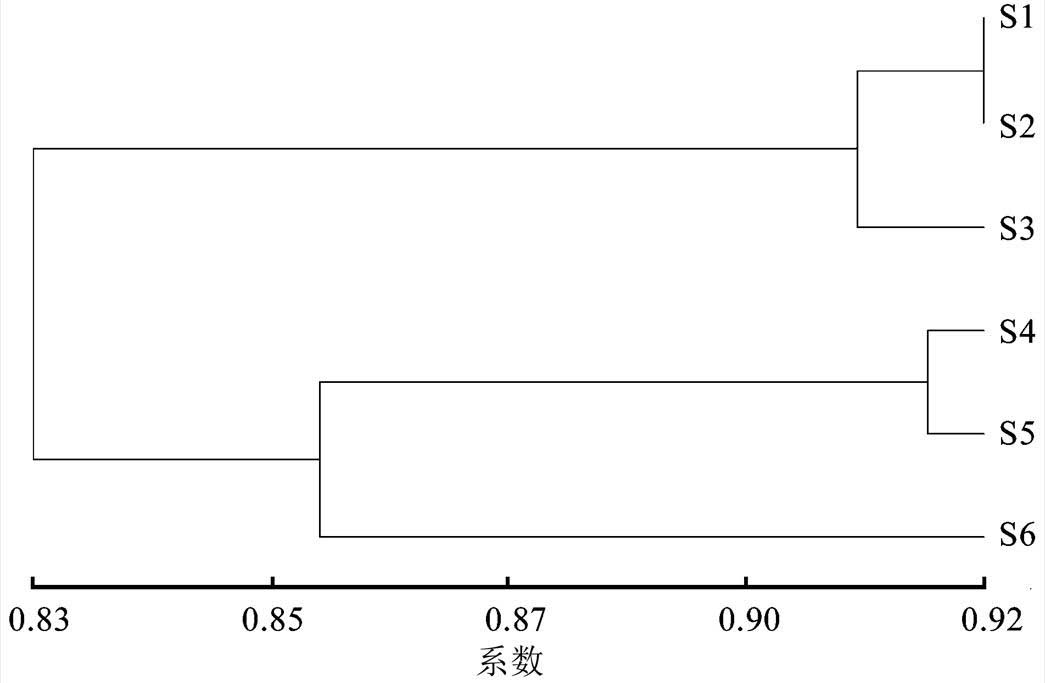
图2 基于ISSR标记的6个居群聚类分析
S1、S2、S3-二倍体第1、2、3小区;S4、S5、S6-四倍体第1、2、3小区。
Fig. 2 Cluster analysis of 6 populations based on ISSR markers
S1, S2, S3-Diploid 1, 2, 3 area; S4, S5, S6-Tetraploid 1, 2, 3 area.
四倍体黄芩及二倍体黄芩的ISSR多态性分析表明,尽管多个引物扩增结果显示四倍体与二倍体都有共同的条带,但总体多态性百分率达84.2%,说明两者之间具有较大的遗传差异性。推测可能是由于染色体诱变加倍时,秋水仙碱的浓度、作用时间与部位,以及外部环境条件的差异,转座子活化,甲基化模式的改变[9],造成四倍体在遗传结构上也发生多方向变异。另外部分结果显示四倍体株系的条带多于二倍体(图1d~e UBC2874874引物),也有部分结果显示四倍体株系扩增条带少于或弱于二倍体,如引物UBC2900扩增结果。推测可能是由于二倍体在加倍到四倍体的过程中,某些染色体位点发生基因位点的重复、突变、缺失等;聚类结果显示,ISSR分子标记能将黄芩二倍体与四倍体分开,为品系的鉴定提供一定依据。
黄芩以根入药,因此根部农艺性状和根部有效成分的含量成为衡量多倍体优良品种的重要标准。前期研究表明[10-11],四倍体黄芩新品系D20由于染色体的加倍,在农艺性状上显示出多倍体植株所特有的巨大性特征,且其植株生活力增强,在产量及有效成分含量等方面均优于二倍体,有望进一步开发利用。
本研究利用ISSR标记技术,初步揭示了黄芩四倍体及二倍体的遗传差异,未来可利用分子育种技术并结合四倍体黄芩新品系D20的优势进一步阐明四倍体黄芩D20的生理生化及遗传基础,为四倍体黄芩新品系D20大田栽培提供理论依据。但四倍体黄芩是否可以完全代替二倍体黄芩入药,还有待于进一步药理、毒理和临床实验的深入研究。
REFERENCES
[1] 中国药典. 一部[S]. 2015: 344-345.
[2] WEN M M, LI G S, ZHANG L J, et al. Analysis and evaluation on genetic diversity ofScutellaria baicalensisG. by ISSR markers [J]. Bull Bot Res(植物研究), 2012, 32(01): 32-37.
[3] CHEN H G, ZHANG Y H, WANG H Z, et al. Tissue culture and rapid propagation ofScutellaria baicalensisGeorgi D20 [J]. J Shanxi Agric Sci(山西农业科学), 2012, 40(1): 11-12.
[4] CHEN B J, GAO S L, BIAN Y Y, et al. The inducing of autotetraploid ofScutellaria baicalensisGeorgi by tissue culture [J]. J Plant Resources Envir(植物资源与环境学报), 2000, 9(1): 10-12.
[5] WANG X P, YONG H J, DU J C, et al. Tetraploid induction and issr analysis inRosaroxburghiiTratt [J]. Northern Horticulture(北方园艺), 2010, (17): 158-160.
[6] DUAN Y Z. Analysis of genetic variation between diploids and their homologous tetraploids ofLsatis indigoticafort. by ISSR [J]. Acta Bot Boreali-Occidentalia Sin(西北植物学报), 2012, 32(8): 1534-1538.
[7] WANG H J, HAN P P, LI Y T, et al. MSAP and ISSR analysis of diploid and autotetraploid ofAtractylodes macrocephala[J]. J Nanjing Agricult Univ(南京农业大学学报), 2016, 39(02): 220-227.
[8] Nei M, Li W H. Mathematical model for studying genetic variation in term of restriction endonuclease [J]. Proc Natl Acad Sci USA, 1979, 76(10): 5269-5273.
[9] LIU Y, DU T, CHAI J W, et al. Comparative study on shapes, properties and microscopic characteristics between diploid Radix Scutellariae and tetraploid Radix Scutellariae D20 [J]. J Gansu Univ Chin Med(甘肃中医药大学学报), 2017, 34(2): 65-69.
[10] LIU Y, CHAI J W, ZHANG Y Y, et al. Comparative study on chemical constituents between tetraploid and diploidScutellaria baicalensis[J]. J Chin Med Mater(中药材), 2017, 40(2): 284-289.
[11] 于辉, 高赛男, 任亚超, 等. HPLC法测定四倍体黄芩中黄芩苷和汉黄芩苷的含量[J]. 现代中药研究与实践, 2013, 27(1): 15-16.
(本文责编:蔡珊珊)
Analysis of Genetic Diversity Between Tetraploid and DiploidScutellaria Baicalensisby ISSR Markers
Chai Junwen1, Liu Yu1, Chen Honggang1, Zhu Tiantian1, Du Tao1,2,3*
(1.College of Pharmacy, Gansu University of Chinese Medicine, Lanzhou 730000, China; 2.Key Laboratory of Traditional Chinese Medicine Quality and Standard in Gansu Province, Lanzhou 730000, China; 3.Institute of Medicinal Plant Genetics and Breeding, Gansu University of Chinese Medicine, Lanzhou 730000, China)
ABSTRACT: OBJECTIVETo study the genetic variation between tetraploid and diploidScutellaria baicalensis.METHODSISSR molecular markers were used to study the genetic differences between tetraploid and diploid ofScutellaria baicalensis.RESULTSISSR primers were screened from 100 primers for formal amplification, the percentage of polymorphism reached 84.2%. The variation range of genetic distance was 0.086 9-0.242 9. The UPGMA clustering tree divided the samples into two major groups. The diploid groups were clustered into one category, and the tetraploid were clustered into another.CONCLUSIONthere are genetic differences between tetraploid and diploidScutellaria baicalensisGeorgi, and ISSR molecular markers can effectively reveal the polymorphism among materials.
KEY WORDS: Scutellaria baicalensisGeorgi; diploid; tetraploid; genetic diversity; ISSR
中图分类号:R282
文献标志码:A
文章编号:1007-7693(2018)05-0665-05
DOI:10.13748/j.cnki.issn1007-7693.2018.05.010
引用本文:柴俊雯, 刘玉, 陈红刚, 等. 四倍体黄芩及二倍体黄芩遗传差异的ISSR分析[J]. 中国现代应用药学, 2018, 35(5): 665-669.
收稿日期:2017-07-10
基金项目:甘肃省中药产业科技攻关项目(GYC12-05);国家基本药物所需中药原料资源调查和监测项目(国中医药办规财发[2013]41)
作者简介:柴俊雯,女,硕士生 Tel: 18298387332 E-mail: 1172546955@qq.com
*通信作者:杜弢,男,硕士,教授 Tel: (0931)8765393 E-mail: gslzdt@163.com