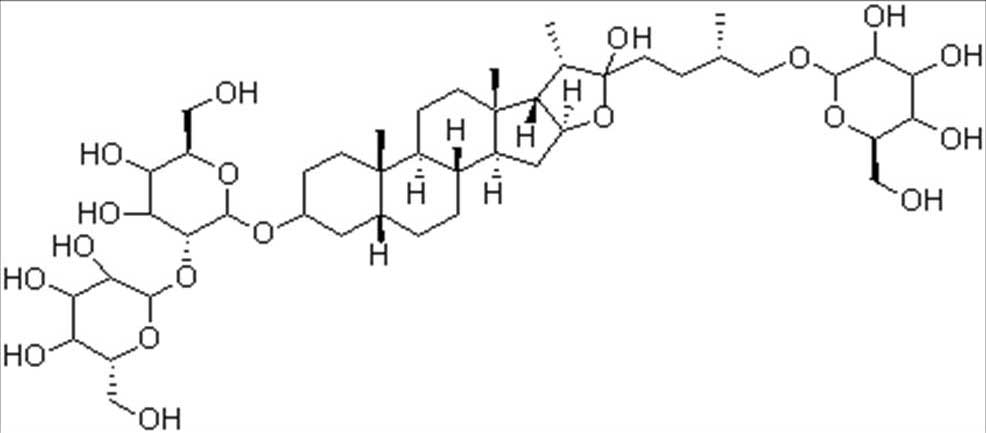
图1 知母皂苷BⅡ结构图
Fig. 1 Structure of timosaponin BⅡ
刘艳平1,余自成2
(1.上海市浦东新区人民医院,上海 201200;2.同济大学附属杨浦医院,上海 200090)
摘要:目的考察知母皂苷BⅡ在不同生理pH介质和生物样品中的体外稳定性。方法取知母皂苷BⅡ分别在不同生理pH介质(pH 1.2,6.8,7.4,8.0)的缓冲液、人工胃液、无蛋白酶人工胃液、人工肠液、无蛋白酶人工肠液介质和离体生物介质中进行孵育,利用HPLC测定不同介质中知母皂苷BⅡ的含量变化,考察知母皂苷BⅡ的降解情况及酶稳定性。结果知母皂苷BⅡ在不同生理pH介质溶液中9 h内未发生明显降解,在离体大鼠大肠和小肠及其内容物中发生明显降解。结论知母皂苷BⅡ在模拟人体胃肠道环境的溶液中很稳定,不会发生明显降解,在大鼠大肠及其内容物和小肠及其内容物中发生明显降解,不受胃蛋白酶和胰蛋白酶的影响,受肠道菌群作用的影响。
关键词:知母皂苷BⅡ;人工胃肠液;生物样品;pH液
知母是百合科植物知母(Anemarrhena asphodeloidesBge.)的干燥根茎,味苦,性寒,归肺、胃、肾经,具有清热泻火、止渴除烦、滋阴润燥等功效,临床用于外感热病、高热烦渴、骨蒸潮热、肺热燥咳、内热消渴、肠燥便秘等症状[1]。知母皂苷BⅡ(timosaponin BⅡ,TBⅡ,结构见图1)是知母中的主要活性成分。TBⅡ具有改善学习记忆、抗老年痴呆、抗抑郁、抗炎、抗肿瘤、降糖等多方面的药理活性,中国药典规定,知母中TBⅡ不得少于3.0%[2]。
目前,对TBⅡ药理方面的研究比较多,而对其在胃肠道内的稳定性还鲜有报道。本实验通过考察TBⅡ在不同pH体液环境,模拟在人工胃液、人工胃液NE(无胃蛋白酶)、人工肠液、人工肠液NE(无胰蛋白酶)、pH 1.2,6.8,7.4,8.0及大鼠离体胃、小肠、大肠及肝脏组织匀浆中的代谢降解情况,阐明其影响体内稳定性的因素,为TBⅡ体内处置过程提供一定研究基础,对其剂型选择和生物利用度改善有重要意义,并为进一步阐明知母的体内药效物质提供参考。

图1 知母皂苷BⅡ结构图
Fig. 1 Structure of timosaponin BⅡ
Agilent 1100高效液相色谱仪(美国Agilent公司);Alltech 3300蒸发光散射检测器(美国Grace); MS204S电子分析天平(北京梅特勒仪器系统有限公司);DK-S22电热恒温水浴锅(上海精宏实验设备有限公司)。
TBⅡ对照品(上海源叶生物有限公司,批号:B21657,纯度≥98%);磷酸二氢钾(批号:20170330)、磷酸氢二钾(批号:20170522)和氢氧化钠(批号:20170412)均购自国药试剂有限公司;乙腈(美国Fisher公司);其他均为分析纯。
健康SD大鼠,♂,SPF级,体质量200~220 g,上海市杨浦区中心医院转化医学中心提供,实验动物合格证号:SCXK(沪)2012- 0016。
色谱柱为AlltimaTM C18色谱柱(4.6 mm× 250 mm,5 μm);流动相:乙腈-水(25∶75);流速:1 mL·min-1;检测器:蒸发光散射检测器,温度为60 ℃,雾化气体流速为1.5 L·min-1;柱温:25 ℃;进样量:20 μL。
精密称取对照品适量,用30%丙酮溶解,配成0.58 mg·mL-1和0.058 mg·mL-1的溶液。
精密称取对照品适量,用30%丙酮溶解,逐级稀释,配置浓度为58,116,232,464,928,1 160 μg·mL-1的对照品溶液,分别注入液相色谱仪,进样量为20 μL,每个浓度进样2次,以TBⅡ峰面积平均值的常用对数为纵坐标,对照品浓度的常用对数为横坐标绘制标准曲线,计算回归方程得y=1.479 4x-1.168 3,r2=0.999 1。表明TBⅡ在58~1 160 μg·mL-1内其浓度的常用对数与峰面积的常用对数呈良好的线性关系。
吸取人工胃液混合对照品溶液、人工肠液混合对照品溶液、空白人工胃液、空白人工肠液、空白人工肠液NE、空白人工胃液NE、空白pH 6.8溶液、空白pH 7.4溶液、空白pH 8.0溶液、空白肝液、空白胃液、空白大肠及其内容物、空白小肠及其内容物各2 mL微孔滤膜(0.45 μm)滤过。再分别吸取TBⅡ对照品溶液各20 μL,注入液相色谱仪,结果空白人工胃、肠液没有相应峰,说明人工胃、肠液没有干扰。见图2。
精密吸取同一对照品溶液连续进样6次,计算峰面积RSD值为1.94 %,说明仪器精密度良好。
精密称取TBII 适量,置于10 mL 量瓶中,加30%丙酮超声溶解并定容至刻度,摇匀,得0.42 mg·mL-1的TBII储备液。用37 ℃预温孵的 pH 1.2 盐酸溶液和 pH 6.8,7.4,8.0 的磷酸盐缓冲液,作为其稳定性实验用溶液。精密吸取TBⅡ储备液2 mL加入5 mL上述pH液中,迅速混合,分别装在8个1.5 mL具塞试管中,将试管置于37 ℃恒温水浴中反应并计时,在混合后的第0,0.25,0.5,1,2,3,4,6,9 h (每管500 μL),定时取出试管。立即吸取溶液20 μL,进样。每个pH溶液重复2管,每个时间点平行做2个。
2.7.1 人工胃液的配制 取浓盐酸9 mL,加水约800 mL及胃蛋白酶10 g,充分溶解后,定容至1 000 mL,即为人工模拟胃液。除不含蛋白酶外,其他与人工模拟胃液相同配制即得人工胃液NE[3]。
2.7.2 人工肠液的配制 称取6.8 g KH2PO4溶解于500 mL水中,用0.1 mol·L-1的NaOH调节混合液的pH至6.8;另取胰蛋白酶10 g,加水适量使溶解;将两溶液混合后加水稀释至1 000 mL,即得。除不含胰蛋白酶外,其他与人工模拟肠液相同配制即得人工肠液NE。
精密吸取TBⅡ储备液2 mL(浓度为1.1 mg·mL-1),分别加入人工模拟胃液、人工模拟胃液NE 5 mL中,迅速混合,分装在9个1.5 mL具塞试管中(每管500 μL),将试管置于37 ℃恒温水浴中反应并计时,在混合后的第1,0.25,0.5,1,2,4,6,9 h分别取出其中1管,混匀,立即吸取溶液20 μL,进样。精密吸取TBⅡ储备液2 mL(0.42 mg·mL-1),加入人工模拟肠液、人工模拟肠液NE 5 mL中,操作同人工胃液、人工胃液NE,每个pH溶液重复2管,每个时间点平行做2个。测定TBⅡ的浓度。具体见图3。
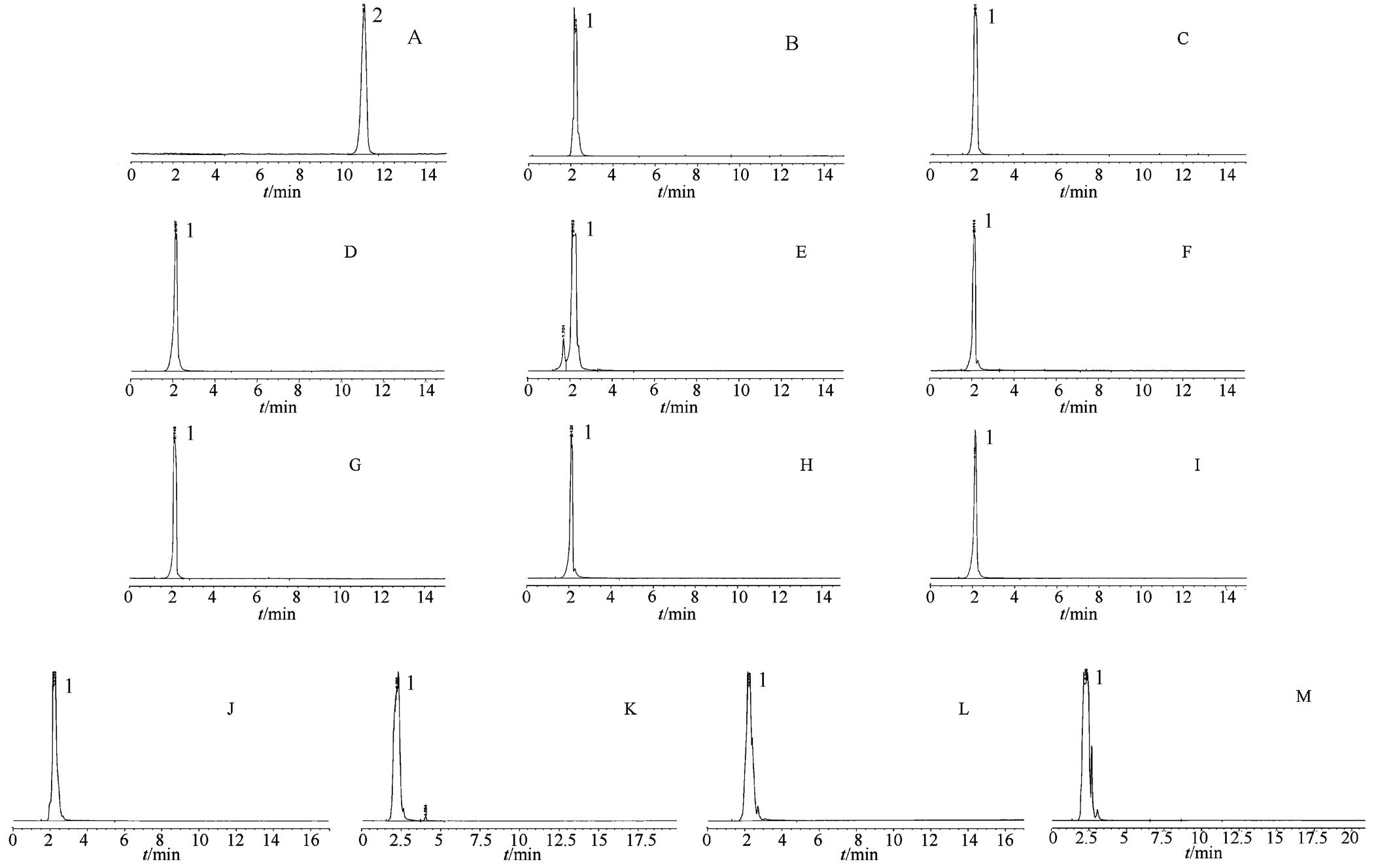
图2 高效液相色谱图
A-TBⅡ对照品溶液;B-空白人工胃液;C-空白人工胃液NE;D-空白人工肠液;E-空白人工肠液NE;F-空白pH 1.2溶液;G-空白pH 6.8溶液;H-空白pH 7.4溶液;I-空白pH 8.0溶液;J-空白大鼠肝液;K-空白大鼠胃液;L-空白大鼠大肠及其内容物;M-空白大鼠小肠及其内容物;1-溶剂;2-TBⅡ。
Fig. 2 HPLC chromatograms
A-standard solution of TBII; B-blank simulated gastric fluid; C-blank simulated gastric fluid with pepsin free; D-blank simulated intestinal fluid; E-blank simulated intestinal fluid with trypsin free; F–blank pH 1.2 solution; G-blank pH 6.8 solution; H–blank pH 7.4 solution; I-blank pH 8.0 solution; J–blank rat liver fluid; K–blank rat gastric fluid; L–blank rat large intestine fluid; M-blank rat small intestine fluid; 1-solution; 2-TBⅡ.
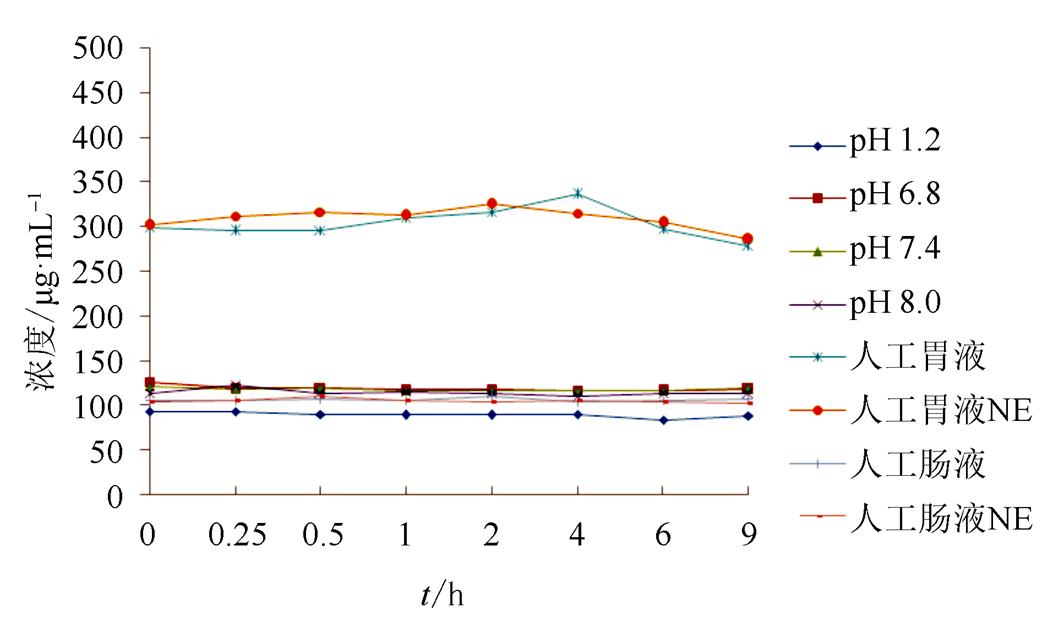
图3 TBⅡ在不同介质中的稳定性(n=2)
Fig. 3 Stability of TBⅡ in different media (n=2)
计算不同时间点TBⅡ的浓度。结果表明TBⅡ在人工胃液、人工胃液NE、人工肠液、人工肠液NE、pH 1.2、pH 6.8、pH 7.4、pH 8.0溶液中降解相对稳定,9 h 后未发生明显降解;比较人工胃液、人工胃液NE、人工肠液、人工肠液NE的试验数据,说明胃蛋白酶和胰蛋白酶对TBⅡ稳定性影响较小。
2.8.1 空白生物样品的制备[4-5]取SD大鼠(200~220 g)5只,禁食不禁水12 h,腹腔注射水合氯醛麻醉,经心脏取血处死,迅速取出胃、肝、小肠、大肠至冰浴生理盐水中备用。分别用适量冰冷的pH 1.2、pH 6.8、pH 7.4、pH 8磷酸盐缓冲液冲洗大鼠的肝、胃、小肠、大肠,收集胃、小肠、大肠内容物,各组织剪碎,分别加入适量的pH缓冲液放入匀浆机中匀浆,然后合并内容物与组织匀浆,混合均匀,按质量体积比加入5倍体积的各pH缓冲液涡旋30 min,使其充分混合均匀,将上述内容物匀浆高速离心(4 000 r·min-1,15 min),除去浮层油脂和微粒,取上清液备用。所有生物样品均在冰浴条件下进行,临用前新鲜配制。
2.8.2 TBⅡ在生物样品中的稳定性试验 精密吸取TBⅡ储备液2 mL,分别加入到上述制备好的5 mL胃液、大肠及其内容物、小肠及其内容物、肝液中,迅速混合,分装在7个1.5 mL具塞试管中(每管500 μL),将试管置于37 ℃恒温培养箱中反应并计时,在混合后的第1,2,4,6,8,12,24 h分别取出其中1管,立即加入500 μL冰乙腈终止反应,涡旋振荡2 min后,14 800 r·min-1离心10 min,取上清液0.5 mL于水浴上(37 ℃)氮气流吹干。残渣用100 μL 30%丙酮溶解,14 800 r·min-1离心10 min,取上清液进行HPLC分析,测定TBⅡ的含量,每个组织溶液重复2管,每个时间点平行做2个。另取一部分样品残渣用100 μL 甲醇溶解,14 800 r·min-1离心10 min,取上清液进行HPLC分析,结果见图4。
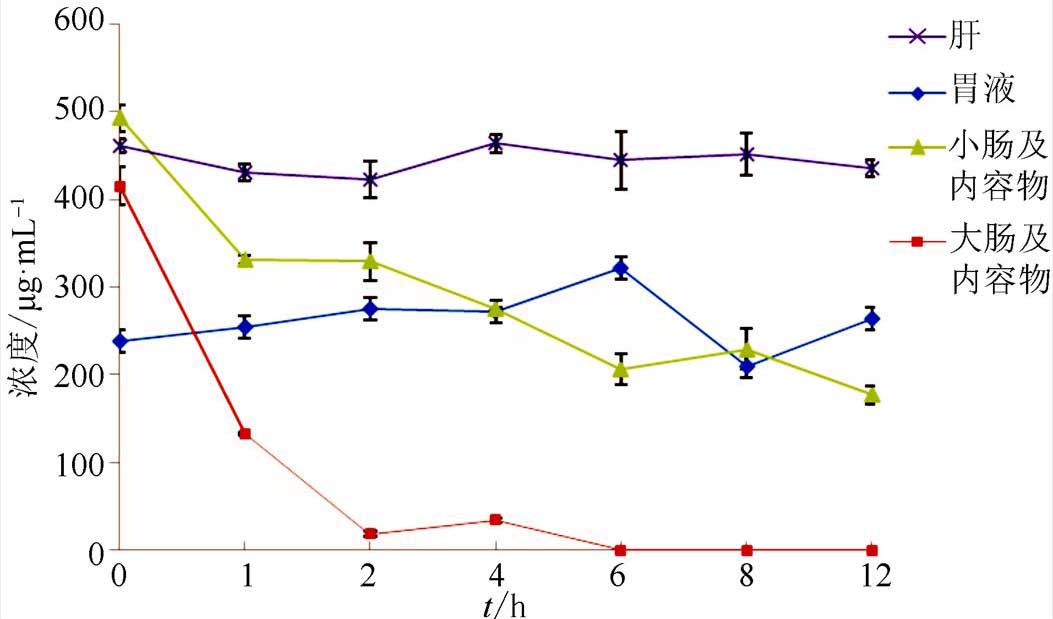
图4 TBⅡ在生物介质中的稳定性(n=2)
Fig. 4 Stability of TB II in biological fluids
计算不同时间点TBⅡ的浓度。结果表明,TBⅡ在肝脏匀浆和胃中未发生明显的降解,在大肠和小肠及其内容物中发生明显降解,在大肠及其内容物中,1 h TBⅡ的转化率为63.6%,2 h TBⅡ的转化率为94.20%,6 h之后TBⅡ已经完全降解。在小肠及其内容物中,24 h降解率为61.8%,残渣用甲醇溶解后经HPLC分析,与对照品知母皂苷AⅢ比较,在相同的保留时间上显示相同的色谱峰,为TBⅡ脱去一分子糖后的产物。说明TBⅡ在体内发生代谢转化可能受其肠道菌群、肠内微生物或肠道内的酶等影响较大,胃蛋白酶和肝微粒体酶对其没有影响。
药物在胃肠道环境下的稳定性测定是药物发现和开发过程中必要的研究步骤,特别是口服药物在胃肠道的稳定性,将会直接影响到药物在胃肠道吸收进入血液循环的有效性[6]。TBⅡ是甾体皂苷类化合物,其在体内的生物利用度很低,从研究的数据来看,在体外模拟的胃肠道环境中,TBⅡ是个比较稳定的化合物,不受溶液酸碱度和胃蛋白酶、胰蛋白酶的影响,其代谢可能受肠道菌群、肠内微生物或肠道内的酶等影响较大,这或许是其在体内生物利用度低的原因之一。TBⅡ是一个糖苷类的化合物,研究表明,大部分糖苷类化合物在体内不能通过小肠壁进入血液,而是被肠内微生物通过裂解的方式降解和代谢,仅有小部分产生苷元再重新吸收进入血液,本实验的研究对TBⅡ药物的开发利用提供了一定的参考价值。
REFERENCES
[1] Luo j, Fan x h, Cui s j, et al. UPLC fingerprint of Anemarrhenae Rhizoma and its hierarchical cluster analysis [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2013, 30(1): 28-31.
[2] Wang d, Wang y y, Shi s b. Quality control of Zhimu(Rhizoma Anemarrhenae) [J]. J Beijing Univ Tradit Chin Med(北京中医药大学学报), 2011, 34(4): 263-265.
[3] 中国药典. 一部[S]. 2015: 212-213.
[4] Sun y m, Chen x y, Xu h y, et al. Stability of glufosfamide in phosphate buffers and in biological samples [J]. J Chromatogr B, 2006(832): 224-230.
[5] Krondahl E, von Euler-Chelpin H, Orzechowski A, et al.In vitrometabolism of opioid tetrapeptide agonists in various tissues and subcellular fractions from rats [J]. Peptedes, 22(4): 613-621.
[6] Guo z r. Stategy of molecular drug design: activity and druggability [J]. Acta Pharm Sin(药学学报), 2010, 45(5): 539-547.
(本文责编:曹粤锋)
Stability of Timosaponin BⅡ in Simulated Conditions of Human Stomach, Intestines and in Biological Fluidsin vitro
Liu yanping1, Yu zicheng2
(1.Pudong New Area People’s Hospital of Shanghai, shanghai 201200, China; 2.Yangpu Hospital of Tongji University of Medicine,Shanghai200090,China)
Abstract: ObjectiveTo investigate thein vitrostability of timosaponin BⅡ in different physiological pH and biological sample.MethodsTimosaponin BⅡ was incubated in different phosphate buffer solutions with pH of 1.2, 6.8, 7.4 and 8.0, artificial gastrointestinal fluid, artificial gastrointestinal with no pepsin and trypsin and isolate biological media. The concentration of timosaponin BⅡ was determined by HPLC in order to investigate the degradation and the enzymatic stability of timosaponin BⅡ.ResultsTimosaponin BⅡ was stable in pH 1.2, 6.8, 7.4 and 8.0, artificial gastrointestinal fluid, artificial gastrointestinal with no pepsin and trypsin within 9 h. Obvious degradation of timosaponin BⅡ was observed after incubationedin the large intestine and small intestine and their contents of isolated rats.ConclutionTimosaponin BⅡ is stable in simulated conditions of human stomach, intestines fluids, with no degradation and influence by pepsin and trypsin. But obvious degradation of timosaponin BⅡ is observed after incubationedin the large intestine and small intestine and their contents of isolated rats. Unaffected by pepsin and trypsin, it is affected by intestinal flora.
Key words:timosaponin BⅡ; artificialgastrointestinal fluid; biological sample; pH fluids
中图分类号:R965.2
文献标志码:B
文章编号:1007-7693(2018)05-0653-04
DOI:10.13748/j.cnki.issn1007-7693.2018.05.007
引用本文:刘艳平, 余自成. 知母皂苷BII在模拟人体胃肠道环境及生物样品中的稳定性研究[J]. 中国现代应用药学, 2018, 35(5): 653-656.
收稿日期 :2017-08-03
基金项目:上海市杨浦区卫计委资助项目(YP15Q05);2015年同济大学优秀青年人才培养计划(2015KJ049);上海市杨浦区中心医院院级课题(Se1201509)
作者简介:刘艳平,女,博士,主管药师 Tel: (021)65690520-433 E-mail: lyp1066@hotmail.com