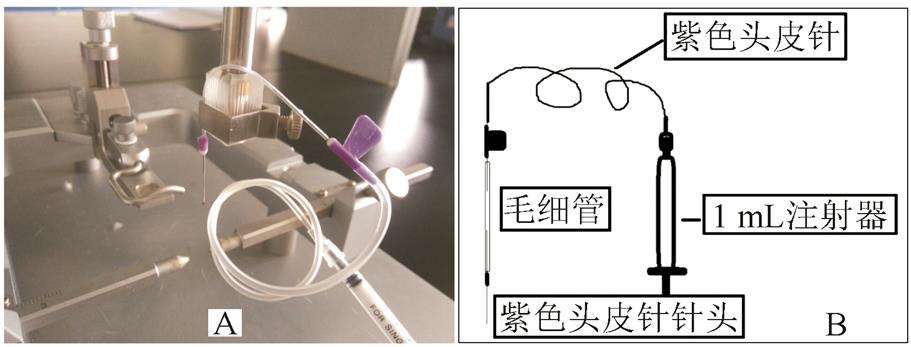
图1 改装后的采样器
顾利强1,2,章媛3,徐晓珍1,陈灵芳1,张升1,黄敏聪1,辛艳飞1,郑高利1*,陈忠坚4*
(1.浙江省医学科学院安全性评价研究中心,杭州 310013;2.浙江中医药大学药学院,杭州 310053;3.杭州市萧山区第三人民医院,杭州 311251;4.浙江省肿瘤医院肿瘤研究所,杭州 310022)
摘要:目的建立大鼠多次采集脑脊液的动物模型,以进行药物在大鼠脑部的动力学研究。方法将大鼠麻醉后,利用脑立体定位仪,通过大鼠双侧耳道与上方门齿固定大鼠头部,切开大鼠头部皮肤,暴露颅骨与颈部肌肉交界处,将采样针对准大鼠颅骨与颈部肌肉交界处的中心位置,利用脑立体定位仪的上下轴将采样针竖直缓慢向下刺入,刺入约0.6~0.9 cm(视大鼠体质量而定)后,脑脊液即可被采出。结果脑脊液采集成功率(脑脊液成功采样1次及以上)100%(26例),动力学采样成功率(脑脊液成功采样6次及以上)80%(10例)。结论本模型操作简单、结果稳定、成功率高、重复性高,适合脑部作用药物进行脑脊液动力学研究。
关键词:大鼠;脑脊液;采集模型;脑部药动学
脑脊液(cerebrospinal fluid,CSF)是充满在各脑室、蛛网膜下腔和脊髓中央管内的无色透明液体[1],由脑室中的脉络丛产生,其与血液由血脑屏障隔开,在血脑屏障内形成较为独立的体液系统[2]。患者有中枢神经系统疾病时,常常要作腰椎穿刺吸取脑脊液检查,以协助诊断。同样,研究药物是否能有效地通过血脑屏障,可以通过检测药物在脑脊液中的含量来探索[3]。目前,脑脊液的采集多为一次性采集,在进行药物脑脊液的药动学(pharmacokinetics,PK)研究时,采用分批采集不同个体动物CSF的方法以得到多时间点的药物数据[4-5],这种非单体动物的数据影响了PK实验的准确性与科学性。本研究建立了大鼠脑脊液多次采集的模型,经26例大鼠的试验验证,该模型操作简单、结果稳定、成功率高、重复性好,非常适合脑部作用药物进行脑脊液动力学研究和药物血脑屏障透过率研究。
戊巴比妥钠(上海西唐生物科技有限公司,批号:WS20150310;规格:每瓶25 g);0.9%氯化钠注射液(浙江国镜药业有限公司,批号:C214110505;规格:100 mL)。
51600型脑立体定位仪(上海玉研科学仪器有限公司);Polyethylene Tubing(美国Becton Dickinsonand Company,毛细管,ID:0.58 mm;OD:0.968 mm);一次性使用静脉输液针(紫色头皮针,单翼,规格:0.55 mm×20 mm)和一次性使用无菌注射器(带针,规格:1 mL和5 mL)购自上海双鸽实业有限公司;样品管(江苏海门市耀文实验器材公司)。
SD大鼠,♀♂各半,体质量200~300 g,SPF级,由浙江省医学科学院实验动物中心提供,动物质量合格证:0018987,动物生产许可证:SCXK(浙)2014-0001。动物使用许可证:SYXK(浙)2012-0176。
将紫色头皮针剪去后部软管,剪去持针塑料翼片及连接软管的塑料,暴露金属质内芯,留3~5 mm塑料以利于固定采样针头,金属质内芯连接毛细管,毛细管后接紫色头皮针,再连接1 mL注射器。连接金属质内芯与紫色头皮针的毛细管中间留出约1~2 cm的软管以观察脑脊液是否被采出。见图1。

图1 改装后的采样器
A-实物图;B-示意图。
Fig. 1 The sample collector after being modified
A-the picture of the actual object; B-the picture of the general view.
配制1%戊巴比妥钠生理盐水溶液,按50 mg·kg-1腹腔注射将大鼠麻醉。待大鼠完全麻醉后,利用脑立体定位仪,通过大鼠双侧耳道与大鼠上颚门齿固定大鼠头部,以手术剪切开大鼠头部皮肤,经钝性分离后暴露颅骨与颈部肌肉交界处。见图2。
改装后的头皮针固定于脑立体定位仪的持针处并对准大鼠颅骨与颈部肌肉交界处的中心位置。利用脑立体定位仪的上下轴将采样针竖直缓慢向下刺入,并利用1 mL注射器形成少许负压,以利于脑脊液自行流出。脑立体定位仪的上下轴刺入约0.6~0.9 cm深(视大鼠体质量而定),到达大鼠小脑延髓池处,脑脊液可在负压下自行通过采样针流入取样器具。
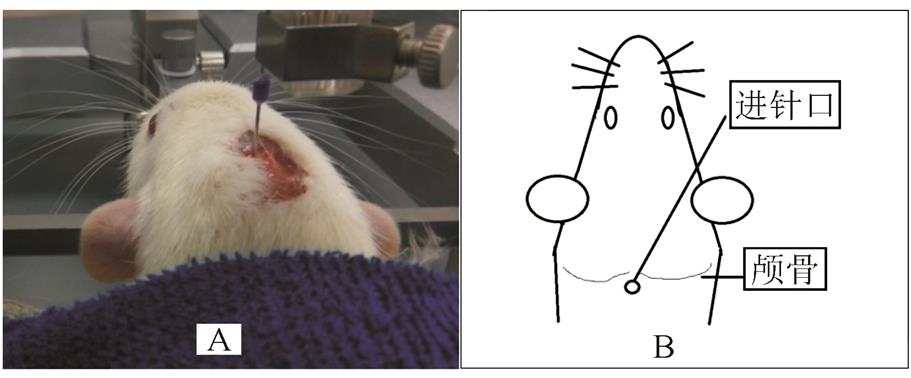
图2 大鼠脑脊液采集模型
A-实物图;B-示意图。
Fig. 2 The rat cerebrospinal fluid collection model
A-the picture of the actual object; B-the picture of the general view.
一般至少需要5个以上的浓度数据进行基本的动力学计算,以进一步获得药动学参数。因此,脑脊液动力学采集按“2.3”项下方法操作,在单次脑脊液量满足收集要求后,通过1 mL注射器少许加压,脑脊液即可回流至脑部。脑脊液采集后取下毛细管后的头皮针和1 mL注射器,脑脊液全部转入样品管进行离心待后续处理,毛细管随采样针被固定在采样器上。本模型多次采集脑脊液时,每次更换毛细管后面的紫色头皮针以减轻对后续样品的污染。
以脑脊液离心后肉眼未观察到红细胞为标准,通过26例大鼠试验,本模型脑脊液采集成功率(脑脊液成功采样1次及以上)100%。26例大鼠中的10例进行了动力学采样,成功8例,动力学采样成功率(脑脊液成功采样6次及以上)80%,失败的2例均由于从第4或5个采样点开始,脑脊液被血污染。见图3。

图3大鼠脑脊液样品
A-采样成功样品;B-采样失败样品。
Fig. 3 The rat cerebrospinal fluid samples
A-the sample collected successfully; B-the sample collected unsuccessfully.
目前脑脊液采集主要有以下几种方法:直接采取[4-5]、植入导管采取[6-7]和微透析技术。其中直接采取只能一次性采取脑脊液,而植入导管和微透析技术可以进行多次采取脑脊液。但微透析技术对于器材和手术要求较高,植入导管方法较为经济和简便易行。本模型属于植入导管方法的改良版,与报道过的类似方法相比,本模型优点主要体现在:①简单、迅速。脑立体定位仪定位,位置固定,只需切开大鼠头部皮肤找到颅骨与颈部肌肉交界处便可,不需进行复杂的手术,操作熟练后单人即可在5 min之内完成脑脊液首次采集(从完全麻醉开始计时),采样迅速。②低成本、污染小:本方法采样1次更换1个头皮针,最大程度避免交叉污染。其他模型多采用微量注射器[8],成本较高,多为重复利用,药动学多次采样时容易造成样品交叉污染。③成功率高:本采样方法利用负压原理,首次采样时,采样针到达部位后脑脊液由内部压力自动流出,可以避免进针过深或过浅的失误。其他模型大多需主动抽取[9-11],首次采样时无负压主动吸取难于判断进针位置,进针过深容易进入脑组织,过浅还在肌肉层,过深或过浅均采不出脑脊液,即使经调整后采集到的脑脊液也往往会被血液污染。
虽然本模型经济、简单、高效,但大鼠头部被固定,不适用眼眶采血,同时大鼠如以静脉注射方式给药,尾静脉采血也有血样被污染的可能。因此本方法对原方法进行了以下改进:将大鼠麻醉后先进行股静脉插管,再对其进行脑脊液采集,可高质量地采集血样。
本模型采样成功率极高,26例大鼠采样成功率达100%(脑脊液成功采样1次及以上),但10例动力学采样成功率下降为80%(脑脊液成功采样6次及以上),现象为后期采样的脑脊液不易采集,或虽能被采集,但易被血液污染,离心后可观察到少量血细胞。与类似模型的成功率相比:100%(一次采样,10例)[8],100%(一次采样,例数未明)[9],100%(一次采样,10例)[10],90%(一次采样,50例)[11],90%(一次采样,50例)[11],≤100%(多种模型,一次采样,50例)[12],本模型单次采样成功率居前。综合多次采样等因素,本模型优势较为明显。分析采样失败的原因,笔者认为可能是多次采样后,脑脊液失去的速度大于脑脊液生成的速度,脑脊液量下降,此时若1 mL注射器的负压较大,可能使毛细血管内血细胞渗出污染脑脊液,该现象可通过合理设置采样间隔和减少采样量减少发生。本模型可采集样品的极限次数、体积与大鼠体质量、采样间隔和采样体积有关:在一定范围内,大鼠体质量越大,采样间隔越长,采样体积越小,可采集的次数越多。一般情况下,体质量>300 g的大鼠,一次性采样可采集脑脊液150~250 μL,多次采样,脑脊液一次采集30 μL,1 h内采集≤3次,可采集6次以上的脑脊液,保证采样点数足够用于药动学计算。
REFERENCES
[1] CHEN T, CONG Z, WEI Q. Improvement of the collection technique of cerebrospinal fluid in monkeys [J]. Chin J Comp Med(中国比较医学杂志), 2011, 21(2): 49-50.
[2] RODRÍGUEZ-FANJUL J, FERNÁNDEZ-FEIJÓO C D, CAMPRUBÍ M C. A new technique for collection of cerebrospinal fluid in rat pups [J]. J Exp Neurosci, 2015(9): 37-41.
[3] LI X Q, WANG X L, ZHU H G, et al. Concentration of erlotinib in rat cerebrospinal fluid and plasma and its correlation with efficacy [J]. Pract J Cancer(实用癌症杂志), 2016, 31(3): 353-355.
[4] LONG B, YU R G, WANG L, et al. Pharmacokinetics of Linezolid in rat plasma, brain tissue and cerebrospinal fluid [J]. Chin J Clinicians(中华临床医师杂志), 2013, 7(1): 208-211.
[5] WALKER M C, TONG X, PERRY H, et al. Comparison of serum, cerebrospinal fluid and brain extracellular fluid pharmacokinetics of lamotrigine [J]. Br J Pharmacol, 2000, 130(2): 242-248.
[6] ZARGHAMI A, ALINEZHAD F, PANDAMOOZ S, et al. A modified method for cerebrospinal fluid collection in anesthetized rat and evaluation of the efficacy [J]. Int J Mol Cell Med, 2013, 2(2): 97-98.
[7] DURIS K, MANAENKO A, SUZUKI H, et al. Sampling of CSF via the cisterna magna and blood collection via the heart affects brain water content in a rat SAH model [J]. Transl Stroke Res, 2011, 2(2): 232-237.
[8] YANG Z, LAI G C, WANG G B, et al. Method improvement of collecting cerebrospinal fluid of SD rat [J]. Chin Occup Med(中国职业医学), 2011, 38(2): 117-119.
[9] REN C H, GAO M Q, CAO J Q, et al. A new method for extracting cerebrospinal fluid of rat [J]. Lab Animal Sci(实验动物科学), 2012, 29(1): 61-62, 68.
[10] WANG S J, MENG X K, CONG B, et al. The modification of cerebrospinal fluid extraction method in rats [J]. J Hebei Med Univ(河北医科大学学报). 2010, 31(2): 125-127.
[11] CAO Y D, ZHANG L Z, WANG M S, et al. Two methods to collect cerebrospinal fluid in SD rats [J]. Acta Acad Med Xuzhou (徐州医学院学报), 2005, 25(4): 317-319.
[12] LV T M, PAN Z Y. Methods of sampling cerebral spinal fluids in rodent [J]. Chin J Clinicians(中华临床医师杂志), 2013, 7(24): 11623-11626.
(本文责编:曹粤锋)
Establishment of cerebrospinal fluid multiple collection model in rat
Gu Liqiang1,2, Zhang Yuan3, Xu Xiaozhen1, Chen Lingfang1, Zhang Sheng1, Huang Mincong1, Xin Yanfei1, Zheng Gaoli1*, Chen Zhongjian4*
(1.Center of Safety Evaluation, Zhejiang Academy of Medical Sciences, Hangzhou 310013, China; 2.College of Pharmaceutical Science, Zhejiang Chinese Medical University, Hangzhou 310053, China; 3.The third people’s Hospital of Xiaoshan District, Hangzhou 311251, China; 4.Zhejiang Cancer Research Institute, Zhejiang Cancer Hospital, Hangzhou 310022, China)
ABSTRACT: OBJECTIVETo study the pharmacokinetics of drug in rat’s brain by establishing a model that can collect cerebrospinal fluid at different times.METHODSThe rat’s head was fixed by the antrum auris and cutting tooth after anesthesia using brain stereotaxis. Cut and open the skin in corona capitis to find the crossing line between the cranium and muscle in cervical part. The needle used to collect the cerebrospinal fluid pricked into the center point of the crossing line and was pushed down by the “Z” axis slowly. When the depth of 0.6-0.9 cm (the number of the depth depended on the body weight of the rat) was arrived, the cerebrospinal fluid would be got.RESULTSThe achievement ratio of single collection was 100% based on the data of 26 rats and the achievement ratio of multiple collections (6 times and above) was 80% based on the data of 10 rats.CONCLUSIONThe model is proved to be simple, stable, high efficient and repeatable and is suitable to be adopted to apply in brain research in rats.
KEY WORDS:rat; cerebrospinal fluid; collection model; brain pharmacokinetics
中图分类号:R965.1
文献标志码:A
文章编号:1007-7693(2018)03-0311-03
DOI:10.13748/j.cnki.issn1007-7693.2018.03.002
引用本文:顾利强, 章媛, 徐晓珍, 等. 大鼠脑脊液多次采集改良模型的建立[J]. 中国现代应用药学, 2018, 35(3): 311-313.
收稿日期:2017-10-11
基金项目:国家自然科学基金(81302840);浙江省医药卫生科技计划科研基金项目(2017KY305);浙江省科技计划项目(2016F10007);浙江省医学科学院安评中心科研基金项目(ZA1701S)
作者简介:顾利强,男,硕士,助理研究员 Tel: (0571)87568012 E-mail: xiaoguddy@163.com
*通信作者:郑高利,男,博士,研究员 Tel: (0571)87568016 E-mail: 13255810206@163.com 陈忠坚,男,博士,助理研究员 Tel: (0571)88122515 E-mail: chenzj@zjcc.org.cn