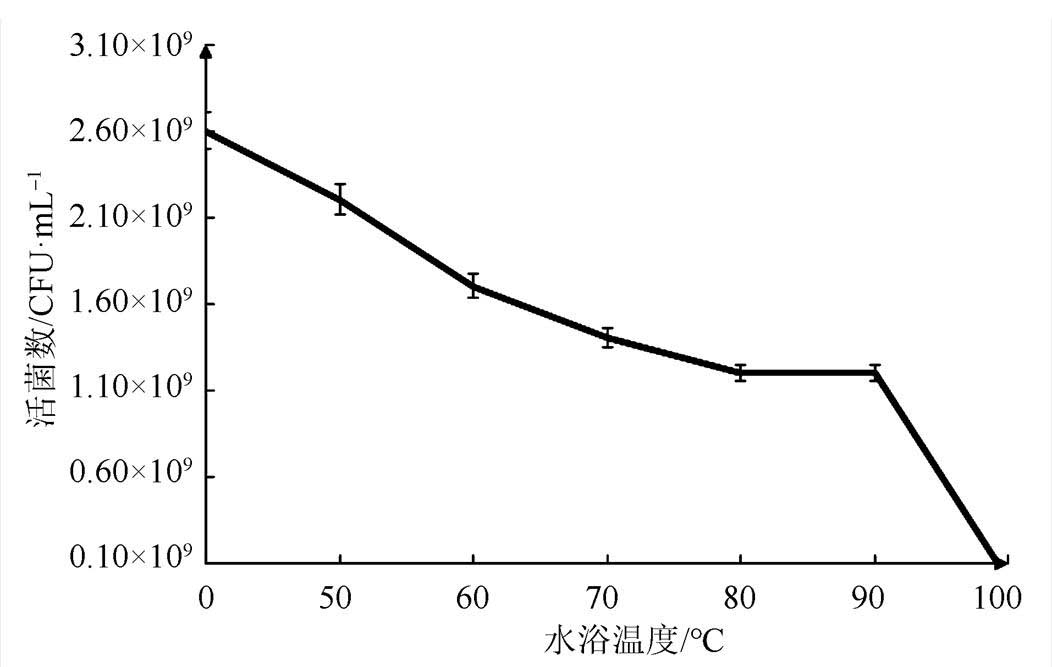
图1 不同水浴温度加热处理10 min后活菌数的变化
Fig. 1 The changes of viable count which were heated 10 min by different water bath temperature
王银环1,钱凌1,董芳华2,李珏1,陈敏3,郑小玲1*
(1.浙江省食品药品检验研究院,杭州 310052;2.绍兴市市场监督管理局滨海新城分局,浙江 绍兴 312000;3.浙江省药品认证检查中心,杭州 310052)
摘要:目的考察流式细胞技术和平板计数法2种方法检测地衣芽孢杆菌活菌制剂(片剂、颗粒剂和胶囊剂)中芽孢数的不同。方法分别采用BD FACSMicroCount全自动微生物分析系统和平板计数法检测不同水浴温度及不同水浴时间处理过的地衣芽孢杆菌活菌胶囊中的芽孢数。同时采用上述2种方法检测3种地衣芽孢杆菌活菌制剂(片剂、颗粒剂和胶囊剂)中的活菌数、芽孢数和芽孢率。结果流式细胞技术和平板计数法对于检测不同水浴温度及不同水浴时间处理过的地衣芽孢杆菌活菌胶囊中的芽孢数无显著性差异。采用上述2种方法检测的3种地衣芽孢杆菌活菌制剂(片剂、颗粒剂和胶囊剂)中的活菌数、芽孢数和芽孢率的结果比较均无显著性差异。结论流式细胞技术和平板计数法对于3种地衣芽孢杆菌活菌制剂(片剂、颗粒剂和胶囊剂)检测活菌数、芽孢数和芽孢率无显著性差异。
关键词:地衣芽孢杆菌活菌制剂;流式细胞技术;平板计数法;芽孢数测定;活菌数测定;芽孢率
地衣芽孢杆菌活菌制剂是根据微生态学基本原理制成的活菌制品,主要用于治疗急慢性肠炎、痢疾及各种因素引起的肠道菌群失调、腹泻等疾病[1-2]。有效活菌数是衡量地衣芽孢杆菌活菌制剂品质的重要指标,中国药典2015年版三部微生态活菌制品总论也明确规定微生态活菌制品必须由非致病的活细菌组成,无论在生产过程、制品贮存和使用期间均应保持稳定的活菌状态[3]。但是微生态活菌制剂随着保存时间的延长,活菌数量不断减少,有效活菌数降低,严重影响微生态制剂的使用效果[4]。活菌数包括营养体和芽孢,营养体耐受性差,储藏期短,易死亡。而芽孢没有新陈代谢,能经受多种环境伤害,较其营养体细胞易保藏,且保存期长,复活率高[5-6]。因此,芽孢是制备微生态活菌制品的理想存在形式。制剂中的芽孢含量是影响制剂应用效果的关键因素,芽孢数的测定是评价微生态活菌制品安全、稳定、有效的重要质控指标。
目前芽孢数的测定多采用传统的微生物检测方法,如80~100 ℃热处理10 ~30 min或孔雀绿染色法。前者操作繁琐,检测周期长,严重滞后于生产过程;后者染色困难,只能检测芽孢率,不能计数芽孢数量[7]。随着微生物快检技术的发展及中国药典2015年版9201《药品微生物检验替代方法验证指导原则》的强制执行,采用快速准确的新技术替代经典的微生物计数方法成为微生物检测技术发展的必然趋势[8-10]。BD FACSMicroCount全自动微生物分析系统是一台基于流式细胞技术的全自动快速微生物计数分析系统,检测限能达到10CFU·mL-1数量级,可同步完成细菌、霉菌和酵母菌的计数,并且能够区分出死菌和活菌[11-12]。
本研究采用BD FACSMicroCount全自动微生物分析系统和平板计数法,分别检测不同水浴温度及不同水浴时间处理过的地衣芽孢杆菌活菌制剂中的芽孢数,同时采用上述2种方法检测3种地衣芽孢杆菌活菌制剂(片剂、颗粒剂和胶囊剂)中的活菌数、芽孢数和芽孢率,以考察上述2种方法对芽孢数计数结果的影响,为研究开发出微生态活菌制剂中芽孢数的快速检测方法,控制微生态活菌制剂质量,延长微生态活菌制剂保藏期奠定实验基础。
HFsafe-1200生物安全柜(上海力康医疗设备有限公司);MLS-3781高压蒸气灭菌器(日本Panasonic公司);IF260恒温培养箱、SF450灭菌箱(德国Memmert公司);S400-B酸度计、ME2002E电子天平(上海Mettler Toledo公司);TW20恒温水浴锅(德国JULABO公司);HY-2调速多用振荡器(国华电器有限公司);FACSMicroCount全自动微生物分析系统(美国BD公司)。
地衣芽孢杆菌活菌片(批号:20140501,20140502,20140503;规格:每片0.5 g)、地衣芽孢杆菌活菌颗粒(批号:20131102,20131104,20131106;规格:每袋0.5 g)和地衣芽孢杆菌活菌胶囊(批号:201603019,201607106,201608128;规格:每粒0.25 g)均由浙江京新药业股份有限公司提供。
营养琼脂培养基(青岛高科园海博生物技术有限公司,批号:20161115),经培养基适用性检查,结果符合规定。0.9%无菌氯化钠注射液(浙江莎普爱思药业股份有限公司,批号:160708-2C)。MicroCount鞘液(批号:7060746)、MicroCount清洗液(批号:7046973)、MicroCount磷酸盐缓冲液(批号:7055645)、MicroCount校验标准品(批号:6265599)、MicroCount BIOMASS染料(批号:6243815)、MicroCount BRAG3荧光淬灭剂(批号:7009812)、MicroCount叠氮钠(批号:7060806)均购自美国BD公司。
2.1.1 供试液制备 无菌称取地衣芽孢杆菌活菌胶囊内容物(批号:201603019)3.0 g,加入0.9%无菌氯化钠稀释液27.0 ml,添加无菌玻璃珠置摇床上振摇30 min,充分混匀,制成1∶10供试液。
2.1.2 芽孢数的测定 取制备好的1∶10供试液数份,经不同水浴温度,分别为50,60,70,80,90,100 ℃加热处理10 min后,迅速冷却,采用10倍梯度稀释法制成适宜稀释度的供试液。取上述适宜稀释度的供试液各100 µl,分别涂布于营养琼脂平板,平行涂布3个平板,37 ℃倒置培养18~24 h后计数。
取上述制备好的1∶10供试液数份,分别经75,80,85,90,95,100 ℃水浴加热处理10 min后,迅速冷却。分别采用BD FACSMicroCount全自动微生物分析系统和平板计数法检测其中的芽孢数。
取“2.1.1”项下制备好的1∶10供试液数份,采用80 ℃水浴分别加热处理5,10,15,20,25,30 min后,迅速冷却。分别采用BD FACS MicroCount全自动微生物分析系统和平板计数法检测其中的芽孢数。
2.3.1 活菌数测定 无菌称取地衣芽孢杆菌活菌制剂(胶囊取内容物),按“2.1.1”项下方法制成1∶10供试液。取制备好的1∶10供试液,分别采用BD FACSMicroCount全自动微生物分析系统和平板计数法进行检测。
2.3.2 芽孢数测定 取“2.3.1”项下制备好的1∶10供试液分别经80 ℃水浴加热处理30 min后,迅速冷却。采用BD FACSMicroCount全自动微生物分析系统和平板计数法检测其中的芽孢数。
2.3.3 芽孢率测定 芽孢率=芽孢数/活菌数× 100%。
采用Microsoft Excel 2007软件和SPSS 19.0统计软件进行数据处理和统计分析,多个样本之间的两两比较采用配对样本t检验,P<0.05认为有显著性差异。
地衣芽孢杆菌活菌胶囊经不同水浴温度处理10 min后,活菌数先逐渐减少,80~90 ℃内活菌数处于平台期,90 ℃水浴处理10 min后,活菌数急剧下降。地衣芽孢杆菌活菌制剂中活菌数包括营养体和芽孢,营养体不耐热,随着水浴温度的升高,营养体逐渐死亡,80 ℃水浴处理10 min后,营养体基本全部死亡。芽孢耐热性强,在80~90 ℃内芽孢数基本不变,90 ℃水浴处理10 min后,一些不耐热芽孢逐渐死亡,芽孢数急剧下降[13]。结果见图1和表1。

图1 不同水浴温度加热处理10 min后活菌数的变化
Fig. 1 The changes of viable count which were heated 10 min by different water bath temperature
地衣芽孢杆菌活菌胶囊经不同水浴温度处理10 min后,采用流式细胞术(flow cytometry,FCM)和平板计数法2种方法分别检测芽孢数。将表1中lg(FCM计数结果)与lg(平板计数结果)采用配对样本t检验进行统计学分析(显著性水平为0.05)。统计结果表明,采用FCM和平板计数法2种方法计数结果的P值为0.21,无显著性差异。
地衣芽孢杆菌活菌制剂经80 ℃水浴处理不同时间后,分别采用FCM和平板计数法检测芽孢数,结果见表2。将表2中lg(FCM计数结果)与lg(平板计数结果)采用配对样本t检验进行统计学分析。统计结果表明,采用FCM和平板计数法2种方法计数结果的P值为0.10,无显著性差异。
表1 2种方法检测不同水浴温度处理10 min后芽孢数的变化
Tab. 1 The changes of spore count which were detected by two methods after different water bath temperature heating 10 min

表2 2种方法检测不同水浴时间热处理后芽孢数的变化
Tab. 2 The changes of spore count which were detected by two methods after different water bathtime
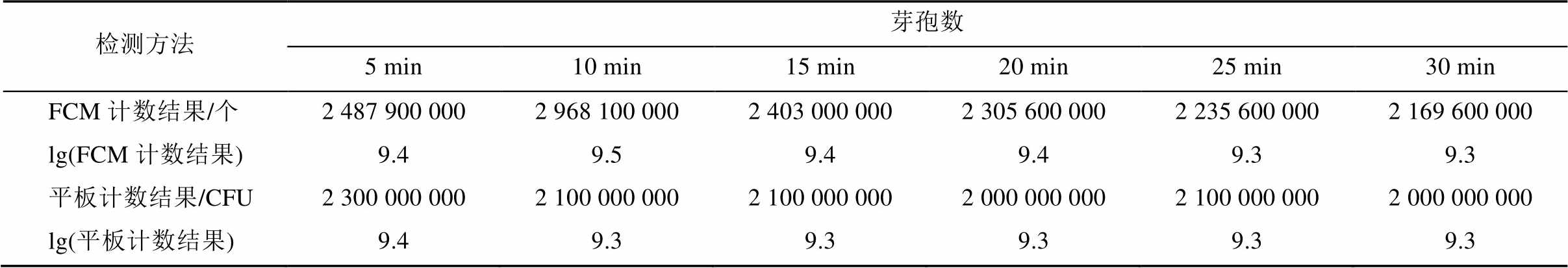
由表2可知,80 ℃水浴处理不同时间后,2种方法检测的芽孢数基本不变,说明80 ℃水浴处理后,营养体基本全部死亡,而芽孢耐热性强,芽孢数基本不变。参考林陈强等[14]80 ℃水浴处理对地衣芽孢杆菌营养细胞具有良好的杀灭作用,为保证试验结果的准确性和稳定性,本研究采用80 ℃水浴处理30 min作为营养体灭活的时间,也即芽孢数计数的处理条件。
3种活菌制剂中活菌数、芽孢数和芽孢率的测定结果见表3。将表3中地衣芽孢杆菌片剂、颗粒剂和胶囊剂3种剂型的lg(FCM活菌计数结果)与lg(平板活菌计数结果)、lg(FCM芽孢计数结果)与lg(平板芽孢计数结果)、FCM计数的芽孢率与平板计数法的芽孢率分别采用t检验进行统计学分析,统计结果见表4。可见采用FCM法和平板计数法对地衣芽孢杆菌片剂、颗粒剂和胶囊剂3种剂型进行活菌计数、芽孢计数、芽孢率计数的结果均无显著性差异。以上结果表明,对于该企业生产的地衣芽孢杆菌片剂、颗粒剂和胶囊剂,其活菌数、芽孢数和芽孢率的检测均可采用FCM和平板计数法,2种方法检测结果之间无显著性差异。
表3 3种活菌制剂中的活菌数、芽孢数和芽孢率测定结果
Tab. 3 The determination results of viable count, spore count and sporulation efficiency of three viable organism preparation
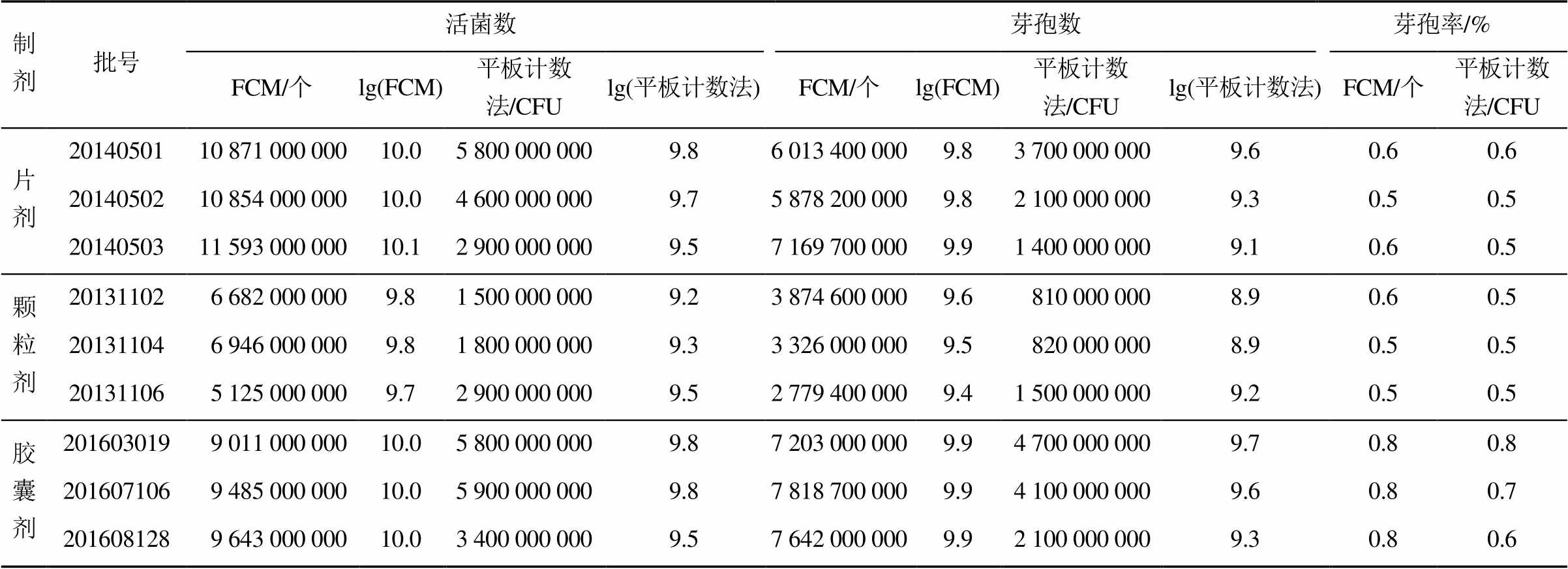
表4 2种方法检测的3种剂型中的活菌数、芽孢数和芽孢率比较的t检验结果
Tab. 4 Thet-test results of viable count, spore count and sporulation efficiency of three viable organism preparation which detected by two methods

刘道亮等[15]通过Q检验法和方差分析发现,在一定浓度范围下,FCM检测液态商品中的细菌总数与平板法呈线性相关,符合性好。本课题中,50~90 ℃水浴加热处理后,采用FCM与平板计数法检测活菌数和芽孢数,2种检测方法之间无显著性差异。然而100 ℃加热10 min后2种方法检测的芽孢数对数值差距很大,△lg[lg(FCM计数结果)-lg(平板计数结果)]为2.9。说明在该处理点,2种检测方法差异很大,这可能与BD FACS MicroCount全自动微生物分析系统计数原理有很大的关系。BIOMASS染料是可透膜的核酸染料,能穿过所有细胞的细胞膜与胞内核酸进行染色,BRAG3荧光淬灭剂不可透膜,只能与死细胞或被损伤的细胞进行染色。100 ℃水浴加热处理10 min后,可能使芽孢胞外壁的脂蛋白、芽孢衣的疏水性角蛋白变性,同时破坏了皮层中的肽聚糖[16],芽孢内的膜结构在受到较高温度冲击时也会发生内翻或崩解,导致 BRAG3荧光淬灭剂进入死细胞或受损伤细胞膜内的量变少,最终造成活菌计数结果明显偏大。此外,光学显微镜和电子显微镜下观察发现,由营养体形成成熟的芽孢需经历7个阶段[13],前4个阶段的芽孢不耐热,直到后3个阶段的芽孢才具有耐热性,故100 ℃水浴加热处理10 min后,一些不耐热芽孢被杀死,最终芽孢计数结果急剧下降。
林陈强等[14]研究发现80 ℃水浴处理对地衣芽孢杆菌营养细胞具有良好的杀灭作用,80℃水浴处理15 min后,经活体染色实验验证,CHB6营养细胞死亡率近100%。本课题根据平板计数法和FCM计数结果的分析,结合前期镜检结果,为保证试验结果的准确性和稳定性,采用80 ℃水浴处理30 min作为营养细胞灭活的时间,也即芽孢数计数的处理条件。
平板计数法是微生物计数的经典方法,但因操作繁琐、误差大,检测周期长,严重滞后于生产过程,不能实时监测微生态活菌制剂中的活菌数和芽孢数,控制微生态活菌制剂质量,限制了其在活菌制剂方面的应用。近年来,FCM因其灵敏、快速、操作简便、高通量、多参数分析等特点被迅速地应用于细胞生物学、分子生物学、免疫学等领域,在微生物学领域中的应用也越来越广泛[17-18]。本课题研究发现FCM和平板计数法对于检测地衣芽孢杆菌活菌制剂中的活菌数、芽孢数和芽孢率无显著性差异。说明在一定条件下,FCM有望替代平板计数法,成为微生态活菌制剂检测的现代新技术。但是,目前流式细胞仪价格昂贵,所需试剂及耗材成本较高,且荧光染料的选择有一定的限制性,因此应进一步加强有关设备和试剂的研究与开发,降低检测成本,使流式细胞仪在活菌制剂检测方面的应用得到推广和普及。相信随着科学技术的迅猛发展,流式细胞仪将有更广阔的应用前景。
REFERENCES
[1] 骆稽酉, 曲淑敏. 益生菌制剂整肠生[J]. 医学综述, 2001, 7(4): 245-247.
[2] 陆文婷. 地衣芽胞杆菌活菌制剂(整肠生)治疗肠道菌群失调56例报告[J]. 中国微生态学杂志, 2005, 17(6): 465.
[3] 中国药典. 三部[S]. 2015: 44-50.
[4] 袁佩娜. 微生态制剂的质量控制要求[J]. 中国微生态学杂志, 2002, 14(4): 187-188.
[5] Traag B A, Pugliese A, Eisen J A, et al. Gene conservation among endospore-forming bacteria reveals additional sporulation genes in Bacillus subtilis [J]. J bacteriol, 2013, 195(2): 253-260.
[6] XU S R, CHEN X, WU Y P. Application of the mechanism of sporulation in production of pharmaceutical probiotics [J]. J Food Sci Biotechnol(食品与生物技术学报), 2007, 26(4): 121-126.
[7] 徐蓉, 葛平, 陈蓉, 等. 3 种不同方法检测艰难梭菌芽孢率的比较[J]. 检验医学, 2015, 30(2): 201-205.
[8] 中国药典. 四部[S]. 2015: 385-387.
[9] ZHENG X L, RUAN H, CHEN S, et al. A method for live bacteria counting ofBacillus licheniformisparticles [J]. Chin J Pharm Anal(药物分析杂志), 2014, 34(10):1792-1795.
[10] Zheng X L, Xiong Z Q, Wu J Q. The use of a simple flow cytometry method for rapid detection of spores in probioticBacillus licheniformis-containing tablets [J]. Food Sci Biotechnol(食品与生物技术学报), 2017, 26(1): 167-171.
[11] Patel V, Kopher K, Zhang Y, et al. Enumeration ofPasteurella multocidain a fermentation culture using the BD FACSMicroCount System [J]. J Valid Technol, 2012, 18(3): 70.
[12] Zeng W, Li H, Chen Y, et al. Survivin activates NF‑κB p65 via the IKKβ promoter in esophageal squamous cell carcinoma [J]. Mol Med Rep, 2016, 13(2): 1869-1880.
[13] 潘梦垚, 王凯英, 王阳. 细菌芽孢理化性质和耐热机制研究[J]. 科协论坛(下半月), 2012(4): 102-103.
[14] LIN C Q, XIE N H, QIU H R, et al. The fermentation conditions for high sporulation rate ofBacillus licheniformisCHB6 [J]. Chin J Trop Crops(热带作物学报), 2011, 32(9): 1746-1749.
[15] LIU D L, ZHAO Z M, HU L X, et al. Rapid determination of total bacterial number in liquid foods by a flow cytometry method [J]. Food Sci(食品科学), 2011, 32(2): 157-163.
[16] GAO Y L, JU X R, WU D. Study on synergetic killing effects of mild heat treatment and high hydrostatic pressure on Bacillus spores [J]. Food Sci(食品科学), 2007, 28(3): 59-63.
[17] 魏熙胤, 牛瑞芳. 流式细胞仪的发展历史及其原理和应用进展[J]. 现代仪器, 2006(4): 8-11.
[18] 王建中, 王淑娟. 当前临床流式细胞分析的发展趋势[J]. 中华检验医学杂志, 2002, 25(1): 5-7.
(本文责编:曹粤锋)
Comparative Research on the Detection of Viable Organism Preparation ofBacillus licheniformisbetween Flow Cytometry and Plate Counting Method
WANG Yinhuan1, QIAN Ling1, DONG Fanghua2, LI Jue1, CHEN Min3, ZHENG Xiaoling1*
(1.Zhejiang Institute for Food and Drug Control, Hangzhou 310052, China; 2.Market Supervision Administration of Shaoxing Municipality Binhai Branch, Shaoxing 312000, China; 3.Zhejiang Center for Drug Inspection, Hangzhou 310052, China)
ABSTRACT: OBJECTIVETo investigate the differences between flow cytometry(FCM) and plate counting method on detecting the spore count in viable organism preparation ofBacillus licheniformis(tablet, granule and capsule).METHODSBD FACSMicroCount analytical system and plate counting method respectively were used to survey and evaluate the spore count in viable organism capsuleofBacillus licheniformis, which were treated by different water bath temperature or by different water bath time. The methods of above-mentioned were applied to detect the spore count in three viable organism preparation ofBacillus licheniformis(tablet, granule and capsule), at the same time.RESULTSThere were no significant differences between FCM and plate counting method, with regard to detect the spore count in viable organism capsule ofBacillus licheniformiswhich were treated by different water bath temperature or by different water bath time. And there were no significant differences in viable count, spore count and sporulation efficiency of three viable organism preparation ofBacillus licheniformis(tablet, granule and capsule), which were detected by above-mentioned methods.CONCLUSIONThere are no significant differences between FCM and plate counting method, with regard to detect the viable count, spore count and sporulation efficiency of three viable organism preparation ofBacillus licheniformis(tablet, granule and capsule).
KEY WORDS:viable organism preparationofBacillus licheniformis; flow cytometry; plate counting method; spore counting; viable counting; sporulation efficiency
中图分类号:R927.12
文献标志码:B
文章编号:1007-7693(2018)03-0352-05
DOI:10.13748/j.cnki.issn1007-7693.2018.03.010
引用本文:王银环, 钱凌, 董芳华, 等. 流式细胞术和平板计数法用于地衣芽孢杆菌活菌制剂检测的比较研究[J]. 中国现代应用药学, 2018, 35(3): 352-356.
收稿日期:2017-09-12
基金项目:浙江省药品接触材料质量控制研究重点实验室(2014E10006)
作者简介:王银环,女,硕士 Tel: (0571)86459427 E-mail: 779829255@qq.com
*通信作者:郑小玲,女,硕士,副主任药师 Tel: (0571)86459427 E-mail: linghuxiao83@163.com