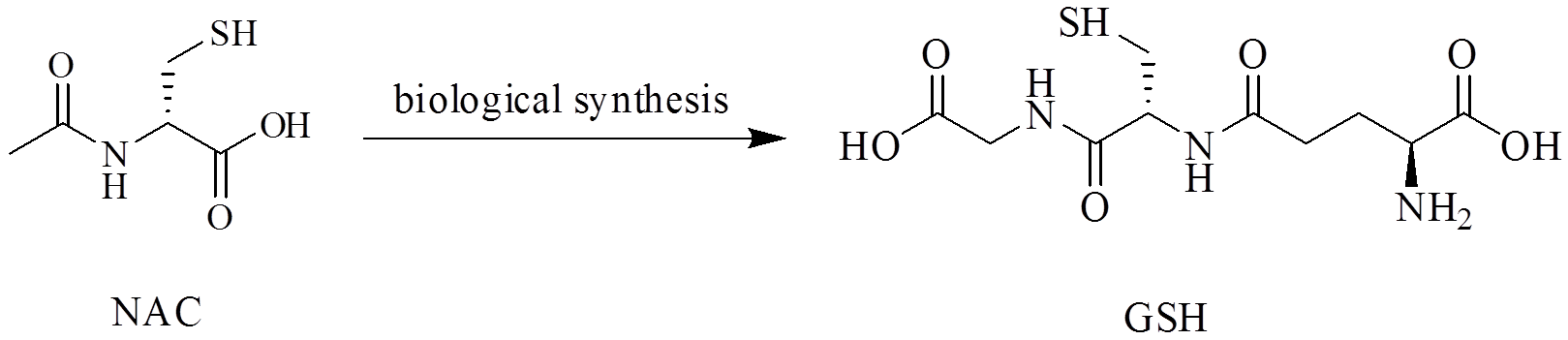
图1 NAC和GSH的结构式
Fig. 1 Structures of NAC and GSH
琚立萍,席建军,赵艳梅,何若愚,张建康,史婷婷,刘寿荣*,庄让笑*
(浙江中医药大学附属杭州市西溪医院,杭州 310023)
摘要:目的设计、合成N-乙酰半胱氨酸衍生物,并评价目标化合物对H2O2诱导的LO2细胞氧化损伤的保护作用。方法以L-半胱氨酸和N-乙酰半胱氨酸为起始原料,采用酰氯酯化法合成具有全新结构的乙酰半胱氨酸衍生物;以H2O2损伤LO2人肝细胞建立体外氧化损伤模型,利用CCK-8法检测不同浓度H2O2对LO2细胞存活率的影响,并检测细胞上清中MDA含量和SOD活性。结果共合成了6个全新结构的N-乙酰半胱氨酸衍生物,其结构经1H-NMR、13C-NMR、ESI-MS确证,目标化合物能够抑制H2O2诱导的LO2氧化损伤,并能够降低MDA含量和提高SOD活性(p<0.01或p<0.05)。结论本研究快速、高效地合成了N-乙酰半胱氨酸系列衍生物,目标化合物对体外肝细胞损伤具有保护作用。
关键词:N-乙酰半胱氨酸;肝损伤;二硫键;硫酯键;活性评价
N-乙酰半胱氨酸(N-acetylcysteine,NAC)是细胞内谷胱甘肽(GSH)的前体,见图1,能够提高细胞内谷胱甘肽的生物合成,具有显著的清除机体氧自由基和抗氧化作用,临床上主要用于呼吸系统和肝脏疾病的治疗[1-3]。随着对NAC研究的不断深入[4-8],很多研究证实NAC不仅具有黏液溶解的作用,还具有较强的抗氧化等多方面药理作用。但NAC结构中含有活泼的巯基(-SH),极易被氧化,导致NAC进入体内后被快速代谢,其口服生物利用度为6%~10%,而且大剂量使用NAC易引起面部潮红、恶心、呕吐等不良反应,从而限制了其临床应用。
二硫键和硫酯键作为一种共价键,在药物设计中扮演很重要的角色,通过将药物结构中的巯基修饰成二硫键或硫酯键,进入体内后借助还原反应或水解反应转化为巯基发挥作用是一种重要的药物设计策略。因此,基于NAC临床应用的不足和其结构的特殊性,对NAC的结构进行改造,在保留其药效的小分子骨架基础上,在-SH基团上引入二硫键或硫酯键,得到全新结构的NAC衍生物,并对目标化合物体外抗肝损伤活性进行评价。合成路线和目标化合物的结构见图2。
NAC(武汉武大弘元药业有限公司,批号:201701006);L-半胱氨酸(南京多点化学,批号:20140910);Brüker Avancenmx-500型核磁仪、Esquire-LC-00075 型质谱仪(美国Brüker公司);Nanodrop 1000紫外分光光度计(美国Thermo Scientific 公司);薄层色谱硅胶GF254、硅胶H均为青岛海洋化工有限公司生产;其余试剂均为分析纯。
1.2.1 化合物2的合成 将m-CPBA(5.5 mmol,949 mg)溶于二氯甲烷(12 mL)中,0 ℃下缓缓滴加到溶有二乙基二硫醚(1,5 mmol,610 mg)的二氯甲烷(3 mL)溶液中,0 ℃反应30 min,然后恢复至室温反应1 h。反应液分别用饱和碳酸氢钠溶液(30 mL×2)和饱和氯化钠溶液(30 mL×1)洗,无水硫酸钠干燥,减压回收有机溶剂,得到663 mg油状物2,收率为96.1%,ESI-MS:m/z=138.3 [M+H]+,该产物直接投下一步反应。
1.2.2 化合物3的合成L-半胱氨酸(5 mmol,605 mg)溶于水(20 mL)中,然后加入化合物2(5 mmol,690 mg),室温反应10 min后,抽滤,水洗(20 mL×2),减压干燥后得到790 mg的白色固体3,收率为87.3%,ESI-MS:m/z=182.4[M+H]+,该产物直接投入下一步反应。
1.2.3 化合物4的合成 化合物3(3 mmol,543 mg)置于25 mL圆底烧瓶中,加入10 mL二氯甲烷,冰浴下缓慢滴加乙酰氯(3.3 mmol,0.23 mL)的二氯甲烷溶液5 mL,室温反应0.5 h。反应结束后,分别用饱和碳酸氢钠(30 mL×3)和饱和氯化钠(30 mL×1)洗,无水硫酸钠干燥,减压回收溶剂,得到570 mg的白色固体4,收率为85.2%。1H-NMR (500 MHz,d6-DMSO):δ=12.97(s,1H,OH),8.29 (d,J= 8.0 Hz,1H,NH),4.48-4.44 (m,1H,CH),3.10 (q,J= 4.5,13.5 Hz,1H,CH2),2.89 (q,J= 4.5,13.5 Hz,1H,CH2),2.71 (q,J= 7.5,15.0 Hz,2H,CH2),1.86 (s,3H,CH3),1.23 (t,J= 7.5,14.5 Hz,3H,CH3);13C-NMR (100 MHz,d6-DMSO) :δ= 172.0,169.26,51.39,31.54,22.32,22.32,14.21。ESI-MS:m/z= 224.1[M+H]+。

图1 NAC和GSH的结构式
Fig. 1 Structures of NAC and GSH
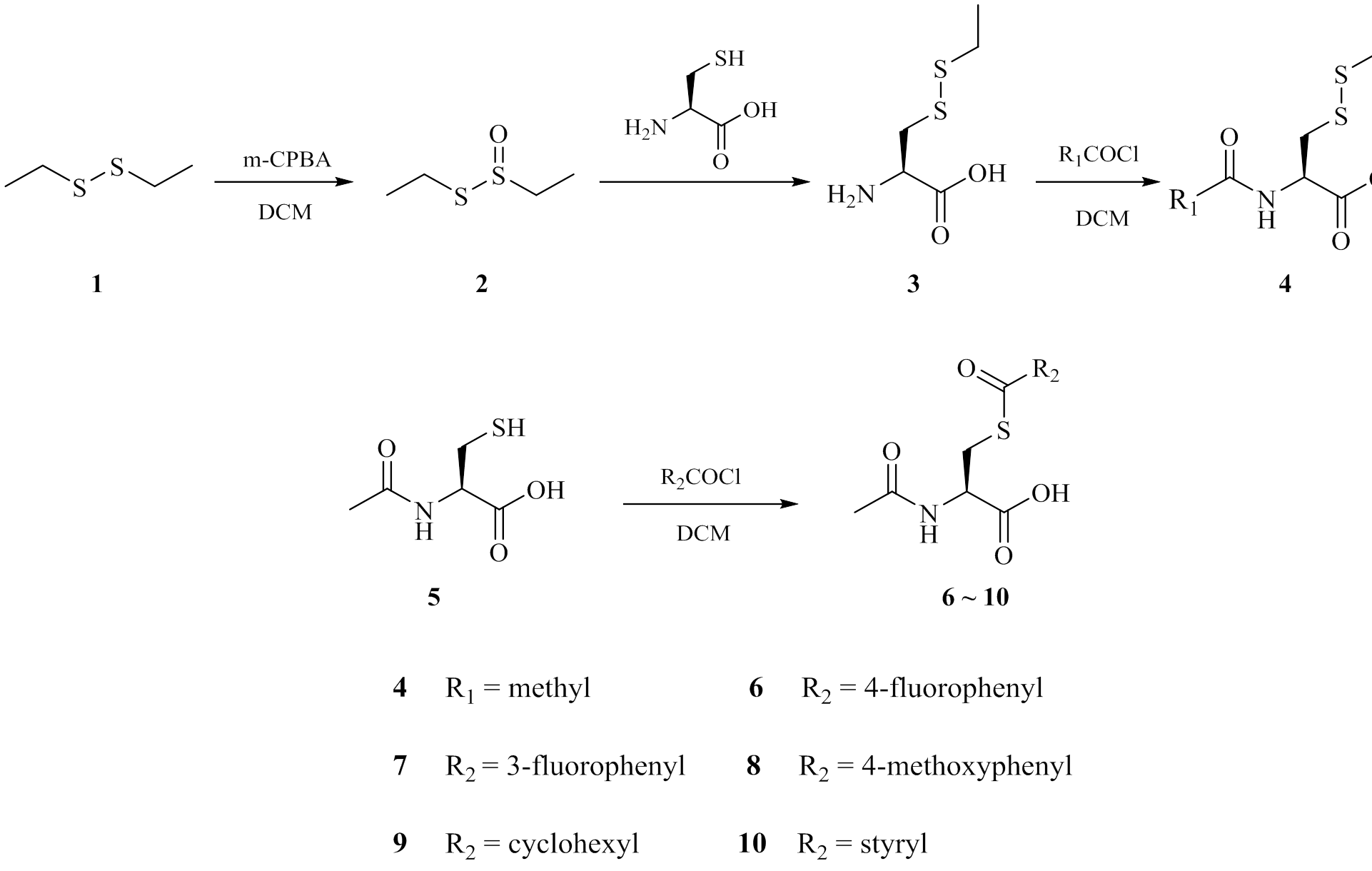
图2 目标化合物合成路线和结构
Fig. 2 Synthetic routes and structures of the target compounds
1.2.4 化合物6的合成 化合物5(2 mmol,326.4 mg)置于25 mL圆底烧瓶中,加入10 mL二氯甲烷,冰浴下缓慢滴加对氟苯甲酰氯(2.2 mmol,0.26 mL)的二氯甲烷溶液(5 mL),反应0.5 h后,恢复室温后继续反应2 h。反应结束后,分别用饱和碳酸氢钠(30 mL×3)和饱和氯化钠(30 mL×1)洗,无水硫酸钠干燥,减压回收溶剂,得到514 mg的白色固体6,采用同样方法得到化合物7~9,收率为90.1%。1H-NMR (500 MHz,d6-DMSO):δ= 12.97 (s,1H,OH),8.36 (d,J= 8.0 Hz,1H,NH),8.01~7.98 (m,2H,Ar-H),7.42~7.38 (m,2H,Ar-H),4.48~4.44 (m,1H,CH),3.56 (dd,J= 5.0,14.0 Hz,1H,CH2),3.27~3.23 (m,1H,CH2),1.84 (s,3H,CH3);13C-NMR (100 MHz,d6-DMSO):δ= 189.04,171.64,169.37,166.63,164.12,132.77,132.74,129.88,129.78,116.33,116.11,51.32,30.12,22.29。ESI-MS:m/z= 286.1[M+H]+。
1.2.5 化合物7的合成 采用同样方法得到化合物7,白色固体506.7 mg;收率为88.8%;1H-NMR (500 MHz,d6-DMSO):δ= 12.99 (s,1H,OH),8.36 (d,J= 8.0 Hz,1H,NH),7.77 (d,J= 8.0 Hz,1H,Ar-H),7.65~7.54 (m,3H,Ar-H),4.48-4.44 (m,1H,CH),3.56 (dd,J= 5.0,14.0 Hz,1H,CH2),3.26 (dd,J= 8.5,14.0 Hz,1H,CH2),1.83 (s,3H,CH3);13C-NMR (100 MHz,d6-DMSO):δ= 189.46,189.44,171.60,169.60,169.39,163.31,160.86,138.21,138.14,131.47,131.39,123.21,120.78,113.38,113.15,51.24,30.23,22.28。ESI-MS:m/z= 286.1[M+H]+。
1.2.6 化合物8的合成 采用同样方法得到化合物8,白色固体501.3 mg;收率为84.3%;1H-NMR (500 MHz,d6-DMSO):δ= 12.92 (s,1H,OH),8.32 (s,1H,NH),7.89~7.87 (m,2H,Ar-H),7.08~7.06 (m,2H,Ar-H),4.42~4.41 (m,1H,CH),3.83 (s,3H,CH3),3.51 (dd,J= 5.0,14.0 Hz,1H,CH2),3.19 (dd,J= 8.5,13.5 Hz,1H,CH2),1.83 (s,3H,CH3);13C-NMR (100 MHz,d6-DMSO):δ= 188.62,171.72,169.34,163.34,163.74,129.16,128.76,114.28,55.64,51.51,29.82,22.29。ESI-MS:m/z= 298.2[M+H]+。
1.2.7 化合物9的合成 采用同样方法得到化合物9,白色固体480.1 mg;收率为87.8%;1H-NMR (500 MHz,d6-DMSO):δ= 12.80 (s,1H,OH),8.22 (d,J= 8.0 Hz,1H,NH),4.33~4.28 (m,1H,CH),3.31~3.27 (m,2H,CH,CH2),3.01~2.97 (m,1H,CH2),1.81 (s,3H,CH3),1.69~1.66 (m,2H,CH2),1.58~1.56 (m,1H,CH2),1.34~1.10 (m,7H,CH2);13C-NMR (100 MHz,d6-DMSO):δ= 201.21,171.67,169.24,51.59,51.40,29.02,28.95,25.12,24.73,24.71,22.25。ESI-MS:m/z= 274.2[M+H]+。
1.2.8 化合物10的合成 采用同样方法得到化合物10,黄色油状物502.4 mg;收率为89.4%;1H-NMR (500 MHz,CDCl3):δ= 7.66 (d,J= 15.5 Hz,1H,CH),7.55~7.54 (m,2H,Ar-H),7.41~7.40 (m,3H,Ar-H),6.86 (d,J= 6.5 Hz,1H,NH),6.74 (d,J= 15.5 Hz,1H,CH),4.81~4.77 (m,1H,CH),3.57~3.48 (m,2H,CH2),2.05 (m,3H,CH3);13C-NMR(100 MHz,d6-DMSO):δ= 188.34,171.70,169.32,140.70,130.84,128.79,124.73,51.46,29.82,22.31。ESI-MS:m/z= 294.2[M+H]+。
2.1.1 材料 人正常LO2肝细胞(上海睿智化学研究有限公司);DMSO(美国Sigma,批号:52396AK);RPMI-1640培养基(Invitrogen,批号:1234-12);胎牛血清(FBS,法国BIOSERA,批号:030813);BCA蛋白浓度测定试剂盒(批号:LF146255)、丙二醛检测试剂盒(MDA,批号:041916160630)、超氧化物歧化酶活性检测试剂盒(SOD,批号:051216160706)均购自江苏碧云天生物技术研究所;H2O2(美国Sigma,批号:52396AK)。
2.1.2 仪器 371气套式CO2细胞培养箱、MK3酶标仪(美国Thermo公司);5430R低温离心机(德国Eppendorf公司);SW-CJ-1FD超净工作台(苏州安泰空气技术有限公司);BT25 S分析天平(德国Sartorius公司);96孔板(美国Corning公司)。
2.2.1 细胞培养及分组 LO2细胞复苏后,用含10% FBS的RPMI-1640培养液转移至培养皿中,37 ℃、5% CO2条件下培养,每2~3 d换液1次,将对数生长期的LO2细胞密度调整为2×106·mL-1后接种于100 mm平皿,每皿接种1 mL,接种12 h细胞完全贴壁后,将LO2细胞随机分为空白组、正常对照组、模型组(H2O2)、阳性对照组(NAC)和各化合物组(即化合物4组、化合物6组、化合物7组、化合物8组、化合物9组和化合物10组)。
2.2.2 H2O2诱导LO2细胞损伤模型 取对数生长期的LO2细胞,调整细胞密度为2×106·mL-1后接种于100 mm平皿,每皿接种1 mL,接种12 h细胞完全贴壁后,设不同浓度梯度(300,400,500,600mmol·L-1)的H2O2进行造模,实验设阴性对照孔和空白对照孔,每个浓度设6个平行孔,造模6 h后弃上清液,用CCK-8检测LO2细胞的存活率,结果见图3。
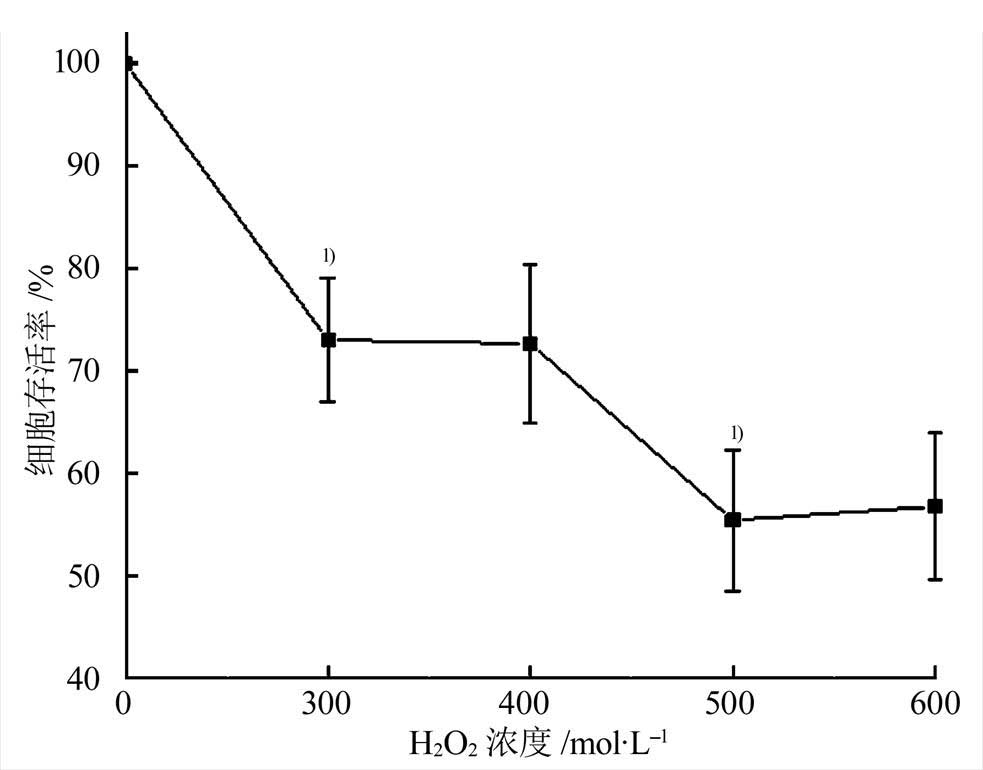
图3 不同浓度H2O2对LO2细胞存活率的影响
与对照组比较,1)p<0.01。
Fig. 3 Effects of different concentrations of H2O2on LO2 cell survival rate
compared with the control group,1)p<0.01.
2.2.3 目标化合物对H2O2诱导LO2细胞损伤的影响
取对数生长期的LO2细胞,调整细胞密度为2×106·mL-1后接种于100 mm平皿,每皿接种1 mL,接种12 h细胞完全贴壁后,按“2.2.1”项下细胞分组后,空白组即无细胞只加培养基,正常对照组加入正常培养液,模型组加入300mmol·L-1的H2O2,阳性对照组加入100mmol·L-1的NAC,各化合物组分别加入100mmol·L-1的各化合物,阳性对照组和各化合物组在加入相应药物处理后2 h加入 300mmol·L-1的H2O2。每组设6个平行孔,继续培养6 h,收集上清液,按试剂盒说明书步骤测定上清液中MDA含量和SOD活性,结果见图4。
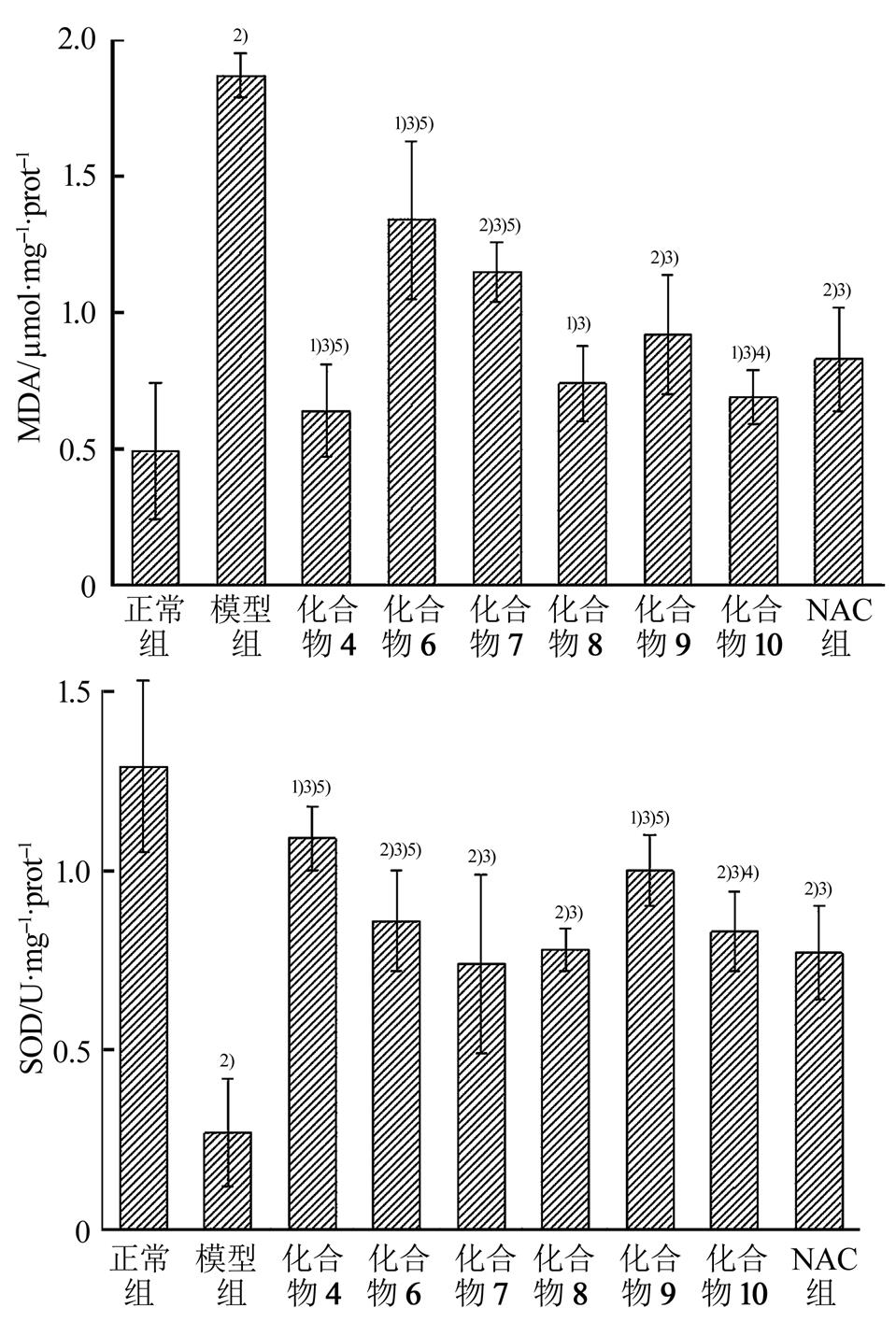
图4 目标化合物抗肝损伤MDA含量和SOD活性
与正常组比较,1)p<0.05,2)p<0.01;与模型组比较,3)p<0.01;与NAC组比较,4)p<0.05,5)p<0.01。
Fig. 4 MDA content and SOD activities of target compounds against liver injury
compared with the normal group,1)p<0.05,2)p<0.01; compared with the model group,3)p<0.01; compared with the NAC group,4)p<0.05,5)p<0.01.
2.2.4 数据统计分析 采用SPSS 20.0软件进行统计处理,实验数据以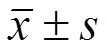 表示,组间均数比较采用One-way ANOVA单因素方差分析,p<0.05表示有统计学意义。
表示,组间均数比较采用One-way ANOVA单因素方差分析,p<0.05表示有统计学意义。
肝损伤是由多种因素引起的各种肝脏疾病的共同病变基础和表现,而内源性活性氧引发的氧化应激是肝损伤最重要的发病机制[9]。正常情况下,机体内抗氧化系统能够维持细胞内氧自由基的代谢平衡,但当肝细胞受到大量氧自由基的攻击时,机体氧化平衡系统被打破,造成细胞膜和细胞结构的破坏,导致肝细胞肿胀坏死,进一步使细胞内清除自由基酶的活性下降,使肝细胞损伤进一步加重[10-11]。H2O2是一种重要的活性氧,能够穿透细胞膜使细胞内氧自由基增加,而且极易通过细胞膜与细胞内铁离子反应形成高活性羟基(·OH)损伤肝细胞[12-13]。本研究通过对NAC结构进行改造,设计并合成了6个具有二硫键或硫酯键结构的NAC衍生物,以H2O2诱导LO2肝细胞损伤模型评价目标化合物的体外抗肝损伤活性。
本研究显示,不同浓度的H2O2诱导LO2肝细胞损伤6 h后,LO2肝细胞存活率显著下降,尤其当H2O2浓度为300mmol·L-1和500mmol·L-1时,细胞存活率有显著性统计学差异(p<0.01),由于H2O2的易挥发不稳定性、不同浓度及人为环境等因素的存在,对LO2肝细胞损伤造模影响较大,综合考虑细胞的耐受性及H2O2造模浓度,最终采用300mmol·L-1的H2O2诱导6 h作为肝细胞损伤建模的最佳条件。
基于上述损伤条件下,再给予一定浓度的目标化合物,从图4检测指标MDA和SOD结果可以看出,各目标化合物与模型组比较,均能够减轻L02肝细胞损伤,能够降低MDA含量并使SOD活性升高,结果具有显著统计学差异(p<0.01),尤其是化合物4、化合物8和化合物10均优于其他化合物;与阳性药物NAC相比较,仅化合物4和化合物10在调节MDA含量和SOD活性方面均优于其他化合物且优于NAC阳性药物,结果具有显著的统计学意义(p<0.01或p<0.05)。提示目标化合物能够在一定程度上提高LO2肝细胞清除自由基的能力,从而减轻自由基对LO2细胞攻击的损伤,保护肝细胞。
综上所述,通过对NAC结构的改造,设计并合成的NAC衍生物能够通过抗氧化损伤发挥不同程度的保护肝细胞作用。下一步,笔者将根据目标化合物的构效关系对其结构进行再优化,并进行体内药效学和药动学研究,探讨相关机制和体内代谢性质,期望发现具有潜力的抗肝损伤药物。
REFERENCES
[1] CAI Z B, ZHUANG R X, PAN X W, et al. Effect ofN-acetylcysteine on Nrf2, heme oxygenase-1 and γ-glutamate cysteine synthetase in chronic hepatic injury rats [J]. Chin J Pharmacol Toxicol(中国药理学与毒理学杂志), 2016, 30(11): 1136-1141.
[2] WANG F G, ZHUANG R X, XI J J. et al. Preparation and distribution in mice of acetylcysteine nanoparticles [J]. Chin J Pharm(中国医药工业杂志), 2012, 43(7): 572-576.
[3] FANG H Y, ZHUANG R X, XI J J. et al. Protective effect of activated carbonN-acetylcysteine microcapsule on liver fibrosis in rats [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2016, 33(8): 993-996.
[4] Sofia R D. Effect of glyceryl guaiacolate in animal models of inflammation and pain [J]. Res Commun Chem Pathol Pharmacol, 1980, 28(2): 285-293.
[5] Nabi T, Nabi S, Rafiq N, et al. Role ofN-acetylcysteine treatment in non-acetaminophen-induced acute liver failure: A prospective study [J]. Saudi J Gastroenterol, 2017, 23(3): 169-175.
[6] Talasaz A H, Khalili H, Fahimi F, et al. Potential role ofN-acetylcysteine in cardiovascular disorders [J]. Therapy, 2011, 8(3): 237-245.
[7] Jang S, Bak E J, Cha J H.N-acetylcysteine prevents the development of gastritis induced by Helicobacter pylori infection [J]. J Microbiol, 2017, 55(5): 396-402.
[8] ZHANG Y L, YUAN B D, XU J, et al. Protective effect ofN-acetylcysteine on rifampicin-induced hepatic injury in mice [J]. Her Med(医药导报), 2016, 35(7): 724-727.
[9] CAI Z B, ZHUANG R X, PAN X W, et al. Therapeutic efficacy and mechanisms of low dose broncholysin on CCl4induced chronic hepatic injury in rats [J].Chin J Mod Appl Pharm(中国现代应用药学), 2016, 33(10): 1251-1255.
[10] WU J, ZHOU C X, ZHAO F M, et al. Protective effect of three kinds of mahuang lianqian chixiaodou decoction on l-o2 hepatocyte injury induced by H2O2[J]. Tradit Chin Drug Res Pharmacol(中药新药与临床药理), 2013, 24(4): 367-370.
[11] LI B X, ZHANG J, WU J, et al. The molecular mechanism of hepatic cell injury modelin vitro[J]. Progr Mod Biomed(现代生物医学进展), 2014, 14(9): 1786-1788.
[12] HUANG L, FU Y S, ZHU C X, et al. Protective effect of Cassia mimosoides linn-containing serum on LO-2 liver cells injured by H2O2[J]. J Liaoning Univ Tradit Chin Med (辽宁中医药大学学报), 2017, 19(1): 45-47.
[13] LIU H L, HU L, WANG J K, et al. Protective effects of quercetin on PC12 cells with H2O2-induced oxidative damage [J]. Chin Pharmacol Bull(中国药理学通报), 2014, 30(3): 373-377.
(本文责编:蔡珊珊)
Synthesis and Anti-liver Injury Activities Evaluation of Novel Acetylcysteine Derivatives with Disulphide and Thioester Bonds
JU Liping, XI Jianjun, ZHAO Yanmei, HE Ruoyu, ZHANG Jiankang, SHI Tingting, LIU Shourong*, ZHUANG Rangxiao*
(HangzhouXixi Hospital Affiliated Zhejiang Chinese Medical University, hangzhou 310023, china)
ABSTRACT: OBJECTIVETo design and synthesis a series ofN-acetylcysteine derivatives, as well as evaluate the protective effects of the target compounds on H2O2-induced oxidative injury on LO2 cells.METHODSA series of novelN-acetylcysteine derivatives were synthesized by acyl chloride esterification method fromL-cysteine andN-acetylcysteine. Thein vitrooxidative injury model was established by inducing H2O2into the LO2 cells. The effects of different concentrations of H2O2on the LO2 cell survival rates were detected by CCK-8 kit, and the contents of MDA and the activities of SOD were measured in the cell culture supernate.RESULTSSix novelN-acetylcysteine derivatives were synthesized and the structures were confirmed by1H-NMR,13C-NMR and ESI-MS. The target compounds could alleviate H2O2-induced oxidative injury on LO2 cells, reduce the concentrations of MDA and increase the activities of SOD(p<0.01 orp<0.05).CONCLUSIONA series of novelN-acetylcysteine derivatives are designed and synthesized, which display protective effects on hepatocytes injury induced by H2O2.
KEY WORDS:N-acetylcysteine; liver injury; disulphide bonds; thioester bonds; biological evaluation
中图分类号:R914.2
文献标志码:B
文章编号:1007-7693(2018)03-0340-05
DOI:10.13748/j.cnki.issn1007-7693.2018.03.008
引用本文:琚立萍,席建军,赵艳梅,等. 新型含二硫键和硫酯键的乙酰半胱氨酸衍生物的合成与抗肝损伤活性评价[J]. 中国现代应用药学, 2018, 35(3): 340-344.
收稿日期:2017-08-11
基金项目:杭州市科技发展计划项目(20142013A60,20152013A03)
作者简介:琚立萍,女,主管药师 Tel: (0571)86481960 E-mail: 122501796@qq.com
*通信作者:庄让笑,男,主任药师 Tel: (0571)86481960 E-mail: zhuangrangxiao@sina.com 刘寿荣,男,主任医师 Tel: (0571)86481960 E-mail: lsr8j463990@sina.com