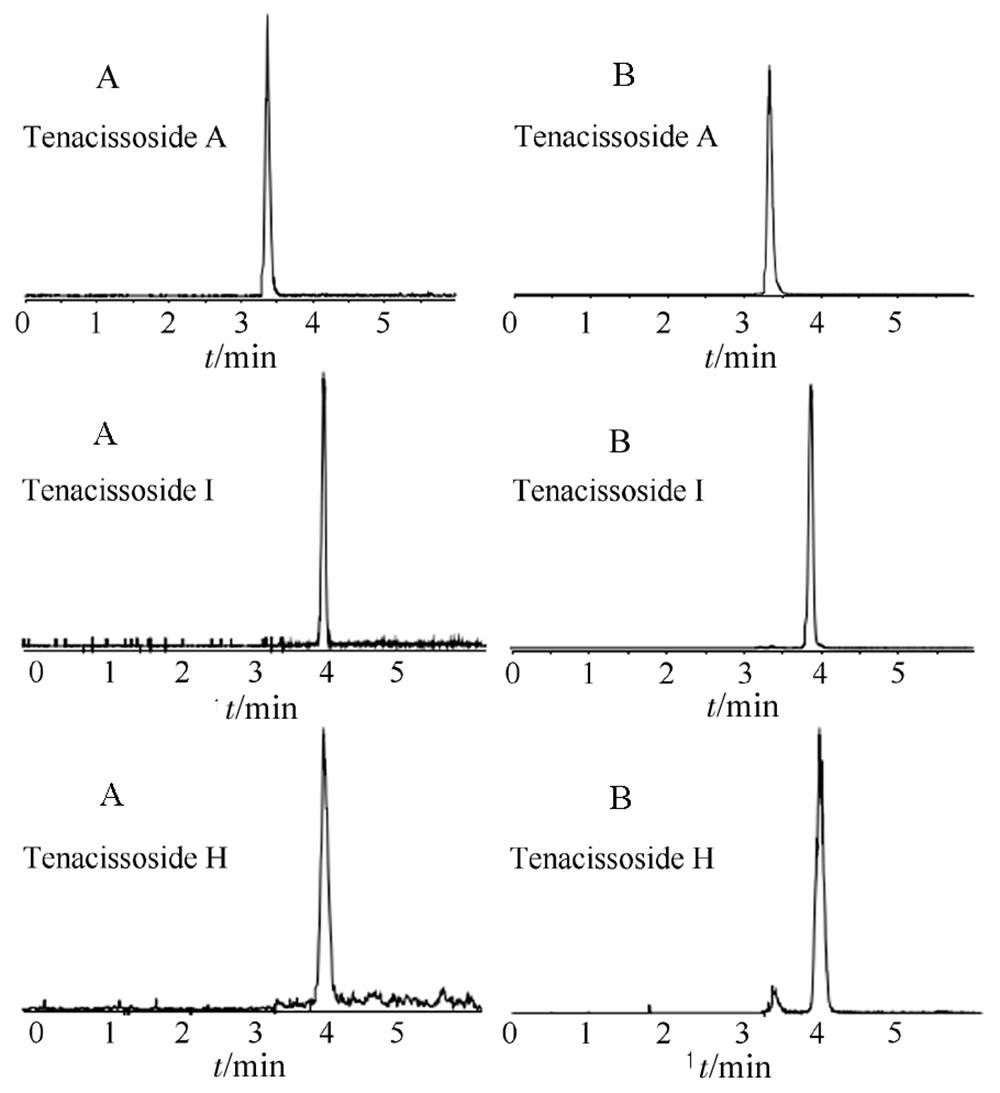
图1 通关藤苷A、I、H对照品溶液(A)和消癌平样品溶液(B)提取离子流图
Fig. 1 MRM chromatograms of Tenacissoside A, Tenacissoside H and Tenacissoside I reference solution(A), and Xiaoaiping sample solution (B)
董占军,安静,王祁民,宋浩静
(河北省人民医院药学部,石家庄 050057)
摘要:目的 建立UPLC-MS/MS同时测定消癌平注射液中通关藤苷A、通关藤苷I、通关藤苷H的含量。方法 采用Phenomenex Kinetex XB-C18色谱柱(2.1 mm×50 mm,2.6 μm),以0.1%甲酸水-乙腈为流动相,梯度洗脱分离,流速为0.2 mL∙min-1,通过电喷雾离子源,多反应监测(MRM),正离子模式。结果 通关藤苷A、I、H分别在0.05~10 ng∙mL-1,0.025~10 ng∙mL-1,0.025~10 ng∙mL-1浓度内呈良好的线性关系,r>0.998,检测限为0.012 5~0.025 ng∙mL-1,平均回收率分别为97.9%,95.7%,96.1%,RSD<3.4%。结论 方法简单快速,准确灵敏,可用于消癌平注射液中通关藤苷A、I、H的定量测定。
关键词:消癌平注射液;通关藤苷A;通关藤苷I;通关藤苷H;超高效液相色谱-串联质谱法;含量测定
消癌平注射液为萝摩科植物通关藤经过水提醇沉提取过程制得的单味多组分制剂,具有清热解毒、化痰软坚的功效,在临床上用于治疗各种恶性肿瘤[1]。消癌平注射液含有甾体苷、多糖、生物碱、有机酸、树脂及色素等多种化学成分,其中C21甾体苷类是其主要抗肿瘤活性成分[2]。张慧的研究团队采用HPLC-UV分别同时测定了通关藤药材中的通关藤苷G、I[3],以及通关藤苷A、D[4]。通关藤苷H没有紫外吸收,李华丽等[5]采用HPLC-ELSD测定了通关藤苷H的含量。但液相色谱分析速度慢,分析时间长达30 min。有文献报道采用LC-MS[6]测定了消癌平注射液中2种甾体皂苷含量,李洋等[7]建立了通关藤皂苷H、G、I的HPLC-ESI/MS同时测定法,质谱法大大提高了分析速度,但其采用的选择性离子监测模式灵敏度较低。尚未见有关通关藤苷A、H和I同时检测的报道。为了更好地控制制剂质量,本课题组采用UPLC-MS/MS建立了消癌平注射液中通关藤苷A、I、H含量测定方法,为改进消癌平注射液及其他制剂的质量控制标准提供依据。
Shimadzu 30A UPLC system超高效液相色谱系统(Applied Biosystems公司);AB Sciex Triple QuadTM 5500型串联四极杆线性离子阱质谱仪(美国应用生物系统公司);Analyst 1.6数据采集软件;BP211D型分析天平(北京赛多利斯仪器有限公司)。
对照品通关藤苷A(山西省中医药研究院,批号:20130513;纯度>98.3%);对照品通关藤苷H(中国食品药品检定研究院,批号:111913-201202;纯度>98%);通关藤苷I(深圳远扬生物技术有限公司,批号:20160311;纯度>98%);消癌平注射液(南京圣和制药股份有限公司,批号:201603111,201603021,201605011;规格:20 mL);乙腈、甲醇、甲酸为色谱纯;水为纯净水。
色谱柱为Phenomenex Kinetex XB-C18柱(2.1 mm×50 mm,2.6 μm);流动相为0.1%甲酸水(A)-乙腈(B),梯度洗脱,0~1 min,40%B;1~2 min,40%→90%B;2~4 min,90%B;4~4.01 min,90%→40%B;4.01~6 min,40%B。流速为0.2 mL∙min-1,进样量为5 μL,柱温为40 ℃。对照品和样品的提取离子流色谱图见图1。

图1 通关藤苷A、I、H对照品溶液(A)和消癌平样品溶液(B)提取离子流图
Fig. 1 MRM chromatograms of Tenacissoside A, Tenacissoside H and Tenacissoside I reference solution(A), and Xiaoaiping sample solution (B)
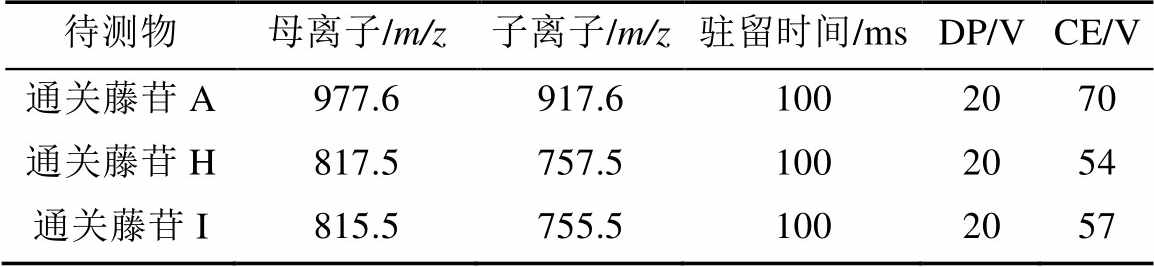
质谱采用电喷雾离子源(ESI源),多反应离子监测模式(multion reation monitoring,MRM);正离子扫描,源喷射电压为5 500 V,雾化气(gas 1)为60 psi,加热气(gas 2)为60 psi,帘气为20 psi,去溶剂温度为600 ℃;其余质谱分析参数见表1。
手动优化3种化合物的去簇电压(DP),设置DP起止0~200 V,步长为2 V,随着DP值的增加,响应逐渐降低,选择3种物质的DP为20 V。设定DP为20 V,手动调节碰撞能(CE),以便产生好的碎片信息。CE能量过高,会产生很多小碎片,而能量过低,母离子打不碎,得不到碎片信息。设置CE起止0~180 V,步长为1 V,选择各化合物响应最好的CE值,结果见表1。
表1 质谱参数
Tab. 1 Parameters of MS
精密称取各对照品适量,加甲醇溶解并定容至10 mL量瓶中,摇匀,配成通关藤苷A、H、I质量浓度分别为1.01,1.04,1.02 mg∙mL-1对照品贮备液,置4 ℃冰箱中保存。分别精密量取各对照品贮备液10 μL,置10 mL量瓶中,得10 μg∙mL-1的对照品溶液。精密吸取各对照品贮备液适量置同一量瓶中,用甲醇准确配制浓度均约为100 ng∙mL-1的混合对照品溶液。
精密量取消癌平注射液100 μL,置10 mL量瓶中,加甲醇稀释至刻度,摇匀;再取所得样品溶液100 μL置10 mL量瓶中,用甲醇稀释至刻度,摇匀;用0.22 μm微孔滤膜过滤,取澄清的续滤液作为供试品溶液。
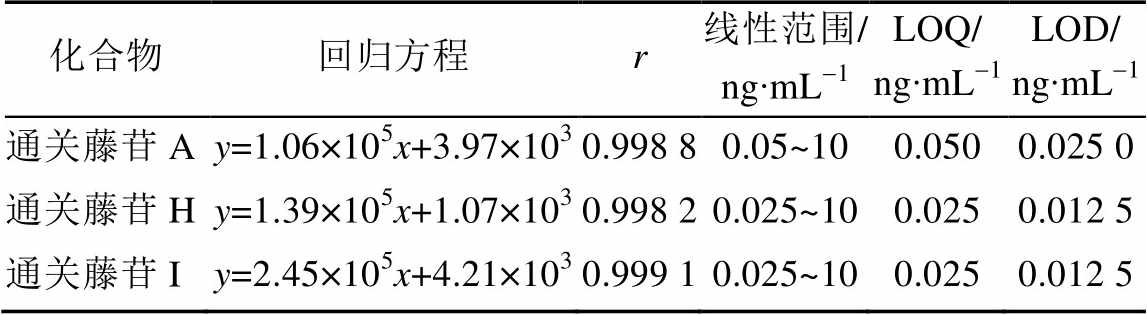
2.5.1 线性关系、定量限和检测限 取100 ng∙mL-1的混合对照品溶液,逐级稀释成浓度约为10,8,4,2,1,0.5,0.2,0.1,0.05,0.025 ng∙mL-1的系列线性工作溶液。按“2.1”项下色谱条件进样分析,记录峰面积。以对照品浓度x为横坐标,峰面积y为纵坐标,用加权(w=1/x)最小二乘法进行回归运算,得线性方程;将混合对照品溶液逐步稀释,分别以信噪比S/N=10和3时各对照品的量作为定量限(LOQ)和检测限(LOD),结果见表2。
表2 回归方程、线性范围、定量限和检测限
Tab. 2 Regression equations, correlation coefficients and linearity ranges, LOQs and LODs of the 3 compounds
2.5.2 仪器精密度试验 取1 ng∙mL-1混合对照品溶液,连续进样6次,按“2.1”项下色谱条件进样检测。通关藤苷A、H、I峰面积的RSD分别为7.1%,3.3%,3.6%,表明仪器精密度良好。
2.5.3 重复性试验 取同一供试品6份(批号:201603111),按“2.4”项下方法分别制备供试品溶液,按“2.1”“2.2”项下色谱、质谱条件进样检测,通关藤苷A、H、I峰面积的RSD分别为5.8%,4.2%,3.9%,表明方法的重复性良好。
2.5.4 稳定性试验 取同一批供试品(批号:201603111),分别于制备后0,4,8,12,24 h按“2.1”“2.2”项下色谱、质谱条件进行测定,通关藤苷A、H、I峰面积的RSD分别为5.1%,2.9%,3.1%。表明供试品溶液放置24 h稳定性良好。
2.5.5 加样回收率试验 精密量取3份同一批样品(批号:201603111)50 μL,分别置10 mL量瓶中,分别精密加入3个被测组分的对照品溶液适量,用甲醇稀释至刻度,摇匀。再取所得样品溶液100 μL置10 mL量瓶中,用甲醇稀释至刻度,摇匀;用0.22 μm微孔滤膜过滤,取续滤液进样分析,计算通关藤苷A、H、I的回收率,结果见表3。
表3 通关藤苷A、H、I的回收率测定结果(n=3)
Tab. 3 Result of recovery of the Tenacissoside A, Tenacissoside H and Tenacissoside I(n=3)

取3批消癌平注射液各3份,按“2.4”项下方法制备供试品溶液,按“2.1”“2.2”项下色谱、质谱条件进样检测,记录3种组分峰面积,据回归方程计算通关藤苷A、H、I的含量,结果见表4。
表4 消癌平中通关藤苷 A、H、I的含量测定结果(n=3)
Tab. 4 Contents of the Tenacissoside A, Tenacissoside H and Tenacissoside I in Xiaoaiping injection(n=3) μg∙mL-1

目前对于通关藤及其制剂质量控制方法的研究相对缺乏,文献中大多以绿原酸为指标[8-9]来评价消癌平制剂的质量,而通关藤的主要活性物质为C21甾体苷,且绿原酸在植物中广泛存在,代表性不足,因此有必要以通关藤苷如A、H、I等为指标建立通关藤制剂的质量标准。
通关藤皂苷A、I属于甾体皂苷类,在紫外末端有吸收。因此多数文献[3-4]报道采用HPLC对甾体类进行测定,但是采用末端吸收波长会受到较大干扰;且由于通关藤苷H没有紫外吸收,所以不能和其他成分同时检测。另一方面,中药成分复杂,采用液相色谱分析干扰较大,为达到合格的分离度,往往分析时间很长(>30 min)。
消癌平注射液中通关藤苷H、I等的质量浓度较低,LC-MS相对于HPLC-UV来说灵敏度更高、分析速度更快。有报道[6-7]采用LC-MS测定消癌平制剂中苷类成分,但是仅母离子监测,准确度不如MRM。
本研究采用UPLC-MS/MS技术,MRM模式,通过对色谱条件及质谱条件的优化,6 min内完成了对通关藤苷A、I、H的同时分析,检测灵敏度达到0.012 5~0.025 ng∙mL-1,方法简单、快速、准确,为消癌平注射液的质量控制提供了可靠手段。
REFERENCES
[1] 李迩娜, 王芳, 钦松, 等. 消癌平注射液抗肿瘤作用机制研究进展[J]. 中国中医药信息杂志, 2012, 19(9): 111-112.
[2] 白爽, 李奕诺, 徐鑫, 等. 通关藤化学成分及药理活性研究进展[J]. 解放军药学学报, 2015, 31(3): 260-264.
[3] XU K, QIAO J, HAN L, et al. HPLC determination of tenacissoside G and tenacissoside I in Marsdenia tenacissima from different origins [J]. Chin J Pharm Anal(药物分析杂志), 2016, 36(4): 607-610.
[4] ZHANG H, PEI Z D, JIANG H, et al. Simultaneous determination of tenacissosides A and D in Marsdeniae Tenacissimae Caulis by HPLC [J]. Chin J Pharm Anal(药物分析杂志), 2013, 33(6): 1037-1040.
[5] LI H L, LU Y, HU J Y, et al. Determination of tenacissoside H in Marsdeniae tenacissimae by HPLC-ELSD [J]. China J Chin Mater Med(中国中药杂志), 2010, 35(16): 2083-2086.
[6] XIE L Y, LIU S J, XU J, et al. Simultaneous determination of two major compound in Xiao Aiping injection by LC-MS [J]. Chin J Exp Tradit Med Form(中国实验方剂学杂志), 2012, 18(23): 90-93.
[7] LI Y, WANG H, LYU L, et al. Simultaneous determination of 3 major compounds in Xiaoaiping injection by HPLC-ESI/MS [J]. Acad J Guangdong Coll Pharm(广东药学院学报), 2015, 31(4): 462-465.
[8] LI C Y, MA Y, LI H M, et al. Optimization of extraction and concentration process for Xiaoaiping injection [J]. Chin Tradit Herb Drugs(中成药), 2016, 38(8): 1712-1715.
[9] ZHANG M, LI H R. The determination of chlorogenic acid content in Xiao’aiping oral liquid by liquid phase microextraction HPLC [J]. J Jilin Med Coll(吉林医药学院学报), 2015, 36(1): 15-17.
(本文责编:蔡珊珊)
Simultaneous determination of Tenacissoside A, Tenacissoside H and Tenacissoside I in Xiaoaiping injection by UPLC-MS/MS
DONG Zhanjun, AN Jing, WANG Qimin, SONG Haojing
(Department of Pharmacy, Hebei General Hospital, Shijiazhuang 050057, China)
ABSTRACT: OBJECTIVE to establish a method for the simultaneous determination of Tenacissoside A, Tenacissoside H and Tenacissoside I in Xiaoaiping injection by UPLC-MS/MS. METHODS The separation was performed on a Phenomenex Kinetex XB-C18 column(2.1 mm×50 mm, 2.6 μm) using the mobile phase of acetonitrile-0.1% formic acid solution at a flow rate of 0.2 mL∙min-1 in gradient elution mode. The detection was performed on a triple quadrupole tandem mass spectrometer by multiple reaction monitoring via electrospray ionization source in positive mode. RESULTS The linearity range of Tenacissoside A, Tenacissoside H and Tenacissoside I were 0.05-10 ng∙mL-1, 0.025-10 ng∙mL-1, 0.025-10 ng∙mL-1, respectively, with all correlation coefficient (r) >0.998. The limit detection was 0.012 5-0.025 ng∙mL-1 and the recoveries were 97.9%, 95.7%, 96.1%, respectively, with RSD <3.4%.CONCLUSION The proposed UPLC-MS/MS method is simple, rapidness, accurate, and sensitivity, can be used for the quantitative determination of Tenacissoside A, Tenacissoside H and Tenacissoside I in Xiaoaiping injection.
KEY WORDS: Xiaoaiping injection; Tenacissoside A; Tenacissoside H; Tenacissoside I; UPLC-MS/MS; content determination
中图分类号:R917.101
文献标志码:B
文章编号:1007-7693(2018)03-0396-03
DOI: 10.13748/j.cnki.issn1007-7693.2018.03.019
引用本文:董占军, 安静, 王祁民, 等. UPLC-MS/MS法同时检测消癌平注射液中通关藤苷A、I、H的含量[J]. 中国现代应用药学, 2018, 35(3): 396-398.
收稿日期:2017-07-30
基金项目:河北省医学科学研究重点课题计划(20170245)
作者简介:董占军,男,主任药师,硕导 Tel: (0311)85988604 E-mail: 13313213656@126.com