樟芝多糖通过CD4+CD25+Foxp3+调节性T细胞对小鼠非酒精性脂肪性肝病的保护作用
杨毅,张晓玲,官俏兵,郭丽,韩晨阳*
(嘉兴市第二医院,浙江 嘉兴 314001)
摘要:目的研究樟芝多糖通过CD4+CD25+Foxp3+调节性T细胞(Treg)的调控对小鼠非酒精性脂肪性肝病(NAFLD)的保护作用。方法高脂饮食构建小鼠NAFLD模型,设置对照组、模型组、低剂量组、高剂量组。樟芝多糖干预1~4周中每周流式细胞术检测外周血Treg细胞的比例,谷丙转氨酶(ALT)、谷草转氨酶(AST)的表达,外周血中转化生长因子β(TGF-β)、白介素-6(IL-6)的表达。樟芝多糖干预4周后,小鼠处死,取肝脏进行油红染色,Western blot法检测肝组织中TGF-β和Foxp3、Smad3蛋白的表达,RT-qPCR检测IL-6、TGF-β、Foxp3、Smad3的mRNA表达。结果高脂饮食喂养4周后成功构建NAFLD小鼠模型,且模型组中Terg比例显著低于对照组(P<0.05),樟芝多糖干预后Treg比例相比模型组显著增高(P<0.05),小鼠肝功能得到显著改善,外周血中TGF-β表达上调、IL-6的表达下调,肝组织中TGF-β和Foxp3、Smad3蛋白和mRNA均上调,而IL-6的mRNA表达下调。结论樟芝多糖可以通过Treg和TGF-β-Smad3信号对NAFLD起到保护作用,作用机制和免疫改善有关。
关键词:樟芝多糖;调节性T细胞;非酒精性脂肪性肝病
近年来,非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)的发病率在我国呈现上升趋势,NAFLD已经被公认为影响全球公共健康的重要问题之一。如果不加以干预,NAFLD会进一步发展为肝硬化、肝纤维化等更为严重的肝脏疾病。有报道称NAFLD形成过程存在免疫微环境的变化,调节性T细胞(regulatory T-cell,Treg)作为一种重要的调节性免疫细胞参与其重要的生理过程,对NAFLD的发生有着重要的意义,而Treg的比例变化和Foxp3的表达与NAFLD的进程有着密切的相关。樟芝作为台湾独有的一种多孔菌类,在当地被认为有着很好的保肝作用,对多种肝病有一定的治疗效果。课题组前期研究发现,樟芝中的多糖可以对免疫抑制的小鼠模型起到很好的免疫调节作用,所以在此基础上进一步研究樟芝多糖通过Treg的调节来治疗NAFLD,为此类多糖药物的研究提供支持。
1 材料
1.1 药物
樟芝粉末(杭州众芝康股份有限公司,批号:20160214)已过50目筛。乙醇、三氟乙酸、氯仿(国药试剂股份有限公司,纯度>99%);双蒸水(实验室自制)。高脂饮食(88%的普通饮食+10%的猪油+ 2%的胆固醇,北京博泰宏达生物技术有限公司)。
1.2 实验动物
清洁级小鼠40只,♀♂各半,体质量(20±2.0)g,购自浙江中医药大学动物实验中心,实验动物合格证号:SCXK(浙)2013-0184,小鼠分笼饲养,每笼5只。动物实验室温度为20~25 ℃,湿度为(70±5)%,依据国家标准啮齿类动物干燥饲料喂养,大鼠活动自由、摄食自由。
1.3 试剂
谷丙转氨酶(ALT)试剂盒、谷草转氨酶(AST)试剂盒、转化生长因子β(TGF-β)试剂盒、白介素-6(IL-6)试剂盒(南京建成生物工程研究所,批号分别为C009205、C010211、H034112、H007101);PCR引物合成(Takara公司);Trizol试剂(Invitrogen公司,批号:147240);FITC-CD4、APC-CD25、PE-Foxp3(美国eBioscience公司,批号分别为115202、121451、147122);淋巴细胞分离液(天津灏洋生物有限公司,批号:10771201);TGF-β和Foxp3、smad3蛋白一抗和HRP标记二抗(Abcam公司,批号:31031、20034、40854);RT-qPCR试剂盒(美国Bio-Rad公司,批号:110131)。
1.4 仪器
全自动生化分析仪(日本日立公司);电子分析天平(梅特勒-托里多仪器有限公司);DP11显微镜(日本奥林巴斯公司);PCR仪(美国Bio-Rad公司);流式细胞仪(美国BD公司)。
2 方法
2.1 樟芝多糖的提取
100 g樟芝粉末加入500 mL双蒸水,80 ℃回流提取2次,每次2 h。合并滤液后浓缩至150 mL,加入3倍体积的乙醇混匀后于4 ℃条件下静置12 h。抽滤获得沉淀。沉淀溶于100 mL热水,采用Sevag方法脱蛋白5次,调节乙醇浓度为90%,4 ℃静置12 h,获得的樟芝多糖按照上述水提醇沉方法提取2次,采用硫酸-蒽酮法测定总多糖,BCA法测定总蛋白含量。
2.2 动物建模和分组
实验用小鼠均用基础饲料适应性喂养1周,随机分为对照组、模型组、高剂量组、低剂量组,每组10只(♀♂各半),其中模型组和高剂量组、低剂量组给予高脂饮食喂养,同时对照组给予普通饮食喂养,所有动物均自由进食和饮水,活动自由。由于高脂成分可以在短时间中增加小鼠体质量,可以选择体质量为造模成功的间接标准,小鼠在第4周造模完成。
在造模完成后,高剂量组给予樟芝多糖以100 mg·kg-1·d-1进行给药,1 d 2次,每次50 mg·kg-1,而低剂量组给予50 mg·kg-1·d-1,1 d 2 次,每次25 mg·kg-1。对照组和模型组给予等剂量的生理盐水,给药方式均为灌胃给药,干预时间为4周。4组小鼠在用药期间均用普通饲料饲养,饮水、摄食、活动均自由。
2.3 检测指标
(1)樟芝多糖干预1~4周中每周流式细胞术检测外周血Treg细胞的比例:取小鼠眼内眦静脉丛取血1.0 mL,置于EDTA抗凝管,1 h内提取单个核细胞(peripheral blood monouclear cells,PBMC)。在无菌条件下将外周血进行1 500 r·min-1离心15 min,弃去上层血清,将血细胞沉淀加入生理盐水15 mL,均匀吹打后加入10 mL的淋巴细胞分离液。3 000 r·min-1离心30 min,小心吸取中间的单个核细胞层,转移至干净的无菌管中,1 500 r·min-1离心10 min,弃去上清液后用PBS洗2次,最后得到的细胞加入PBS均匀吹打制备成为混悬液,待检测。分别用FITC-CD4、APC-CD25、PE-Foxp3标记淋巴细胞,上机检测。
(2)ALT、AST的检测,外周血中转化生长因子β(TGF-β)和白介素-6 (IL-6)的表达检测,均按照说明书操作。
(3)在小鼠多糖干预4周后进行如下检测:取小鼠肝脏包埋、切片后进行油红染色观察小鼠肝脏病理变化。提取小鼠肝脏总蛋白,BCA定量后,Western blot法检测肝组织中TGF-β和Foxp3、Smad3蛋白的表达,提取总mRNA后,RT-qPCR检测IL-6、TGF-β、Foxp3、Smad3的mRNA表达。引物设计如下表1。
表1 引物序列
Tab. 1 Primer sequence

基因名称引物名称序列(5,-3,)bp GAPDH F primerR primerGGTTGTCTCCTGCGACTTCATGGTCCAGGTTTCTTACTCC220 TGF-β F primerR primerGACCGCAACAAGCAATCTATGTATTCCGTCTCCTTGGTTCAGC300 Foxp3 F primerR primerCACTGGGCTTCTGGGTATGTAGACAGGCCAGGGGATAGTT228 Smad3 F primerR primerAGGGCTTTGAGGCTGTCTACCGTCCAC GCTGGCATCTTCTG364 IL-6 F primerR primerTGGGAAATCGTGGAAATGAGCTCTGAAGGACTCTGGCTTTG254
2.4 数据处理和统计
实验数据均以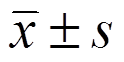 表示,用SPSS 17.0进行统计学处理,组间比较P<0.05视为差异有统计学意义。
表示,用SPSS 17.0进行统计学处理,组间比较P<0.05视为差异有统计学意义。
3 结果
3.1 樟芝多糖浓度及所含蛋白测定结果
硫酸-蒽酮法测定总多糖,BCA法测定总蛋白含量,结果显示樟芝多糖含量为85%,蛋白含量为18.7 mg·g-1。
3.2 小鼠肝功能指标ALT、AST的变化
模型组相比对照组血清中ALT和AST的表达显著增高(P<0.05),而樟芝多糖干预后表达降低,与模型组比较具有显著性差异(P<0.05)。结果见表2~3。
3.3 小鼠外周血中TGF-β和IL-6的表达
模型组TGF-β表达显著低于对照组(P<0.05)而IL-6则高于对照组。樟芝多糖干预后,TGF-β的表达显著增高,而IL-6表达降低,与模型组比较具有显著差异(P<0.05)。结果见表4~5。
3.4 小鼠外周血中CD4+CD25+Foxp3+Treg的比例变化
相比对照组,模型组中Treg的比例显著降低(P<0.05),而樟芝多糖干预后Treg的比例得到显著的提高,相比模型组具有显著差异(P<0.05)。结果见表6。
表2 小鼠血清ALT的表达变化(n=10,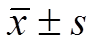 )
)
Tab. 2 The expression of ALT in mice serum(n=10,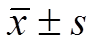 )
)
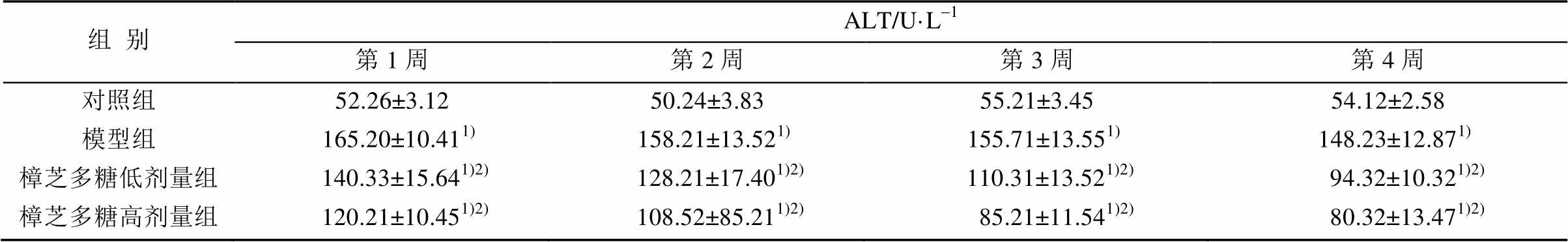
组别ALT/U·L-1 第1周第2周第3周第4周 对照组52.26±3.1250.24±3.8355.21±3.4554.12±2.58 模型组 165.20±10.411) 158.21±13.521) 155.71±13.551) 148.23±12.871) 樟芝多糖低剂量组 140.33±15.641)2) 128.21±17.401)2) 110.31±13.521)2) 94.32±10.321)2) 樟芝多糖高剂量组 120.21±10.451)2) 108.52±85.211)2) 85.21±11.541)2) 80.32±13.471)2)
注:与对照组比较,1)P<0.05;与模型组比较,2)P<0.05。
Note: compared with the control group,1)P<0.05; compared with the model group,2)P<0.05.
表3 小鼠血清AST的表达变化(n=10,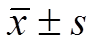 )
)
Tab. 3 The expression of AST in mice serum(n=10,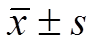 )
)

组别AST/U·L-1 第1周第2周第3周第4周 对照组112.50±11.20110.31±10.00113.51±11.23115.40±13.50 模型组 265.21±21.111) 270.20±24.501) 258.60±13.851) 243.21±20.351) 樟芝多糖低剂量组 225.31±13.251)2) 203.74±14.541)2) 187.21±15.241)2) 166.85±20.141)2) 樟芝多糖高剂量组 214.21±15.851)2) 180.23±17.521)2) 162.31±15.771)2) 145.28±19.521)2)
注:与对照组比较,1)P<0.05;与模型组比较,2)P<0.05。
Note : Compared with the control group,1)P<0.05; compared with the model group,2)P<0.05.
表4 小鼠外周血中TGF-β的表达变化(n=10,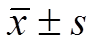 )
)
Tab. 4 The expression of TGF-β in peripheral blood of mice(n=10,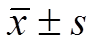 )
)

组别TGF-β/pg·mL-1 第1周第2周第3周第4周 对照组215.31±12.33212.23±18.57213.54±20.41223.51±18.77 模型组 52.12±13.211) 50.41±15.851) 53.20±20.131) 48.52±18.771) 樟芝多糖低剂量组 63.21±18.221)2) 88.33±17.311)2) 103.63±13.541)2) 123.54±15.331)2) 樟芝多糖高剂量组 85.32±11.251)2) 110.20±17.801)2) 135.65±22.101)2) 167.33±18.731)2)
注:与对照组比较,1)P<0.05;与模型组比较,2)P<0.05。
Note: Compared with the control group,1)P<0.05; compared with the model group,2)P<0.05.
表5 小鼠外周血中IL-6的表达变化(n=10,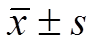 )
)
Tab. 5 The expression of IL-6 in peripheral blood of mice(n=10,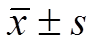 )
)

组别IL-6/pg·mL-1 第1周第2周第3周第4周 对照组32.52±7.31 35.21±11.2034.71±8.2130.25±9.21 模型组 98.52±14.211) 102.21±12.581) 100.36±10.581) 108.52±13.621) 樟芝多糖低剂量组 82.36±14.501)2) 73.36±13.211)2) 64.21±14.331)2) 56.31±13.771)2) 樟芝多糖高剂量组 77.31±8.311)2) 66.25±10.521)2) 51.32±13.211)2) 45.31±11.331)2)
注:与对照组比较,1)P<0.05;与模型组比较,2)P<0.05。
Note : Compared with the control group,1)P<0.05; compared with the model group,2)P<0.05.
表6 小鼠外周血中Treg的比例变化(n=10,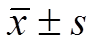 )
)
Tab. 6 The proportion of Treg in peripheral blood of mice(n=10,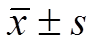 ) %
) %

组别第1周第2周第3周第4周 对照组10.20±0.829.86±0.639.35±0.509.67±0.67 模型组 3.21±0.521) 3.05±0.481) 2.98±0.631) 3.10±0.491) 樟芝多糖低剂量组 3.95±0.501)2) 4.83±0.611)2) 5.13±0.711)2) 6.43±0.641)2) 樟芝多糖高剂量组 4.53±0.341)2) 5.36±0.701)2) 6.32±0.531)2) 7.80±0.831)2)
注:与对照组比较,1)P<0.05;与模型组比较,2)P<0.05。
Note: Compared with the control group,1)P<0.05; compared with the model group,2)P<0.05.
3.5 小鼠肝组织油红染色的结果
对照组小鼠油红染色呈阴性,而模型组小鼠呈强阳性,说明NAFLD小鼠模型构建成功,小鼠肝组织发生脂肪性病变,而高剂量组和低剂量组有红染色结果显示弱阳性(相比模型组),以油红阳性面积利用Image J软件进行半定量分析,结果暗示,模型组小鼠阳性面积显著高于对照组和樟芝多糖干预组。结果见图1。
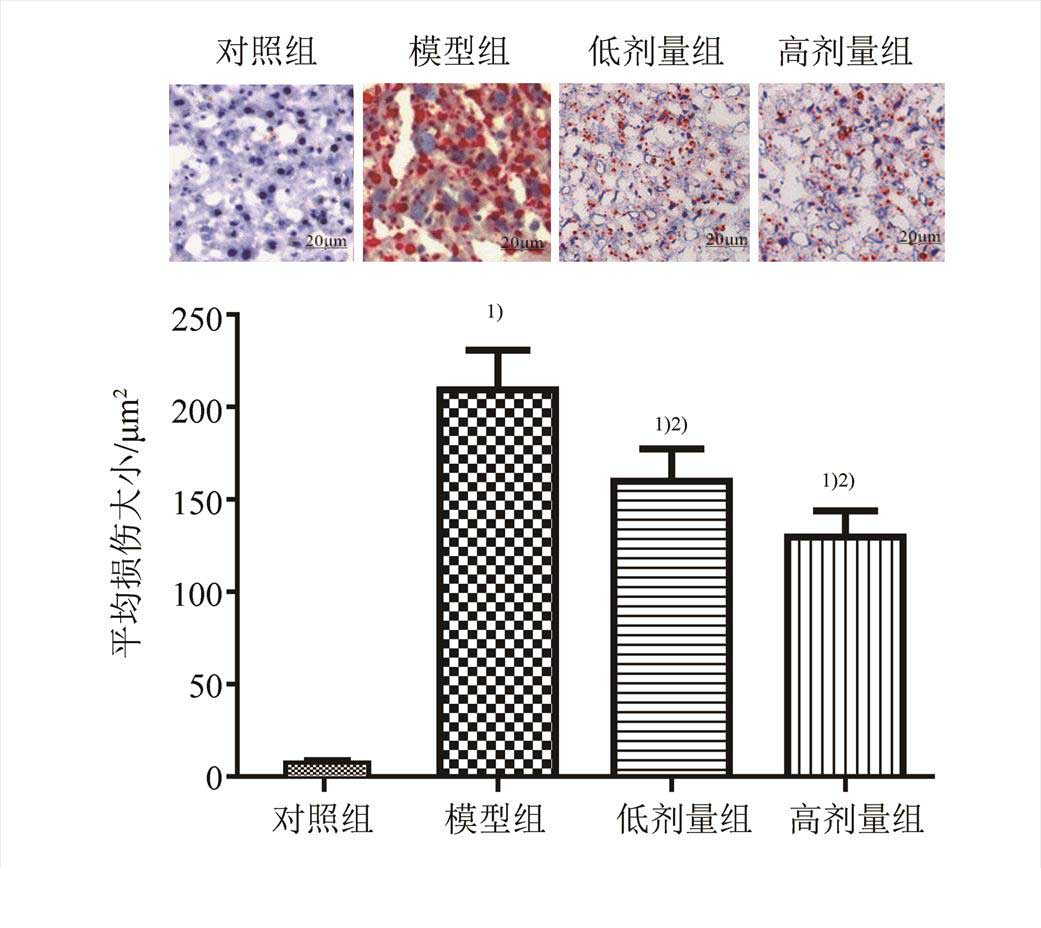
图 1 小鼠肝组织油红染色结果
与 对照组比较,1)P<0.05;与模型组比较,2)P<0.05。
Fig. 1 Liver tissue oil red staining results
Compared with the control group,1)P<0.05; compared with the model group2)P<0.05.
3.6 Western blot检测小鼠肝组织中TGF-β、Foxp3和Smad3的表达
模型组中TGF-β、Foxp3和Smad3的表达显著低于对照组(P<0.05),而高剂量组和低剂量组中TGF-β、Foxp3和Smad3的表达显著增高(P<0.05)。说明樟芝多糖增强了TGF-β-Smad3信号的表达。结果见图2。
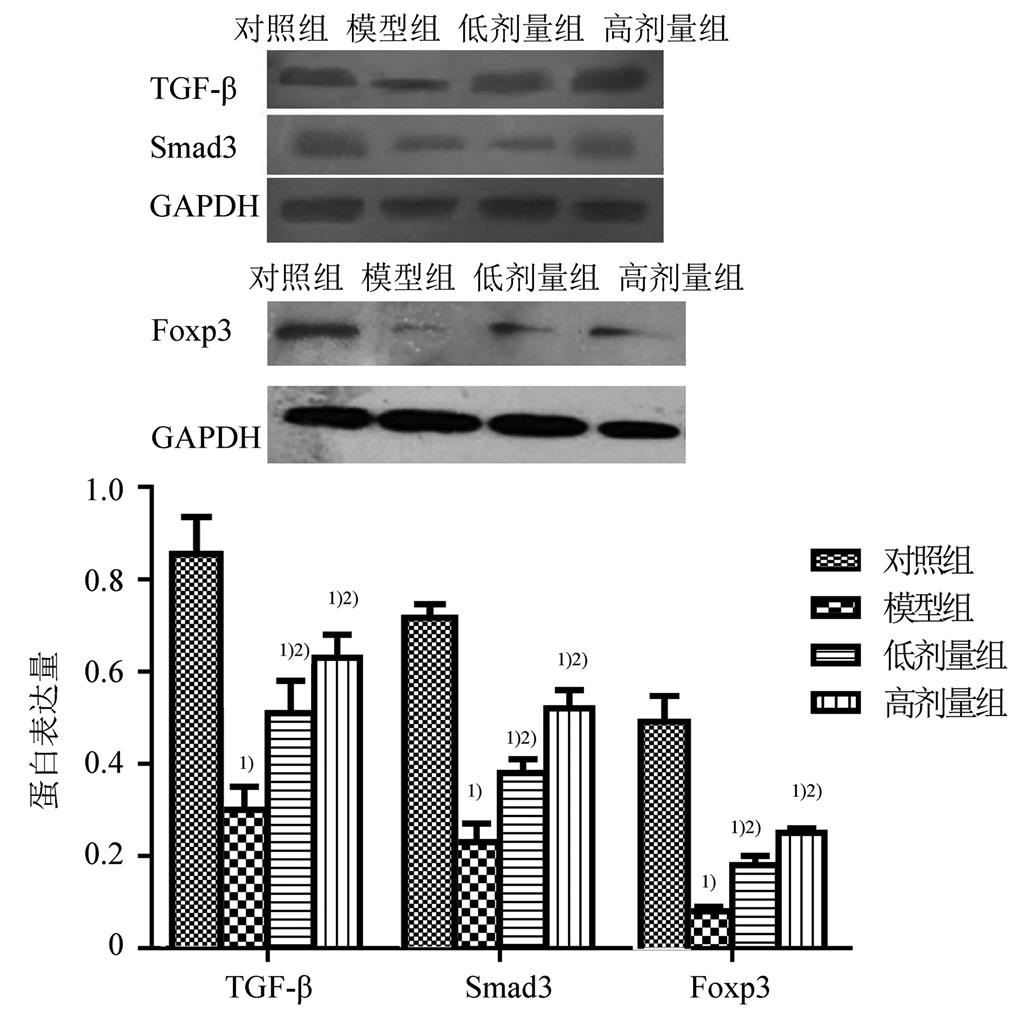
图2 小鼠肝组织中TGF-β、Foxp3和Smad3的表达(n=3)
与 对照组比较,1)P<0.05;与模型组比较,2)P<0.05。
Fig. 2 The expression of TGF-β、Foxp3 and Smad3 in liver tissue of mice(n=3)
Compared with the control group,1)P<0.05; compared with the model group,2)P<0.05.
3.7 RT-qPCR检测小鼠肝组织中TGF-β、Foxp3、Smad3和IL-6的mRNA表达
设计引物序列见表1,与对照组比较,模型组中TGF-β、Foxp3、Smad3的mRNA表达下调,而IL-6的mRNA表达上调(P<0.05),樟芝多糖干预后,TGF-β、Foxp3、Smad3的mRNA表达上调,而IL-6 mRNA表达下调,对比模型组具有显著性差异(P<0.05),结果见表7。
表7 小鼠肝组织中TGF-β、Foxp3、Smad3和IL-6的mRNA表达(n=10,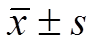 )
)
Tab. 7 The mRNA expression of TGF-β, Foxp3, Smad3 and IL-6 in liver tissue of mice(n=10,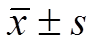 )
)

组别TGF-βSmad3Foxp3IL-6 对照组0.76±0.040.80±0.050.63±0.040.96±0.10 模型组 0.38±0.031) 0.26±0.071) 0.14±0.011) 1.48±0.131) 樟芝多糖高剂量组 0.60±0.081)2) 0.67±0.061)2) 0.35±0.011)2) 1.13±0.141)2) 樟芝多糖低剂量组 0.46±0.071)2) 0.52±0.031)2) 0.22±0.021)2) 1.27±0.111)2)
注:与对照组比较,1)P<0.05;与模型组比较,2)P<0.05。
Note: compared with the control group,1)P<0.05; compared with the model group,2)P<0.05.
4 讨论
樟芝作为一种台湾独有的多孔菌类,具有较好的安神、祛风行气、活血化瘀的作用,民间常用于腹痛、肝癌、肝炎等的治疗,是上等的食用/药用真菌[1-3]。目前在关于保肝作用的研究中发现,樟芝的固培物和液培物及其提取物都有很好的保肝作用,可以降低小鼠急性肝损伤的肝酶水平,还可以提高GSH表达[4]。在免疫研究中发现,樟芝多糖对免疫抑制性小鼠有着免疫增强作用。
近年来,随着人们饮食习惯的变化,肥胖、糖尿病等代谢性疾病的发病率呈现上升趋势,而脂类代谢紊乱是直接造成NAFLD的重要原因之一[5-7],但是免疫病理在NAFLD发生发展中的作用机制还未被阐明。Treg是近年来发现的一种CD4+T细胞的亚群,具有重要的免疫调节作用,可以通过细胞因子(TGF-β)发挥抑制免疫T细胞活化、维持免疫耐受的作用[8-9]。NAFLD被认为是导致慢性肝炎、肝纤维化的一种常见病因,其中炎症反应的发生和NAFLD具有直接的关系。
本实验发现高脂饮食构建的NAFLD小鼠模型中,Treg的比例显著下调,与此同时,Foxp3表达也下调,与其密切相关的TGF-β及其受体Smad3表达也同样下调,这说明NAFLD小鼠肝脏中氧化应激损伤可以导致Treg的凋亡,而且还可以抑制其活化关键蛋白Foxp3和关键信号通路TGF-β-smad3[10-11],这一系列反应导致肝脏中对炎性反应的抑制性降低。IL-6是Treg发挥作用的一种重要炎性因子,已经发现其在病毒性肝炎、酒精性肝炎中发挥着重要的作用[12-13],而NAFLD小鼠中同样存在IL-6的高表达。这一系列的病理变化说明Treg的免疫失调和炎症因子的表达增高引起了NAFLD的发生和发展。
在本研究中发现,樟芝多糖可以改善小鼠肝功能,小鼠AST和ALT的表达显著下调,高剂量的樟芝多糖相比低剂量多糖效果更好。而在外周血指标检测中发现,樟芝多糖可以提高Treg的比例,在1~4周中,Treg随着时间延长比例逐渐升高,外周血中TGF-β同样呈现出上调趋势,而IL-6则表达下降,这说明樟芝多糖提高了小鼠的免疫调节能力,降低了炎症因子的表达,激活了TGF-β信号,这一系列结果都和Treg的表达呈现正相关。小鼠肝组织的油红染色结果显示NAFLD小鼠中呈现强阳性,而樟芝多糖干预后肝脏中脂类含量显著下调,阳性减弱。通过Western blot实验发现樟芝多糖干预后TGF-β、Foxp3和Smad3的表达显著增高,由于Foxp3是Treg活化的关键因子,而TGF-β-smad3信号通路和Treg的增殖、活化也有重要的作用,所以两者表达增高可以说明Treg确实得到了增殖和活化,樟芝多糖的保肝作用和Treg有着密切的关系。
综上所述:樟芝多糖可以通过对Treg的调节发挥NAFLD的保护作用,可以降低肝酶的表达,炎症因子IL-6的表达,以及提高TGF-β、Smad3、Foxp3的表达。
REFERENCES
[1] LU M, EL-SHAZLY M, WU T Y, et al. Recent research and development of Antrodia cinnamomea [J]. Pharmacol Ther, 2013, 139(2): 124-156.
[2] WANG L P, LU X L, ZHAO Z J. Overview of Antrodia camphorata research[J]. Pharm Today(今日药学), 2017, 27(2): 140-144.
[3] DU Y, WU T, CHANG F, et al. Chemical profiling of the cytotoxic triterpenoid-concentrating fraction and characterization of ergostane stereo-isomer ingredients from Antrodia camphorata [J]. J Pharm Biomed Anal, 2012(58): 182-192.
[4] KER Y B, PENG C C, CHANG W L, et al. Hepatoprotective bioactivity of the glycoprotein, antrodan, isolated from Antrodia cinnamomea mycelia [J]. PLoS One, 2014, 9(4): e93191.
[5] TSAI M C, SONG T Y, SHIH P H, et al. Antioxidant properties of water-soluble polysaccharides from Antrodia cinnamomea in submerged culture [J]. Food Chem, 2007, 104(3): 1115-1122.
[6] SHAO Y D, ZHAO Y M, PAN J M, et al. Effect of apigenin on inflammatory response and insulin resistance of LO2 cell nonalcoholic steatohepatitis model [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2015, 32(11): 1309-1312.
[7] HU W Y, MA X H, LI X X, et al. Progress of potential drugs in non-alcohol fatty liver disease [J]. Chin J New Drugs(中国新药杂志), 2017, 26(14): 1661-1666.
[8] BIREBENT B, LORHO R, LECHARTIER H, et al. Suppressive properties of human CD4+CD25+regulatory T cells are dependent on CTLA-4 expression [J]. Eur J Immunol, 2004, 34(12): 3485-3496.
[9] SHAO Y D, SHI T T, ZHAO Y M, et al. Study ofn-acetylcysteine's anti-nonalcoholic steatohepatitis activityin vitro[J]. Chin J Mod Appl Pharm(中国现代应用药学), 2017, 34(2): 200-203.
[10] WORKMAN C J, VIGNALI D A. Negative regulation of T cell homeostasis by lymphocyte activation gene-3 (CD223) [J]. J Immunol, 2005, 174(2): 688-690.
[11] TANIGUCHI H , KATO N, OTSUKA M, et al. Hepatitis C virus core protein upregulates transforming growth factor-beta 1 transcription [J]. J Med Virol, 2004, 72(1): 52-59.
[12] BOURD-BOITTIN K, BONNIER D, LEYME A, et al. Protease profiling of liver fibrosis reveals the ADAM metallopeptidase with thrombospondin type 1 motif, 1 as a central activator of transforming growth factor beta [J]. Hepatology, 2011, 54(6): 2173-2184.
[13] MA Q P, LI L. Significance of the changes of CD4+CD25+Foxp 3 T cells in patients with the level of non-alcoholic fatty liver disease [J]. Chin J Clin Gastroenterol(临床消化病杂志), 2011, 23(5): 289-291.
(本文责编:李艳芳)
Protective Effect of Polysaccharide from Antrodia Camphorata on NAFLD Mice via CD4+CD25+Foxp3+Treg
YANG Yi, ZHANG Xiaoling, GUAN Qiaobin, GUO Li, HAN Chenyang*
(The Second Hospital of Jiax ing, Jiaxing 314001, China)
ABSTRACT: OBJECTIVETo study the protective effect of polysaccharide from antrodia camphorata on nonalcoholic fatty liver disease (NAFLD) in mice by regulatory T-cell (Treg) controled.METHODSThe model of NAFLD mice was established by high fat diet, and setted up the control group, model group, low dose group and high dose group. The proportion of Treg cells in peripheral blood were detected by flow cytometry and detect the expression of alanine aminotransferase (ALT), aspartate aminotransferase (AST), transforming growth factor beta (TGF-β) and interleukin-6 (IL-6) expression in 1-4 weeks. After 4 weeks, the mice were killed and the liver was stained with oil red staining. The expression of TGF-β, Foxp3 and Smad3 proteins in liver tissue were detected by Western blot. RT-qPCR was used to detect the mRNA expression of IL-6, TGF-b, Foxp3 and Smad3.RESULTSNAFLD mice model was successfully constructed after 4 weeks fed with high fat diet, and the proportion of Treg in model group was significantly lower than that in control group(P<0.05). Compared with the model group, the proportion of Treg increased significantly(P<0.05). The liver function of mice was significantly improved. The expression of TGF-β increased and IL-6 decreased in peripheral blood. The levels of TGF-β, Foxp3, Smad3 mRNA were up-regulated in liver tissues, whereas the expression of IL-6 mRNA was down.CONCLUSIONThe polysaccharide from antrodia camphorata can protect NAFLD via Treg and TGF-β-Smad3 signal pathway. The mechanism of action is related to immune improvement.
KEY WORDS:antrodia camphorate; regulatory T-cell (Treg); non-alcoholic fatty liver disease(NAFLD)
中图分类号:R285.4
文献标志码:A
文章编号:1007-7693(2018)03-0382-06
DOI:10.13748/j.cnki.issn1007-7693.2018.03.016
引用本文:杨毅, 张晓玲, 官俏兵, 等. 樟芝多糖通过CD4+CD25+Foxp3+调节性T细胞对小鼠非酒精性脂肪性肝病的保护作用[J]. 中国现代应用药学, 2018, 35(3): 382-387.
收稿日期:2017-07-25
作者简介:杨毅,男,硕士,副主任药师 Tel: 13967351048 E-mail: wasd911@126.com
*通信作者:韩晨阳,男,硕士,药师 Tel: 13736496736 E-mail: 691513770@qq.com

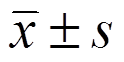 表示,用SPSS 17.0进行统计学处理,组间比较P<0.05视为差异有统计学意义。
表示,用SPSS 17.0进行统计学处理,组间比较P<0.05视为差异有统计学意义。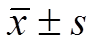 )
)






