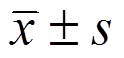 表示,多组间均数比较采用方差分析,所有数据均由SPSS 17.0统计软件进行处理,P<0.05为差异具有统计学意义。
表示,多组间均数比较采用方差分析,所有数据均由SPSS 17.0统计软件进行处理,P<0.05为差异具有统计学意义。童晔玲,戴关海*,任泽明,陈璇,聂晓静,杨锋
(浙江省中医药研究院,杭州 310007)
摘要:目的体外观察杨梅醇与5-对氟苄氧基杨梅醇(myricanol 5-fluorobenzyloxy ether,5FEM)对人肝癌细胞HepG2活性的影响。方法制备杨梅醇与5FEM,杨梅醇(25,12.5,6.25 μg·mL-1)、5FEM(25,12.5,6.25 μg·mL-1)作用于HepG2细胞,实时细胞分析系统记录96 h细胞指数,观察杨梅醇与5FEM对HepG2细胞增殖和迁移的影响。结果杨梅醇与5FEM对HepG2细胞的增殖和迁移均有较好的抑制作用,且呈现较好的量效关系,相等剂量下,5FEM的作用优于杨梅醇。结论杨梅醇与5FEM能有效抑制HepG2细胞的增殖和迁移。
关键词:杨梅醇;5-对氟苄氧基杨梅醇;人肝癌HepG2细胞;细胞增殖;细胞迁移
杨梅(Myrica rubraSieb.et Zucc)系杨梅科杨梅属植物,有较好的药用和食用价值。杨梅树皮味苦、性温,含有黄酮类、环状二芳基庚烷类、单宁类、三萜类等多种化合物[1],具有抗病毒、抗菌、抗氧化、抗炎、抗肿瘤等活性[2-5]。杨梅醇是从杨梅树皮中提取的环状二芳基庚烷类化合物,笔者前期研究发现杨梅醇具有显著的抗肿瘤活性,对人肺腺癌A549、人早幼粒白血病HL-60、人肝癌HepG2细胞均有较好的抑制作用[6-7]。现将结构修饰后的5-对氟苄氧基杨梅醇(myricanol 5-fluorobenzyloxy ether,5FEM)与杨梅醇的抗HepG2活性进行比较。
杨梅醇与5FEM均为本实验室制备;杨梅醇对照品(云南西力生物技术有限公司,批号:BBP01843;纯度:98%)。
人肝癌HepG2细胞(中国科学院细胞库),本实验室液氮保存。
RPMI-1640培养液(吉诺生物医药技术有限公司,批号:16011505);胎牛血清(浙江天杭生物科技股份有限公司,批号:20160323);0.25%胰蛋白酶(含0.02%EDTA,吉诺生物医药技术有限公司,批号:2016062902);PBS(吉诺生物医药技术有限公司,批号:2016061304);0.4%台盼蓝(Sigma公司,批号:20151025);甲苯、无水乙醇、石油醚、碳酸钾(K2CO3)、丙酮、氯仿(CHCl3)、碳酸铯(Cs2CO3)、氢氧化钠(NaOH)、二氯甲烷(DCM)、二甲基亚砜(DMSO)、盐酸、无水硫酸镁、丙酮等均为分析纯,由汇普化工仪器有限公司提供。
RE2000A型旋转式减压蒸发仪(成都市蜀华西部科技中心有限公司);Centrifuge 5810R低温离心机(Eppendorf 公司);BS210S电子天平(Sartorius公司);层析柱(江苏建湖玻璃有限公司);SKB-Ⅲ型水泵(河南太康科教器材厂);waters H-class超高效液相色谱仪(美国Waters公司);核磁氢谱分析仪:Varian AS 400 FT-NMR specctrometer (400.13 MHz,美国Varian);3111型CO2培养箱(Thermo公司);HR40-Ⅱ-A2型医用净化工作台(青岛海尔特种电器有限公司);CK40-F200型倒置显微镜(日本OLYMPUS公司);xCELLigence RTCA DP多功能实时无标记细胞分析仪、E-Plate 16(批号:20160310)、CIM-Plate 16检测板(批号:20160308)均来自艾森生物(杭州)有限公司;超低温冰箱(Thermo公司);TC-20细胞计数仪(Bio-Rad公司)。
取干燥清洁的杨梅树皮药材1 000 g,剪碎,置于蒸馏烧瓶中,加3 000 mL的80%乙醇,80 ℃水浴回流提取2次,每次2 h,合并2次提取液,过滤,滤液减压浓缩,回收乙醇,干燥,得醇提物,醇提物加水热溶后,依次用1.6倍量石油醚、氯仿各萃取2次,合并各萃取液,分别于旋转蒸发仪上80 ℃回收溶剂,真空减压干燥至恒重,得氯仿萃取物,再用凝胶柱结合用TLC、UPLC分离得到杨梅醇。
在圆底烧瓶中加入杨梅醇0.05 g,溶于5 ml丙酮中,搅拌溶解,加入K2CO30.063 g,搅拌1 h后,加入4-氟苄溴0.085 g,避光、室温下反应。TLC检测反应至杨梅醇点消失。将得到的反应液用旋转蒸发仪蒸去溶剂,加入0.1 g硅胶拌样。取300~400目硅胶装柱,压实后用石油醚压柱3次,将拌好的样品用刮刀刮出(尽量刮净),装样。用石油醚-乙酸乙酯(3∶1)做层析液,连续收集层析液,点板确定所含产品的纯度,收集层析液,合并,旋干。旋干后得到的黄色固体即为5FEM。
人肝癌HepG2细胞用含10%胎牛血清的1640培养液,置37 ℃、5% CO2培养箱中培养,取对数生长期的细胞用台盼蓝染色,检测细胞存活率≥95%,即可用于实验。
倒置显微镜观察经杨梅醇与5FEM作用后的细胞形态学改变。
取对数生长期的HepG2细胞,胰酶消化后制成单细胞悬液,调整细胞浓度为5×104·mL-1,先在E-Plate板上每孔放入50 μl培养基测基线,随后加入100 μl细胞悬液,置37 ℃、5% CO2培养箱中培养24 h,记录细胞指数(cell index,CI)。24 h后加入杨梅醇(25,12.5,6.25 µg·mL-1)和5FEM(25,12.5,6.25 μg·mL-1),同时设正常对照组、5-FU 10 μg·mL-1组,每组设3复孔,继续培养72 h,记录CI值。
取对数生长期的HepG2细胞,胰酶消化后制成单细胞悬液,调整细胞浓度为4×105·mL-1,先在CIM-Plate板下室每孔放入165 μl含血清培养基,随后装配上室后加入30 μl无血清培养基测基线,再加入100 μl无血清细胞悬液,置37 ℃、5% CO2培养箱中培养24 h,记录CI值。24 h后加入杨梅醇(25,12.5,6.25 µg·mL-1)和5FEM(25,12.5,6.25 μg·mL-1),同时设正常对照组、5-FU 10 µg·mL-1组,每组设3复孔,继续培养72 h,记录CI值。
各组数据用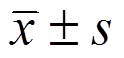 表示,多组间均数比较采用方差分析,所有数据均由SPSS 17.0统计软件进行处理,P<0.05为差异具有统计学意义。
表示,多组间均数比较采用方差分析,所有数据均由SPSS 17.0统计软件进行处理,P<0.05为差异具有统计学意义。
分离得到杨梅醇的纯度为98.2%,5FEM为 0.057 g,5FEM核磁氢谱图见图1。
细胞经杨梅醇与5FEM处理48 h后,镜下均可见细胞由贴壁不同程度脱落,光镜下见细胞变圆,体积缩小,细胞质内可见较多颗粒,并出现片状无细胞生长区。对照组细胞呈多角形,贴壁生长,几乎无脱落,光镜下见细胞完整,胞质饱满,相邻细胞生长融合成片。结果见图2。
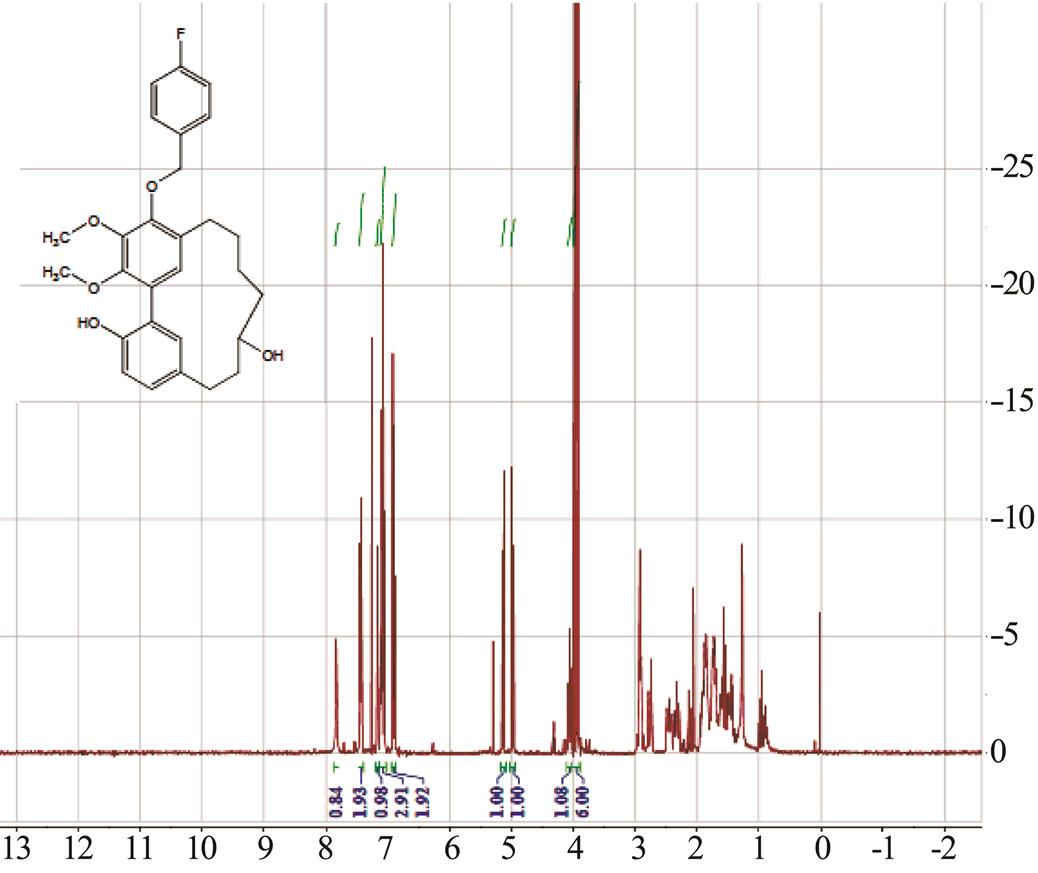
图1 5FEM核磁氢谱图
Fig. 1 5FEMnuclear magnetic spectrum
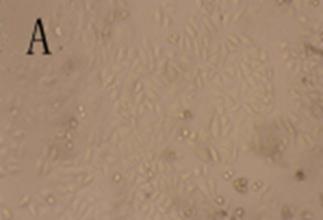
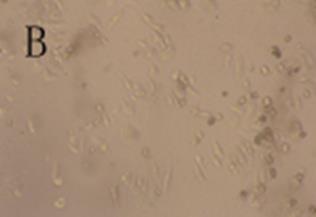

图2 细胞形态学观察(100×)
A-对照组;B-杨梅醇12.5 μg·mL-1;C-5FEM 12.5 μg·mL-1。
Fig. 2 Cell morphological observation(100×)
A-control group; B-myricanol group(12.5 μg·mL-1); C-5FEM group (12.5 μg·mL-1).
给药后,杨梅醇(25,12.5,6.25 μg·mL-1)、5FEM(25,12.5,6.25 μg·mL-1)组的CI值均低于正常对照组,且呈剂量相关性。结果见图3。
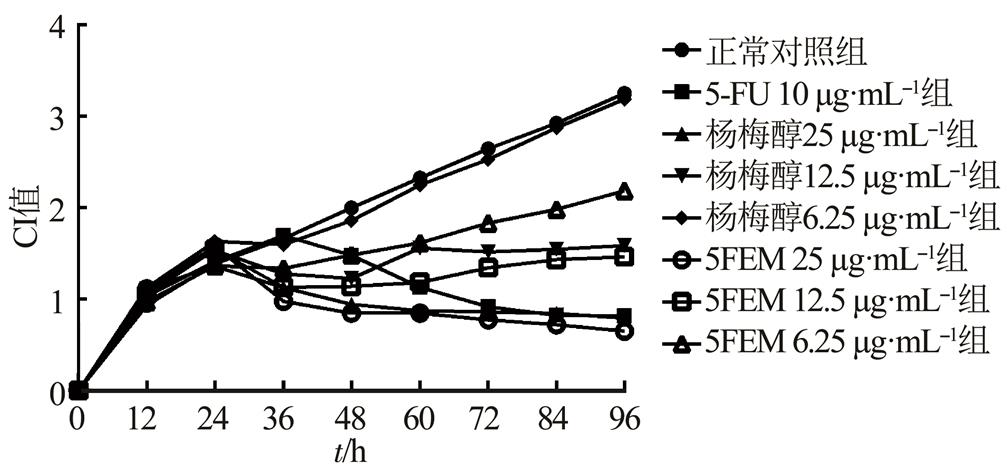
图3 杨梅醇和5FEM对HepG2细胞增殖的影响
Fig. 3 The effect of myricanol and 5FEM on cell proliferation
给药后24,48 h,与正常对照组相比,杨梅醇(25,12.5 μg·mL-1)、5FEM(25,12.5,6.25 μg·mL-1)组的CI值均显著减低(P<0.01)。与5-FU组相比,杨梅醇(25,12.5 μg·mL-1)和5FEM(25,12.5 μg·mL-1) 的24 h CI值明显降低(P<0.01);杨梅醇25 μg·mL-1组与5FEM 25 μg·mL-1组的48 h CI值显著降低(P<0.01)。结果见表1。
给药后,杨梅醇(25,12.5,6.25 μg·mL-1)、5FEM(25,12.5,6.25 μg·mL-1)组的CI值均低于正常对照组,且呈剂量相关性。结果见图4。
表1 杨梅醇和5FEM对HepG2细胞增殖的影响(n=3,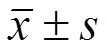 )
)
Tab. 1 The effect of myricanol and 5FEM on cell proliferation(n=3,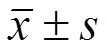 )
)
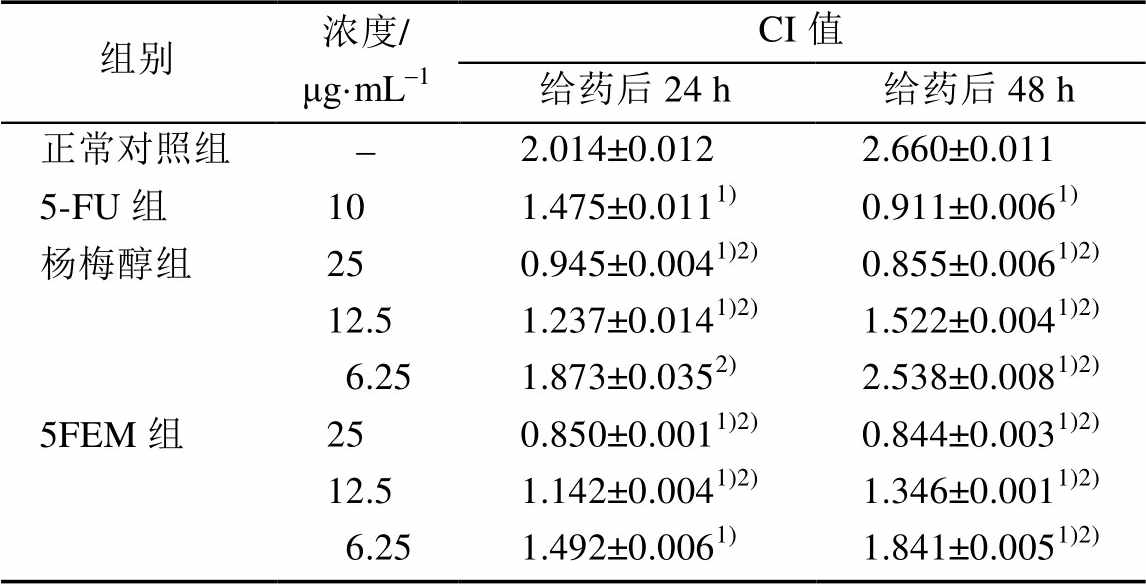
注:与正常对照组相比,1)P<0.01;与5-FU组相比,2)P<0.01。
Note: Compared with control group,1)P<0.01; compared with 5-FU group,2)P<0.01.
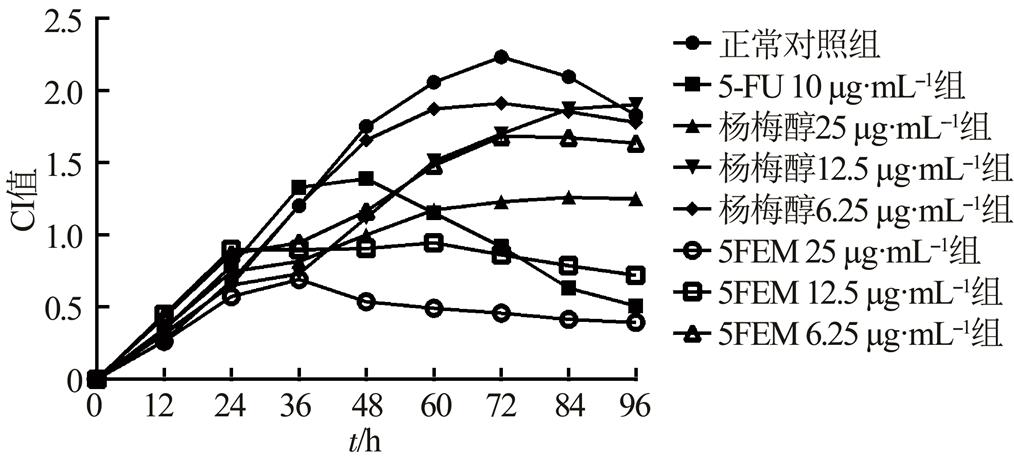
图4 杨梅醇和5FEM对HepG2细胞迁移的影响
Fig. 4 The effect of Myricanol and 5FEM on cell migration
给药后24,48 h,与正常对照组相比,杨梅醇(25,12.5 μg·mL-1)、5FEM(25,12.5,6.25 μg·mL-1)组的CI值显著减低(P<0.01)。与5-FU组相比,杨梅醇(25,12.5 μg·mL-1)和5FEM(25,12.5,6.25 μg·mL-1) 的24 h CI值明显降低(P<0.01);杨梅醇25 μg·mL-1和5FEM(25,12.5 μg·mL-1)的48 h CI值显著降低(P<0.01)。结果见表2。
表2 杨梅醇和5FEM对HepG2细胞迁移的影响(n=3)
Tab. 2 The effect of myricanol and 5FEM on cell migration(n=3)
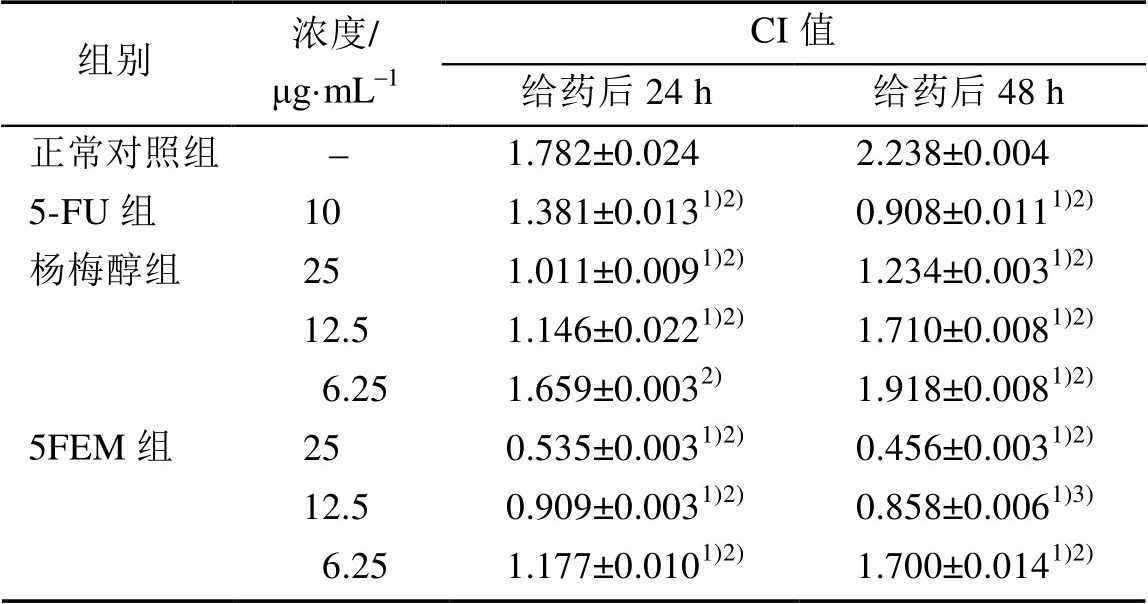
注:与正常对照组相比,1)P<0.01;与5-FU组相比,2)P<0.01,3)P<0.05。
Note: Compared with control group,1)P<0.01; compared with 5-FU group,2)P<0.01,3)P<0.05.
杨梅醇属于环状二芳基庚烷类化合物,在杨梅树皮中含量丰富(达到0.7%),杨梅醇具有多种生物学活性,包括逆转阿尔茨海默氏病[8]、抑制一氧化氮的产生[9]、预防肝损伤[10]、抗雄激素活性[11]、诱导肿瘤细胞凋亡[12]等作用。
目前,对杨梅醇的结构修饰仍处于初步研究阶段,而对杨梅醇进行结构修饰用于抗肿瘤的研究仍是一片空白。本课题组通过结构修饰得到了25个杨梅醇衍生物,并获得了相关专利[13]。课题组前期研究发现,不同剂量的杨梅醇、5-苄氧基杨梅醇、5FEM及5-对溴苄氧基杨梅醇(3.13~ 100.0 μg·mL-1)对A549、HepG2及HL-60细胞均有明显的抑制作用,并有很好的量效关系,其中5FEM对HL-60细胞抑制作用尤为明显,而对正常细胞HLF1的毒性较5-苄氧基杨梅醇及5-对溴苄氧基杨梅醇小,这为5FEM的进一步开发应用提供了依据。
课题组又运用RTCA技术对杨梅醇和5FEM的抗人肝癌HepG2细胞活性进行了评价。RTCA技术是一种建立在阻抗基础上的瞬时细胞电感应连续记录系统[14],与传统的MTT法、同位素掺入法等相比具有无标记、非损伤、自动、实时、连续检测的技术优势,可以全程动态记录处理之后细胞的效应变化,获得效应变化起始时间点,最大效应的时间点等多种信息,适用于细胞生物学研究的各个领域,尤其对肿瘤学研究具有其独特的优势,可应用于肿瘤细胞增殖、迁移、凋亡,以及免疫细胞对肿瘤细胞的杀伤等众多领域,从而进行抗肿瘤药物的筛选。
本研究结果显示,杨梅醇和5FEM对HepG2细胞的增殖和迁移均有较好的抑制作用,且呈现较好的量效关系,相等剂量下,5FEM的作用优于杨梅醇,这可能与降低HepG2细胞中caspase-9和Bcl-2基因和蛋白的表达水平,提高p21基因和蛋白以及Bax蛋白的表达水平相关[1,6-7]。本研究结果为杨梅醇和5FEM抗肿瘤新药的进一步研发提供了实验依据,本课题组后续也将继续进行杨梅醇和5FEM抗肿瘤作用机制的研究。
REFERENCES
[1] Dai G H, Meng G M, Tong Y L, et al. Growth-inhibiting and apoptosis-inducing activities of myrieanol from the bark of Mcarubra in human lung adenocarcinoma A549 cells [J]. Phytomedicine, 2014, 21(11): 1490-1496.
[2] DAI G H, TONG Y L, REN Z M, et al. Effect of extracts from bark ofMyrica rubraon resisting human lung adenocarcinoma A549 cellsin vitro[J]. Chin Arch Tradit Chin Med(中华中医药学刊), 2013, 31(1): 81-82.
[3] TONG Y L, DAI G H, REN Z M, et al. Inhibition effect of Chloroform extracts from Yangmei(Myrica Rubra) bark on lewis lung cancer of mice [J]. Chin J Tradit Med Sci Technol (中国中医药科技), 2016, 23(1): 50-52.
[4] Mochida K. Anti-influenza virus activity ofMyrica rubraleaf ethanol extract evaluated using Madino-Darby canine kidney(MDCK) cells [J]. Biosci, Biotechnol, Biochem, 2008, 72(11): 3018-3020.
[5] CHEN X, TONG Y L, REN Z M, et al. Effect of myricanone on cell apoptosis and cell cycle in human lung adenocarcinoma A549 cells [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2015, 30(10): 3656-3658.
[6] DAI G H, TONG Y L, REN Z M, et al. Inhibition effects of myricanol on A549, HL-60 and HepG2 proliferation [J]. Chin J Tradit Med Sci Technol(中国中医药科技), 2016, 23(1): 52-54.
[7] CHEN X, TONG Y L, REN Z M, et al.Influence of myricanol on expression of Caspase-9, Bcl-2, p21 and Bax in human hepatoma HepG2 cells [J]. China J Tradit Chin Med Pharm(中华中医药杂志), 2015, 30(10): 3656-3658.
[8] Jones J R, Lebar M D, Jinwal U K, et al. The diarylheptanoid (+)-aR, 11S-myricanol and two flavons from bayberry(Myrica cerifera) destabilize the microtubule- associated protein tau [J]. J Nat Prod, 2011, 74(1): 38-44.
[9] Tao J, Morikawa T, Toguchida I, et al. Inhibitors of nitric oxide production from the bark ofMyrica rubra: structures of new biphenyl type diarylheptanoid glycosides and taraxerane type triterpene [J]. Bioorg Med Chem, 2002, 10(12): 4005-4012.
[10] Ohta S, Sakurai N, Kamogawa A, et al. Protective effects of the bark ofMyrica rubraSieb. et Zucc. on experimental liver injuries [J]. Yakugaku Zasshi, 1992, 112(4): 244-252.
[11] Matsuda H, Yamazaki M, Matsuo K, et al. Anti-androgenic activity of Myricae cortex-isolation of active constituents from bark ofMyrica rubra[J]. Biol Pharm Bull, 2001, 24(3): 259-263.
[12] Zhang J, Yamada S, Ogihara E, et al. Biological activities of triterpenoids and phenolic compounds from Myrica cerifera bark [J]. Chem biodiversit, 2016, 13(11): 1601-1609.
[13] Dai G h, Li Z h, Tong Y l, et al. Myricanol derivatives and their preparation methods and applications: China, 201510501517.3 [P]. 2017-06-27.
[14] YAN G J, PEI Y F, ZHU Z H, et al. Research progress in application of real-time cell-based assay(RTCA) [J]. Chin Pharm J(中国药学杂志), 2014, 49(3): 169-173.
(本文责编:蔡珊珊)
Preparation of Myricanol and Myricanol 5-fluorobenzyloxy Ether and its Effect on the Activity of HepG2Cells
TONG Yeling, DAI Guanhai*, REN Zeming, CHEN Xuan, NIE Xiaojing, YANG Feng
(Zhejiang Institute of Traditional Chinese Medicine, Hangzhou 310007, China)
ABSTRACT: ObjectiveTo observe the activity of myricanol and myricanol 5-fluorobenzyloxy ether (5FEM) on liver cancer of cell HepG2invitro.MethodsMyricanol (25, 12.5 and 6.25 μg·mL-1) and 5FEM (25, 12.5 and 6.25 μg·mL-1) were prepared to act on HepG2cells, real time cellular analysis was used to record 96 h cell index (CI) to observe the effect of Myricanol and 5FEM on the proliferation and migration of HepG2cells.ResultsMyricanol and 5FEM could inhibit the proliferation and migration of HepG2cells, showing a dose-effect curve. The effect of 5FEM was better than myricanol at the same dose.ConclusionMyricanol and 5FEM can effectively inhibit the proliferation and migration of HepG2cells.
KEY WORDS:myricanol; myricanol 5-fluorobenzyloxy ether; HepG2cell; proliferation; migration
中图分类号:R285.4
文献标志码:A
文章编号:1007-7693(2018)03-0375-04
DOI:10.13748/j.cnki.issn1007-7693.2018.03.014
引用本文:童晔玲,戴关海,任泽明,等. 杨梅醇与5-对氟苄氧基杨梅醇的制备及其对人肝癌HepG2细胞活性的影响[J]. 中国现代应用药学, 2018, 35(3): 375-378.
收稿日期:2017-07-24
基金项目:浙江省科技计划项目(2015F10015、2013F50020、2017C33169)
作者简介:童晔玲,女,硕士,副研究员 Tel: (0571)88849082 E-mail: tongyeling@sina.com
*通信作者:戴关海,男,硕士,研究员 Tel: (0571)88849082 E-mail: 13989494472@163.com