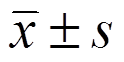 表示,组内比较采用重复测量方差分析,组间比较采用成组t检验,计数资料用百分比或率表示,比较采用c2检验,P<0.05为差异有统计学意义。
表示,组内比较采用重复测量方差分析,组间比较采用成组t检验,计数资料用百分比或率表示,比较采用c2检验,P<0.05为差异有统计学意义。韩杨杨,郑君刚,杨秋红,梁国晋,陈益君,钱幸尔,黄长顺*
(宁波市第一医院麻醉科,浙江 宁波 315010)
摘要:目的探讨右美托咪定对肺癌根治术单肺通气患者术侧肺组织自噬相关蛋白LC3的影响。方法择期行肺癌根治术患者46例(美国麻醉医师协会分级Ⅰ~Ⅱ级),采用随机数字表法分为对照组和实验组各23例。实验组于麻醉诱导前静脉输注负荷量右美托咪定1.0 μg·kg-1,用时15 min,然后以0.5 μg·kg-1·h-1的速度维持至手术结束前30 min;对照组静脉输注等容量生理盐水。于单肺通气即刻(T1),单肺通气30 min(T2)、60 min(T3),术毕(T4)时分别采集动脉血,进行动脉血气分析,计算氧合指数。采用ELISA法检测血浆TNF-α和IL-6浓度。切取拟切除肺肿瘤周边正常组织,采用Western blot法检测自噬标志蛋白LC3表达水平,计算LC3-Ⅱ/LC3-Ⅰ比值。结果与对照组比较,实验组血浆TNF-α、IL-6的浓度降低,LC3-Ⅱ/LC3-Ⅰ比值和氧合指数升高(P<0.05)。2组患者单肺通气时间、出血量以及术后双腔支气管插管带管时间无明显差异。结论右美托咪定可以增强肺癌根治术患者单肺通气期间术侧肺组织的自噬,减轻全身炎症反应,改善肺功能。
关键词:右美托咪定;呼吸,人工;肺;自噬
单肺通气是胸腔外科手术常用的通气方式,多种因素可造成肺组织的炎症反应及急性肺损伤[1-2]。其中包括非通气侧肺组织的缺血再灌注、手术挤压以及机械通气对通气侧肺组织的影响。右美托咪定为一种高选择性α2肾上腺素能受体激动剂,对缺血组织具有保护作用[3-4],研究发现右美托咪定可降低支气管肺泡灌洗液中炎症因子水平,减轻缺血/再灌注肺组织的损伤[5]。并发现右美托咪定可通过调节海马神经元自噬水平减轻创伤性脑损伤[6]。自噬是细胞的一种正常的生理活动,通过溶酶体途径降解细胞内损伤的蛋白质和亚细胞器的过程[7]。自噬可通过抑制炎症反应对急性肺损伤产生保护作用[8]。本研究拟探讨右美托咪定对行肺癌根治术单肺通气患者肺组织的保护作用与自噬的关系,为临床提供参考。
研究获宁波市第一医院伦理委员会批准,告知患者及家属相关内容并签署知情同意书。于2014年9月~2015年8月期间,选择就诊于笔者所在医院择期行胸腔镜下肺癌根治术患者46例,年龄33~75岁,体质量指数(BMI)18~27 kg·m-2,美国麻醉医师协会(ASA)分级为Ⅰ~Ⅱ级,并且不包括符合排除标准的患者。根据随机数字表法分为实验组和对照组各23例。排除标准:①合并冠心病、心肌梗死;②肝、肾、肺功能不全;③有免疫系统疾病;④孕妇或有严重的精神疾病;⑤对本研究使用药物有禁忌症。
术前常规禁食、禁饮8 h,无术前用药。入室后常规监测心电图(ECG)、脉搏血氧饱和度(SpO2)、无创血压(NIBP)和脑电双频谱指数(BIS),予面罩吸氧,开放上肢外周静脉通路,输注林格氏液4~8 mL·min-1。局麻下行桡动脉及颈内静脉穿刺置管,用于监测血压和采血。实验组于麻醉诱导前静脉输注负荷量右美托咪定(江苏恒瑞医药股份有限公司,批号:16113032)1.0 μg·kg-1,用时15 min,然后以0.5 μg·kg-1·h-1的速度维持至手术结束前30 min;对照组静脉输注等容量生理盐水。麻醉诱导:静脉注射咪达唑仑(江苏恩华药业股份有限公司)0.05 mg·kg-1,舒芬太尼(宜昌人福医药有限公司)0.3~0.5mg·kg-1,依托咪酯(江苏恩华药业股份有限公司)0.2~0.3 mg·kg-1,当患者无意识时,注射罗库溴胺(N.V.Organon公司)0.8 mg·kg-1;经口插入双腔支气管导管,男性采用37 F气管导管,女性采用35 F气管导管,经纤支镜定位双腔管位置准确,行机械通气。双肺通气时呼吸参数:VT6~8 mL·kg-1,RR每分钟10~14次,吸呼比1︰2,吸入氧浓度100%,单肺通气时呼吸参数:RR每分钟12~16次,其他参数维持不变,维持PETCO235~45 mmHg。麻醉维持:静脉泵注丙泊酚(费森尤斯卡比医药有限公司)4~8 mg·kg-1·min-1,间断静推舒芬太尼0.1~0.2mg·kg-1,苯磺顺阿曲库铵(江苏恒瑞医药股份有限公司)0.05~0.1 mg·kg-1,BIS 指数维持在40~60。术中心率<每分钟50次时,静推阿托品0.3 mg;血压降低超过基础值30%时,静推麻黄碱6 mg。于手术结束前5 min停止丙泊酚输注,术毕转入麻醉恢复室,由恢复室固定人员按统一标准拔除气管导管。
1.3.1 围手术期指标 对照组与实验组的单肺通气时间、出血量、双腔支气管导管带管时间等。
1.3.2 血气分析 于单肺通气即刻(T1),单肺通气30 min(T2)、60 min(T3),术毕(T4)时分别采集桡动脉血1 mL进行动脉血气分析,并计算氧合指数。
1.3.3 血浆TNF-α和IL-6浓度测定 于单肺通气即刻(T1),单肺通气30 min(T2)、60 min(T3),术毕(T4)时分别采集颈内静脉血样5 mL注入肝素抗凝试管,离心提取血浆,采用ELISA法检测TNF-α和IL-6(北京博凌科为生物科技有限公司)浓度。
1.3.4 肺组织自噬标志蛋白LC3的测定 手术标本切除后取离肿块边缘>2 cm的正常肺组织,保存于液氮罐中,采用Western blot检测自噬相关蛋白(微管相关蛋白轻链Ⅰ和Ⅱ,LC3-Ⅰ和LC3-Ⅱ)。抽提肺组织蛋白,蛋白定量,煮沸后点样于 15% SDS 聚丙酰胺凝胶电泳分离,电转移至纤维素膜,然后分别与LC3一抗(1︰500,Novus公司,美国),羊抗兔二抗(1︰10 000,Novus公司,美国)孵育,反应后用胶片显影。蛋白条带密度的定量分析扫描后运用Image J 软件(NIH公司,美国)分析目标蛋白条带灰度值,计算LC3-Ⅱ/LC3-Ⅰ比值。
采用SPSS 19.0统计学软件进行分析,计量资料以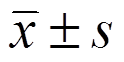 表示,组内比较采用重复测量方差分析,组间比较采用成组t检验,计数资料用百分比或率表示,比较采用c2检验,P<0.05为差异有统计学意义。
表示,组内比较采用重复测量方差分析,组间比较采用成组t检验,计数资料用百分比或率表示,比较采用c2检验,P<0.05为差异有统计学意义。
2组患者一般情况各指标、OLV时间、术中出血量、双腔支气管带管时间比较差异无统计学意义。结果见表1。
表1 2 组患者一般资料比较(n=23,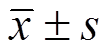 )
)
Tab. 1 Comparison of patient characteristics and surgical data(n=23,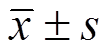 )
)

与T1时比较,2组患者T2~4时氧合指数降低(P<0.05);与对照组比较,实验组T2~4时氧合指数升高(P<0.05),结果见表2。
与T1时比较,2组患者T2~4时血浆TNF-α、IL-6的浓度升高(P<0.05);与对照组比较,实验组 T2~4时血浆TNF-α、IL-6的浓度降低(P<0.05),结果见表3。
表2 2组不同时间点氧合指数变化(n=23,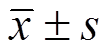 )
)
Tab. 2 Comparison of oxygenation index at different time points(n=23,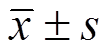 )
)

注 :与T1时刻点对比,1)P<0.05;与对照组比较,2)P<0.05。
Note: Compared with the time point T1contrast,1)P<0.05; compared with control group,2)P<0.05.
表3 2组不同时间点血浆TNF-α、IL-6浓度变化(n=23,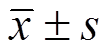 )
)
Tab. 3 Comparison of plasma concentrations of TNF-α and IL-6 at different time points(n=23,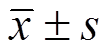 )
)

注 与T1时刻点对比,1)P<0.05;与对照组比较,2)P<0.05。
Note: Compared with the time point T1contrast,1)P<0.05; compared with control group,2)P<0.05.
实验组患者肺组织中自噬标志蛋白LC3-Ⅱ/LC3-Ⅰ比值为2.61±1.37,与对照组LC3-Ⅱ/LC3-Ⅰ值(1.93±0.50)比较,明显上调(P<0.05)。
本研究参照文献[9]选择在麻醉诱导开始前静脉输注1.0 μg·kg-1的右美托咪定负荷量,用时15 min,随后以0.5 μg·kg-1·h-1的速度维持至手术结束前30 min。结果显示,与对照组比较,实验组患者血浆TNF-α、IL-6的浓度降低,氧合指数升高,表明右美托咪定可减轻行肺癌根治术单肺通气患者的炎性反应,改善氧合,产生肺保护作用。
自噬是细胞死亡的一种类型,广泛存在于人体生理及病理情况下,其作用是组织与模型依赖性的。当细胞缺血缺氧时,机体可通过诱导自噬水平的上调,保护细胞,促进细胞存活[10]。在脓毒症小鼠中自噬可通过抑制炎症反应对急性肺损伤产生保护作用[8]。LC3是自噬体膜上的标志性蛋白,在细胞质内存在LC3-Ⅰ和LC3-Ⅱ 2种形式,在自噬泡的形成过程中,LC3-Ⅰ经过一系列活化结合过程转变为LC3-Ⅱ,LC3-Ⅱ能特异性与自噬体结合,被广泛作为自噬泡的标记物[11-12]。右美托咪定可通过调控机体炎症反应、自噬水平对多种脏器产生保护作用[5-6]。
在本研究中,与对照组比较,实验组患者T2~4时血浆TNF-α、IL-6的浓度降低,氧合升高,肺组织中自噬标志蛋白LC3-Ⅱ/LC3-Ⅰ比值明显上调。研究表明,右美托咪定可以增强肺癌根治术患者单肺通气期间术侧肺组织的自噬,改善氧合,减轻全身炎症反应。右美托咪定可通过调控炎症反应的水平,抑制炎症因子的释放,减轻机体全身及局部肺组织的炎症反应,改善氧合,减轻单肺通气期间肺组织的损伤[13]。细胞自噬可通过降解因炎症反应损伤或死亡的细胞器或细胞,并重新利用维持细胞稳态。而另一方面,细胞自噬的信号调控通路可调节机体免疫应答、控制或减轻机体的过度炎症反应[14-15]。
患者术后的气管导管带管时间、胸腔引流管带管时间以及术后住院时间组间无明显差别,分析原因一方面可能是因为胸腔镜手术为临床微创手术的一种,对患者各项生理功能的影响尚轻,在患者的自身代偿范围内,其二不排除临床医师平时的工作习惯影响。
综上所述,右美托咪定可以增强肺癌根治术患者单肺通气期间术侧肺组织的自噬,减轻全身炎症反应,改善肺功能。
REFERENCES
[1] SUGASAWA Y, YAMAGUCHI K, KUMAKURA S, et al. The effect of one-lung ventilation upon pulmonary inflammatory responses during lung resection [J]. JAnesth, 2011, 25(2): 170-177.
[2] XUE F, CHEN Z L, LIU C C, et al. Effects of dexmedetomidine on intrapulmonary shunt and arterial oxygenation during one-lung ventilation [J]. Chin J New Drugs Clin Rem(中国新药与临床杂志), 2015, 34(11): 861-865.
[3] KIP G, ÇELIK A, BILGE M, et al. Dexmedetomidine protects from post-myocardial ischaemia reperfusion lung damage in diabetic rats [J]. Libyan J Med, 2015(10): 27828. Doi: 10.3402/ljm.v10.27828.
[4] SHANG Y, GU P F, YUAN S T, et al. Effects of dexmedetomidine on astrocytes glial fibrillary acidic protein expression in focal cerebral ischemia/reperfusion rats [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2015, 32(7): 799-803.
[5] JIANG L, LI L, SHEN J, et al. Effect of dexmedetomidine on lung ischemia‑reperfusion injury [J]. Mol Med Rep, 2014, 9(2): 419-426.
[6] ZHANG M H, ZHOU X M, XING Y J, et al. Effect of dexmedetomidine on autophagy in hippocampal neurons of rats with traumatic brain injury [J]. Chin J Anesthesiol(中华麻醉学杂志), 2015, 35(3): 373-376.
[7] JONES S A, MILLS K H, HARRIS J. Autophagy and inflammatory diseases [J]. Immunol Cell Biol, 2013, 91(3): 250-258.
[8] BIAN Y X, CHEN H G, XIE K L, et al. Relationship between endogenous protection induced by autophagy against acute lung injury and inflammatory responses in septic mice [J]. Chin J Anesthesiol(中华麻醉学杂志), 2016, 36(5): 602-605.
[9] ZHANG R Z, SHI Y S, ZHANG Y M, et al. Effects of different doses of dexmedetomidine on perioperative inflammatory responses in patients undergoing one-lung ventilation [J]. Chin J Anesthesiol(中华麻醉学杂志), 2014, 31(s1): 1443-1445.
[10] CARLONI S, GIRELLI S, SCOPA C, et al. Activation of autophagy and Akt/CREB signaling play an equivalent role in the neuroprotective effect of rapamycin in neonatal hypoxia-ischemia [J]. Autophagy, 2010, 6(3): 366-377.
[11] KLIONSKY D J, ABDALLA F C, ABELIOVICH H, et al. Guidelines for the use and interpretation of assays for monitoring autophagy [J]. Autophagy, 2012, 8(4): 445-544.
[12] MINTERN J D, MACRI C, CHIN W J, et al. Differential use of autophagy by primary dendritic cells specialized in cross-presentation [J]. Autophagy, 2015, 11(6): 906-917.
[13] WANG D X, KAN H L, YU X D, et al. Pulmonary protection of dexmedetomidine during on-lung ventilation in patients undergoing radical operation for lung cancer [J]. Chin J Anesthesiol(中华麻醉学杂志), 2014, 34(6): 674-676.
[14] PAN H, ZHANG Y, LUO Z, et al. Autophagy mediates avian influenza H5N1 pseudotyped particle-induced lung inflammation through NF-κB and p38 MAPK signaling pathways [J]. Am J Physiol Lung Cell Mol Physiol, 2013, 306(2): 183-195.
[15] MA Y, GALLUZZI L, ZITVOGEL L, et al. Autophagy and cellular immune responses [J]. Immunity, 2013, 39(2): 211-227.
(本文责编:李艳芳)
Effects of Dexmedetomidine on the Expression of Autophagy Protein LC3 in Operated Lung Tissues of Patients Undergoing Radical Operation for Lung Cancer
HAN Yangyang, ZHENG Jungang,YANG Qiuhong, LIANG Guojin, CHEN Yijun, QIAN Xinger, HUANG Changshun*
(Department of Anesthesiology, First Hospital of Ningbo, Ningbo 315010, China)
ABSTRACT: OBJECTIVETo evaluate the effect of dexmedetomidine on autophagy protein LC3 in operated lung tissues during one lung ventilation in patients undergoing radical operation for lung cancer.METHODSForty-six patients scheduled for elective radical operation for lung cancer (ASA physical status Ⅰ-Ⅱ), were randomly divided into control group and experimental group. Each group included 23 patients. Before induction of anesthesia, dexmedetomidine was infused at a rate of 1.0 μg·kg-1over 15 min, followed by continuous infusion at a rate of 0.5 μg·kg-1·h-1until 30 min before the end of operation in experimental group; meanwhile the equal volume of normal saline was given in control group. At four time points, including immediately after one-lung ventilation(T1), at 30 min(T2) and 60 min(T3)of one-lung ventilation, and at the end of operation(T4), arterial blood samples were collected for blood gas analysis and oxygenation indices were calculated. Plasma concentrations of tumor necrosis factor-α(TNF-α) and interleukin-6(IL-6) were measured by ELISA method. The specimens for normal lung tissues around the cancer were collected to measure the level of LC3 protein expression by Western blot and the ratio of LC3-Ⅱ/LC3-Ⅰwas calculated.RESULTSCompared with control group, plasma concentrations of TNF-α and IL-6 were significantly decreased, the ratios of LC3-Ⅱ/LC3-Ⅰand oxygenation indices were significantly increased (P<0.05) in experimental group. Moreover, there were no statistical difference in the time of one lung ventilation, blood loss and the time of tracheal tube extubation between two groups.CONCLUSIONDexmedetomidine can enhance autophagy in the operated lung tissues and mitigate inflammatory responses, improving pulmonary function during one lung ventilation in patients undergoing radical operation for lung cancer.
KEY WORDS:dexmedetomidine; respiration; artificial; lung; autophagy
中图分类号:R969.4
文献标志码:B
文章编号:1007-7693(2018)03-0411-04
DOI:10.13748/j.cnki.issn1007-7693.2018.03.023
引用本文:韩杨杨, 郑君刚, 杨秋红, 等. 右美托咪定对肺癌根治术术侧肺组织自噬相关蛋白LC3的影响[J]. 中国现代应用药学, 2018, 35(3): 411-414.
收稿日期:2017-07-20
基金项目:宁波市自然科学基金(2015A610200);浙江省医学会临床科研基金项目(2015ZYC-A51);浙江省中医药科学研究基金项目(2015ZA186)
作者简介:韩杨杨,女,主治医师 Tel: 13732172185 E-mail: 13732172185@163.com
*通信作者:黄长顺,男,主任医师 Tel: (0574)87086437 E-mail: nbhcs1967@163.com