山豆根生物碱对DEN诱发肝癌大鼠的作用及机制研究
曹洛云1,李天娇1,2,3,孟宪生1,2,3*,包永睿1,2,3,王帅1,2,3
(1.辽宁中医药大学药学院,辽宁 大连 116600;2.辽宁省组分中药工程技术研究中心,辽宁 大连 116600;3.辽宁省现代中药研究工程实验室,辽宁 大连 116600)
摘要:目的在山豆根生物碱成分明确的基础上,开展体内药理药效及作用机制研究。方法采用DEN诱发肝癌模型,将SD大鼠随机分为空白组,模型组,环磷酰胺组(0.01 g·kg-1)和山豆根生物碱低、中、高剂量组(0.036,0.108,0.324 g·kg-1),造模第7周后治疗组给予相应药物,连续给药9周;观察各组大鼠的生理指标及病理组织切片,检测大鼠血清中甲胎蛋白的含量,RT-PCR技术检测肿瘤组织中VEGF、PI3K、PTEN基因表达。结果与模型组相比,山豆根生物碱低剂量和中剂量组能显著降低大鼠血清中AFP 的含量(P<0.05),减少肿瘤组织中癌结节数,同时,山豆根生物碱能不同程度地减少肝组织中VEGF、PI3K mRNA 表达,增加PTEN mRNA 表达。结论山豆根生物碱能产生明确的体内抗肝肿瘤药理作用,改善免疫调节,延长生存时间;其作用机制与环磷酰胺类似,参与VEGF、PI3K及PTEN基因的调控,为山豆根的临床应用提供参考依据。
关键词:山豆根;抗肝癌;二乙基亚硝胺;AFP;作用机制;RT-PCR
山豆根为豆科植物越南槐(Sophora tonkinensisGapnep.)的干燥根及根茎,药用功效始载于唐代《开宝本草》[1],味苦性寒,具有泻火解毒、消肿利咽、止痛杀虫的功效,主治火毒蕴结、咽喉和齿龈肿痛等症状[2]。生物碱类成分为山豆根药材的主要活性成分,也是药效作用的物质基础[3]。山豆根与核桃楸皮、菟丝子、云芝是满药复方木鸡颗粒的药味组成,用于治疗肝炎、肝硬化、肝癌。方中山豆根具有泻火解毒、散结之功效,即具有“祛邪”的作用[4]。本实验室前期开展了山豆根生物碱提取纯化工艺研究,制备的山豆根生物碱组分通过溴百里香酚蓝显色检测纯度>70%。基于液质联用技术对山豆根生物碱进行成分表征研究,确定了氧化苦参碱、苦参碱、氧化槐果碱等化学成分。据文献报道,山豆根可抑制癌细胞增殖,对肝癌细胞(Hep3B、SMMC-7721、H22)、小鼠肉瘤S180等均有不同程度的抑制和杀伤作用[5-6]。本研究在山豆根生物碱成分明确的基础上,开展DEN诱发大鼠肝癌的体内药效学研究,并初步探讨了基于VEGF、PI3K-AKT信号通路的作用机制,为山豆根生物碱成为临床抗肝肿瘤药物提供实验依据和理论基础。
1 仪器与材料
RT-PCR(Piko Thermol公司);紫外分光光度计(日本SHIMADZU公司);SUNRISE酶标仪(瑞士TECAN公司);-80 ℃低温冰箱(NEW BRUNSWICK SCIENTIFIC公司)等。
山豆根生物碱:取山豆根粗粉适量,采用本实验室前期提取纯化工艺制备组分(纯度>70%);环磷酰胺(上海源叶生物科技有限公司);AFP 试剂盒(上海朗顿生物科技有限公司,批号:20161220VN);TransZol Up、EasyScript First-Strand cDNA Synthesis SuperMix、TransStart Top Greenq PCR SuperMix(北京全式金生物技术有限公司,批号分别为L30607,L10303,K31215);Primer(设计合成Invitrogen公司)。
清洁级SD大鼠,♂,体质量(180~220)g,购自辽宁长生生物技术有限公司,合格证号:SCXK(辽)2015-0001。
2 实验方法
2.1 动物造模与给药
分组:SD大鼠随机分为空白组(K),模型组(M),环磷酰胺组(XY),山豆根生物碱低、中、高剂量组(SSD、SSZ、SSG),共6组,每组20只。造模:大鼠适应性喂养1周,除空白组,其余每组以70 mg·kg-1的DEN灌胃,每周1次,连续灌胃13周[7-8]。给药:治疗组于造模第7周后灌胃给药,XY(0.01 g·kg-1),SSD(0.036 g·kg-1)、SSZ (0.108 g·kg-1)、SSG(0.324 g·kg-1),K及M组灌服等体积的生理盐水。每日观察大鼠的一般情况,包括精神状态、饮食状况及背毛的变化。
2.2 样本采集与处理
实验前将各组大鼠禁食12 h,期间自由饮水。对大鼠进行无菌摘眼球取血,血清静置30 min,以3 000 r·min-1(4 ℃)离心10 min,取上清,分装置-80 ℃冰箱保存备用。将大鼠颈椎脱臼法处死,剪取肝脏、脾、胸腺等组织器官,称量并记录。剪取一部分肝组织固定于4%中性甲醛溶液中,石蜡包埋,制备成4 μm厚的切片,采用HE染色法进行常规组织学检查;另一部分迅速放于液氮中冻存,并转移至-80 ℃冰箱保存备用。计算胸腺及脾指数:胸腺(脾脏)指数=大鼠胸腺(脾脏)质量(mg)/大鼠体质量(g)。
2.3. ELISA法检测大鼠血清中AFP的含量
采用ELISA法检测大鼠血清中AFP的含量。按照AFP试剂盒说明书,酶标仪450 nm下测定每组的吸光度,建立标准曲线,根据标准曲线计算各组AFP的含量。
2.4 RT-PCR检测VEGF、PI3K、PTEN mRNA表达的影响
各组剪取0.1 g肿瘤组织,采用TRIzol试剂提取总RNA,通过紫外分光光度计,记录A260和A260/A280,计算RNA浓度。提取的总RNA通过反转录试剂盒合成第一链cDNA。反应条件:42 ℃15 min,85 ℃5 s。随后以β-actin为内参基因,应用TransStartTop Green qPCR SuperMix试剂盒进行扩增。反应条件:95 ℃预变性30 s;95 ℃10 s、57 ℃20 s、72 ℃ 34 s,共40个循环;最后72 ℃延伸7 min。计算VEGF、PI3K、PTEN mRNA的相对表达量。引物序列如表1所示。
表1 各引物序列
Tab. 1 The sequences of primers

名称引物序列 β-actinforward prime: 5′-TGCTGTCCCTGTATGCCTCT-3′ reverse primer: 5′-TTTGATGTCACGCACGATTT-3′ VEGFforward prime: 5′-TTGCTGCTCTACCTCCAC-3′ reverse primer: 5′-AATGCTTTCTCCCCTCTG-3′ PI3Kforwardprime: 5′-AACGAGAACGTGTGCCATTTG-3′ reverse primer: 5′-AGAGATTGGCATGCTGTCGAA-3′ PTENforward prime: 5′-CCCAGTCAGAGGCGCTATG-3′ reverse primer: 5′-GGCAGACCACAAACTGAGGATT-3′
2.5 统计学处理
应用SPSS 22.0和GraphPad Prism 5软件处理数据,实验结果以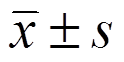 表示,多组间比较采用单因素方差分析,以P<0.05表示有统计学意义。
表示,多组间比较采用单因素方差分析,以P<0.05表示有统计学意义。
3 实验结果
3.1 一般情况观察
空白组大鼠进食、饮水好,喜活动,背毛柔顺、有光泽,无死亡。模型组进食量下降,行动迟缓,皮毛蓬乱且缺乏光泽。通过观察,环磷酰胺组大鼠随着给药天数的增加明显消瘦,伴有掉毛、牙齿脱落现象,尿液发黄,死亡率高。山豆根生物碱给药组偶有精神不振、尿液发黄的现象,但死亡率较环磷酰胺组和模型组低。
3.2 大鼠肝组织形态观察
空白大鼠的肝脏表面光滑水润,色泽暗红,质密有光泽且柔软。模型组表面粗糙,颗粒状,有癌结节及肿大现象,颜色较淡甚至无血色。环磷酰胺和山豆根生物碱各剂量组与模型组相比,表面略光滑,无颗粒或颗粒不明显,颜色较模型组深,见图1。

图1 各大鼠肝组织形态
Fig. 1 The morphology of rats liver in all groups
3.3 山豆根生物碱对大鼠胸腺指数、脾指数、AFP、死亡率的影响
山豆根生物碱组与模型组比较,胸腺指数明显升高,且接近空白组,脾指数显著降低(P<0.01或P<0.05)。山豆根生物碱低剂量和中剂量组大鼠血清中AFP 含量明显降低(P<0.01或P<0.05),尤以低剂量效果明显。从表中死亡率可以看出,山豆根生物碱低剂量死亡率远远低于模型组和环磷酰胺组,结果见表2。
表2 大鼠胸腺指数、脾指数、AFP、死亡率结果(n=8,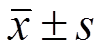 )
)
Tab. 2 The thymus index, spleen index, AFP, mortality of rats(n=8,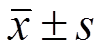 )
)
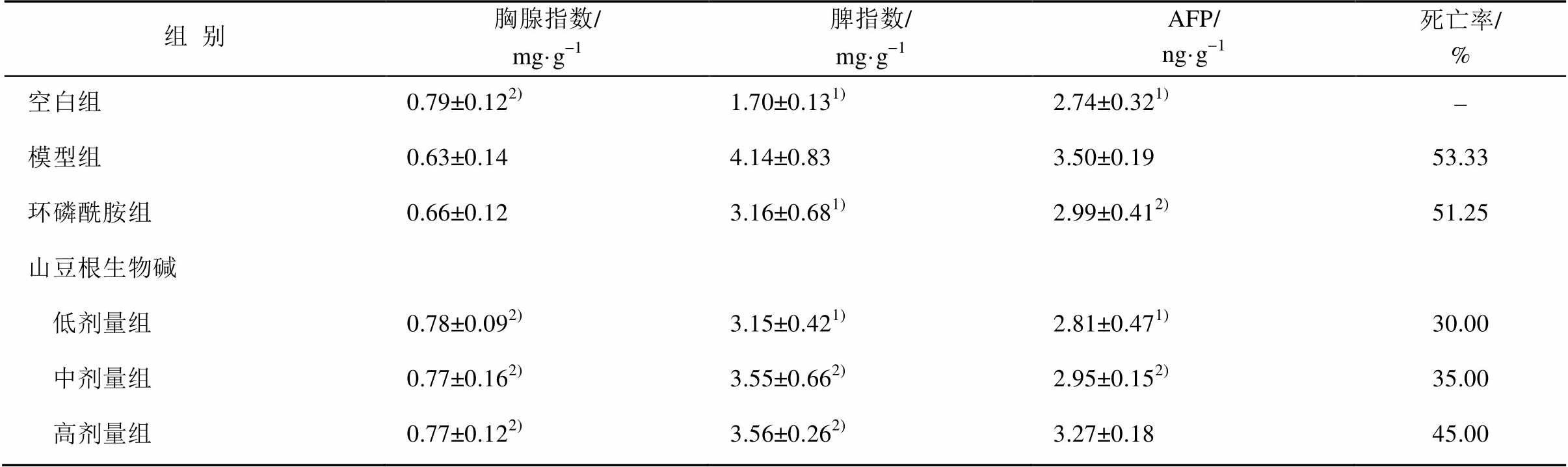
组别胸腺指数/mg·g-1脾指数/mg·g-1AFP/ng·g-1死亡率/% 空白组0.79±0.122)1.70±0.131)2.74±0.321)- 模型组0.63±0.144.14±0.833.50±0.1953.33 环磷酰胺组0.66±0.123.16±0.681)2.99±0.412)51.25 山豆根生物碱 低剂量组0.78±0.092)3.15±0.421)2.81±0.471)30.00 中剂量组0.77±0.162)3.55±0.662)2.95±0.152)35.00 高剂量组0.77±0.122)3.56±0.262)3.27±0.1845.00
注 :与模型组比较,1)P<0.01,2)P<0.05。
Not e:compared with the model group,1)P<0.01,2)P<0.05.
3.4 HE染色法评价山豆根生物碱对大鼠肝肿瘤的影响
空白组肝细胞排列整齐有规则,以中央静脉为中心呈放射状排列,肝细胞大小均匀,无核分裂现象。模型组异型性细胞增多,有结节,细胞核变大且界限不清,核分裂象多;周围胆管区上皮增生,炎细胞浸润,见大片坏死区,癌细胞排列极紊乱。环磷酰胺组与模型组比较,肝细胞排列层次较规整,但细胞大小均匀不一,肝细胞形态结构稍不清晰,肿瘤细胞基本固缩,可见小叶间有微量的炎性细胞[9]。山豆根生物碱组肝细胞排列层次稍规整,肝细胞形态结构较清晰,肿瘤细胞和炎性细胞现象稍微减轻,局部区域细胞透明亚变。
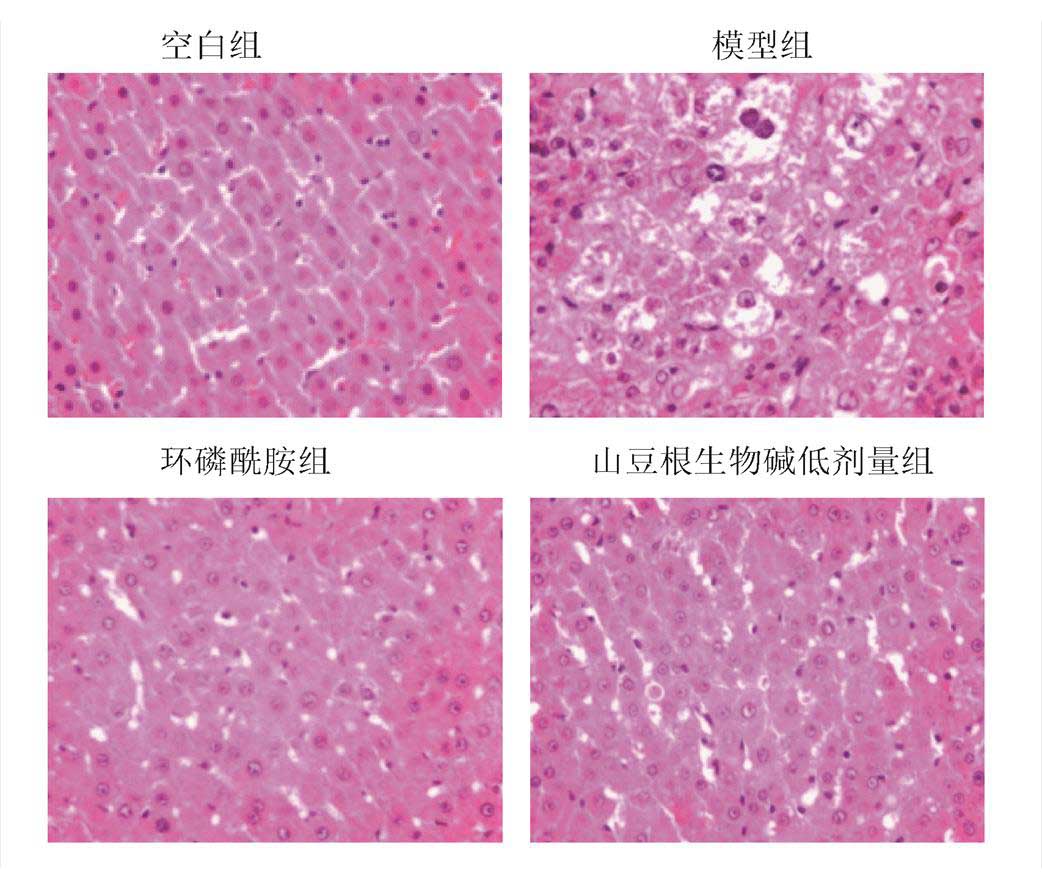
图2 肝组织病理学观察(HE,400×)
Fig. 2 Pathological observation of liver tissue (HE, 400×)
3.5 山豆根生物碱对VEGF、PI3K、PTEN mRNA表达的影响
3.5.1 VEGF、PI3K、PTEN mRNA的表达情况 RT-PCR结果显示,山豆根生物碱各剂量组和环磷酰胺组与模型组比较均不同程度的使VEGF、PI3K mRNA表达量降低,使PTEN mRNA表达量升高(P<0.05)。结果见图3。

图3 VEGF、PI3K、PTEN mRNA的表达
A-PI3K、VEGF mRNA的表达,B-PTEN mRNA的表达;与模型组相比,1)P<0.05。
Fig. 3 The expression of VEGF, PI3K, PTEN mRNA
A-The expression of PI3K, VEGF mRNA; B-The expression of PTEN mRNA; Compared with model group,1)P<0.05.
3.5.2 山豆根生物碱同环磷酰胺抗肝肿瘤机制
据文献报道,环磷酰胺能直接破坏DNA并阻止其复制,可通过抑制促血管生成因子VEGF等多种途径[10],发挥抗肿瘤活性。山豆根生物碱通过上调PTEN mRNA,降低VEGF、PI3K mRNA的表达,参与VEGF、PI3K/AKT信号通路而起到抗肝肿瘤作用,见图4。
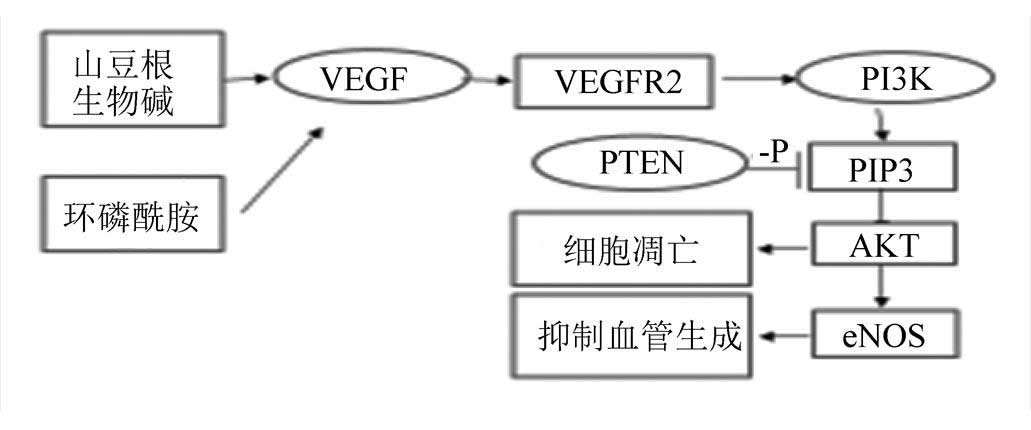
图4 山豆根生物碱及环磷酰胺抗肝肿瘤通路
Fig. 4 The anti liver tumor pathway of Sophorae Tonkinensis Radix et Rhizoma
4 讨论
肝癌是我国发病率较高的恶性肿瘤,其发病率已位居我国恶性肿瘤的第2位,严重危及人类的健康和生命。环磷酰胺作为一种抗癌谱广、疗效较好的抗癌药物,已广泛应用于临床。但其不良反应强,患者生存质量差,生存期较短,既能抑制肿瘤细胞生长与繁殖,又会影响人体正常细胞的生长和发育[10]。因此,开发不良反应少、疗效高的抗肿瘤药物已成为当前国内外研究的热点和共识。
山豆根为满族药复方木鸡颗粒的组方之一,本实验室在前期体外实验表明,山豆根生物碱对人肝癌SMMC-7721细胞[11]具有抗增殖及促进凋亡的作用。本研究采用DEN诱导肝癌模型,综合大鼠的生存状态、死亡率及病理组织切片等指标,并对大鼠血清中AFP的含量进行检测。结果显示,山豆根生物碱与环磷酰胺可提高大鼠胸腺指数、降低脾肿大及血清中AFP含量,对肝肿瘤有明确的治疗作用,即具有“祛邪”的作用。山豆根生物碱低、中剂量组产生与环磷酰胺样抗肝肿瘤作用的同时,能够减少肿瘤组织中癌结节数,肝脏损伤程度较环磷酰胺组低,且能提高大鼠胸腺指数和生存质量,延长生存期,降低死亡率,即“扶正”。近年来,中医药对肝癌发生发展的根本原因、病理基础、病变脏腑等病因病机进行分析,提出活血化瘀、清热解毒、扶正祛邪等方面的中医治法[12]。山豆根通过改善免疫系统及生理指标体现了“扶正”的治法,而降低AFP含量抑制肝肿瘤体现了“祛邪”的治法。
机体实体瘤的生长具有明显的血管生成依赖性,VEGF是目前作用最强的一种促血管生长因子[13]。本研究从经典的VEGF信号通路着手,研究山豆根生物碱与临床常用药物环磷酰胺作用机制的相似性,为其成为作用机制明确的候选药物奠定基础。本研究结果表明,山豆根生物碱与环磷酰胺通过上调肝肿瘤组织中PTEN的表达量,抑制VEGF、PI3K的表达量,缓解PIP3的积聚,抑制AKT的持续活化[14],从而起到抑制肿瘤的作用。
本实验研究在山豆根生物碱提取纯化工艺完善,成分明确的基础上,开展了基于DEN诱发大鼠肝癌的体内药效学研究,并从经典的VEGF信号通路阐述其抗癌作用机制,为该药成为临床抗肝肿瘤药物奠定前期实验基础。
REFERENCES
[1] 何晓艳, 周应军, 田洪. 山豆根化学成分及药理作用研究进展[J]. 中南药学, 2011, 9(7): 525-528.
[2] 中国药典. 一部[S]. 2015: 附录27.
[3] LI F, LI C P, FU H, et al. Research progress of Radix Sophorae Tonkinensis and supplementary reports of assay method for toxic chemical composition [J]. Chin J Pharm Anal(药物分析杂志), 2013, 33(8): 1453-1463.
[4] SONG Y R, JIANG C X. New study progress of Compound Muji granule of Manchu medicin [J]. Chin Med Herald(中国医药导报), 2013, 10(1): 4-5.
[5] LI H C, YUAN D P, LIU Y. Research progress on chemical constituents in plants ofEuchresta J. Benn and their biological activities [J]. Chin Tradit Herb Drugs(中草药), 2014, 45(23): 3486-3493.
[6] WANG J M, CUI Y. Research progress in chemical components, pharmacological effectiveness and toxicity of Radix et rhizoma sophorae tonkinensis [J]. China J Exp Tradit Med Form(中国实验方剂学杂志), 2011, 17(4): 229-232.
[7] 汤靓. DEN诱导大鼠肝癌模型的代谢组学研究[D]. 上海: 第二军医大学, 2010.
[8] DAI Z J, WANG X J, JI Z Z, et al. Inhibitory effects of scutellaria barbate extracts on diethylnitrosamine-induced hepatocarcinoma in rats [J]. J Chin Med Mater(中药材), 2009, 32(4): 568-571.
[9] LI J, MENG X S, BAO Y R. Effect of Siweiga ntai nanoparticles on aflatoxin B1-induced liver cancer [J]. Chin J New Drugs(中国新药杂志), 2012, 21(5): 481-485, 542.
[10] CHI S P, BAI B K, XIE J, et al. Study of the effect and mechanism of Cyclophosphamide on antitumor in animal model [J]. Chin Med Herald(中国医药导报), 2012, 9(14): 20-22.
[11] LI N N, MENG X S, BAO Y R, et, al.In vitroantitumor activity and chemical analysis of oroxyli semen volatile constituents [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2016, 33(11): 1361-1365.
[12] 韦艾凌, 张永琴. 中医药诱导原发性肝癌细胞凋亡的研究近况[J]. 辽宁中医杂志, 2006, 33(7): 905-906.
[13] GUO B, SHEN H B, PENG H W, et al. Effect of matrine on VEGF mRNA and protein expression levels of lewis lung carcinoma in C57BL/6J mouse [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2011, 28(1): 14-17.
[14] LI T J, BAO Y R, WANG S, et al. Study on proliferation and mechanism of hepatocarcinoma cells induced by Ophicalcitum based on PTEN/PI3K/AKT signaling pathway [J]. Lishizhen Med Mater Med Res(时珍国医国药), 2017, 28(1): 63-67.
(本文责编:李艳芳)
Study on the Efficacy and Mechanism of Liver Cancer Induced by DEN in Rats of Alkaloids ofSophorae Tonkinensis Radix Et Rhizoma
CAO Luoyun1, LI Tianjiao1,2,3, MENG Xiansheng1,2,3*, BAO Yongrui1,2,3, WANG Shuai1,2,3
(1.College of Pharmacy, Liaoning University of Traditional Chinese Medicine, Dalian 116600, China; 2.Liaoning Province Multi-Component Chinese Medicine Engineering Technology Research Center, Dalian 116600, China; 3.Liaoning Province Modern Traditional Chinese Medicine Research and Engineering Laboratory, Dalian 116600, China)
ABSTRACT: OBJECTIVETo carry out the pharmacological efficacyin vivoand mechanism research based on clear component of alkaloids of Sophorae Tonkinensis Radix et Rhizoma.METHODSHepatocarcinoma model rats were induced by diethylnitrosamine (DEN), SD rats were randomly divided into six groups: normal control group, hepatocarcinoma model group, cyclophosphamide group (0.01 g·kg-1)and low, medium, high dose group of alkaloids (0.036, 0.108, 0.324 g·kg-1), and seven weeks later treated with corresponding drugs for nine weeks. Observe physiological indexes and pathologic section of each group, the levels of AFP in serum were measured and the expression levels of VEGF、PI3K、PTEN mRNA were analyzed by RT-PCR.RESULTSCompared with model group, the alkaloids of Sophorae Tonkinensis Radix et rhizoma could significantly reduce the content of AFP in serum(P<0.05), Histological examination demonstrated that the number of liver cancer nodes in alkaloids groups were lower than that of model group, at the same time, the alkaloids of Sophorae Tonkinensis Radix et rhizoma could down-regulate the expression of VEGF, PI3K mRNA and up-regulate the expression of PTEN mRNA in liver tissue.CONCLUSIONThe clear pharmacological effects of liver cancer-suppressionin vivois produced by the alkaloids of Sophorae Tonkinensis Radix et rhizoma.Improved immunityand extended lifetime;Its mechanism is similar with cyclophosphamide, regulation VEGF, PI3K, PTEN expression. Provide a reference basis for alkaloids of Sophorae Tonkinensis Radix et rhizoma for the clinical application.
KEY WORDS:Sophorae Tonkinensis Radix et Rhizoma; anti-liver cancer; diethylnitrosamine(DEN); AFP;mechanism; RT-PCR
中图分类号:R965.2
文献标志码:A
文章编号:1007-7693(2018)03-0370-05
DOI:10.13748/j.cnki.issn1007-7693.2018.03.013
引用本文:曹洛云, 李天娇, 孟宪生, 等. 山豆根生物碱对DEN诱发肝癌大鼠的作用及机制研究[J]. 中国现代应用药学, 2018, 35(3): 370-374.
收稿日期:2017-08-10
基金项目:辽宁省教育厅一般项目(L201608)
作者简介:曹洛云,女,硕士 Tel: (0411)85890185 E-mail: caoluoyun0229@163com
*通信作者:孟宪生,男,教授,博导 Tel: (0411)85890185 E-mail: mxsvvv@126.com

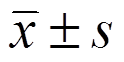 表示,多组间比较采用单因素方差分析,以P<0.05表示有统计学意义。
表示,多组间比较采用单因素方差分析,以P<0.05表示有统计学意义。
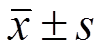 )
)


