表1 立法透明性
Tab. 1 Legislative transparency %

沈黎新1,钟元华2,沈莉3,董作军2*
(1.浙江省医疗器械检验院,杭州 310018;2.浙江工业大学药学院,杭州 310014;3.赛诺菲杭州制药有限公司,杭州 310051)
摘要:目的调查我国新版药品GMP的实施效果,分析存在的问题并提出相应对策建议。方法采用文献研究、问卷调查等方法,向药品行业人员发放问卷,调查内容涉及法制建设、执法队伍、执法监督和监管环境等方面。结果通过问卷调查,大部分受访者认为目前的法规协调性和实用性有待提高;检查员专业性和管理需加强;执法尺度需统一,检查信息公开不足;对是否取消认证制度仍存在一定疑虑。结论药品监管部门可加强法制建设,提高工作效率;加强检查员培训,逐步实现专职化;完善执法监督机制,提高检查公开程度;优化资源配置,营造良好监管环境。
关键词:药品监管;生产质量管理规范;检查员;执法;问卷调查
《药品生产质量管理规范》(Good Manufacturing Practice,GMP)是保证药品质量安全的主要手段。1982年,原中国药品行业协会发布了作为行业标准的GMP。1999年,原国家药品监督管理局以法规形式发布了1998年修订版GMP。2011年,卫生部发布了2010年修订的新版GMP。与1998年修订版相比,新版GMP在文本内容广度和深度上都有较大的增加[1]。虽然我国药品GMP在文本内容上已逐步与国际标准接轨,但实施情况如何仍需要仔细评估分析,并为下一步药品生产许可证和GMP认证证书的“两证合一”打下基础。
为增加研究的科学性,本研究应用文献研究、问卷调查等方法,综合分析和评估新版GMP的实施效果。
调查问卷发放对象为全国范围的药品生产企业人员、政府监管人员、高校、科研院所等机构专家。企业人员涵盖了国有企业、民营企业、中外合资企业、外方独资企业的企业负责人、生产管理人员、质量管理人员等。监管人员主要包括国家、省、市、县的药品安全监管人员、药品认证检查人员等。专家包括在高校、科研院所从事药品研发、生产制造、政策法规等领域的专家。
调查内容主要涉及GMP法律法规、执法队伍、执法监督、监管环境4个方面。
本次调查共回收问卷809份,其中有效问卷790份,无效问卷19份。790份有效问卷中,企业人员561名,占71.01%;监管人员189名,占23.92%;高校、科研院所等机构专家40名,占5.06%。
2.1.1 立法透明性 对于新版药品GMP相关法规、指南的制定过程公开透明程度,监管人员持正面态度(选择很好、较好,下同)>75%,企业人员次之(>65%),持正面态度的高校、科研院所等机构专家较少(仅有40%),见表1。
表1 立法透明性
Tab. 1 Legislative transparency %

按照现行部门立法的惯例,从法规立项、调研、初步起草到征求意见,系统内监管人员有更多机会参与立法。持正面态度的企业人员也相对较多,显示监管部门在立法过程中也相当重视企业的意见。持正面态度的机构专家较少,可能和其所处地位更加中立,直接参与立法较少相关。这也提示监管部门在制定法规时应该更加重视机构专家的意见和建议。
2.1.2 法规协调性 特别需要注意的是,在监管部门法规协调性上,持正面态度的企业人员和监管人员<40%;没有机构专家选择很好,选择较好的也仅有22.5%,见表2。说明GMP相关法规的协调性需要大大加强。
表2 法规协调性
Tab. 2 Regulatory harmonization %

2.1.3 法规实用性 对于当前药品管理法律法规处罚违反GMP行为的实用性,持正面态度的企业人员较多(>60%),而监管人员和高校、科研院所等机构专家较少(42%和32%),认为处罚力度小、实际可操作性差,见表3。由于目前处罚条款更加利于企业,或许是企业界满意度较高的原因。
表3 法规实用性
Tab. 3 Regulatory practicability %

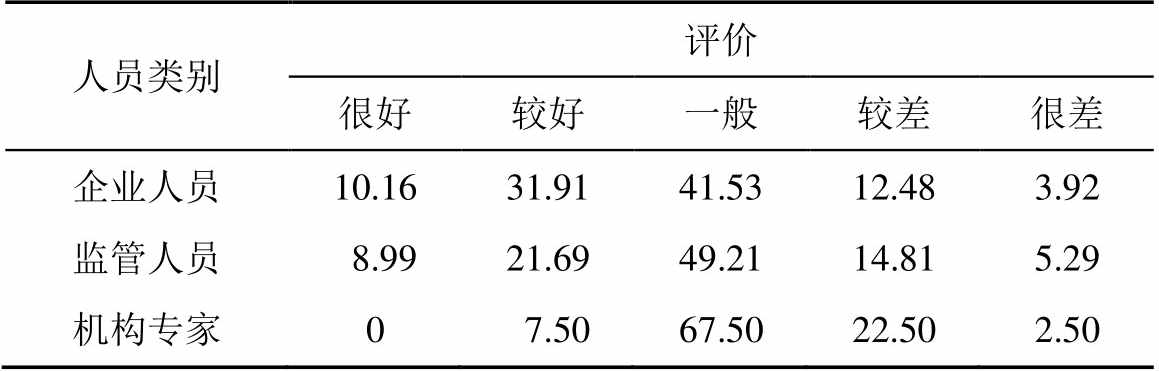
2.2.1 检查员专业性 对药品GMP检查员的专业性持正面态度的受访者<50%,见表4。这说明GMP执法队伍建设工作有待进一步加强,应从GMP检查员的遴选、培训等方面不断提高,从而保证其执法水平的一致性。
表4 检查员专业性
Tab. 4 Inspector speciality %
2.2.2 检查员管理 执法检查人员始终是有效监管的核心因素,其作用的有效发挥依靠相关管理制度的设置[2]。
对药品GMP检查员的管理持正面态度的受访者<40%,特别是监管人员自身的满意度不高,说明GMP检查员的培训、考核机制有待进一步完善,见表5。
表5 检查员管理
Tab. 5 Inspector management %

2.2.3 专职检查员 对于药品GMP专职检查员队伍,超过80%受访者认为有必要建立。大部分受访者支持在国家级或省级层面建立专职检查员队伍,企业人员和监管人员倾向于在省级层面建立(>40%),而高校、科研院所等机构专家更倾向于在国家级层面建立,见表6。
根据我国实际情况,笔者认为加强省级监管部门的专职检查员队伍建设更加切实可行。省级监管部门起到承上启下的作用,其更能发挥属地监管的优势。
表6 专职检查员
Tab. 6 Full-time inspector %

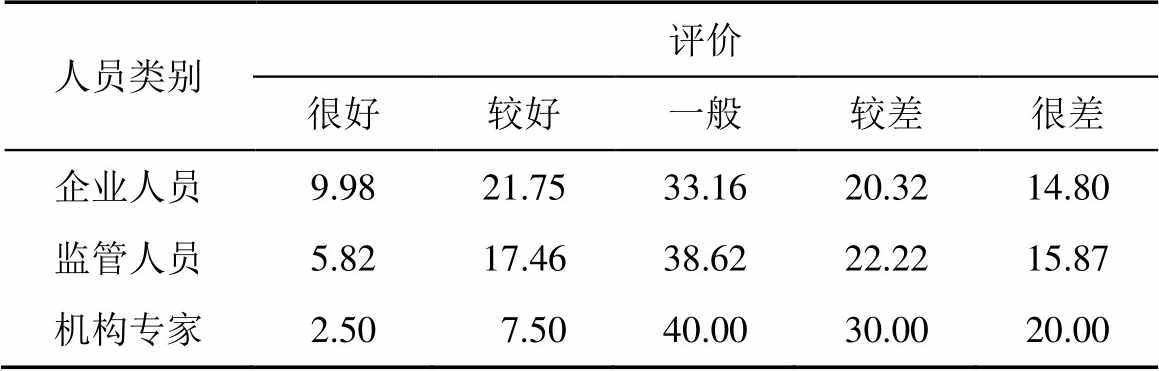
2.3.1 执法独立性 对各地药品监管部门的执法独立性持正面态度的受访者<40%,高校、科研院所等机构专家持正面态度的<15%,见表7。这从另一个角度说明目前的GMP检查执法受地方保护主义、检查员水平差异等因素的影响,尺度难以统一。
表7 执法独立性
Tab. 7 Enforcement independence %
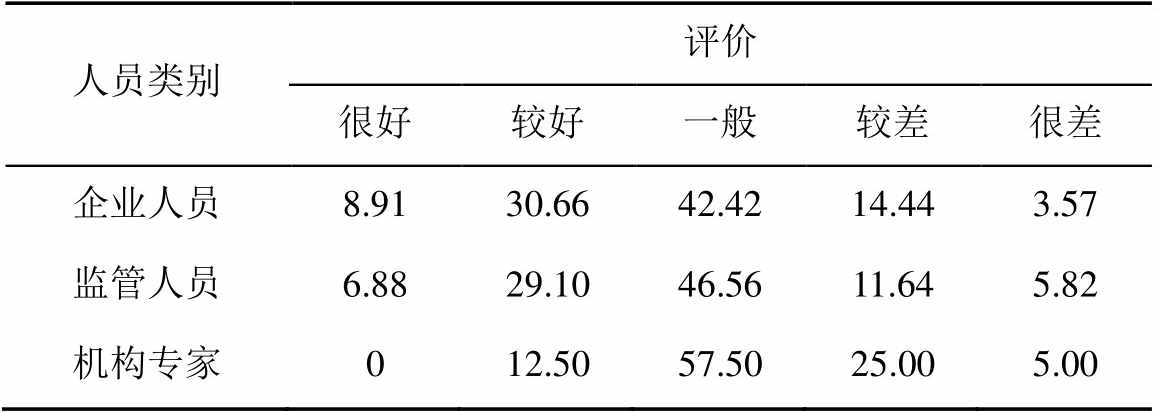
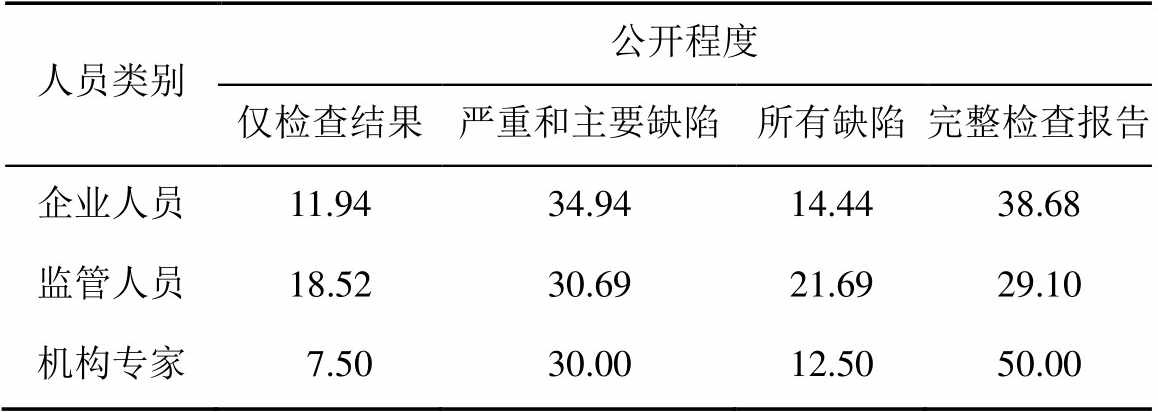
2.3.2 信息公开性 对于GMP检查报告应公开的程度,有50%以上的受访者认为应该公开所有缺陷或者完整的检查报告,见表8。说明受访者认为提高信息公开透明程度有利于统一GMP检查执法尺度、促进企业遵守GMP要求。
表8 信息公开性
Tab. 8 Information disclosure %
2.4.1 监管体制 大部分受访者(特别是超过85%的监管人员)认为垂直管理的药品监管体制有利于加强药品GMP监管,见表9。超过65%的监管人员认为目前取消了垂直管理的分层药品监管不利于药品GMP监管,见表10。
表9 垂直管理体制
Tab. 9 Vertical management system %

表10 分层管理体制
Tab. 10 Hierarchical management system %

2.4.2 监管方式 多数企业人员(63.28%)认为如果取消现行药品GMP认证制度(即加强日常检查以代替认证检查)不会影响企业GMP执行水平,而较多的监管人员(59.79%)和高校、科研院所等机构专家(62.5%)认为加强日常检查无法代替认证制度。这一方面说明对现有GMP认证制度的肯定,另一方面说明部分人员对取消认证制度的疑虑。
2.4.3 市场环境 大部分受访者认为目前的市场环境对企业主动提高药品质量的作用不大(持正面态度<30%),见表11,如部分省市招标采购唯最低价中标,导致发生劣币驱逐良币的现象。
这说明严格的GMP标准具有促进企业提高产品质量的作用,但市场选择才是最终决定因素。这提示监管部门,应当重视与相关部门共同营造优胜劣汰的市场环境,激发企业主动执行GMP、提高产品质量的能动性,形成正向激励。
表11 市场环境
Tab. 11 Market environment %
通过对上述调查的分析,笔者认为可从以下几个方面增强我国药品GMP实施效果。
良好的法律法规应具有以下特征,法规制定过程透明,利益相关者充分参与,符合社会和企业发展水平,具有权威性、协调性、可操作性等。
加强监管部门内部协调性。加强对安监、注册、市场、稽查的协调机制建设,及时出台各类指导原则,使源头监管、事中监管、事后处罚高效、顺畅衔接,加强GMP法规、标准的可操作性、可预测性和统一性。建议在修订《药品管理法》七十八条时,增加不符合GMP时应当对相应产品进行处置的相关规定,在原有基础上,再赋予监管部门根据违法情节暂停相应产品生产的处罚权。
加强检查员培训。由于体制编制所限,在选择合适的检查员方面自由度较小,可能使得执法水平出现较大差异。加强对检查员的日常培训,注重检查员综合能力的培养将更为重要[3]。在当前的培训体系中,符合GMP检查要求的知识体系建设和培训教材仍然是短板,需要着重加强。
逐步建立专职检查员队伍。目前在我国全面建立专职检查员制度,仍旧存在很多实际困难。现阶段,可以积极探索建立专职检查员与兼职检查员相结合的制度。每个认证检查机构均应设立专职检查员岗位,专职检查员数目至少要满足每个检查组配备一个专职检查员的要求。最理想的解决办法是在药品管理法修订时,将专职检查员队伍建设纳入法规要求,从根本上解决这一问题。
发挥国家食药总局的纵向监督作用。总局审核查验中心加强对各省级机构执行GMP检查标准的监督,将GMP认证检查执行标准的把握作为认证检查机构能力评估重要指标。例如,可组织对省级认证机构的认证案卷评查,GMP认证检查执行标准把握不到位将被列为缺陷项,认证检查机构必须及时整改。严重情况下,可以中止机构的认证检查资格。
构建透明公开的检查制度。发达国家基本都是公开检查报告全文的,公开越彻底越能起到应有作用。首先可以起到公开检查过程的作用,增加公众的信任度。其次,在这个过程中,也体现出检查员的水平和所把握的标准,有利于检查员水平的提高。第三,客观上起到促进执法标准的统一。面对执法标准上的差异,为维护法规执行的同一性,全面彻底的公开或许是最为简捷、成本最低的改善方法。
优化监管资源的配置。药品生产企业既是源头,也是药品监管所有对象中风险最高的群体,建议建立和完善药品生产监管数据库。利用大数据进行分析和风险评估,对风险高的企业和产品增加GMP检查频次,加大检查力度,提高检查的针对性,使有限的监管资源得到更合理的使用。
营造良好监管环境,加强企业执行GMP的主动性。药品生产企业是实施药品GMP制度的最终决定因素。加强药品质量量度研究,做到能够区分企业执行水平,优先采购高水平企业的产品。切实执行黑名单制度,并与招标采购制度挂钩,对严重违反GMP的企业实行市场禁入。
REFERENCES
[1]YAN J Z, SHAO R. Research on current situation, difficulties and specific suggestions of certification of the new version of GMP [J]. Pharm Res(药学研究), 2014, 33(6): 311-314.
[2]刘渊, 毕军, 邹毅. 国内外药品GMP检查员制度对比分[J]. 中国药师, 2011, 14(6): 870-873.
[3]Zhou Y, Ma J. Problems in implementation on current GMP and counter measures [J]. Chin Pharm Aff(中国药事), 2015 (4): 350-352.
(本文责编:曹粤锋)
Investigation and Analysis of New Drugs GMP Implementation Effect
SHEN Lixin1, ZHONG Yuanhua2, Shen Li3, DONG Zuojun2*
(1.Zhejiang Institute of Medical Device Testing, Hangzhou 310018, China; 2.College of Pharmaceutical Science, Zhejiang University of Technology, Hangzhou 310014, China; 3.Senofi Hangzhou Pharmaceutical Co., Ltd., Hangzhou 310051, China)
ABSTRACT: OBJECTIVETo investigate implementation effect of new drugs GMP, analyse problems and propose policy suggestions.METHODSLiterature review and questionnaire survey were adopted. The questionnaire included legal construction, law enforcement personnel, supervision and environment.RESULTSThrough the questionnaire survey, most respondents thought that regulatory harmonization and practicability should be improved. Speciality and management of inspector should be enhanced. Enforcement was not unified, and information disclosure was insufficient.Some respondents still doubt whether the GMP certification should be eliminated.CONCLUSIONDrug administration can strengthen legal construction and raise working efficiency; enhance training and gradually realize full-time inspector; improve enforcement supervision and disclose the inspection information; optimize the resource distribution and set up a favorable environment.
KEY WORDS:drug administration; GMP; inspector; law enforcement; questionnaire survey
中图分类号:R951
文献标志码:B
文章编号:1007-7693(2018)03-0436-04
DOI:10.13748/j.cnki.issn1007-7693.2018.03.030
引用本文:沈黎新, 钟元华, 沈莉, 等. 新版药品GMP实施效果调查与分析[J]. 中国现代应用药学, 2018, 35(3): 436-439.
收稿日期:2017-08-09
基金项目:浙江省软科学研究项目(2017C35052)
作者简介:沈黎新,男 Tel: 13750881819 E-mail: 244928716@qq.com
*通信作者:董作军,男,博士 Tel:13588116094 E-mail: jzd1970@zjut.edu.cn