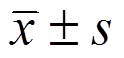 表示并用SPSS 14.0统计分析软件进行处理,2组间均数的比较采用Student’st检验,多组间均数的比较采用单因素方差分析,P<0.05认为有显著性差异。
表示并用SPSS 14.0统计分析软件进行处理,2组间均数的比较采用Student’st检验,多组间均数的比较采用单因素方差分析,P<0.05认为有显著性差异。郑璐,胡静,陈雪,许权
(宁波市医疗中心李惠利医院放疗科,浙江 宁波 315000)
摘要:目的研究miR-489对卡铂的协同抗乳腺癌效应及机制。方法MTT细胞活力试验检测卡铂和miR-489对T-47D细胞的杀伤活性。生物信息学、western blot试验及荧光素酶报告基因试验验证X连锁凋亡抑制蛋白(X-linked inhibitor of apoptosis protein,XIAP)是否为miR-489的靶点。分离去除T-47D细胞中的线粒体,western blot试验检测miR-489、卡铂及XIAP质粒处理后T-47D细胞Smac/DIABLO的释放和caspase-9及caspase-3的活化。免疫共沉淀试验检测XIAP与Smac/DIABLO的相互作用。流式细胞术检测T-47D细胞的凋亡情况。结果miR-489处理能显著增强卡铂对T-47D细胞的杀伤活性。XIAP是miR-489的靶点。miR-489不影响卡铂依赖的线粒体中Smac/DIABLO的释放,但能通过下调XIAP的表达减弱XIAP与Smac/DIABLO的相互作用。另外,转染XIAP质粒能显著抑制miR-489对卡铂的协同抗乳腺癌效应, XIAP质粒能显著抑制miR-489联合卡铂对T-47D细胞凋亡的诱导。XIAP质粒能显著抑制miR-489联合卡铂对T-47D细胞caspase-9及caspase-3的活化。结论miR-489抑制XIAP的表达发挥对卡铂的协同抗乳腺癌作用。
关键词:乳腺癌;miR-489;X连锁凋亡抑制蛋白;卡铂;凋亡
乳腺癌是女性中发病率最高的恶性肿瘤,手术是治疗乳腺癌最有效的手段。然而由于乳腺癌的肿瘤转移能力较强,不少乳腺癌患者在确诊时肿瘤已发展为中晚期,严重影响手术治疗效果[1-2]。对于这些中晚期乳腺癌患者而言,化疗是不可替代的重要方法。然而长期大剂量的化疗药物使患者有很大的不良反应,严重影响患者的生活质量,而且大剂量化疗药物的使用容易造成肿瘤细胞对化疗的抵抗[3-4]。因此联合应用一些辅助治疗药物降低化疗药物的剂量并提高化疗药物的抗肿瘤活性具有十分重要的意义。
卡铂是一种广谱抗肿瘤化疗药物,对包括乳腺癌在内的多种肿瘤均有较好的治疗效果。卡铂进入肿瘤细胞后能与细胞DNA发生交联反应,从而破坏DNA的结构和正常的功能,诱导肿瘤细胞发生凋亡性死亡[5-6]。卡铂的药理活性类似于顺铂,但卡铂的神经毒性和耳毒性明显低于顺铂。尽管如此,大剂量的卡铂对患者的不良反应特别是骨髓抑制反应仍然较大,而且随着卡铂的持续使用,肿瘤细胞对卡铂的敏感性会逐渐降低[7-8],因此降低卡铂的使用剂量,并提高乳腺癌细胞对卡铂的敏感性是提高化疗效果并改善患者生活质量的有效方法。
MicroRNAs(miRNAs)是存在于细胞中的非编码寡聚核苷酸,长度约为20~25个核苷酸。miRNAs能与靶基因的mRNA 3’ 非翻译区(3’ UTR)发生互补结合,从而抑制靶基因的转录和翻译,因此miRNAs是细胞中调节基因表达的重要分子,参与细胞的增殖、分化、迁移、凋亡等各种生物学活动[9-10]。研究表明肿瘤细胞中miRNAs表达水平的失调会促进肿瘤的增殖和转移。更为重要的是,一些miRNAs表达水平的改变还能引起肿瘤细胞的化疗抵抗,降低包括卡铂在内的化疗药物的抗肿瘤活性,而纠正肿瘤细胞中失调的miRNAs则能显著提高肿瘤细胞对化疗的敏感性[11-14]。文献报道miR-489在多种肿瘤细胞中低表达[15-16],因此miR-489可能是一种肿瘤抑制性miRNA。更为重要的是,研究表明在一些肿瘤细胞中过表达miR-489能显著提高其对化疗药物的敏感性[17],因此miR-489可能是一种潜在的化疗增效药物。本研究的目的在于探讨miR-489对卡铂的抗乳腺癌活性是否有协同作用,并研究其机制。
人乳腺癌细胞系T-47D购于美国模式培养物保存中心(ATCC),培养在含10%胎牛血清的DMEM培养基中,置于37 ℃恒温培养箱,并通入5% CO2。
卡铂(批号:C2538)、噻唑蓝(MTT,批号:M2128)和凋亡检测试剂盒(批号:APOAF)购于美国Sigma-Aldrich;DMEM培养基(美国Gibco,批号:11995065);蛋白G免疫共沉淀琼脂糖珠(批号:sc-2002)和X连锁凋亡抑制蛋白(X-linked inhibitor of apoptosis protein,XIAP)小干扰RNA(XIAP siRNA,批号:sc-37508)购于美国Santa Cruz;XIAP(批号:#14334)、Smac/DIABLO(批号:#15108)、caspase-9 (批号:#9502)、caspase-3(批号:#9665)和GAPDH (批号:#5174)抗体购于美国Cell Signaling;ECL试剂盒(批号:32109,购于美国Pierce);pcDNA3.1 (批号:V79520)、Lipofectamine 2000(批号:11668019)购于美国Invitrogen;pGL3荧光素酶报告基因质粒(批号:E1751)和双荧光素酶报告基因检测试剂盒(批号:E1910)购于美国promega;miR-489模拟物(上海吉玛生物);线粒体分离试剂盒(江苏碧云天生物科技有限公司,批号:C3601);Applied Biosystems 7500 Sequence Detection system荧光定量PCR仪(美国Applied Biosystems公司);FACSCalibur流式细胞仪(美国Becton Dickinson公司)。
构建:人XIAP基因的开放阅读框架序列经PCR扩增后以分子克隆的方法与pcDNA3.1连接后构建成XIAP重组过表达质粒。人XIAP基因的3’ UTR序列经PCR扩增后以分子克隆的方法与pGL3荧光素酶报告基因质粒连接后构建成包含XIAP 3’ UTR的报告质粒。转染:XIAP重组过表达质粒(2 μg·mL-1)、包含XIAP 3’ UTR的报告质粒(2 μg·mL-1)、miR-489模拟物(0~500 pmol·mL-1)及XIAP siRNA(50 pmol·mL-1)用脂质体2000进行包裹后将其加入到无血清培养基进行混合。T-47D细胞接种在6孔板上孵育过夜,培养板中加入上述无血清培养基孵育6 h,之后弃去该无血清培养基并加入新鲜的含10%胎牛血清的DMEM培养基培养24 h。
按文献所示方法[18],将T-47D细胞用miR-489和包含XIAP 3’ UTR的报告质粒进行共转染。之后按照双荧光素酶报告基因检测试剂盒操作步骤检测细胞中的荧光素酶活性。相对荧光素酶活性用处理组与对照组的荧光素酶活性比值表示。
miR-489及XIAP质粒转染的T-47D细胞按每孔5×103接种在96孔板上孵育过夜,使细胞贴壁。之后再用2 µmol·L-1卡铂处理肿瘤细胞48 h。药物处理完毕后在培养基中加入20 μl MTT (5 μg·mL-1)并在37 ℃恒温培养箱中继续培养4 h,移除孔内培养基,加入100 μl二甲亚砜,570 nm波长下测定A值。细胞活力结果用药物处理组与对照组的A值比值表示。
miR-489及XIAP质粒转染的T-47D细胞按每孔5×103接种在96孔板上孵育过夜,使细胞贴壁。之后再用2 µmol·L-1卡铂处理肿瘤细胞48 h。药物处理完毕后用线粒体分离试剂盒按试剂说明书步骤将T-47D细胞中的线粒体从细胞质中分离出来,取无线粒体的细胞质进行后续的western blot试验。
miR-489及XIAP质粒转染的T-47D细胞按每孔5×103接种在96孔板上孵育过夜,使细胞贴壁。之后再用2 µmol·L-1卡铂处理肿瘤细胞48 h。药物处理完毕后提取T-47D细胞中的总蛋白质。将等量的总蛋白质用12.5% SDS-PAGE进行电泳分离。分离完毕后通过电转方法将蛋白质从分离胶上转到聚偏二氟乙烯膜上,用XIAP、Smac/DIABLO、caspase-9、caspase-3和GAPDH抗体(均1∶1 000稀释)孵育过夜,之后再用带辣根过氧化物酶的二抗孵育2 h,蛋白条带用ECL试剂盒显色发光。目的蛋白的相对表达用目标蛋白灰度值与GAPDH灰度值的比值表示,蛋白灰度值分析用Image J软件处理。
miR-489及XIAP质粒转染的T-47D细胞按每孔5×103接种在96孔板上孵育过夜,使细胞贴壁。之后再用2 µmol·L-1卡铂处理肿瘤细胞48 h。药物处理完毕后裂解细胞并将细胞在12 000r·min-1下离心10 min,收取上清液分成等量2份,一份直接进行western blot试验,检测Smac/DIABLO和XIAP的蛋白表达水平作为对照(input),另外一份加入XIAP抗体孵育过夜。XIAP抗体孵育完毕后加入蛋白G琼脂糖珠孵育2 h。之后在12 000 r·min-1下离心10 min收集沉淀的蛋白G琼脂糖珠,加入上样缓冲液进行western blot试验,检测与XIAP结合的Smac/DIABLO蛋白。
miR-489及XIAP质粒转染的T-47D细胞按每孔5×103接种在96孔板上孵育过夜,使细胞贴壁。之后再用2 µmol·L-1卡铂处理肿瘤细胞48 h。药物处理完毕后按照凋亡试剂盒说明书步骤将PI(碘化丙啶)和Annexin-V加入细胞中孵育20 min,采用western blot试验检测肿瘤细胞的凋亡,Annexin-V阳性细胞即为凋亡细胞。
所有试验重复3次,试验数据用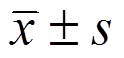 表示并用SPSS 14.0统计分析软件进行处理,2组间均数的比较采用Student’st检验,多组间均数的比较采用单因素方差分析,P<0.05认为有显著性差异。
表示并用SPSS 14.0统计分析软件进行处理,2组间均数的比较采用Student’st检验,多组间均数的比较采用单因素方差分析,P<0.05认为有显著性差异。
MTT试验结果显示卡铂(0~16 µmol·L-1)对T-47D细胞的杀伤活性呈浓度依赖性,低浓度卡铂对T-47D细胞的杀伤活性较弱。miR-489单独处理(0~500 pmol·L-1)对T-47D细胞的杀伤活性较弱,且T-47D对miR-489的浓度依赖性较弱(图1A~B)。然而,实验结果显示联用miR-489 (50 pmol·mL-1)能显著提高各种浓度卡铂(0~16 µmol·L-1)对T-47D细胞的杀伤活性,使低浓度卡铂(2 µmol·L-1)也能显著杀伤T-47D细胞(图1C)。为了研究miR-489是否对低浓度卡铂的抗乳腺癌活性有协同作用,后续试验选择低浓度卡铂(2 µmol·L-1)和miR-489 (50 pmol·mL-1)进行联合治疗。试验结果显示联用miR-489能显著提高卡铂对T-47D细胞的杀伤活性(图1D),表明在乳腺癌细胞中过表达miR-489能显著提高其对卡铂诱导的细胞死亡的敏感性,增强卡铂的治疗效果。
miRNA靶点预测公共数据库TargetScan (www.targetscan.org)显示XIAP基因的3’ UTR存在miR-489的互补结合位点(图2A),提示XIAP可能是miR-489的靶点。另外,由于肿瘤细胞中XIAP的表达水平与化疗药物抵抗密切相关[19-20],因此本研究探讨乳腺癌细胞在卡铂治疗中miR-489与XIAP的调节关系。Western blot试验结果显示在T-47D细胞中转染miR-489能显著降低细胞中XIAP的表达水平(图2B)。另外,荧光素酶报告基因试验结果显示XIAP在T-47D肿瘤干细胞中可能受miR-489的调控。转染miR-489后,荧光素酶报告基因试验结果显示在T-47D细胞中转染miR-489能显著降低细胞中包含XIAP 3’ UTR的pGL3质粒的荧光素酶活性,但miR-489对对照pGL3质粒的荧光素酶活性无影响(图2C)。这些结果表明miR-489能与XIAP基因的3’ UTR发生互补结合,并显著降低XIAP基因的表达水平,XIAP是miR-489的有效靶点。MTT试验结果显示在T-47D细胞中转染XIAP表达质粒后,miR-489联合卡铂对T-47D细胞的杀伤活性受到显著抑制。另外,直接用siRNA沉默XIAP也能明显提高卡铂对T-47D的杀伤活性(图2D),表明miR-489发挥对卡铂协同抗乳腺癌效应的机制可能为miR-489下调乳腺癌细胞中XIAP的表达水平。
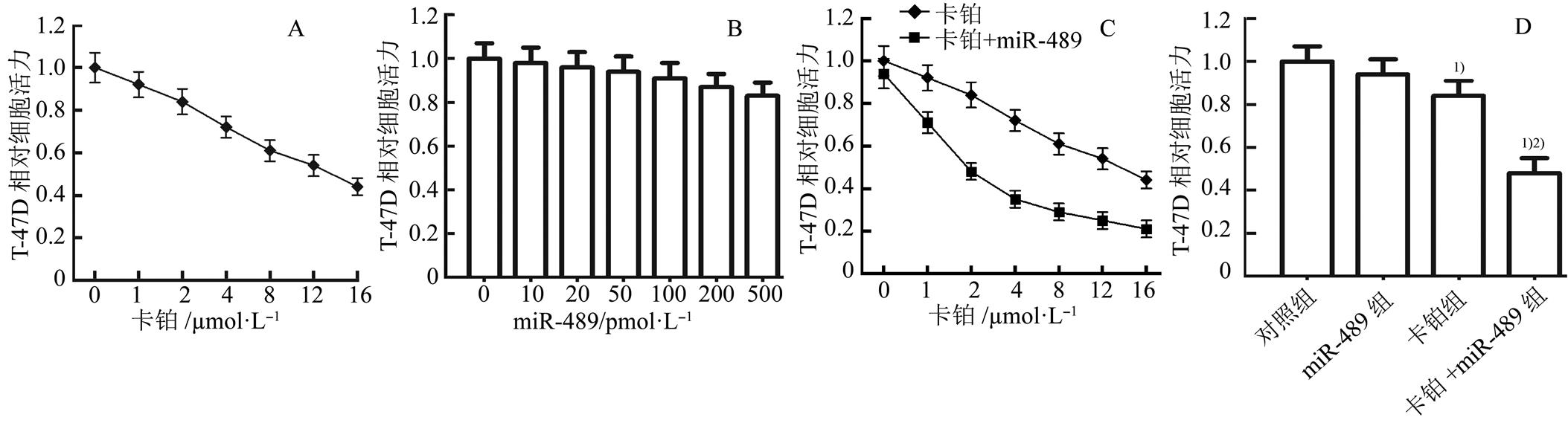
图1 miR-489增强卡铂对T-47D细胞的杀伤活性(n=3,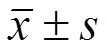 )
)
A-卡铂(0~16 µmol·L-1)单独处理对T-47D细胞的杀伤活性;B-miR-489(0~500 pmol·mL-1)单独处理对T-47D细胞的杀伤活性;C-miR-489 (50 pmol·mL-1)显著增强不同浓度卡铂(0~16 µmol·L-1)对T-47D细胞的杀伤活性;D-miR-489 (50 pmol·mL-1)对低浓度卡铂(2 µmol·L-1)的协同抗乳腺癌活性;与对照组相比,1)P<0.05;与卡铂组相比,2)P<0.05。
Fig . 1 miR-489 enhanced the cytotoxicity of carboplatin to T-47D cells(n=3,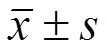 )
)
A-cytotoxicity of carboplatin (0-16 µmol·L-1) single treatment to T-47D cells; B-cytotoxicity of miR-489 (0-500 pmol·mL-1) single treatment to T-47D cells; C-miR-489 (50 pmol·mL-1) enhanced the cytotoxicity of different concentrations of carboplatin (0-16 µmol·L-1) to T-47D cells; D-synergistic effect of miR-489 (50 pmol·mL-1) on the low dose of carboplatin (2 µmol·L-1) against breast cancer; Compared with the control group,1)p<0.05; Compared with the carboplatin group,2)p<0.05.
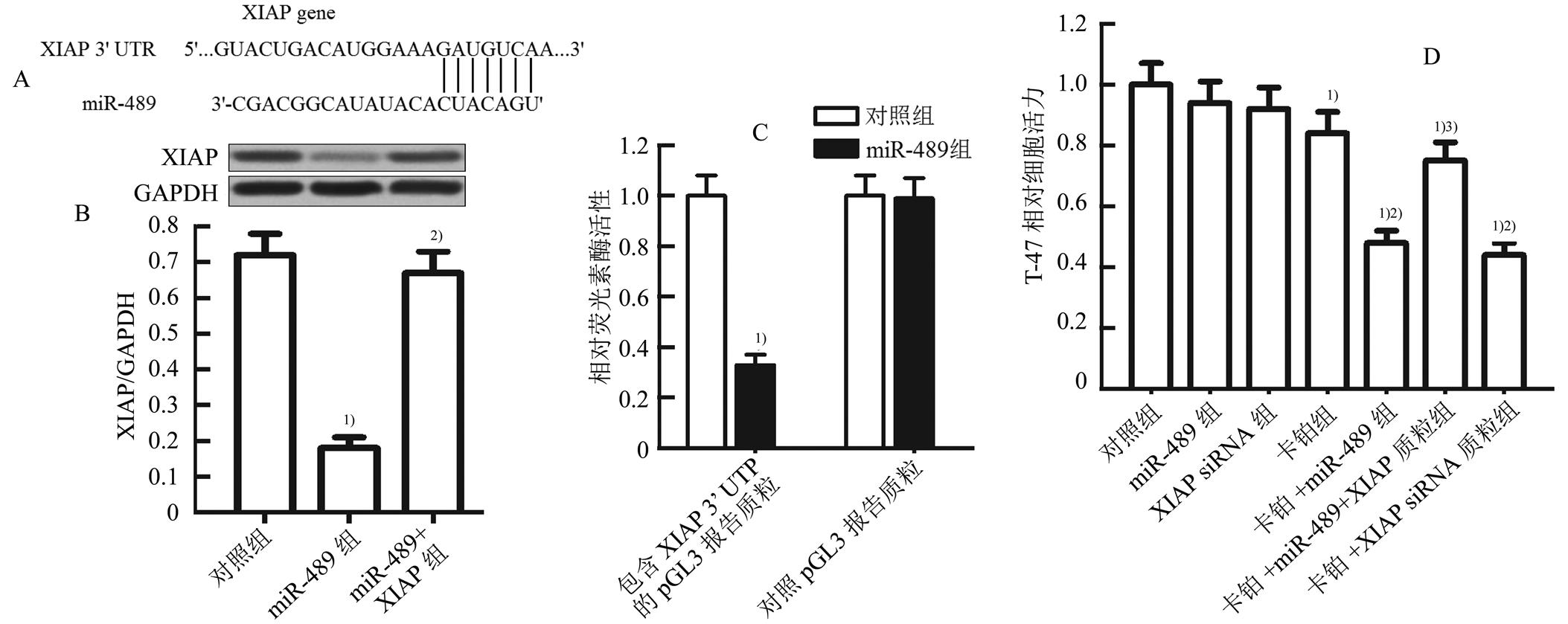
图2 miR-489通过下调XIAP的表达增强卡铂对T-47D细胞的杀伤活性(n=3,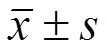 )
)
A-TargetScan公共数据库表明XIAP基因的3’ UTR存在miR-489的互补结合位点。B-转染miR-489抑制T-47D细胞中XIAP的表达水平,而转染XIAP质粒能废除miR-489对XIAP的抑制作用;与对照组比较,1)p<0.05;与miR-489组相比,2)p<0.05。C-转染miR-489显著降低包含XIAP 3’ UTR的pGL3质粒的荧光素酶活性;与对照组比较,1)p<0.05。D-转染XIAP表达质粒抑制miR-489对卡铂的协同抗乳腺癌活性;与对照组相比,1)p<0.05;与卡铂组相比,2)p<0.05;与miR-489+卡铂组相比,3)p<0.05。
Fig. 2 miR-489 enhanced the cytotoxicity of carboplatin to T-47D through inhibiting the expression of XIAP(n=3,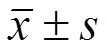 )
)
A-TargetScan public database showed that the XIAP 3’ UTR contained complementary sequence paired with miR-489. B-miR-489 inhibited the expression of XIAP in T-47D cells, whereas the XIAP plasmid abolished the inhibition of XIAP induced by miR-489; compared with the control group,1)p<0.05; compared with the miR-489 group,2)P<0.05. C-Transfection with miR-489 in T-47D decreased the luciferase activity of pGL3 plasmid contained with XIAP 3’ UTR; compared with the control group,1)p<0.05. D-Transfection of XIAP plasmid inhibited the synergistic effect of miR-489 on carboplatin-induced cytotoxicity to breast cancer; compared with the control group,1)p<0.05; compared with the carboplatin group,2)p<0.05; compared with the carboplatin+miR-489 group,3)P<0.05.
免疫共沉淀试验结果显示卡铂处理能诱导T-47D细胞的Smac/DIABLO从线粒体中释放到细胞质中,然而XIAP能与细胞质中的Smac/DIABLO发生结合。miR-489处理虽不能促进卡铂诱导的Smac/DIABLO的释放,但它能通过下调XIAP的表达明显减弱XIAP与Smac/DIABLO的相互作用(图3A)。Western blot试验结果显示miR-489能明显促进T-47D细胞中卡铂诱导的caspase-9及其下游caspase-3的活化(图3B)。流式细胞试验结果显示miR-489能明显促进卡铂对T-47D细胞凋亡的诱导活性(图3C)。另外,转染XIAP质粒明显抑制miR-489联合卡铂对T-47D细胞caspases的活化和凋亡的发生,这些结果表明了miR-489通过抑制XIAP的表达促进卡铂对乳腺癌的凋亡诱导活性。
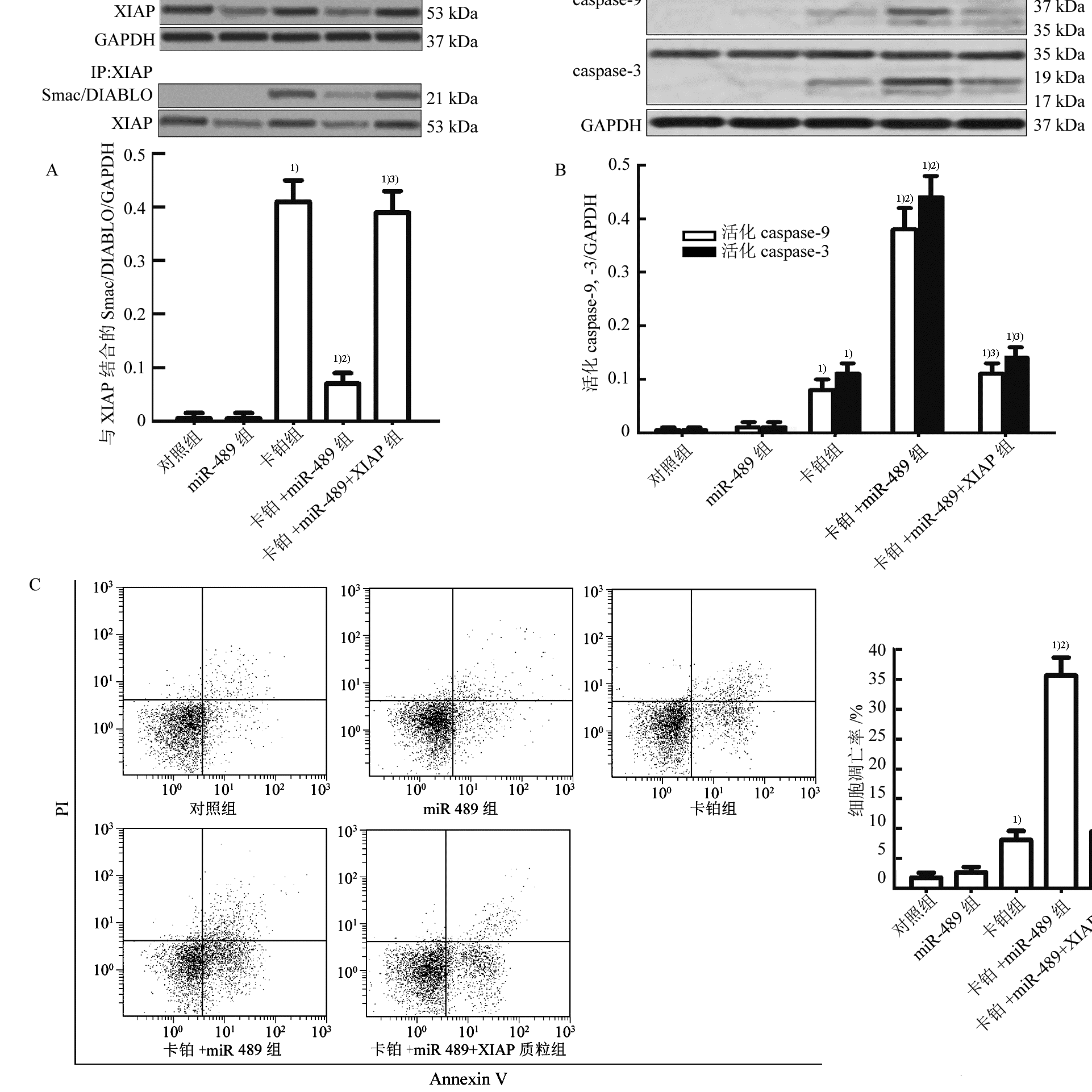
图3 miR-489通过抑制XIAP的表达促进卡铂诱导的细胞凋亡(n=3,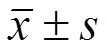 )
)
A-miR-489通过下调XIAP的表达抑制XIAP与Smac/DIABLO的相互作用;B-miR-489促进T-47D细胞中卡铂诱导的caspase-9及其下游caspase-3的活化;与miR-489+卡铂组相比,3)p<0.05;C-miR-489促进卡铂对T-47D细胞的凋亡诱导活性;与对照组相比,1)p<0.05;与卡铂组相比,2)p<0.05;与miR-489+卡铂组相比,3)p<0.05。
Fig. 3 miR-489 enhanced the carboplatin-induced apoptosis through inhibiting the expression of XIAP(n=3,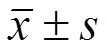 )
)
A-miR-489 inhibited the interaction with XIAP and Smac/DIABLO through inhibiting the expression of XIAP; B-miR-489 promoted carboplatin- induced activation of caspase-9 and caspase-3; C-miR-489 promoted carboplatin-induced apoptosis in T-47D cells; compared with the control group,1)p<0.05; compared with the carboplatin group,2)p<0.05; compared with the carboplatin+miR-489 group,3)p<0.05.
研究表明miR-489是一种肿瘤抑制性分子。在膀胱癌细胞中,miR-489能下调jagged 1(JAG1)蛋白的表达从而抑制肿瘤细胞的增殖和转移[15];又如在肺癌细胞中,miR-489往往表达下调,而在肿瘤细胞中过表达miR-489后,肺癌组织的生长受到明显抑制[16]。然而,miR-489是否在乳腺癌的化疗中起协同作用,至今还很少报道。在本研究中,试验结果发现在乳腺癌细胞中过表达miR-489能明显提高乳腺癌细胞对低浓度卡铂的敏感性,表明miR-489对卡铂有协同抗乳腺癌活性。
XIAP属于抗凋亡蛋白家族成员,能与细胞质中的Smac/DIABLO等凋亡活性物质结合,从而使凋亡活性物质失活而发挥抗凋亡作用,因此细胞中XIAP的水平越高则细胞对凋亡信号的敏感性越弱[21-22]。研究表明肿瘤细胞中XIAP的过表达是肿瘤细胞产生对化疗药物抵抗性的重要因素,往往肿瘤患者的XIAP表达水平越高,其预后也越差[19-20],因此采取辅助治疗方法降低肿瘤细胞中XIAP的表达水平被认为是提高化疗疗效的有效方法[23]。
在本研究中,实验结果发现miR-489能明显提高卡铂对乳腺癌细胞的凋亡诱导活性。机制研究实验结果发现卡铂治疗能诱导Smac/DIABLO这一重要的凋亡活性物质从线粒体中释放到细胞质中。而miR-489辅助治疗虽然不能直接增强卡铂诱导的Smac/DIABLO的释放,但能与XIAP基因的3’ UTR互补结合抑制XIAP的表达水平,从而显著降低细胞质中的Smac/DIABLO与XIAP的结合,使Smac/DIABLO游离出来激活下游的caspase-9和caspase-3,最终促进卡铂诱导的细胞凋亡。
综上所述,本研究证明了miR-489辅助治疗能显著提高卡铂对乳腺癌细胞的杀伤活性。通过机制研究发现miR-489能通过下调XIAP的表达明显减弱XIAP与Smac/DIABLO的相互作用,从而增强卡铂对乳腺癌细胞的凋亡诱导活性。这些研究为卡铂等化疗药物的增效作用提供了新的策略和思路。
REFERENCES
[1] Siegel R, Naishadham D, Jemal A. Cancer statistics, 2013 [J]. CA Cancer J Clin, 2013, 63(1): 11-30.
[2] ZHANG H, ZHU L. Osthole induce human breast cancer cells lines MCF-7 apoptosis by activating p53 signaling pathway [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2016, 33(5): 547-551.
[3] Pan Y, Shao D, Chen L, et al. Berberine reverses hypoxia-induced chemoresistance in breast cancer through the inhibition of AMPK-HIF-1α [J]. Int J Biol Sci, 2017, 13(6): 794-803.
[4] Sun G, Yang L, Ma B, et al. PRKDC regulates chemosensitivity and is a potential prognostic and predictive marker of response to adjuvant chemotherapy in breast cancer patients [J]. Oncol Rep, 2017, 37(6): 3536-3542.
[5] Barghout S H, Zepeda N, Fu Y, et al. RUNX3 contributes to carboplatin resistance in epithelial ovarian cancer cells [J]. Gynecol Oncol, 2015, 138(3): 647-655.
[6] Lum E, Vigliotti M, Lucito R, et al. Loss of DOK2 induces carboplatin resistance in ovarian cancer via suppression of apoptosis [J]. Gynecol Oncol, 2013, 130(2): 369-376.
[7] Wang L Y, Xie H, Wang Y, et al. Efficacy of carboplatin-based preoperative chemotherapy for triple- negative breast cancer. A meta-analysis of randomized controlled trials [J]. Saudi Med J, 2017, 38(1): 18-23.
[8] Castrellon A B, Pidhorecky I, Raez L E, et al. The role of carboplatin in the neoadjuvant chemotherapy treatment of triple negative breast cancer [J]. Oncol Rev, 2017, 11(1): 324.
[9] Gargalionis A N, Basdra E K. Insights in microRNAs biology [J]. Curr Top Med Chem, 2013, 13(13): 1493-1502.
[10] Iorio M V, Croce C M. MicroRNA involvement in human cancer [J]. Carcinogenesis, 2012, 33(6): 1126-1133.
[11] Zarogoulidis P, Petanidis S, Zarogoulidis K, et al. MiR-205 and miR-218 expression is associated with carboplatin chemoresistance and regulation of apoptosis via Mcl-1 and Survivin in lung cancer cells [J]. Cell Signal, 2015, 27(8): 1576-1588.
[12] HE H, TIAN W, JIANG K, et al. MiR-944 functions as a novel oncogene and regulates the chemoresistance in breast cancer [J]. Tumour Biol, 2016, 37(2): 1599-1607.
[13] Dong Z, Zhong Z, Gong Z, et al. MicroRNA-31 inhibits cisplatin-induced apoptosis in non-small cell lung cancer cells by regulating the drug transporter ABCB9 [J]. Cancer Lett, 2014, 343(2): 249-257.
[14] LONG J P, WAN F, ZHOU J, et al. Relationship between the mir-182 and the cisplatin-resistance in breast cancer [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2016, 33(6): 721-726.
[15] Li J, Qu W, Du S, et al. miR-489 suppresses proliferation and invasion of human bladder cancer cells [J]. Oncol Res, 2016, 24(6): 391-398.
[16] Zhang B, Ji S, Chen X, et al. miR-489 acts as a tumor suppressor in human gastric cancer by targeting PROX1 [J]. Am J Cancer Res, 2016, 6(9): 2021-2030.
[17] Wu H, Xiao Z, Hao Q, et al. MiR-489 modulates cisplatin resistance in human ovarian cancer cells by targeting Akt3 [J]. Anticancer Drugs, 2014, 25(7): 799-809.
[18] Jiang J, Feng X, Yang Y, et al. MiR-128 reverses the gefitinib resistance of the lung cancer stem cells by inhibiting the c-met/PI3K/AKT pathway [J]. Oncotarget, 2016, 7(45): 73188-73199.
[19] Rodríguez-Berriguete G, Torrealba N, RoyuelaM, et al. Prognostic value of inhibitors of apoptosis proteins (IAPs) and caspases in prostate cancer: caspase-3 forms and XIAP predict biochemical progression after radical prostatectomy [J]. BMC Cancer, 2015(15): 809-817.
[20] Obexer P, Ausserlechner M J. X-linked inhibitor of apoptosis protein-a critical death resistance regulator and therapeutic target for personalized cancer therapy [J]. Front Oncol, 2014(4): 197.
[21] Attaran-Bandarabadi F, Abhari B A, Davoodi J, et al. Integrity of XIAP is essential for effective activity recovery of apoptosome and its downstream caspases by Smac/Diablo [J]. Int J Biol Macromol, 2017(101): 283-289.
[22] Zhou S, Huang Q, Zhang X, et al. miR-27a regulates the sensitivity of breast cancer cells to cisplatin treatment via BAK-SMAC/DIABLO-XIAP axis [J]. Tumour Biol, 2016, 37(5): 6837-6845.
[23] Flanagan L, Kehoe J, Prehn J H, et al. High levels of X-linked Inhibitor-of-Apoptosis Protein (XIAP) are indicative of radio chemotherapy resistance in rectal cancer [J]. Radiat Oncol, 2015, 10(1): 131-139.
(本文责编:蔡珊珊)
MiR-489 targets X-linked Inhibitor of Apoptosis Protein to enhance the anti-tumor effect of carboplatin on breast cancer
Zheng Lu, Hu Jing, Chen Xue, Xu Quan
(Department of Radiotherapy, Li Huili Hospital of Ningbo Medical Center, Ningbo 315000, china)
Abstract: objectiveTo investigate the effect and mechanism of miR-489 on enhancing the anti-tumor effect of carboplatin on breast cancer.MethodsCell viability of T-47D which were treated with miR-489 and carboplatin was measured by using MTT assay. Bioinformatics, western blot analysis and luciferase reporter assay were performed to confirm whether the XIAP was the target of miR-489. After removal of mitochondria, western blot analysis was conducted to detect the release of Smac/DIABLO and activation of caspase-9 and caspase-3 in T-47D cells treated with carboplatin and miR-489. Co-immunoprecipitation assay was performed to evaluate the interaction with XIAP and Smac/DIABLO. Flow cytometry analysis was used to measure the cell apoptosis of T-47D.ResultsResults of MTT assays showed that miR-489 significantly enhanced the cytotoxicity of carboplatin to T-47D. Results of bioinformatics, western blot analysis and luciferase reporter assay showed that XIAP was the target of miR-489 in T-47D. Overexpression of miR-489 couldn’t influence the carboplatin-induced release of Smac/DIABLO. However, miR-489 was able to inhibit the interaction of Smac/DIABLO and XIAP through down-regulating the expression of XIAP in T-47D. In addition, transfection with XIAP plasmid significantly abolished the synergistic effect of miR-489 on carboplatin-induced cytotoxicity to breast cancer. Results of flow cytometry showed that transfection with XIAP plasmid significantly abolished the miR-489-promoed apoptosis induced by carboplatin. Results of Western blot analysis showed that transfection with XIAP plasmid significantly abolished the miR-489-promoed activation of caspase-9 and caspase-3 induced by carboplatin.ConclusionMiR-489 targets XIAP to enhance the anti-tumor effect of carboplatin on breast cancer.
KEY WORDS:breast cancer; miR-489; X-linked inhibitor of apoptosis protein (XIAP); carboplatin; apoptosis
中图分类号:R965.2
文献标志码:A
文章编号:1007-7693(2018)03-0319-06
DOI:10.13748/j.cnki.issn1007-7693.2018.03.004
引用本文:郑璐, 胡静, 陈雪, 等. miR-489协同卡铂通过抑制XIAP的表达发挥抗乳腺癌作用[J]. 中国现代应用药学, 2018, 35(3): 319-324.
收稿日期:2017-07-03
作者简介:郑璐,女,硕士,副主任医师 Tel: (0574)87018701 E-mail: mzh99mzh@163.com