伴随诊断相关抗肿瘤药物的发展现状
张俊琦1,周斌2*
(1.复旦大学附属儿科医院药剂科,上海 201102;2.同济大学附属东方医院血管外科,上海 200120)
摘要:肿瘤基础研究和基因分子生物学技术的进步促进了伴随诊断和相关抗肿瘤药物的发展。目前伴随诊断应用的最大分支是通过伴随诊断获得患者针对特定治疗药物的治疗反应的信息,协助制定治疗方案,实现患者的个体化治疗。但伴随诊断及其相关药物在研发和应用上与传统药物有较大不同,本文试对其做一综述。
关键词:伴随诊断;抗肿瘤药物;发展现状
伴随诊断(companion diagnostics,CDx)是指通过体外检验设备,提供一定的疾病信息,来帮助提高相性和有效性对应药物在使用过程中安全的手段。这一说法近年来被美国食品药品监督局(Food and Drug Administration,FDA)认可。但仍有文献称之为“药理基因生物标记”或“治疗诊断”。
2011年,FDA发布了CDx指南草案,指出CDx试验是一种用于确认药物的安全有效性体外实验,它应该包括以下3方面:①确定最有可能受益于该特定药物的患者;②区分出那些最有可能受特定药物损害(增加严重不良反应发生率)的患者;③监测治疗反应,据此调整方案(如药物使用的时间、剂量、终止等),提高药物有效性和安全性。由此可见,FDA赋予CDx的功能是用于预测疗效(有效性和安全性)和监测反应。
目前,CDx的预测性和选择性是最受关注的部分。因为在药物的开发中,CDx有利于设计小样本的临床试验方案,在开发过程中,以更少的投入获得更清楚明确的结果。伴随的优势在于可以为患者筛选出有效的治疗方案,节省无效治疗的时间和费用,提高患者服药的依从性,降低不良反应的发生率,保证了药物安全性和疗效。
1 CDx典型药物
目前CDx主要在肿瘤学、心血管疾病[1]、中枢神经系统疾病[2]、炎症和病毒学。其中在肿瘤药物领域应用最为广泛[3],现已开发多种CDx用于相对应的癌症生物标记物的检测。根据普华永道对体外诊断产业的统计数据,2009—2010年肿瘤药物与CDx结合达34宗,远超过中枢神经性疾病,感染性疾病及其他疾病类药物与CDx结合的案例数(伴随诊断高端萌芽)。而在肿瘤学中,主要的靶向基因主要包括原癌基因人类表皮生长因子受体-2(human epidermal growth factor receptor-2,HER2)[4-5],上皮生长因子受体(epidermal growth factor receptor,EGFR)[5]等。以下几个CDx相关的药物在其发展过程中具有重要意义。
1.1 以HER2为靶基因的药物及其伴随诊断
HER2是EGFR家族蛋白的一员,作为酪氨酸激酶受体在调节细胞增殖、分化和生存等众多行为过程中发挥重要作用,在部分乳腺肿瘤和消化道肿瘤中过表达,也是最早作为CDx相关药物靶点的分子;目前HER2相关的药物在通过FDA上市许可的CDx相关药物中,占2/3。
表1 主要的CDx相关药物和CDx适应症[6]
Fig. 1 Major CDx related drugs and CDx indications
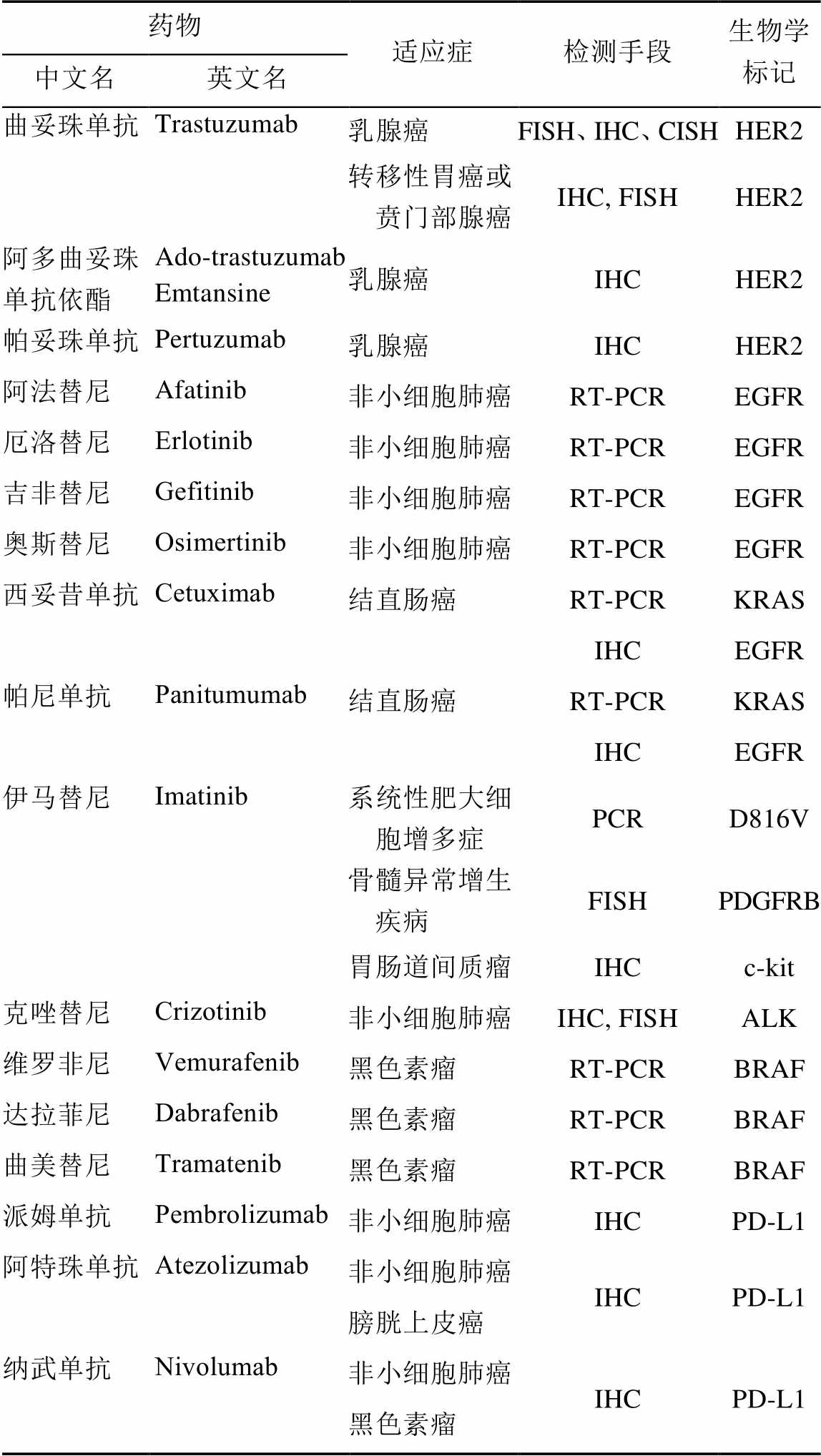
药物适应症检测手段生物学标记 中文名英文名 曲妥珠单抗Trastuzumab乳腺癌FISH、IHC、CISHHER2 转移性胃癌或贲门部腺癌IHC, FISHHER2 阿多曲妥珠单抗依酯Ado-trastuzumab Emtansine乳腺癌IHCHER2 帕妥珠单抗Pertuzumab乳腺癌IHCHER2 阿法替尼Afatinib非小细胞肺癌RT-PCREGFR 厄洛替尼Erlotinib非小细胞肺癌RT-PCREGFR 吉非替尼Gefitinib非小细胞肺癌RT-PCREGFR 奥斯替尼Osimertinib非小细胞肺癌RT-PCREGFR 西妥昔单抗Cetuximab结直肠癌RT-PCRKRAS IHCEGFR 帕尼单抗Panitumumab结直肠癌RT-PCRKRAS IHCEGFR 伊马替尼Imatinib系统性肥大细胞增多症PCRD816V 骨髓异常增生疾病FISHPDGFRB 胃肠道间质瘤IHCc-kit 克唑替尼Crizotinib非小细胞肺癌IHC, FISHALK 维罗非尼Vemurafenib黑色素瘤RT-PCRBRAF 达拉菲尼Dabrafenib黑色素瘤RT-PCRBRAF 曲美替尼Tramatenib黑色素瘤RT-PCRBRAF 派姆单抗Pembrolizumab非小细胞肺癌IHCPD-L1 阿特珠单抗Atezolizumab非小细胞肺癌IHCPD-L1 膀胱上皮癌 纳武单抗Nivolumab非小细胞肺癌IHCPD-L1 黑色素瘤
曲妥珠单抗是最早应用于临床的CDx相关药物,它是一种重组DNA衍生的人源化单克隆抗体,从哺乳动物细胞中产生,能选择性作用于HER2的细胞外部分。曲妥珠单抗是FDA正式批准的第一个与CDx结合的药物。曲妥珠单抗用于治疗HER2过表达的转移性乳腺癌,最初该药物主要采用荧光原位杂交(fluorescence in situ hybridization,FISH)技术[7],但随着药物应用范围的逐渐扩大,有些适应证也认可免疫组织化学(immunohistochemistry,IHC)技术检测。随着技术的进步,有些公司推出了色素原位杂交技术(Chromogenicin Situ Hybridization,CISH)作为检测手段,并进入了临床应用。
虽然曲妥珠单抗在单用或者联合其他化疗药物治疗HER2阳性肿瘤时都体现出显著优势,甚至有学者建议将HER2阳性的肿瘤列为一个单独种类[8],但目前尚无研究数据可以确认何种方式可以作为筛选HER2金标准。HER2的检测以及治疗的预后受很多因素的影响,包括个体原因的曲妥珠单抗的抵抗,HER2的结构异常和下游信号通路异常,酪氨酸激酶信号通路的交互作用等。为了提高HER2检测的准确性,有学者建议通过多次多个标本检测来避免,并同时结合患者的全身状况来考虑。例如HER2阳性的乳腺癌进入全身转移的阶段后,相当部分患者再检验结果转为阴性,同时这些患者的生存周期也较短。这些数据提示对于进展期乳腺癌的活检需要有所改变[9-10]。HER2检测的价值也可能因为IHC和FISH的分析错误而降低。除了科学界的努力,规范机构认证,操作流程和质量控制,也对提高HER2检测价值有重要意义。
继曲妥珠单抗之后,又有一些用于治疗HER2阳性乳腺癌的药物被批准用于临床,如帕妥珠单抗(pertuzumab)和阿多曲妥珠单抗依酯(Ado- trastuzumab emtansine)[11]等,虽然这些药物作用的靶点有所差异,其在研究过程中使用的是IHC试剂盒HercepTest和FISH试剂盒HER2FISH pharmDx,所以FDA只认可这2种试剂盒得出CDx,应用于相对应的药物[12]。
1.2 以EGFR为靶基因的药物及其伴随诊断
EGFR过表达多见于恶性肿瘤晚期,在预后较差、化疗较不敏感的肿瘤中多见。EGFR抑制剂包括2大类:一类是针对EGFR酪氨酸激酶抑制剂(epidermal growth factor receptor tyrosine kinase inhibitor,EGFR-TKI),如吉非替尼(Gefitinib)和厄洛替尼(Erlotinib)等;一类是针对EGFR细胞外区域的单克隆抗体,其中西妥昔单抗为代表。
吉非替尼是首个应用于临床上的EGFR-TKI。吉非替尼通过阻止EGFR细胞内相关信号通路的传导及EGFR二聚体的形成,从而发挥抑制肿瘤血管的生成及肿瘤细胞的增殖、加速肿瘤细胞的生长周期终止及凋亡的效果,在治疗EGFR阳性的非小细胞肺癌(non-small cell lung cancer,NSCLC)有良好的效果,作为成人患者的一线治疗方案。最初吉非替尼的试剂盒采用RT-PCR技术,检测循环肿瘤DNA(circulating tumor DNA,ctDNA)的方法获得认可,评估EGFR的突变状态,进而鉴别出最有可能从吉非替尼治疗中收益的NSCLC的人群。该检测方法是一种非侵入性的诊断方法,利用一种高度敏感的技术,检测患者血液样本的ctDNA片段中的EGFR突变状态[13]。在后续的研究中,该试剂盒表现出了可靠的EGFR突变状态鉴别能力。这种手段使得临床医师能够迅速监测并预判用药的效果,制定相应的用药计划,减少不必要的用药和相关的不良反应。
EGFR-TKI虽然在治疗NSCLC中取得了比较好的效果,但也存在容易耐药的问题,目前已经开发到第三代,如奥斯替尼(Osimertinib)已经在部分国家上市,我国自主研发的Avitinib也取得了不错的阶段性临床成果。
拉帕替尼(Lapatinib)是双靶点TKI,此药可同时作用于HER2和EGFR 2个靶点,可与其激酶区的ATP位点发生可逆性的结合,抑制其受体的自磷酸化,同时特异性地抑制ErbB1和ErbB2酪氨酸酶的活性,竞争性地与其胞内激酶区的ATP位点结合,有效阻止其发生激酶磷酸化。拉帕替尼对于HER2阳性的晚期乳腺癌,尤其是曲妥珠单抗治疗效果不佳的患者具有重要意义,其CDx检测手段和曲妥珠单抗是一致的。
西妥昔单抗是抗EGFR的人鼠嵌合单克隆抗体,与EGFR细胞外区域结合,有效地竞争性抑制其与天然配体的结合。西妥昔单抗用于治疗EGFR表达阳性的结肠直肠癌患者,同时也用于治疗头颈部的鳞状细胞肿瘤。值得注意的是,EGFR下游的Ras信号通路持续活化可能使治疗无效,因此使用此类药物需要同时排除Ras信号通路的突变。西妥昔单抗的CDx包括IHC确认EGFR阳性和用RT-PCR确认KRAS无突变。类似的药物如帕尼单抗等也需要2项CDx技术确认其适应症。
1.3 以间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)为靶基因的药物及其伴随诊断
ALK是NSCLC的关键启动基因。虽然只有5%的患者会出现ALK基因的重排,但中国每年新发病例数仍在递增。ALK阳性的NSCLC具有明显的分子靶点,靶点诊断技术及靶向药物,ALK酪氨酸激酶抑制剂(ALK tyrosine kinase inhibitor,ALK-TKI)由此研发,并获得了良好的临床效果[14]。
克唑替尼是最早获得批准上市的ALK-TKI药物,其CDx采用FISH技术检测ALK,后来就增加了IHC作为CDx手段。该药物及其CDx上市前的临床研究采用了极为简单的实验设计,只用了255个ALK阳性患者,就说服了FDA批准其临床应用。这些患者都进入了Ⅰ期和Ⅱ期的非随机临床试验,且其临床疗效都很有说服力[15-16]。FDA的报告中认为,克唑替尼在2项研究中的有效率分别为50%和61%,高于任何一种现有的NSCLC化疗方案,且安全性更好。虽然临床试验的样本很小,并且是非随机对照试验,但克唑替尼及其CDx仍被认为足够成熟,可以上市。
随着克唑替尼的应用,部分患者的肿瘤ALK再次发生突变而形成耐药,其耐药机制包括ALK靶点依赖性耐药,即通过突变恢复ALK信号通路和通过旁路替代激活。ALK靶点依赖耐药的突变位点相对恒定,在此基础上,又有了“第二代”ALK抑制药物色瑞替尼(Ceritinib)和艾乐替尼(Alectinib)[17-18],这些药物的CDx检测和克唑替尼相同。
1.4 针对KRAS和BRAF的药物
KRAS和BRAF都是Ras相关信号通路上的重要蛋白。KRAS突变多见于晚期胰管腺癌和大肠癌。由于KRAS是EGFR的下游信号分子,在KRAS突变后持续激活的情况下,一般的抗EGFR药物(如西妥昔单抗和帕尼单抗)效果不佳,因此FDA要求这些药物只有在明确KRAS无突变的情况下才能使用[19]。目前尚无直接针对Ras的药物上市,但针对Ras上下游信号通路的酶抑制剂已经有面市的产品,其中就包括抑制BRAF的维罗非尼。
治疗黑色素瘤的维罗非尼相对应的CDx方法为RT-PCR,该药物在极短的时间内被FDA临床准入,被认为是CDx研发最成功的案例之一。维罗非尼是针对BRAF V600E突变型黑色素瘤的药物,其I期临床试验仅纳入26名研究对象,即因为效果卓越而获准进入Ⅱ期临床,在临床研究开始后5年内获准商业化应用,极大地提高了各大公司对CDx相关药物的研究热情[20]。
1.5 BCR-ABL激酶抑制剂
慢性粒细胞白血病(chronic myelogenousleukemia,CML)中,约90%患者的外周血细胞中可以检测到一种异常的PH染色体。PH染色体[t(9;22)(q34;q11)]由9号染色体与22号染色体相互易位形成的,原9号染色体的BCR基因与原22号染色体的c-ABL基因形成了新的基因序列BCR-ABL融合基因。该基因编码的P210蛋白质增强了酪氨酸激酶的活性,从而产生了细胞凋亡的抑制作用[21]。
伊马替尼是第一代BCR-ABL抑制剂,对BCR-ABL酪氨酸激酶的抑制作用最为显著;但对其他酪氨酸激酶如制ABL、PDGFR、Kit受体以及ARG的自磷酸化也有很好的作用,因此伊马替尼也应用于系统性肥大细胞增多症、胃肠道间质肿瘤、黑色素瘤和骨髓纤维化[22]。不同的适应症所需要的CDx技术有所不同,系统性肥大细胞增多症的CDx技术是通过PCR检测D816V;骨髓异常增生/异常发育疾病的CDx技术是FISH检测PDGFRB;而胃肠道间质瘤则通过IHC检测c-kit[23]。
与其他类型的酪氨酸激酶抑制剂一样,伊马替尼的广泛应用也引起了耐药问题,根据其耐药的分子机制,陆续又有达沙替尼、普纳替尼、尼洛替尼等药物陆续被开发,这些药物对于伊马替尼耐药的CML有良好的治疗效果,但目前尚无相关的CDx技术。
1.6 PD-1/PD-L1蛋白相关的CDx药物
PD-1是由PDCD1基因编码的T细胞表面受体蛋白,负向调节T细胞活化,是一种I型跨膜糖蛋白,由IgV型结构域的胞外区、跨膜区和含免疫受体酪氨酸抑制性模序和酪氨酸转换性模序的胞内区3个功能区构成,其中酪氨酸转换性模序是关键功能区。PD-1通过与其配体PD-L1或PD-L2结合发挥作用。PD-L1广泛分布于各类组织,PD-L2主要见于抗原呈递细胞。目前已经发现PD-L1在卵巢癌、黑色素瘤、肾癌、NSCLC等多种肿瘤组织中均有表达;同时在血液系统肿瘤疾病中亦存在PD-L1表达,且其表达与淋巴瘤的侵袭性相关。肿瘤细胞可以通过表达PD-L1,与活化T表面PD-1结合,增加T细胞线粒体内过氧化氢和活性氧,抑制T细胞增殖、活化,诱导T细胞凋亡,达到逃避免疫监视,诱导免疫耐受[24]。
纳武单抗和派姆单抗都通过作用于PD-1发挥作用,两者都可用于不能切除的黑色素瘤或以铂类化疗为基础的NSCLC患者。纳武单抗还有晚期肾癌(接受过抗血管增生治疗)和霍奇金淋巴瘤(缓解或接受过化疗患者)的适应症。阿特珠单抗则通过结合PD-L1发挥抑制作用,活化T细胞PI3k- Akt-mTOR信号,增强肿瘤的抗原性,适应症主要为膀胱上皮癌。目前检测PD-1/PD-L1主要依赖IHC技术检测PD-L1,针对PD-L1的CDx仍然处于比较初级的阶段,有学者提出“补充诊断(complementary diagnostic)”的概念,以区分于传统CDx的概念[25-26]。
PD-1和PD-L1相关药物作用机制通过增强肿瘤免疫实现,该机制涉及肿瘤广泛,其适应症仍在不断增加。
2 CDx的临床试验
CDx相关药物出现的时间要早于CDx的概念,例如曲妥珠单抗上市时尚未有CDx的完整概念,直到2005年FDA提出了对伴随诊断监管的概念性文件,并列出了一系列CDx发展的重要问题,例如分析验证,检测终点,数据分析,临床验证,临床应用以及伴随诊断的监管流程等。在药物研发之初就要开发CDx相关的事宜,在Ⅲ期临床试验之前对伴随诊断要有完整的分析和临床验证是CDx相关药物研发与传统药物最大的不同。
早期CDx检测为阴性的患者同样需要给予随机对照试验,这增加了CDx相关药物的研发成本。在随后7年的发展中,CDx的设计概念逐步改变,有些时候只需将CDx检测阳性患者分配到随机试验中,而不用再检测CDx阴性的患者。如Cobas 4800 BRAF V600突变试验,对应的药物维罗非尼;HercepTest和HER2FISH pharmDx试剂盒对应帕妥珠单抗。目前CDx又提出更简单的改进设计,如Vysis ALK Break Apart FISH探针试剂盒对应克唑替尼的研究。这项研究使用非随机目标设计,虽然参与研究的人数很少,但审批者通过结合之前的研究数据,仍认为它有足够的说服力。但也有案例中出现CDx不被认可,相对应的药物也无法获得审批。如治疗伊马替尼抵抗的慢性粒细胞白血病的药物高三尖杉酯碱就因此未通过审批[27]。
在技术上,CDx从早期以IHC为主,逐步发展到目前FISH、RT-PCR以及DNA测序技术,有的药物已经开始应用分子影像学技术[28]、循环DNA、细胞器基因等技术[29-30];在相关的扶持政策上,CDx相关药物的临床试验要求在逐步简化,这些政策促进了制药和生物技术公司研发相应药物的热情,缩短了药物由实验室进入临床使用的时间,使更多的患者受益。
3 展望
“癌基因依赖”的概念对CDx模型的发展有重要影响,即认为虽然肿瘤有多个基因突变和表型异常,只要打断关键的癌基因,肿瘤的生长就可能受抑制[31]。因此如果认识到一个“癌基因”的存在,那么相对应的药物和CDx就可能被开发出来。例如伊马替尼治疗消化道间质瘤,通过检测c-KIT(CD117)的IHC试剂盒做CDx,在CD117变异的肿瘤,抑制CD117即足够抑制甚至杀灭肿瘤细胞,而不需考虑其他突变的基因。而这些药物一旦离开伴随诊断工具,其疗效会显著下降[6]。
现有研究认为,药物客观有效率>50%的情况下,非随机对照的临床研究就足够说明问题,应当获得临床应用。将来很有可能见到更多的“癌基因依赖”疾病,患者可以通过检测1个生物指标,然后获得有效率>50%的药物治疗。在这种情况下,只需要使用较少的受试者,而更多证实有效的报告可以在批准后的临床应用阶段获得。这个模式可以满足患者和临床医师快速有效地获得治疗,也有利于制药企业和生物技术公司更快地获取抗肿瘤药物上市许可。CDx发展极为迅速,目前已经上市或者在临床试验阶段的CDx药物已有300种左右,在针对同一个靶点位置也出现了竞争性品种[32]。
“癌基因依赖”只是肿瘤发展某一特定阶段的现象。临床研究和基础研究的结构都提示针对特定抗肿瘤药,肿瘤可以通过突变逃避,患者因此出现病情进展。基于此理论,多数学者认为单用特定的抗肿瘤药物无法维持太长时间或者治愈肿瘤。对肿瘤基因多态性的认知已经有几十年的历史,也是促使研究者开始考虑肿瘤个体化用药的基础之一。最近的研究发现,肿瘤的基因异质性不仅限于个体之间,同一个肿瘤的不同时间段也会有不同,研究表明肿瘤行为的变化不只是由基因突变驱动,外界因素和微环境也对其发生影响[33-34]。这些发现更进一步说明肿瘤的治疗是一个复杂的过程。有学者开始提出CDx 2.0的概念,即随着高通量测序技术、多光谱分析、大数据挖掘和人工智能辅助等技术的发展并应用于CDx,通过肿瘤基因组学和蛋白质组学的分析,检测多个生物学指标的检测,明确肿瘤的一致性和特定肿瘤的驱动突变,以获得更好的治疗效果[35-36]。
对肿瘤分子生物学认识的增加或许会挑战现有的药物诊断发展模式。2015年美国国家肿瘤研究中心启动分子分析与治疗选择试验(United States National Cancer Institute Molecular Analysis for Therapy Choice,NCI-MATCH),探索下一代CDx的可能性[37]。在不久的将来,人类可需要根据CDx把患者分成更小但更精确的生物组进行针对性治疗。甚至将每个患者的合并疾病,和不同肿瘤分子生物学特性录入全球公用的数据库,通过独立的临床专家,药学和生物方面的专家审阅,并且有专家组对每个患者进行分组,进而给予针对性用药。这样的系统需要制药和诊断公司共同协作,推动CDx和靶向抗肿瘤药物的临床应用。每当肿瘤的分子生物学中有所发现,就可能发现新的肿瘤药物和药物诊断,并缩短其应用于临床所花费的时间。同时,这些发展和变化需要考虑伦理、监管和实际应用中的挑战。
REFERENCES
[1] Hinton R B. Advances in the treatment of aortic valve disease: Is it time for companion diagnostics? [J]. Curr opin pediatr, 2014, 26(5): 546-552.
[2] Nikolcheva T, Jager S, Bush T A, et al. Challenges in the development of companion diagnostics for neuropsychiatric disorders [J]. Expert Rev Mol Diagn, 2011, 11(8): 829-837.
[3] Olsen D, Jorgensen J T. Companion diagnostics for targeted cancer drugs-clinical and regulatory aspects [J]. Front Oncol, 2014(4): 105. doi: 10.3389/fonc.2014.00105. eCollection 2014.
[4] Hiraoka M. companion diagnostics with fish assay (her2, alk) [J]. Rinsho byori, 2014, 62(4): 390-398.
[5] Angulo B, Lopez-Rios F, Gonzalez D. A new generation of companion diagnostics: Cobas braf, kras and egfr mutation detection tests [J]. Expert rev molecular diagn, 2014, 14(5): 517-524.
[6] Jorgensen J T, Hersom M. Companion diagnostics-a tool to improve pharmacotherapy [J]. Ann Transl Med, 2016, 4(24): 482. doi: 10.21037/atm.2016.12.26.
[7] Thomas J, Stratton E, Keppens M. Companion diagnostics: Emerging strategies and issues in pharmaceutical development [J]. Expert Rev Mol Diagn, 2012, 12(6): 561-563.
[8] Slamon D, Eiermann W, Robert N, et al. Adjuvant trastuzumab in her2-positive breast cancer [J]. New Engl jmed, 2011, 365(14): 1273-1283.
[9] Niikura N, Liu J, Hayashi N, et al. Loss of human epidermal growth factor receptor 2 (her2) expression in metastatic sites of her2-overexpressing primary breast tumors [J]. J Clin Oncol, 2012, 30(6): 593-599.
[10] Lindström L S, Karlsson E, Wilking U M, et al. Clinically used breast cancer markers such as estrogen receptor, progesterone receptor, and human epidermal growth factor receptor 2 are unstable throughout tumor progression [J]. J Clin Oncol, 2012, 30(21): 2601-2608.
[11] ZHAO W b, LIU W h, XU Y c, et al. Progress in research on antibody-drug conjugates [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2016, 33(2): 238-245.
[12] Agilent Technologies. FDA approves two dako assays as companion diagnostics for Genentech’s new breast cancer medicine kadcyla [ET/OL]. [2013-03-05]. Http: //www.agilent. com.
[13] Douillard J Y, Ostoros G, Cobo M, et al. Gefitinib treatment in egfr mutated caucasian nsclc: Circulating-free tumor DNA as a surrogate for determination of egfr status [J]. J Thorac Oncol, 2014, 9(9): 1345-1353.
[14] XU B Y. Research progress for Akt inhibitors [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2016, 33(2): 250-255.
[15] Ou S H I. Crizotinib: A novel and first-in-class multitargeted tyrosine kinase inhibitor for the treatment of anaplastic lymphoma kinase rearranged non-small cell lung cancer and beyond [J]. Drug Des Devel Ther, 2011(5): 471-485.
[16] Kwak E L, Bang Y J, Camidge D R, et al. Anaplastic lymphoma kinase inhibition in non-small-cell lung cancer [J]. New Engl J Med, 2010, 363(18): 1693-1703.
[17] Perez C A, Velez M, Raez L E, et al. Overcoming the resistance to crizotinib in patients with non-small cell lung cancer harboring eml4/alk translocation [J]. Lung cancer, 2014, 84(2): 110-115.
[18] Cameron L, Solomon B. New treatment options for alk-rearranged non-small cell lung cancer [J]. Curr Treat Options Oncol, 2015, 16(10): 49. doi: 10.1007/s11864-015- 0367-z.
[19] Prior I A, Lewis P D, Mattos C. A comprehensive survey of ras mutations in cancer [J]. Cancer res, 2012, 72(10): 2457-2467.
[20] Ravnan M C, Matalka M S. Vemurafenib in patients with braf v600e mutation-positive advanced melanoma [J]. Clin Ther, 2012, 34(7): 1474-1486.
[21] LI L y, XU Y g. Advance research of BCR-ABL kinase inhibitor [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2016, 33(7): 954-962.
[22] Lennartsson J, Ronnstrand L. Stem cell factor receptor/c-kit: From basic science to clinical implications [J]. Physiol rev, 2012, 92(4): 1619-1649.
[23] Iqbal N, Iqbal N. Imatinib: A breakthrough of targeted therapy in cancer [J]. Chemother Res Pract, 2014(2014): 357027. Doi: 10.1155/2014/357027.
[24] Callahan M K, Postow M A, Wolchok J D. Targeting T cell co-receptors for cancer therapy [J]. Immunity, 2016, 44(5): 1069-1078.
[25] Pennell N A. Pd-l1 testing and lack of benefit to guide treatment with immune checkpoint inhibitors in patients with non-small-cell lung cancer [J]. JAMA oncol, 2016, 2(5): 569-570.
[26] Jorgensen J T. Companion and complementary diagnostics: Clinical and regulatory perspectives [J]. Trends cancer, 2016, 2(12): 706-712.
[27] Jorgensen J T. Companion diagnostics in oncology - current status and future aspects [J]. Oncol, 2013, 85(1): 59-68.
[28] Doble B, Tan M, Harris A, et al. Modeling companion diagnostics in economic evaluations of targeted oncology therapies: Systematic review and methodological checklist [J]. Expert Rev Mol Diagn, 2015, 15(2): 235-254.
[29] Sotgia F, Lisanti M P. Mitochondrial mRNA transcripts predict overall survival, tumor recurrence and progression in serous ovarian cancer: Companion diagnostics for cancer therapy [J]. Oncotarget, 2017, 8(40): 66925-66939.
[30] Sotgia F, Lisanti M P. Mitochondrial biomarkers predict tumor progression and poor overall survival in gastric cancers: Companion diagnostics for personalized medicine [J]. Oncotarget, 2017, 8(40): 67117-67128.
[31] Weinstein I B, Joe A. Oncogene addiction [J]. Cancer Res, 2008, 68(9): 3077-3080.
[32] Trusheim M R, Berndt E R. The clinical benefits, ethics, and economics of stratified medicine and companion diagnostics [J]. Drug Discov Today, 2015, 20(12): 1439-1450.
[33] Gerlinger M, Rowan A J, Horswell S, et al. Intratumor heterogeneity and branched evolution revealed by multiregion sequencing [J]. New Engl J Med, 2012, 366(10): 883-892.
[34] Kreso A, O'Brien CA, Van Galen P, et al. Variable clonal repopulation dynamics influence chemotherapy response in colorectal cancer [J]. Science, 2013, 339(6119): 543-548.
[35] Khoury J D, Catenacci D V. Next-generation companion diagnostics: Promises, challenges, and solutions [J]. Arch Pathol Lab Med, 2015, 139(1): 11-13.
[36] Khoury J D. The evolving potential of companion diagnostics [J]. Scand J Clin Lab Invest Suppl, 2016(245): S22-S25.
[37] Brower V. Nci-match pairs tumor mutations with matching drugs [J]. Nat Biotechnol, 2015, 33(8): 790-791.
(本文责编:蔡珊珊)
Progresses of Companion Diagnostics Relatede Antitumor Drugs
Zhang Junqi1, Zhou Bin2*
(1.Pharmacy Department, Children’s Hospital, Fudan University, Shanghai 201102, china; 2.Vascular Surgery Department, East Hospital, Tongji University School of Medicine, Shanghai 200120, china)
Abstract:Companion diagnostics (CDx) and CDx related antitumor drugs develope very fast recently for the improvement of basic research of oncomolecular biology. Antitumor drugs is the largest branch of CDx nowadays. Doctors may prognosis drug effect by CDx, which is important in making treatment plan and individualized treatment. There are many differences between traditional chemotherapy drugs and CDx related drugs. Here is a review of companion diagnostics related antitumor drugs.
Key words:companion diagnostics; antitumor drugs; progress
中图分类号:R979.1
文献标志码:C
文章编号:1007-7693(2018)03-0454-06
DOI:10.13748/j.cnki.issn1007-7693.2018.03.034
引用本文:张俊琦, 周斌. 伴随诊断相关抗肿瘤药物的发展现状[J]. 中国现代应用药学, 2018, 35(3): 454-459.
收稿日期:2017-06-04
作者简介:张俊琦,女,硕士,药师 Tel: 13564376075 E-mail: kexin1985kexin@aliyun.com
*通信作者:周斌,男,博士,主治医师 Tel: 13917814518 E-mail: mcdropin@126.com
