时军1,张慧迪1,吴秀君2,陈桂添1,吴艳婷1,郭思旖1
(1.广东药科大学中药学院,广州 510006;2.广东省妇幼保健院,广州 511400)
摘要:目的根据咪喹莫特的理化性质,利用pH梯度主动载药技术制备脂质体,考察其性状、粒径、表面电荷及体外释药特征。方法葡聚糖凝胶滤过法测定脂质体的包封率,以包封率与成型性为主要指标筛选制备方法,考察水化液的种类、pH值、离子强度及pH梯度载药、磷脂-胆固醇比例、脂药比、维生素E用量对包封率的影响;正交试验优化咪喹莫特脂质体的处方,考察脂质体样品在0~4 ℃下的稳定性。结果按处方咪喹莫特50 mg、大豆卵磷脂400 mg、胆固醇130 mg、油酸 10 mg、维生素E 5 mg、柠檬酸pH 2.5缓冲液5 mL,采用薄膜分散法工艺制备脂质体样品,并进行pH梯度主动载药,pH值调至7.0。制得的咪喹莫特脂质体呈白色均匀的混悬液,脂质体微粒圆整,分散性好,粒径(347±21)nm,包封率(81.2±1.9)%,Zeta电位(-12.19±1.7)mV。结论pH梯度主动载药技术适于咪喹莫特脂质体的制备。
关键词:咪喹莫特脂质体;pH梯度主动载药技术;正交试验设计;体外释药特征
咪喹莫特(imiquimod,Imiq)是人工合成小分子中唯一的干扰素诱导免疫反应调节剂[1]。Imiq通过降低Toll样受体TLR7和TLR8的竞争抑制作用,刺激多种免疫细胞产生一系列细胞素,诱导生成多种细胞因子,从而增强免疫调节作用[2]。作为外用免疫调节剂,Imiq临床主要用于瘢痕疙瘩、尖锐湿疣等皮肤疾病的治疗,现有剂型为软膏剂(油膏)和乳膏剂[3]。
作为常见纳米给药载体,脂质体皮肤给药具有独特的优势,脂质双层膜可加速瘢痕异质化表皮的药物渗透,增强药物真皮滞留性能,水性给药环境满足伤口愈合对O2的需求[4]。本课题组前期在考察Imiq油水分配系数与透皮吸收速率常数的基础上[5],考察处方组成,制备Imiq脂质体。
pH梯度主动载药技术利用药物的两亲性,以电中性形式跨越脂质双层,电离形式却不能跨越,通过形成脂质体膜内、外水相pH值差异,促使外水相药物自发向脂质体内部聚集,从而获得较高的药物包封率[6]。本研究考察pH梯度主动载药技术制备Imiq脂质体可行性,为其外用纳米经皮制剂开发提供科学依据。
胆固醇(CH,分析纯,上海艾韦特医药科技有限公司,批号:B 01221);维生素E(VE,美国Sigma公司,批号:082K1382);大豆卵磷脂(sbPC,磷脂酰胆碱质量分数>94%,德国Lipoid公司,批号:57-1140045-10);油酸(OA,海拓国药,批号:20160422);Imiq(标示规格为98%,武汉胜天宇公司,批号:20151016);Imiq对照品(中国食品药品检定研究院,批号:100632-201501;纯度≥98%);Imiq乳膏(四川明欣药业,批号:161112)。甲醇为色谱纯;HPLC用水为双蒸水,其余试剂均为分析纯。
DIONEX UltiMate 3000 HPLC系统[赛默飞世尔科技(中国)有限公司];JY96-ⅡN细胞超声仪(宁波新芝生物科技股份有限公司);LA-950V2激光散射粒度测定仪(日本HORIBA公司);RE2000A旋转蒸发仪(上海亚荣生化仪器厂);2-16k冷冻高速离心机(美国Sigma公司);BX51光学显微镜(日本Olympus);MS-H280-Pro磁力加热搅拌器(大龙兴创实验仪器有限公司);PHS-3C型pH计(上海精科科学仪器有限公司);LF-1脂质体挤出仪(Avestin公司);透析袋(分子量8 000~14 000,南京森贝伽生物科技有限公司)。
采用葡聚糖凝胶滤过法进行测定包封率,按下式计算包封率(entrapping efficiency,EE/%)。每个样品平行测定3次,取其平均值。
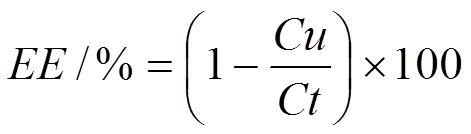
式中,Cu为游离Imiq质量,Ct为投药量。使用HPLC测定Cu,色谱条件:色谱柱C18-PAQ(4.6 mm×250 mm,5mm),流动相甲醇-0.06%磷酸水(35︰65),流速1.0 mL·min-1,柱温30 ℃,紫外检测波长318 nm,理论板数按照Imiq计算≥3 000。峰面积(A)与系列对照品质量浓度(ρ)进行回归,回归方程A=0.943 9ρ-0.012 6,r=0.999 8,Imiq在0.080 4~4.02 µg·mL-1线性关系良好。
为了便于比较,统一处方为Imiq 50 mg、sbPC 250 mg、CH 50 mg、OA 10 mg、VE 5 mg、柠檬酸pH 3.0缓冲液(CBS 3.0) 5 mL,考察以下3种制备工艺。
1.4.1 薄膜分散法 将Imiq、sbPC、CH、OA、VE用10 mL甲醇-氯仿(1︰1)混合溶剂溶解,转移至500 mL茄形瓶中,减压下旋转蒸发60 min,保持水浴温度30 ℃,将形成的均匀白色薄膜加入CBS 3.0,水化过夜,超声(50 kHz,每次2 min,3次)处理,呈乳白色混悬液后,过0.45 μm微孔滤膜,即得。
1.4.2 逆向蒸发法 将Imiq、sbPC、CH、OA、VE溶于10 mL二氯甲烷-甲醇(5︰2)混合溶剂,转移至500 mL茄形瓶中,加入3 mL CBS 3.0振摇,保持水浴温度30 ℃,超声,共5 min,每次持续1 min,2次之间间歇1 min,得乳状液,在45 ℃、50 r·min-1下减压旋转蒸去有机溶剂至凝胶状,再加入2 mL CBS 3.0,继续减压旋转蒸去有机溶剂,超声(50 kHz,每次2 min,3次)处理,呈乳白色混悬液后,过0.45 μm微孔滤膜,即得。
1.4.3乙醇注入法 将Imiq、sbPC、CH、OA、VE,溶于5 mL无水乙醇液中,保温(65±2)℃,在搅拌下匀速注入乙醇液至5 mL CBS 3.0中,注入过程中通入N2除去大部分乙醇。注入完毕后,探头式超声处理(50 kHz,每次2 min,3次)减小粒径,呈乳白色混悬液后,过0.45 μm的微孔滤膜,即得。
按基本处方Imiq 50 mg、sbPC 250 mg、CH 50 mg、OA 10 mg、VE 5 mg,以脂质体外观性状和包封率为指标,进行脂质体水化液种类、pH值和离子浓度考察。采用“1.4.1”项下薄膜分散法工艺条件制备脂质体混悬液,选用5 mL pH 3.0柠檬酸缓冲液(CBS 3.0)、pH 4.0醋酸缓冲液(ABS 4.0)和pH 5.0磷酸缓冲液(PBS 5.0)3种水化液。优选最适宜水化液后,考察相对离子浓度为1,0.5,0.1的水化液,1对应的水化液为0.1 mol·L-1柠檬酸溶液-0.2 mol·L-1磷酸氢二钠溶液(80︰20)混合液,0.5与0.1离子浓度分别由1稀释2,10倍得到。
按处方Imiq 150 mg、sbPC 750 mg、CH 150 mg、OA 30 mg、VE 15 mg、CBS 3.0 15 mL,采用“1.4.1”项下薄膜分散法工艺条件制备脂质体混悬液,CBS 3.0水化液相对离子浓度分别控制在1,0.1水平,从各水化液相对离子浓度水平的脂质体混悬液中分别取4份3 mL的样品,置于不同烧杯中,于室温磁力搅拌下,以1 mol·L-1NaOH溶液分别将4份样品的pH值调至4.0,5.0,6.0,7.0,分别测定pH 值调节前后各样品的包封率。
按处方Imiq 50 mg、sbPC 250 mg、CH 50 mg、OA 10 mg、VE 5 mg、CBS 3.0 5 mL,采用“1.4.1”项下薄膜分散法工艺制备脂质体混悬液,分别以CBS 2.5、CBS 3.0及0.1 mol·L-1柠檬酸溶液为水化液,并进行pH梯度主动载药,3份样品的pH值均调至7.0,分别测定pH梯度载药后样品的包封率,获得pH梯度主动载药最佳条件。
在以上预实验考察sbPC-CH比例(g/g)、脂药比(g/g)、油酸用量(g)和VE用量(g)基础上,确定分散介质为CBS 2.5(离子强度为1)5 mL,按L9(34)正交表安排试验,设定不同的处方药量,按“1.4.1”项下薄膜分散法制备脂质体,按功率20 W(4 ℃)下探针式超声处理(固定探头位置,每次5 s,间隔5 s,共1 min),将所制得的样品利用pH梯度主动载药提高包封率,pH值均调至7.0。以包封率为考察指标,优选最佳制备处方。
按优化后处方和制备工艺,制备3批Imiq脂质体,进行性状、显微观察、粒径和Zeta电位测定,并考察体外释药性能。
体外释药性能考察:分别精密称取含Imiq 100 mg脂质体溶液和市售的Imiq乳膏,放入长3 cm、宽2.5 cm,有效扩散面积15 cm2的透析袋中,溶出介质为500 mL 0.1 mol·L-1盐酸液,搅拌桨转速为100 r·min-1,温度设置为(32±0.5)℃,分别于5,10,15,20,30,60 min取样5 mL,同时补充5 mL等温空白溶出介质,样品经0.45 μm微孔滤膜滤过后,HPLC测定药物浓度。
利用薄膜分散、逆向蒸发和乙醇注入3种方法制得样品,光学显微镜下观察发现,薄膜分散法与逆相蒸发法样品中,有大量圆球形或近圆球形囊泡结构,而乙醇注入法制得的样品中存在大量不规则团块,样品中乙醇难以挥发除去,用于皮肤给药防治增生性瘢痕,可能会引起刺激、疼痛,因此不予采用。对薄膜分散法与逆相蒸发法制得的脂质体分别进行包封率测定,结果表明前者为(44.7±1.9)%(n=3),后者为(39.2±2.1)%(n=3),故选用薄膜分散法。
ABS 4.0和PBS 5.0为水化液的脂质体包封率较高,但在0~4 ℃、充氮条件下放置数天后两者均有颜色变黄或微浊现象,说明其稳定性欠佳,故均不宜采用;CBS 3.0水化的脂质体放置数月无变色现象,故选择CBS。离子强度为0.1,0.5,1.0时的脂质体包封率分别为(50.6±2.9)%,(45.3±2.7)%,(31.2±1.9)%,包封率随CBS 3.0离子浓度的增加而降低。
pH梯度主动载药法可明显提高脂质体药物包封率,水化液的缓冲盐离子浓度较大时,相同pH梯度包封率提高幅度较大,结果见表1。
表1 不同pH梯度下Imiq脂质体的药物包封率(n=3,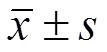 )
)
Tab. 1 EE of Imiq liposomes under different pH gradients (n=3,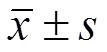 )
)

分别以CBS 2.5、CBS 3.0及0.1 mol·L-1柠檬酸溶液为水化液,外相pH值升高至7.0,包封率分别为(75.2±4.3)%,(70.9±3.6)%,(68.2±3.1)% (n=3),选择CBS 2.5为最终水化液。
考察sbPC/CH在3︰1,2︰1,1︰1,1︰1.5,随着CH用量增加,包封率上升。但是CH作为脂质体膜流动性调节剂,过量易造成脂质体膜超负荷而破裂。考察脂药比分别为2︰1,5︰1,8︰1,10︰1,20︰1,包封率随脂药比增大而呈上升趋势,当脂药比为10︰1时,干膜水化困难,超声后有细小团块状析出,脂药比为2︰1时,药物有渗漏。OA对脂质体包封率几乎无影响。加入不同量VE(2,5,8 mg),随着VE用量的增加,脂质体的包封率有所上升,但是当VE用量为8 mg时,由于VE在极性介质中分散性不佳,脂质体呈较稠厚乳黄色。
按表2设定因素和水平,L9(34)正交试验进行脂质体处方优化。各次实验获得脂质体样品的包封率测定结果见表2。对数据进行方差分析,见表3。
表2 Imiq脂质体处方正交实验结果
Tab. 2 Imiq liposomes formulation by orthogonal experi- mental results

表3 方差分析结果
Tab. 3 The results of variance analysis

由表2直观分析和表3方差分析结果可知,处方因素A和B对Imiq脂质体包封率有显著性影响,最优组合为A3B2C2,确定Imiq脂质体最佳处方:磷脂-胆固醇用量比3︰1,脂药比为8︰1,VE用量为5 mg。
按处方Imiq 50 mg、sbPC 400 mg、CH 130 mg、OA 10 mg、VE 5 mg、CBS 2.5 5 mL,采用“1.4.1”项下薄膜分散法工艺制备脂质体样品,并进行pH 梯度主动载药,pH值调至7.0。制得3批Imiq脂质体,外观为白色均匀的混悬液,分散性好;在显微镜下观察,可以观察到大量的囊泡结构,近似圆形,见图1A;药物包封率为(81.2±1.9)% (n=3);以激光散射粒度测定仪测得脂质体的平均粒径为(347±21)nm(n=3),多分散指数为0.268±0.083,Zeta电位为(-12.19±1.7)mV(n=3),粒径分布见图1B,Zeta电位图见图1C。
将脂质体混悬液置于0~4 ℃冰箱保存,分别于0,7,14 d测定脂质体的各项质量指标,结果见表4,表明样品的外观性状、显微形态、包封率、粒径与Zeta电位等均未发生明显变化,说明样品稳定性良好。
将药物浓度计算得各时间点药物累积释放百分数,以累积释放百分数对时间作图,见图2。
由图2可知,Imiq脂质体中药物1 h内全部释放,与Imiq软膏相比,药物释放呈缓释效应,这与形成脂质双层膜从而延缓药物释放有关。
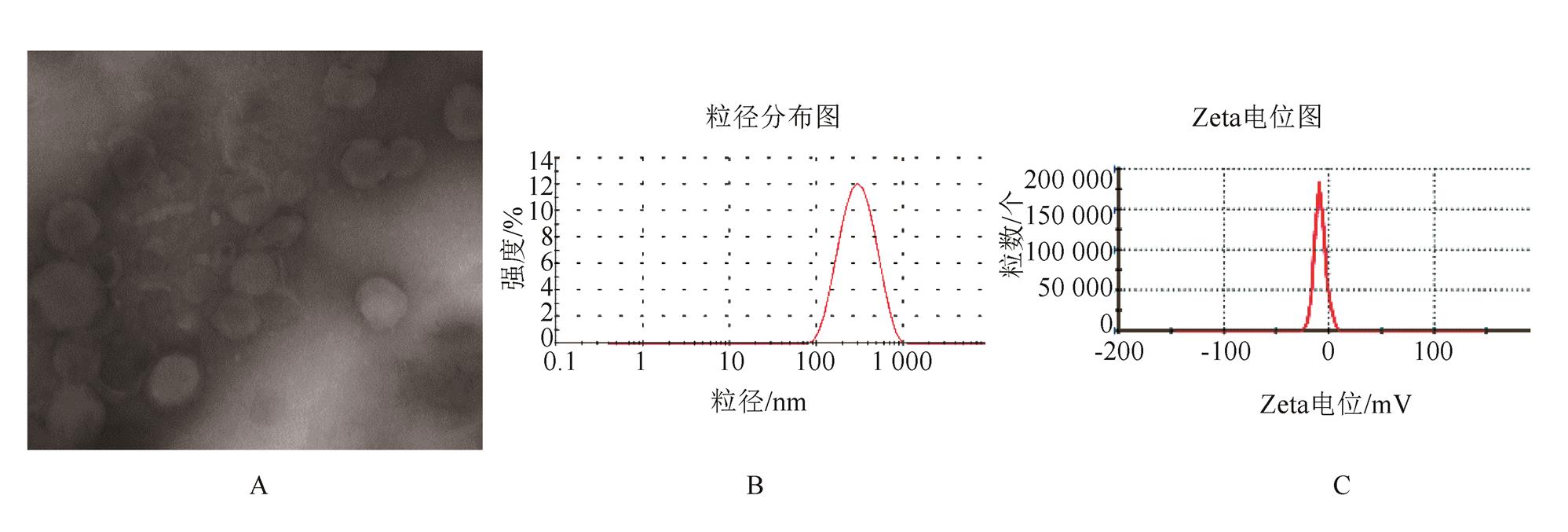
图1 Imiq脂质体的质量评价图
A 显微照片(×20 000);B-粒径分布图;C-Zeta电位图。
Fig. 1 Quality estimation figure of Imiq liposomes
A-Microscopic picture(×20 000); B-Particle size distribution; C-Zeta potential.
表4 成品Imiq脂质体稳定性测定结果
Tab. 4 Stability of Imiq liposomes products

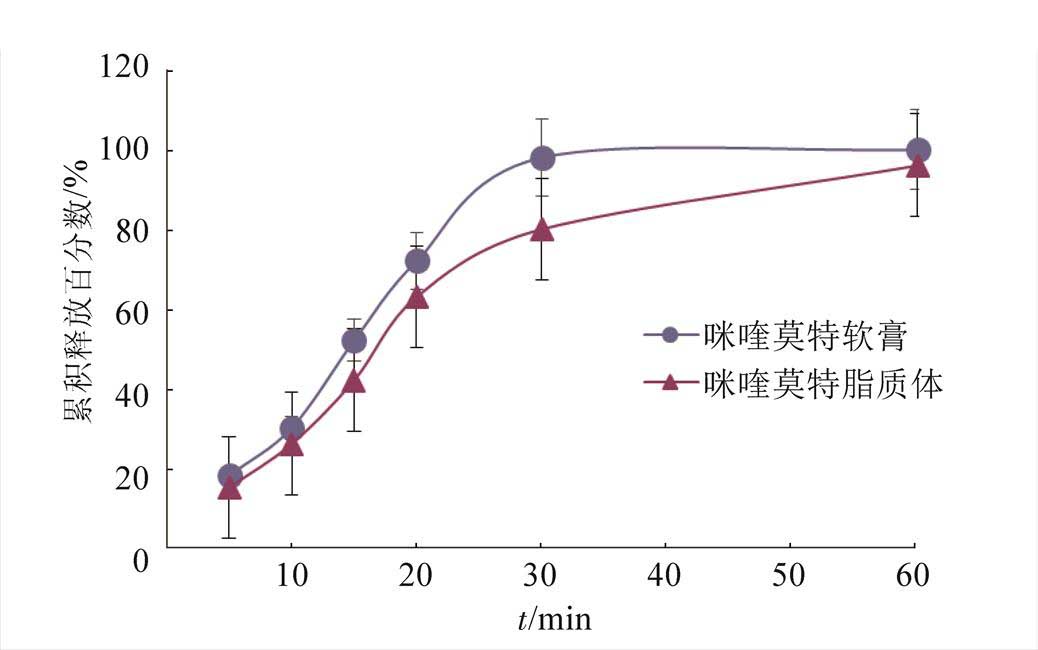
图2 Imiq脂质体与软膏中药物累积释放百分数-时间图
Fig. 2 Release profiles of Imiq liposomes and creamin vitro
本实验比较了薄膜分散法、逆相蒸发法、乙醇注入法3种制备工艺,从而确定选用薄膜分散法工艺。薄膜分散法在无水状态下除去有机溶剂,迅速且完全,可保证制剂有机溶剂残留量符合限量要求,形成的薄膜均匀稳定,故从脂质体实际应用的安全性与工艺研究结果的可靠性考虑,薄膜分散法工艺具有较大优势。本实验筛选了CBS 3.0、ABS 4.0、PBS 5.0 3种水化液,后两者制得的脂质体均在数天内有颜色变黄的现象,而前者制得的脂质体可以长时间稳定存放,这可能与CBS中柠檬酸的协同抗氧化作用有关。
研究脂质体电势,在防止脂质体微粒聚集、融合,以及脂质体与药物之间的作用方面有一定的作用。荷电脂质体微粒之间存在斥力,能够减少相互间的聚集和融合,增加稳定性。ξ电位是衡量电荷多少的一个重要指标,当Zeta电位绝对值>10 mV时,荷电粒子比较稳定,不易聚集[10]。脂质体载体因具有与皮肤角质层高度的结构相似和生理相容特性,易于渗透角质层进入皮肤组织内部,同时其中的主要组成成分-磷脂可加速皮肤表皮水化,可防止药物引起的皮肤干燥。局部应用脂质体制剂,还可使药物相对集中于病灶部位,减少药物的全身吸收[11]。
REFERENCES
[1] WILLIAMS H C, BATH-HEXTALL F, OZOLINS M, et al. Surgery versus 5% imiquimod for nodular and superficial basal cell carcinoma: 5-year results of the SINS randomized controlled trial [J]. J Invest Dermatol, 2017, 137(3): 614-619.
[2] GIACOMASSI C, BUANG N, LING G S, et al. Complement C3 exacerbates imiquimod-induced skin inflammation and psoriasiform dermatitis [J]. J Invest Dermatol, 2017, 137(3): 760-763.
[3] PURWAR R, BAUMER W, NIEBUHR M, et al. A protective role of complement component 3 in T cell-mediated skin inflammation [J]. Exp Dermatol, 2011, 20(9): 709-714.
[4] SUN X, CHENG L, ZHU W, et al. Use of ginsenoside Rg3- loaded electrospun PLGA fibrous membranes as wound cover induces healing and inhibits hypertrophic scar formation of the skin [J]. Colloids Surf B Biointerfaces, 2014, 115(3): 61-70.
[5] SHI J, ZHANG H D, HUANG S H, et al. Study on the correlation between partition coefficient of imiquimod and transdermal absorption rate constant [J]. J Guangdong Pharm Univ(广东药学院学报), 2016, 32(6): 671-674.
[6] ZHENG H S, HUANG S W, LI F Z, et al. Preparation technology of sinomenine hydrochloride liposomes [J]. Chin Tradit Herb Drugs(中草药), 2013, 44(4): 408-413.
[7] LIU Y, GUO W Y. Determination of entrapment efficiency of oxaliplatin liposomes by sephadex microcolumn combined with HPLC [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2014, 31(1): 74-77.
[8] GUBERNATOR J, CHWASTEK G, KORYCIŃSKA M, et al. The encapsulation of idarubicin within liposomes using the novel EDTA ion gradient method ensures improved drug retentionin vitroandin vivo[J]. J Control Release, 2010, 146(1): 68-75.
[9] ESTHER S, ZHANG W L, LIU J P, et al. Physicochemical characterization of asulacrine towards the development of an anticancer liposomal formulation via active drug loading: Stability, solubility, lipophilicity and ionization [J]. Int J Pharm, 2014, 473(1/2): 528-535.
[10] HRURTAULT B, SAULNIER P, PECH B, et al. Physico-chemical stability of colloidal lipid particles. [J]. Biomaticrials, 2003, 24(23): 4283-4300.
[11] ZHANG H, RAN X, HU C L, et al. Therapeutic effects of liposome- enveloped ligusticum chuanxiong essential oil on hypertrophic scars in the rabbit ear model [J]. PLoS One, 2012, 7(2): e31157.
(本文责编:李艳芳)
Study of Preparation Technology of Imiquimod Liposomes Based on pH Gradient Active Drug Loading Method
SHI Jun1, ZHANG Huidi1, WU Xiujun2, CHEN Guitian1, WU Yanting1, GUO Siyi1
(1.Department of Chinese Medicine, Guangdong Pharmaceutical University, Guangzhou 510006, China; 2.Guangdong Women and Children Hospital, Guangzhou 511400, China)
ABSTRACT: OBJECTIVETo prepare imiquimod(Imiq) liposomes using pH gradient active drug loading technology based on the physicochemical properties of Imiq, and investigate the characters, particle size, surface charge and release characteristicsin vitro.METHODSTo determine the encapsulation efficiency by gel filtration method, and use encapsulation efficiency and formability as the main index of preparation screening. To study the impact on entrapment efficiency of the factors involving hydration liquid type, pH value, ionic strength and pH gradient drug loading, phospholipid and cholesterol ratio, drug lipid ratio and the dosage of VE. To optimize the prescription composition of imiquimod liposomes by orthogonal test prescription, and then to observe the stability of liposome samples at 0-4 ℃.RESULTSThe prescription composition of imiquimod liposomes were 50 mg of Imiq, 400 mg of soybean soft phospholipid, 130 mg of cholestorol, 10 mg of oleic acid, 5 mg of vitamin E, 5 mL of citric acid pH 2.5 buffer, and use THF-pH gradient active loading technology, the pH value was adjusted to 7.0. The prepared Imiq liposomes showed white uniform suspension, had round and well dispersed particles, and the particle size was (347±21)nm, encapsulation efficiency was (81.2±1.9)%, Zeta potential was (-12.19±1.7)mV.CONCLUSIONThe pH gradient active drug delivery technique is suitable for the preparation of Imiq liposomes.
KEY WORDS:imiquimod liposomes; pH gradient active drug loading technology; orthogonal experimental design; release characteristicsin vitro
中图分类号:R943
文献标志码:B
文章编号:1007-7693(2018)03-0325-05
DOI:10.13748/j.cnki.issn1007-7693.2018.03.005
引用本文:时军, 张慧迪, 吴秀君, 等. 基于pH梯度载药技术的咪喹莫特脂质体的制备工艺研究[J]. 中国现代应用药学, 2018, 35(3): 325-329.
收稿日期:2017-05-24
基金项目:广东省科技计划项目(2014A020212417);广东省高等学校优秀青年教师培养计划资助项目(YQ2015099)
作者简介:时军,男,博士,副教授 Tel: (020)39352169 E-mail: shijun8008@163.com