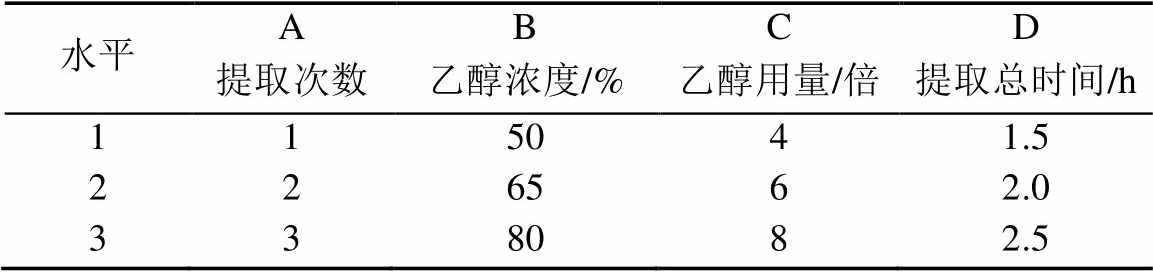
表1 因素水平表
Tab. 1 The factor and level of orthogonal design
俞忠明1,温成平2,杨辉2,吴人杰1,寿旦1*
(1.浙江省中医药研究院中药研究中心,杭州 310007;2.浙江中医药大学基础医学院,杭州 310053)
摘要:目的优选痛风巴布剂的最佳提取工艺。方法以青藤碱、总生物碱的含量和干浸膏得率为评价指标,采用正交设计试验,考察乙醇浓度、乙醇用量、提取时间和提取次数对提取结果的影响,确定痛风巴布剂处方药材的最佳提取工艺。结果痛风巴布剂的最佳提取工艺为65%乙醇,提取3次,每次6倍量溶剂,提取总时间为1.5 h,在该工艺条件下得到的青藤碱含量、总生物碱含量和干浸膏得率分别为2.79 mg·g-1、1.22%和13.06%。结论优选的醇提工艺稳定、可行。
关键词:痛风巴布剂;青藤碱;总生物碱;提取工艺;正交设计
痛风属于代谢性风湿病范畴,是一种由单钠尿酸盐沉积所致的晶体相关性关节病,其发病机理被认为与嘌呤代谢紊乱及尿酸排泄减少所致的高尿酸血症有直接关系[1]。根据尿酸盐结晶在关节或其他结缔组织中沉积的时间及程度不同,其自然病程主要分为无症状高尿酸血症、急性痛风性关节炎、痛风石及肾脏病变。痛风属中医学“痹证”范畴[2],又可称为“历节”“白虎历节”,首次记载于元代名医朱丹溪《丹溪心法》,书中写道“痛风者,四肢百节走痛,方书谓之白虎历节风证是也”。此外,痛风证又有痹证、历节、白虎历节风和痛痹等称谓[3]。对于该病的治疗,以口服药物减少尿酸生成、促进尿酸排泄为主要的手段,并配合代谢产物为嘌呤类的食物控制。痛风急性发作期可同时使用外用药作为辅助治疗,对于关节部位的消肿、止痛、改善关节活动度具有较好的效果。
痛风巴布剂处方源于临床,为浙江省重中之重学科用于风湿病治疗的临床验方,是长期临床实践经验的结晶,经多年的临床应用,改善痛风关节肿痛疗效确切;动物实验证实其具有治疗急性痛风性关节炎的疗效[4]。巴布剂作为新型的外用制剂,用于挫伤、骨病及风湿类等疾病,具有使用方便,起效快,可随时停药等优点[5-6],是一类具有开发前景的外用制剂。痛风巴布剂全方由青风藤、制川乌、山慈菇、细辛等6味药材组成,处方中青风藤主要为青藤碱等生物碱类成分,具有祛风除湿,利尿消肿之功效,制川乌主要含有生物碱类成分,祛风除湿,温经止痛[7],山慈菇清热解毒,化痰散结[8],细辛具有祛风,散寒止痛,石膏清热泻火,冰片既是引经药,又是透皮吸收促进剂,全方使用可达到祛风除湿,消肿止痛之功效。为加强临床验方的规范使用,本课题组开展了痛风巴布剂的提取工艺研究,以主要成分及总生物碱含量为考察指标,优化提取工艺,其中冰片直接入药,细辛提取挥发油,石膏单独水煎,其余药材采用乙醇回流提取。本实验主要对处方中的青风藤、制川乌、山慈菇等药材的醇提取工艺进行优化,期望为痛风巴布剂的制剂工艺研究及临床推广应用提供实验依据。
青藤碱对照品(北京恒元启天化工技术研究院,北京世纪奥科生物技术有限公司联合研制,批号:MUST-11082402;纯度≥98%);甲醇为色谱纯,水为去离子水,其余均为分析纯。
LC-20A vp 高效液相色谱仪(日本岛津);SPD-10A UV检测器(日本岛津); VD真空干燥箱(德国BINDER);AE-240电子天平(梅特勒-托利多上海有限公司);YJ-40L/h型超纯水机(杭州余杭亚洁水处理设备有限公司)。
采用乙醇回流提取方法,按处方配伍比例(3∶2∶2)分别准确称取青风藤、制川乌、山慈菇9.0,6.0,6.0 g,加入一定浓度的乙醇溶液采用回流提取法提取,以提取次数、乙醇浓度、乙醇用量、提取时间作为考察的4个因素,每因素取3个水平,以青藤碱含量、总生物碱含量、干浸膏得率为指标,进行L9(34)正交试验设计,见表1,提取液浓缩至生药含量为1 g·mL‑1的正交试验样品。
表1 因素水平表
Tab. 1 The factor and level of orthogonal design

精密吸取上述正交试验样品各10 mL,在水浴上蒸干,残渣再加少量水溶解,置于分液漏斗中,加一定量氨水调pH至10~11,采用二氯甲烷萃取5次(10,10,10,8,8 mL),合并5次二氯甲烷萃取液,减压回收溶剂,再将萃取液转移至蒸发皿中,水浴上挥干,残渣以5.0 mL无水乙醇溶解,依次精密加入0.01 mol·L-1的硫酸滴定液15 mL、水15 mL及甲基化指示液6滴,再以0.02 mol·L-1的NaOH滴定液滴定至溶液呈黄色,读取消耗的NaOH体积数,每1 mL硫酸滴定液相当于12.9 mg的总生物碱含量,总生物碱计算公式如下:
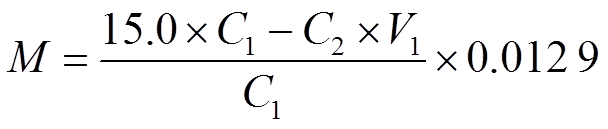
C1为硫酸滴定液浓度,C2为氢氧化钠定滴定液浓度,V1为氢氧化钠定滴定液消耗体积。
精密吸取上述正交试验样品各20 mL,放置于已干燥至恒重的蒸发皿中,水浴上蒸干,在70 ℃真空干燥箱中干燥至恒重后,于干燥器中冷却30 min,称定重量,计算干浸膏得率。
2.4.1 色谱条件[9]色谱柱:资生堂Capcell Pak C18柱(4.6 mm×250 mm,5 μm);流动相:甲醇∶磷酸盐缓冲液(0.005 mol·L-1磷酸氢二钠溶液,以0.005 mol·L-1磷酸二氢钠调节pH至8.0,再以1%三乙胺调节pH至9.0)为55︰45;检测波长:262 nm。
2.4.2 对照品溶液制备 取青藤碱对照品适量,精密称定,置10 mL量瓶中,加甲醇制成每1 mL含0.47 mg的对照品溶液,摇匀,即得。
2.4.3 供试品溶液的制备 精密吸取上述正交试验样品各0.5 mL,分别置于10 mL量瓶中,各加入70%乙醇至刻度,摇匀,即得。
2.4.4 缺味供试品溶液的制备 按痛风巴布剂的处方药材比例,取制川乌、山慈菇药材,加6倍量的65%乙醇,加热回流0.5 h,重复2次,制得生药含量为1 g·mL-1的醇提液,按“2.4.3”项下方法制得缺青风藤供试品溶液。
2.4.5 专属性试验 分别取对照品溶液、供试品溶液及缺味供试品溶液适量,按“2.4.1”项下色谱条件测定,色谱图见图1,表明在上述色谱条件下,供试品中其他成分对青藤碱没有干扰,含量测定方法符合专属性要求。
2.4.6 方法学考察
2.4.6.1 标准曲线制定 分别精密吸取“2.4.2”项下青藤碱对照品溶液各0.5,1,2,4,6,8,10 μL注入液相色谱,按“2.4.1”项下色谱条件测定,以青藤碱色谱峰面积为Y轴,以进样量(μg)为X轴,绘制标准曲线,得标准曲线:Y=5.94×105X+26 555,R2=0.999 8,表明青藤碱进样量在0.235~4.700 μg内呈良好的线性关系。
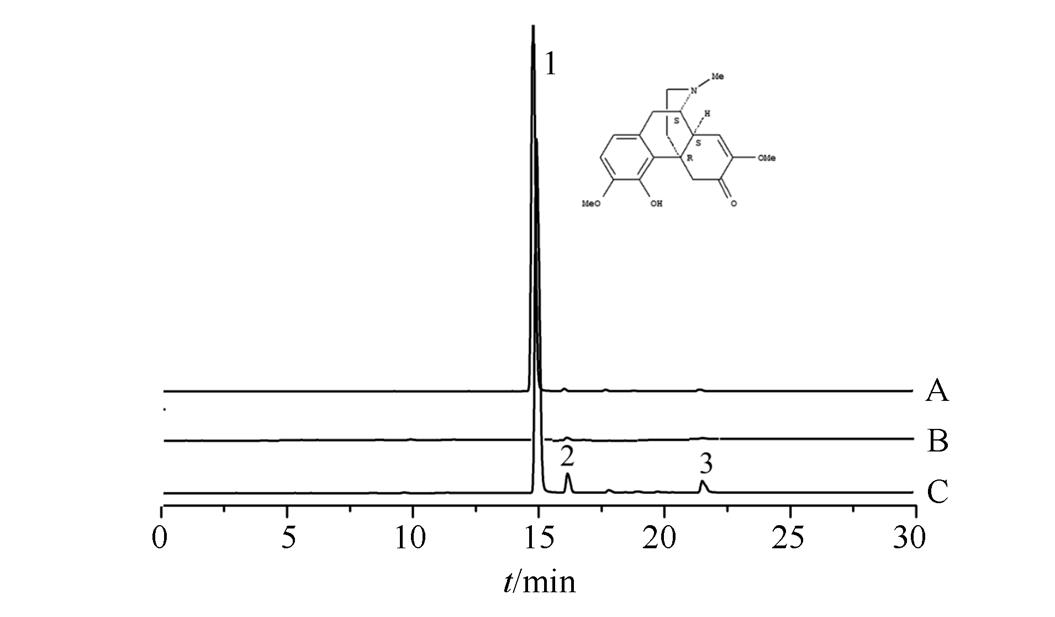
图1 痛风巴布剂的HPLC色谱图
A-对照品;B-缺味供试品;C-供试品;1-青藤碱。
Fig. 1 HPLC chromatogram of Gout cataplasma
A-standard substance; B-sample withoutCaulis Sinomenii; C-sample; 1-sinomenine.
2.4.6.2 仪器精密度试验 精密吸取“2.4.2”项下青藤碱对照品溶液各5 μL,连续进样6次,按“2.4.1”项下色谱条件测定峰面积,计算RSD为0.74%,表明该方法仪器精密度良好。
2.4.6.3 稳定性试验 分别吸取同一供试品溶液各5 μL,于0,2,4,6,8,10,12 h分别进样,按“2.4.1”项下色谱条件测定峰面积,计算RSD为1.83%,表明供试品溶液在12 h内稳定性良好。
2.4.6.4 重复性试验 取同一正交试验样品6份,按“2.4.3”项下操作制得供试品溶液,按“2.4.1”项下色谱条件测定峰面积,计算含量,RSD为1.24%,表明该方法重复性良好。
2.4.6.5 加样回收率试验 精密吸取已知青藤碱含量的样品各9份,分别按高、中、低浓度加入青藤碱对照品溶液适量,每个浓度各3份,采用“2.4.3”项下方法制备供试品溶液,按“2.4.1”项下色谱条件测定峰面积,计算青藤碱含量。结果平均回收率99.86%,RSD为0.95%,表明该方法加样回收率良好。
2.4.7 样品测定 精密吸取对照品溶液、供试品溶液各5 μL,注入液相色谱中,按“2.4.1”项下色谱条件测定峰面积,计算青藤碱含量。
按照L9(34)正交表进行正交试验,分别测定正交试验样品中青藤碱含量、总生物碱含量和干浸膏得率。结果采用综合评分法,以青藤碱含量最高为40分,(青藤碱含量/青藤碱最高含量)×40作为每项得分;总生物碱含量最高为40分,(总生物碱含量/总生物碱最高含量)×40作为每项得分;干浸膏得率最高为20分,(干浸膏得率/干浸膏最高得率)×20作为每项得分;分别计算3项之和的总分,结果见表2~3。结果进行方差分析和极差分析,考察因素A、B、C、D的影响作用。由表2,3可知,4个因素的影响大小关系为A>B>C>D,其中因素A,即提取次数,有显著性差异,根据方差分析和极差分析结果,确定最佳提取工艺为:A3B2C3D1,即最佳提取工艺为65%乙醇8倍量,提取3次,提取总时间为1.5 h。
表2 正交试验结果
Tab. 2 The results of orthogonal design experiment

表3 方差分析表
Tab. 3 Analysis of variance

注:F0.05(2, 2)=19;F0.01(2, 2)=99。
Note:F0.05(2, 2)=19;F0.01(2, 2)=99.
按处方比例称取青风藤、制川乌、山慈菇药材,采用最佳提取工艺进行验证试验,重复3次,结果青藤碱含量为(2.79±0.014)mg·g-1,总生物碱含量为(1.22±0.021)%,干浸膏得率为(13.06± 0.078)%,表明最佳提取工艺稳定可行。
本方中青风藤为君药,主要成分为生物碱,其中青藤碱、双青藤碱、尖防己碱、四氢表小檗碱、土藤碱是其生物碱的主要活性成分,研究证实青藤碱为主要的活性成分,具有祛风镇痛[10]、消炎[11]等作用,经成分分析,方法学考察研究,证明本方法专属性强,测得的含量也较高,因此作为定量指标具有合理性。制川乌的主要有效成分为生物碱类,包括乌头碱等双酯型乌头碱、苯甲酰单酯型生物碱、氨基醇类生物碱,其中后2类为双酯型乌头碱的水解产物,据文献报道,上述生物碱类抗炎、镇痛作用显著[12]。山慈菇具有清热解毒、化痰散结的功效,主要用于痈肿疔毒、瘰疬,蛇虫咬伤等症,国内外文献报道的主要成分为菲类、联苄类、黄烷酮类、生物碱类、萜类[13],其中生物碱类主要有效成分为秋水仙碱、角秋水仙碱、β-光秋水仙碱及N-甲酸-N-去乙酰秋水仙碱等。由于处方中的主要有效成分为生物碱类,根据其理化性质,常用乙醇回流提取方法[14],而以青藤碱、总生物碱、干浸膏得率为评价指标,能够较为全面地反映提取工艺的提取效率。因此本实验采用正交试验设计[15-16],多指标成分综合评分,优化痛风巴布剂药材提取工艺。
青藤碱的含量测定有较多文献可供参考,本实验参照中国药典[17]以及文献方法,通过色谱柱的选择,不同流动相体系的比较,流动相中缓冲盐的选择以及pH的调节研究,经紫外-可见光吸收扫描确定检测波长,确定了色谱条件;进一步优化供试品溶液制备方法,专属性试验显示方法无干扰,确定了含量测定方法。
本实验中对3个评价指标分别做了极差分析,结果显示,采用青藤碱含量为指标,各因素影响大小关系为A>C>B>D,确定的最佳提取工艺为:A3B3C3D1;采用总生物碱含量为指标,各因素影响大小为A>C>B>D,确定的最佳提取工艺为:A3B2C1D1;采用干浸膏得率为指标,各因素影响大小为A>C>D>B,确定的最佳提取工艺为:A3B2C3D3。由于各指标统计未能达到一致性,故采用综合评分法,因素影响A>B>C>D,最佳提取工艺为:A3B2C3D1,由于提取时间的影响最小,选择提取时间作为误差项,通过与其比较分析结果显示因素A有显著性差异,因素C影响较小,无显著性差异,考虑到大生产以及乙醇用量最终确定痛风巴布剂最佳提取工艺为65%乙醇8倍量,提取3次,提取总时间为1.5 h。采用综合评分法能够全面地评价痛风巴布剂的醇提工艺,方法流程简单,成本较低,为后续的痛风巴布剂制剂工艺研究及质量标准制定奠定了基础。
References
[1] 中华医学会风湿病学分会. 原发性痛风诊断和治疗指南[J]. 中华风湿病学杂志, 2011, 15( 6) : 410-413.
[2] LU Y, MENG F X, LIU H. The evolution and development of the names of gout and relating diseases [J]. World Chin Med(世界中医药), 2015, 10(4): 609-612.
[3] 杨仓良. 痛风中医病名探究[J]. 风湿病与关节炎, 2013, 2(9): 50-53.
[4] YAGN H, XIE Z J, WEN C P. External application of chinese medicine for acute gouty arthritis of rats model and the comparison of joint swelling degrees of different measuring methods [J]. J Emerg Tradit Chin Med(中国中医急症), 2013, 22 (12): 1994-1995.
[5] TIAN J, ZHANG X L, ZHOU X Q. A novel cataplasma matrix of traditional Chinese medicine [J]. Front Chem Eng China, 2010, 4(1): 91-95.
[6] LIU H J, ZOU C Z. Preparation ofCleome gynandracataplasm and study on its anti-inflammatory and analgesic activity [J]. Chin J New Drugs(中国新药杂志), 2018, 27(1): 97-101.
[7] Zhou Y, Guo C, Chen H, et al. Determination of sinomenine in cubosome nanoparticles by HPLC technique [J]. J anal methods chem, 2015: 931687.
[8] LYU L F, JIANG Y M, ZHU X, et al. Study on HPLC fingerprints of Cremastrae Pseudobulbus Pleiones Pseudobulbus [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2016, 33(10): 1276-1280.
[9] LIN X Y, YANG Z Z, CHU X Q, et al. Optimization of extraction process for Compound Qingfengteng Babu agent by an orthogonal test [J]. J Anhui Univ Chin Med(安徽中医药大学学报), 2017, 36(1): 85-88.
[10] Liu w w, Qian x, Ji w, et al. Effects and safety of sinomenine in treatment of rheumatoid arthritis contrast to methotrexate: a systematic review and Meta-analysis [J]. J Tradit Chin Med(中医杂志), 2016, 36(5): 564-577.
[11] Qin T, Du R, Huang F, et al. Sinomenine activation of Nrf2 signaling prevents hyperactive inflammation and kidney injury in a mouse model of obstructive nephropathy [J]. Free Radic Biol Med, 2016(92): 90-99.
[12] HUANG Z F, YI J H, TANG X L, et al. Optimization of ester-type alkaloids determination method in aconites medicinal material [J]. Chin J Exp Tradit Med Form(中国实验方剂学杂志), 2013, 19(14): 101-104.
[13] YUAN W K, QIN B H, LI X P, et al. Chemical constituents fromCremastra appendiculata[J]. Mod Chin Med(中国现代中药学), 2017, 19(5): 639-641.
[14] HE W, SHEN X M, FANG Z J. Research on extracting process for Fengshitongbi capsules [J]. J Chin Med Mater(中药材), 2005, 28(6): 509-511.
[15] YANG M M, ZHANG Y, LIU X Y, et al. Optimization of extracting technology of Qufeng Tongluo capsule by orthogonal test [J]. Chin J Exp Tradit Med Form(中国实验方剂学杂志), 2011, 17(10): 45-46. .
[16] YANG L, WANG H W, LI H B, et al. Enrichment of total flavonoids from seed shell ofScutellaria baicalensisby macroporous resin [J]. Her Med(医药导报), 2017, 36(4): 420-424.
[17] 中国药典. 一部[S]. 2015: 195-196.
Optimization of Extraction Technology of Gout cataplasma by Multicriteria Synthesis Assessment
YU Zhongming1, WEN Chengping2, YANG Hui2, WU Renjie1, SHOU Dan1*
(1.Department of Medicine, Zhejiang Academy of Traditional Chinese Medicine, Hangzhou 310007, China; 2.College of basic medicine, Zhejiang Chinese Medical University, Hangzhou 310053, China)
Abstract:ObjectiveTo optimize the extraction process for Gout cataplasma.MethodsThe effects of ethanol concentration, ethanol dosage, extraction time and extraction times on the extraction results were investigated by orthogonal design method using the content of sinomenine, total alkaloid and the yield of dry extract as the indexes.ResultsThe optimal process was found as follows: extraction was performed for three times, the total extraction time was 1.5 h, 6-fold 65% ethanol was added each time. The content of sinomenine, total alkaloid and dry extract obtained under the conditions were 2.79 mg·g‑1, 1.22% and 13.06%, respectively.ConclusionThe optimized extraction process is stable and feasible.
Key words:Gout cataplasma; sinomenine; total alkaloid; extraction process; orthogonal design
中图分类号:R284.1
文献标志码:B
文章编号:1007-7693(2018)10-1498-04
DOI:10.13748/j.cnki.issn1007-7693.2018.10.014
引用本文:俞忠明, 温成平, 杨辉, 等. 多指标综合评分法优化痛风巴布剂的醇提工艺[J]. 中国现代应用药学, 2018, 35(10): 1498-1501.
收稿日期:2018-01-09
基金项目:浙江省科技计划项目(2017C33165);浙江中医药大学科研开放基金
作者简介:俞忠明,男,硕士,副主任中药师 Tel: 13867165266 E-mail: 47479570@qq.com
*通信作者:寿旦,女,博士,研究员 Tel: 13606803860 E-mail: shoudanok@163.com
(本文责编:曹粤锋)