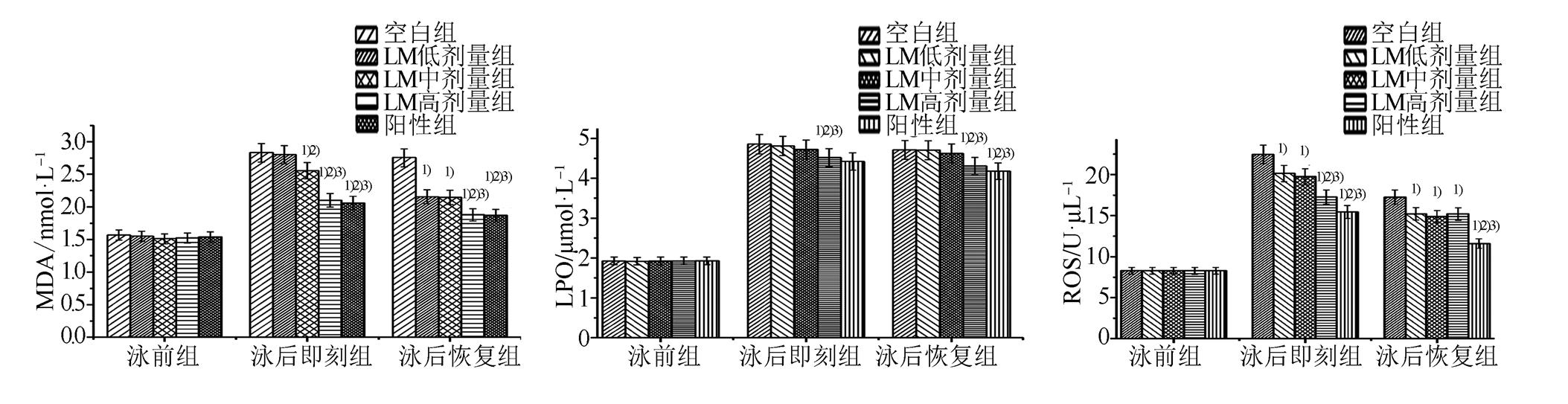
图1 LM对运动疲劳小鼠血清中MDA、LPO和ROS含量的影响(n=10)
杨晓磊1,耿嘉1,仇道静2,王昕3,罗慧英1,4*
(1.甘肃中医药大学药学院,兰州 730000;2.甘肃省兰州市红古区海石湾窑街煤电公司医院海石分院,兰州 730084;3.兰州大学第二医院,兰州 730030;4.甘肃省中药药理与毒理重点实验室,兰州 730000)
摘要:目的研究藏药黑果枸杞水提物对运动疲劳所致氧化应激的影响。方法150只小鼠随机分为3组,分别是泳前组、泳后即刻组和泳后恢复30 min组,每组50只。每组再分为5小组,每组10只,分别是阳性组、空白组和黑果枸杞高、中、低剂量组,灌胃给药30 d后测定小鼠泳前、泳后即刻和泳后恢复30 min后血清中丙二醛(malondialdehyde,MDA)、脂质过氧化物(lipid peroxide,LPO)、活性氧物质(reactive oxygen species,ROS)含量及超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活性。同时采用体外自由基发生体系,评价藏药黑果枸杞对1,1-二苯基-2-三硝基苯肼(DPPH)、羟基自由基(·OH)、超氧阴离子(O2-·)的清除力。结果黑果枸杞不但可以明显降低泳后及泳后恢复组小鼠血清中MDA、LPO、ROS含量,增加SOD、CAT、GSH-Px活性,而且可以减少DPPH、·OH、O2-·的产生。结论藏药黑果枸杞可明显缓解由于运动疲劳所引起的氧化应激反应。
关键词:黑果枸杞;自由基;氧化应激;运动疲劳
黑果枸杞(Lycium ruthenicumMurr.,LM)在藏药中被称为“旁玛”[1],是一种独特的药食两用植物。其果实味甜而多汁、性平,富含紫红素[2],通常被藏医用来治疗心热病、心脏病、月经紊乱、停经等病症,药效显著,被收载于《四部医典》《晶珠本草》等藏医药经典著作中[3]。在前期实验中,本课题组证明了LM不仅可以延长小鼠力竭游泳时间,还可增加小鼠肝糖原和肌糖原储备,降低血清尿素氮水平,减少乳酸的产生,对运动疲劳有一定的缓解作用[4]。本实验旨在通过体内外实验探讨LM对运动疲劳所致氧化应激的影响。
SPF级昆明种小鼠150只,♀♂各半,体质量18~22 g,由甘肃中医药大学实验动物中心提供,动物许可证号:SCXK(甘)2015-0002。
LM 1 200 g购自兰州惠仁堂药业股份有限公司,水煎2次后合并滤液,浓缩至1 000 mL,相当于生药量1.2 g·mL-1,4 ℃冰箱保存,临用时生理盐水稀释成所需浓度。红牛饮料(北京红牛维他命饮料销售有限公司,批号:J1213422PA);丙二醛(malondialdehyde,MDA,批号:2017052)、脂质过氧化物(lipid peroxide,LPO,批号:20170515)、活性氧(reactive oxygen species,ROS,批号:20170605)、超氧化物歧化酶(superoxide dismutase,SOD,批号:20170608)、过氧化氢酶(catalase,CAT,批号:20170720)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px,批号:20170823)试剂盒均购自南京建成生物工程研究所。
UV-5500型紫外分光光度计、TDL-5M台式大容量冷冻离心机(上海精密仪器仪表有限公司);全自动生化分析仪(上海恒盛医疗器械有限公司);酶标仪、电动匀浆机、电子天平、微量移液器、100 ℃水浴箱、游泳箱等均为本实验室自备。
150只小鼠随机分为3组,每组50只,分别是:泳前组、泳后即刻组和泳后恢复30 min组。每组动物再随机分为5小组:黑果枸杞低、中、高剂量组(3,6,12 mg·g-1·d-1),阳性组(红牛饮料0.02 mL·g-1)和空白组(蒸馏水0.02 mL·g-1),每组10只,每天灌胃给药1次,连续30 d,期间每隔1 d进行20 min的游泳训练。于末次给药1 h后检测相关指标。
达实验时限后,泳前组动物直接取样,泳后即刻组动物游泳30 min后取样,泳后恢复组动物先游泳30 min,再恢复30 min后取样。取样方法如下:小鼠股动脉采血1.5 mL,收集于2 mL EP管中,放入4 ℃冰箱中过夜,待血清充分析出后取上清按试剂盒说明测定血中MDA、LPO和ROS含量以及SOD、CAT、GSH-Px活性。
取LM储备液用生理盐水配成不同浓度工作液(生药0.2,0.4,0.6,0.8,1.0,1.2 g·mL-1),维生素C作为阳性对照,采用水杨酸法根据公式(1)测定LM水煎液对羟基自由基(·OH)的清除能力[5]。采用邻苯三酚自氧化法根据公式(2)测定LM水煎液对超氧阴离子(O2-·)的清除能力[6]。DPPH清除力测定方法简介如下:移取0.13 mmol·L-1DPPH溶液2.0 mL、乙醇2.0 mL置入袋盖试管中,室温避光放置30 min后酶标仪517 nm处测定吸光度值(A0),以不同LM浓度溶液替代乙醇,按上述方法操作,测定吸光度值(A1),以不同浓度黑枸杞溶液替代DPPH溶液,按上述方法操作,测定吸光度值(A2),以Vc作为标准抗氧化剂,按公式(3)计算DPPH清除率[7-9]。
·OH清除率=[1-(A1-A2)/A0]×100% (1)
O2-·清除率=(1-K1/K0)×100% (2)
DPPH清除率=[1-(A1-A2)/A0]×100% (3)
A0-对照液吸光值;A1-水解液吸光值;A2-参比液吸光值;K1-测定组吸光度变化斜率;K0-对照组吸光度变化斜率。
所有数据采用SPSS 17.0软件进行处理,用均数±标准差表示,组间比较采用t检验,P<0.05为差异具有统计学意义。
游泳运动后小鼠血清中MDA、LPO和ROS含量明显升高,提示体内脂质过氧化水平因剧烈运动而升高,LM水煎液可以显著降低运动后小鼠体内脂质过氧化水平,表现在降低MDA、LPO和ROS含量,且作用有一定的剂量依赖性和时间依赖性。结果见图1。
游泳运动后小鼠血清中SOD、CAT和GSH-Px活性明显降低,提示由于运动疲劳体内自由基清除能力降低,LM水煎液可以显著提高血清中SOD、CAT和GSH-Px活性,增强运动后小鼠体内自由基清除能力,高剂量作用更明显。结果见图2。
在浓度范围(0.2~1.2 g·mL-1)内,LM水煎液可显著清除DPPH自由基,且随着浓度的升高,清除率逐渐升高。根据ELISA Calc软件得到四参数Logistic曲线拟合方程:y=(70.414 86-4.208 87)/[1+ (x/1.014 58)-3.106 66]+4.208 87,r2=0.985 2,四参数拟合计算出LM水煎液对DPPH的半数清除浓度(IC50)为1.014 58 g·mL-1。结果见图3。
在浓度范围(0.2~1.2 g·mL-1)内,LM水煎液对羟自由基有很强的清除作用,且随着浓度的升高,清除能力逐渐升高。根据ELISA Calc软件得到四参数Logistic曲线拟合方程:y=(109.552 69-16.627 41)/[1+(x/0.947 22)-2.751 8]+16.627 41,r2= 0.978 2,四参数拟合计算出LM水煎液对羟自由基的半数清除浓度(IC50)为0.947 22 g·mL-1。结果见图3。
不同浓度LM水煎液对超氧阴离子有很强的清除作用(P<0.01),且随着浓度的升高,清除能力逐渐升高。根据ELISA Calc 软件得到四参数Logistic曲线拟合方程:y=(122.592 36-9.438 92)/ [1+(x/1.181 32)-1.741 56]+9.438 92,r2=0.984 2,四参数拟合计算出LM水煎液对超氧阴离子的半数清除浓度(IC50)为1.181 32 g·mL-1。结果见图3。

图1 LM对运动疲劳小鼠血清中MDA、LPO和ROS含量的影响(n=10)
与空白组比较,1)P<0.05;与LM低剂量组比较,2)P<0.05;与LM中剂量组比较,3)P<0.05。
Fig. 1 Effects of LM on the contents of MDA, LPO and ROS in the serum of exercise fatigue mice(n=10)
Compared withblank group,1)P<0.05; compared with LM low dose group,2)P<0.05; compared withLM middle dose group,3)P<0.05.
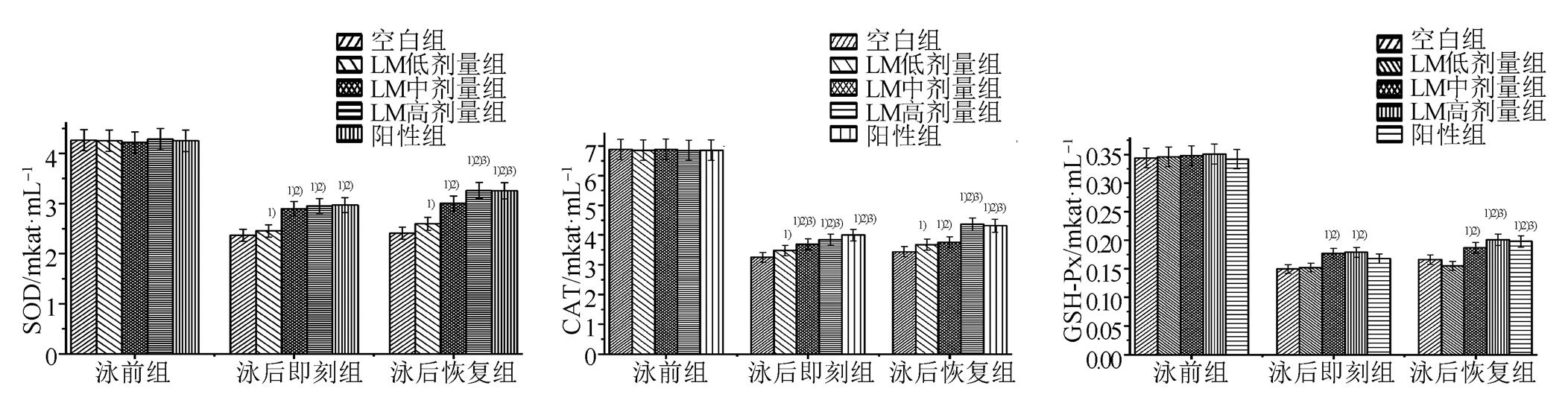
图2 LM对运动疲劳小鼠血清中SOD、CAT和GSH-Px活性的影响(n=10)
与空白组比较,1)P<0.05;与LM低剂量组比较,2)P<0.05;与LM中剂量组比较,3)P<0.05。
Fig. 2 Effects of LM on the activities of SOD, CAT and GSH-Px in the serum of exercise fatigue mice(n=10)
Compared withblank group,1)P<0.05; compared with LM low dose group,2)P<0.05; compared with LM middle dose group,3)P<0.05.
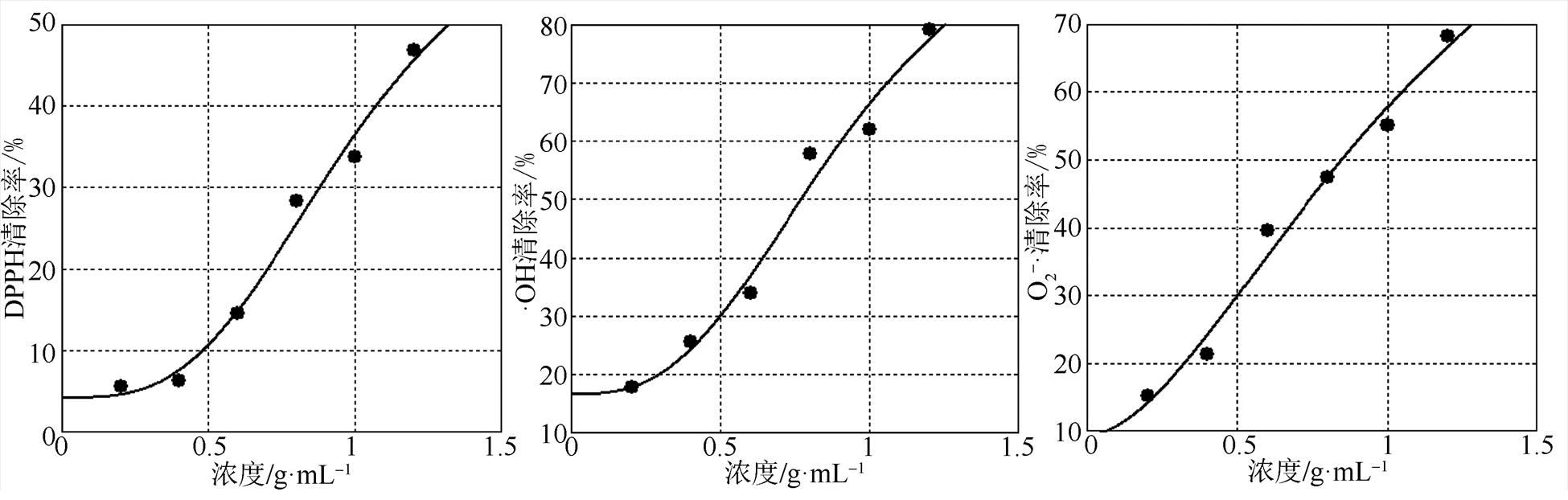
图3 LM对DPPH、·OH、O2-·的清除作用(n=5)
Fig. 3 Scavenging effect of LM on DPPH, ·OH, O2-·(n=5)
自由基是人体内广泛存在的一种游离基团,适量自由基对人体是有益的。例如白血球利用自由基(超级氧,一氧化氮)来杀死外来的微生物;体内一些分解代谢的反应需要自由基来催化;血管的舒张和部分神经、消化系统讯号的传导要借助于自由基(一氧化氮);基因经由自由基的刺激得以产生突变以更适应环境的变化等等。但是大量失控的自由基会削弱细胞的抵抗力,使人体易受细菌和病菌感染,产生破坏细胞的化学物质,诱发癌症;破坏细胞内的线粒体(能量储存体),造成氧化性疲劳;破坏细胞膜,干扰细胞的新陈代谢,使细胞膜丧失保护细胞的功能;破坏蛋白质,破坏体内的酶,导致炎症和衰老;破坏脂肪,使脂质过氧化,导致动脉粥样硬化,发生心脑血管疾病;侵袭细胞组织及激素所必须的氨基酸,干扰体内系统的运作,导致恶性循环,以致产生更多自由基,其连锁反应可导致自由基危害遍及全身等等[10-13]。在正常情况下,人体内自由基与机体的抗氧化机制维持平衡,但在某些特殊状态下,自由基数量升高或抗氧化机制失常,就会导致体内微环境处于氧化应激状态,诱发各种损伤[14-15]。
运动疲劳是大运动量、大强度训练所引起的机体机能的变化,是一个特别复杂的生理生化过程,其中包括:肝糖原等能源过量消耗,血糖下降;乳酸和蛋白质分解物等疲劳物质大量存留在体内;体液的酸碱平衡、离子分布、渗透压平衡等内环境的变化或破坏;机体内离子代谢发生紊乱,自由基增多;内分泌、神经、免疫系统的协调平衡被打破等诸多变化[16]。
本课题在前期研究的基础上,探讨了LM对运动疲劳诱发氧化应激的缓解作用,发现LM可以显著降低运动后血清中氧化应激产生的MDA、LPO、ROS含量,增加自由基清除酶SOD、CAT和GSH-Px活性,增强抗氧化应激能力。体外实验也进一步印证了LM对DPPH自由基、·OH、O2-·的清除能力。本实验结果提示LM可能是通过清除自由基、增加机体抗氧化能力来缓解运动疲劳所致的氧化应激损伤。
REFERENCES
[1] XIA Y Y, MO R N, QV W, et al. Research progress in chemical constituents ofLycium ruthenicumMurr. [J]. Prog Pharm Sci(药学进展), 2015, 39(5): 351-356.
[2] PENG Q, LV X P, HUANG L J, et al. Study on the purification technology ofLycium ruthenicumpolysaccharides [J]. Acta Agric Boreali-occid Sin(西北农业学报), 2012, 21(2): 121-126.
[3] GAN Q M. Preliminary investigation on Tibetan medicinal herb [J]. Chin Tradit Herb Drugs(中草药), 2001, 32(4): 371-373.
[4] CAO R R, YANG X L, SUN M, et al. Relieving effects ofLycium ruthenicumMurr on exercise fatigue in mice [J]. Chin J Clin Pharmacol(中国临床药理学杂志), 2017, 33(4): 351-354.
[5] GORDON M H. The Mechanism of Antioxidant Actionin Vitro[M]. //HUDSONB J F. Food Antioxidants Elsevier Applied Food Science Series. Dordrecht: Springer.
[6] XU S H, HANG H, LI Y P. Study and improvement on the pyrogallol autoxidation assay method for SOD activity assay [J]. Chem J Inter(化学通报), 2001, 64(8): 516-519.
[7] KARAGÖZLER A A, ERDAĞ B, EMEK Y Ç, et al. Antioxidant activity and proline content of leaf extracts fromDorystoechas hastate[J]. Food Chem, 2008, 111(2): 400-407.
[8] SOCHA R, JUSZCZAK L, PIETRZYK S, et al. Antioxidant activity and phenolic composition of herbhoneys [J]. Food Chem, 2009, 113(2): 568-574.
[9] WU C, DUCKETT S K, NEEL J P, et al. Influence of finishing systems on hydrophilic and lipophilic oxygen radical absorbance capacity(ORAC) in beef [J]. Meat Sci, 2008, 80(3): 662-667.
[10] AIKENS J, DIX T A. Perhydroxyl radical (HOO.) initiated lipid peroxidation. The role of fatty acid hydroperoxides [J]. J Biol Chem, 1991, 266(23): 15091-15098.
[11] HORTON A A, FAIRHURST S. Lipid peroxidation and mechanisms of toxicity [J]. Crit Rev Toxicol, 1987, 18(1): 27-79.
[12] NIKI E, YAMAMOTO Y, KOMURO E, et al. Membrane damage due to lipid oxidation [J]. Am J Clin Nutr, 1991, 53(1 Suppl): 201S-205S.
[13] BLAKE D R, ALLEN R E, LUNEC J. Free radicals in biological systems--a review orientated to inflammatory processes [J]. Br Med Bull, 1987, 43(2): 371-385.
[14] HUA G P, NING J. Protective effect and anti-oxidative stress mechanism of Fenofibrate in the kidney of diabetic rats [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2015, 32(3): 285-289.
[15] SUN X D, YAN Y H, ZHANG Y T, et al. Effects of Xuebijing injection on oxidative stress and early inflammatory factors in rats with sepsis induced liver injury [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2016, 33(10): 1255-1259.
[16] 章小菊, 韩慧婉, 姚鸿恩. 疲劳性运动对血浆游离氨基酸和中枢神经递质影响的研究进展[J]. 首都体育学院学报, 1998, 18(4): 150-153.
Effects ofLycium RuthenicumMurr. Aqueous Extract on Oxidative Stress Induced by Exercise Fatigue
Yang Xiaolei1, Geng Jia1, QIU Daojing2, WANG Xin3, LUO Huiying1,4*
(1.Pharmacy College, Gansu University of Chinese Medicine, Lanzhou 730000, China; 2.The Hospital of Yaojie Coal and Electricity Group Co., Ltd., Lanzhou 730084, China;3.Lanzhou UniversitySecond Hospital, Lanzhou 730030, China; 4.Key Laboratory of Pharmacology and Toxicology for Traditional Chinese Medicine of Gansu Province, Lanzhou 730000, China)
Abstract:ObjectiveTo study the effects ofLycium ruthenicumMurr. aqueous extracton oxidative stress induced by exercise fatigue.MethodsOne hundred and fifty mice were randomly divided into 3 groups, 50 in each group:no swimming group, immediate after swimming group and restore 30 min after swimming group. Mice in each group were subdivided into 5 groups of 10 each:positive control group,blank control groupandLycium ruthenicumMurr. low, medium and high dose group. After 30 d of intragastric administration, the contents of MDA, LPO and ROS, and the activities of SOD, CAT, GSH-Px in serum were measured. At the same time, thein vitrofree radical generation system was used to evaluate the scavenging power ofLycium ruthenicumMurr.on 1,1-diphenyl-2-trinitrophenylhydrazine(DPPH), ·OH and O2-·.ResultsLycium ruthenicumMurr. could not only reduce the contents of MDA, LPO and ROS in the serum of mice after swimming and 30 min after swimming significantly, but also increase the activities of SOD, CAT and GSH-Px. Moreover, it could reduce the production of DPPH, ·OH and O2-· radicals.ConclusionLycium ruthenicumMurr. can alleviate the oxidative stress caused by exercise fatigue obviously.
Key words:Lycium ruthenicumMurr.; free radical; oxidative stress; exercise fatigue
中图分类号:R285.5
文献标志码:A
文章编号:1007-7693(2018)10-1494-04
DOI:10.13748/j.cnki.issn1007-7693.2018.10.013
引用本文:杨晓磊, 耿嘉, 仇道静, 等. 藏药黑果枸杞水提物对运动疲劳所致氧化应激的影响[J]. 中国现代应用药学, 2018, 35(10): 1494-1497.
收稿日期:2018-01-05
基金项目:甘肃省自然科学基金项目(1508RJZA005)
作者简介:杨晓磊,男,硕士生 Tel: (0931)8765395 E-mail: 879545656@qq.com
*通信作者:罗慧英,女,博士,教授 Tel: (0931)8765395 E-mail: louria@126.com
(责任编辑:李艳芳)