表1 HPLC-UV的梯度洗脱程序
Tab. 1 The gradient elution program of the HPLC-UV method

林丽琴,杨直,彭彦
(杭州市食品药品检验研究院,杭州 310022)
摘要:目的对复方卡托普利片中新发现的未知杂质进行来源分析和结构的初步确认,以期为该制剂改进工艺和提高标准提供依据。方法采用Kromasil苯基色谱柱(250 mm×4.6 mm,5 μm),以水-磷酸(550︰0.5)和甲醇为流动相进行梯度洗脱,检测波长为210 nm。对市售的复方卡托普利片中的该未知杂质的含量进行系统的评价;同时采用液质联用的方法对该未知杂质的结构进行确认。结果该未知杂质为复方制剂的2种原料卡托普利和氢氯噻嗪在受热过程中产生的二聚物,分子式为C16H23N4O7S3Cl;市售产品多数含有该杂质。结论本研究为复方卡托普利片的质量控制和工艺优化提供了参考依据。
关键词:复方卡托普利片;未知杂质;液质联用
复方卡托普利片含有卡托普利和氢氯噻嗪2种主要成分,其中卡托普利主要抑制血管紧张素转换酶活性,降低血管紧张素Ⅱ水平,减少醛固酮分泌,扩张动静脉,减少水钠潴留,达到降压效果和减轻心脏前后负荷而改善心功能的作用[1];氢氯噻嗪作为利尿剂主要增加肾脏对氯化钠的排出而起利尿作用,使血容量减少而发挥降压效果。复方卡托普利片已被美国预防、检测、评估与治疗高血压全国联合委员会第七次报告推荐为轻、中度高血压患者治疗的首选和联合用药的基础药物[2],经动物实验和临床研究证明,2种药物合并应用能明显增强降压作用[3],广泛用于临床。中国药典2015年版二部采用HPLC[4]对复方卡托普利片中的卡托普利二硫化物(卡托普利杂质I)的含量进行测定,限度为3.0%,对其他杂质无限量要求。笔者在日常监督抽验工作中,发现某药业公司生产的复方卡托普利片有1个明显的未知杂质峰,这个杂质已远远超过《化学药物杂质研究的技术指导原则》中制剂的杂质控制要求[5],该杂质在国外药典中亦均未被收载[6]。通过和厂家沟通,发现以往生产的批次也都存在类似现象,为查找杂质的来源,研究可能存在的危害性,笔者进行了相关的探索性研究,同时对浙江市面上流通的57个批次的样品进行了检测。
UFLC-20A高效液相色谱仪,PAD检测器(日本岛津公司);LC-MS-IT-TOF,配备ESI离子源,飞行时间质谱检测器(日本岛津公司);XS205电子天平(梅特勒公司)。
卡托普利原料、氢氯噻嗪原料、淀粉、乳糖、羟丙纤维素、硬脂酸镁均来自浙江某药业公司,批号分别为:120515,111106,20130112006,L1114,20120141,20130103;复方卡托普利片(57批次,浙江省范围内抽检);醋酸铵、磷酸(分析纯,国药集团化学试剂有限公司);甲醇、乙腈(色谱纯,德国Merck公司);实验用水(纯化水,杭州娃哈哈集团有限公司)。
色谱柱:Kromasil苯基柱(250 mm×4.6 mm,5 μm);流动相A为水-磷酸(550︰0.5),流动相B为甲醇,梯度洗脱程序见表1;检测波长:210 nm;进样量:50mL,柱温:35 ℃。
表1 HPLC-UV的梯度洗脱程序
Tab. 1 The gradient elution program of the HPLC-UV method

色谱柱为Shim-pack ODS II(2.1 mm× 100 mm,2.2 μm),流动相A为5 mmol·L-1醋酸铵水溶液,流动相B为0.1%甲酸-乙腈溶液,梯度洗脱:0 min,25%B;1.0 min,35%B;3.0 min,55%B;5.0 min,60%B;6.0 min,80%B;9.0 min,95%B;10.0 min,25%B;13.0 min,25%B。流速:0.2 mL·min-1;柱温:40 ℃;进样体积:2 μL。
质谱参数:采用ESI离子源,正负离子同时扫描方式,扫描范围m/z200~800,扫描时间为0.2 s,加热模块温度:200 ℃;CDL温度:200 ℃;雾化气流速:1.5 L·min-1;干燥气流速:10 L·min-1;离子源电压:4.5 kV;检测器电压:1.6 kV;离子累积时间:30 ms;校准方法:自动调谐优化电压,外标法校准质量数。
2.3.1 供试品溶液的配制 精密称取本品细粉适量(约相当于卡托普利25 mg),置50 mL量瓶中,加流动相适量,超声15 min,放冷,用流动相稀释至刻度,摇匀,滤过,取续滤液作为供试品溶液(8 h内使用)。
2.3.2 未知杂质来源考察溶液的配制 精密称取卡托普利原料约25 mg、氢氯噻嗪原料约15 mg、辅料混合物(按处方比例混合)约155 mg,分别置50 ml量瓶中,加适量流动相超声15 min使溶解,放冷,并用流动相稀释至刻度,摇匀,作为单独原辅料的考察溶液。
分别精密称取卡托普利原料约25 mg、氢氯噻嗪原料约15 mg、辅料混合物约155 mg各 5份,分别置50 mL量瓶中,分别加入3 mol·L-1盐酸溶液2.0 mL,放置20 h,作为酸破坏供试品溶液;加入3 mol·L-1的氢氧化钠溶液2 mL,摇匀,放置20 h,作为碱破坏供试品溶液;加入30%过氧化氢溶液(其中卡托普利加的是5%的过氧化氢溶液)2 mL,摇匀,放置2 h,作为氧化破坏供试品溶液;在25 000 Lx光照强度下放置48 h,作为光破坏供试品溶液;置105 ℃烘箱中放置6 h,放冷,作为热破坏供试品溶液。上述酸、碱供试品溶液分别中和后与其余样品均用流动相稀释至刻度,摇匀,作为单独原辅料破坏试验的考察溶液。
精密称取①氢氯噻嗪原料约15 mg、卡托普利原料约25 mg与辅料的混合物约155 mg;②氢氯噻嗪原料约15 mg和卡托普利原料约25 mg;③氢氯噻嗪原料约15 mg和辅料的混合物约155 mg;④卡托普利原料约25 mg和辅料的混合物约155 mg,分别置50 ml量瓶中,按照上述方法对其进行酸、碱、加热、氧化和光照的破坏试验。
按“2.1”项下方法,首先对复方卡托普利片样品中有关物质进行了分析,结果见图1。复方卡托普利片样品中除已知的卡托普利二硫化物(卡托普利杂质Ⅰ)外,还有1个非常明显的未知杂质(峰3)。
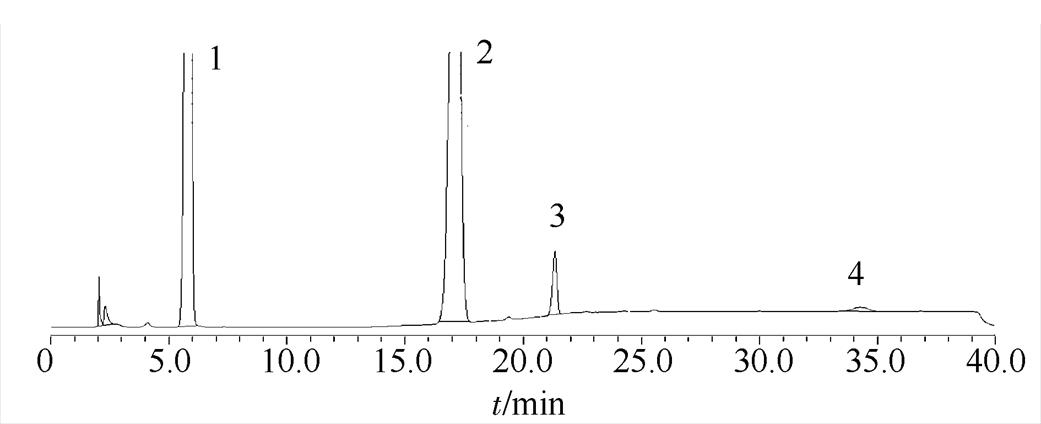
图1 复方卡托普利片的杂质谱
1-氢氯噻嗪;2-卡托普利;3-未知杂质;4-卡托普利二硫化物。
Fig. 1 Impurity profile of the Compound Captopril tablets
1-hydrochlorothiazide; 2-captopril; 3-unknown impurity; 4-captopril disulfide.
取复方卡托普利片原辅料考察溶液及复方卡托普利片原辅料的加速试验制备的酸、碱、加热、光、氧化降解溶液,按“2.1”项下条件进行测定。结果发现在加热破坏且有卡托普利和氢氯噻嗪共存的条件下,未知杂质的含量明显升高,见图2。因此将卡托普利原料和氢氯噻嗪原料共同热降解的溶液作为未知杂质的LC-MS分析用供试液。

图2 原辅料混合加热破坏色谱图
A-氢氯噻嗪原料、卡托普利原料与辅料的混合物;B-氢氯噻嗪原料和卡托普利原料的混合物;C-氢氯噻嗪原料和辅料的混合物;D-卡托普利原料和辅料的混合物;1-氢氯噻嗪;2-卡托普利;3-未知杂质。
Fig. 2 Chromatogram of mixed raw material by heating
A-the mixture of hydrochlorothiazide, captopril and auxiliary materials; B-the mixture of hydrochlorothiazide and captopril; C-the mixture of hydrochlorothiazide and auxiliary materials; D-the mixture of captopril and auxiliary materials; 1-hydrochlorothiazide; 2-captopril; 3-unknown impurity.
将氢氯噻嗪、卡托普利和未知杂质同时进行LC-MS正负离子模式分析,结果见表2。负离子模式下氢氯噻嗪的一级质谱图中m/z295.956 3为其[M-H]-峰,m/z409.948 0为其[M+CF3COO]-峰,m/z592.920 9为其[2M-H]-峰,根据氢氯噻嗪的多级质谱结果推导其可能的质谱裂解规律,结果见图3~4;正离子模式下卡托普利的一级质谱中m/z218.084 3为其[M+H]+峰,m/z240.063 8为其[M+Na]+峰,m/z457.141 4为其[2M+Na]+峰,根据卡托普利的多级质谱结果推导其可能的质谱裂解规律,见图5~6。根据液相色谱和质谱联用的结果,该未知杂质的光谱性质和氢氯噻嗪相近,见图7~8;质谱行为在负离子模式下与氢氯噻嗪的一级和二级质谱图基本一致,见图9和图3;在正离子模式下二级和三级质谱图分别与卡托普利的一级和二级质谱图基本一致,见图9和图5;且该杂质是氢氯噻嗪与卡托普利共存的条件下加热破坏产生的,推测应是两者发生反应后的产物。因此根据其高分辨多级质谱及其相关性质推测其分子式为C16H23N4O7S3Cl,结构式见图10。
表2 分析结果汇总
Tab. 2 The summary of the analysis result

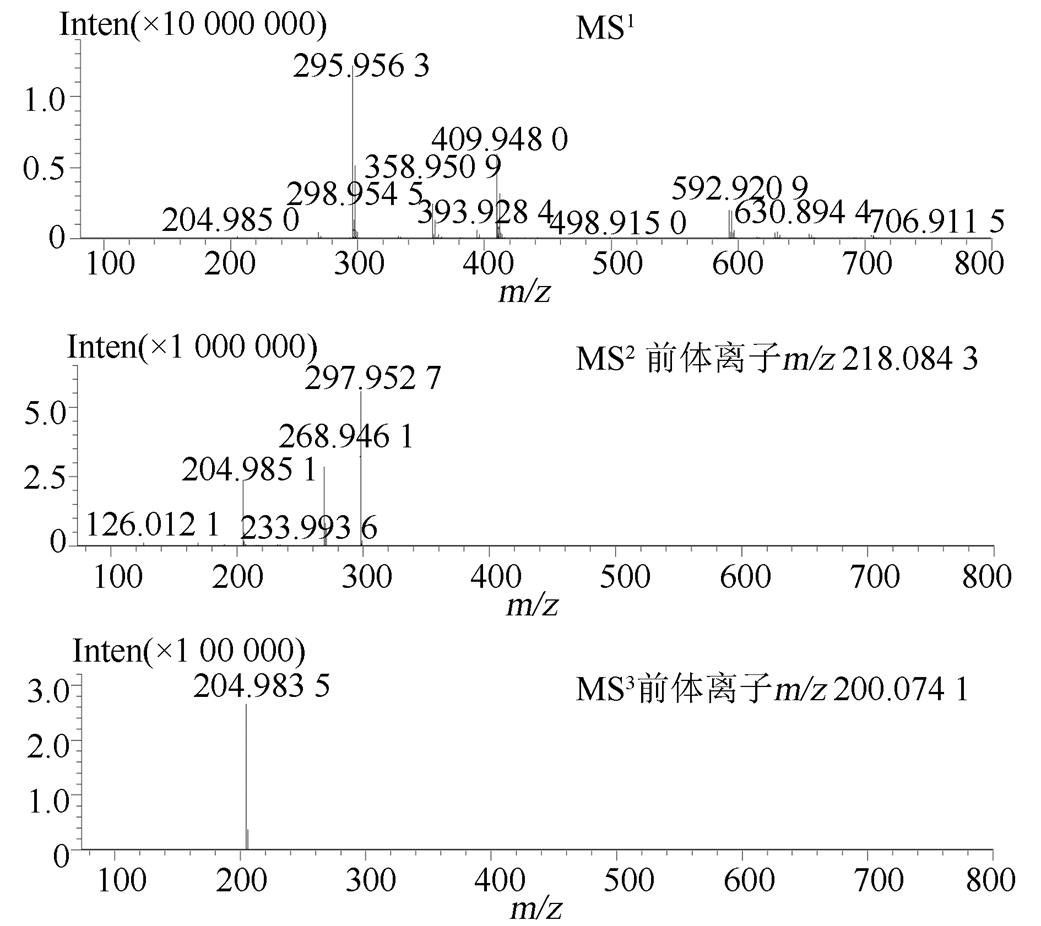
图3 负离子模式下氢氯噻嗪的多级质谱图
Fig. 3 Mass information of hydrochlorothiazide with negative ion modes
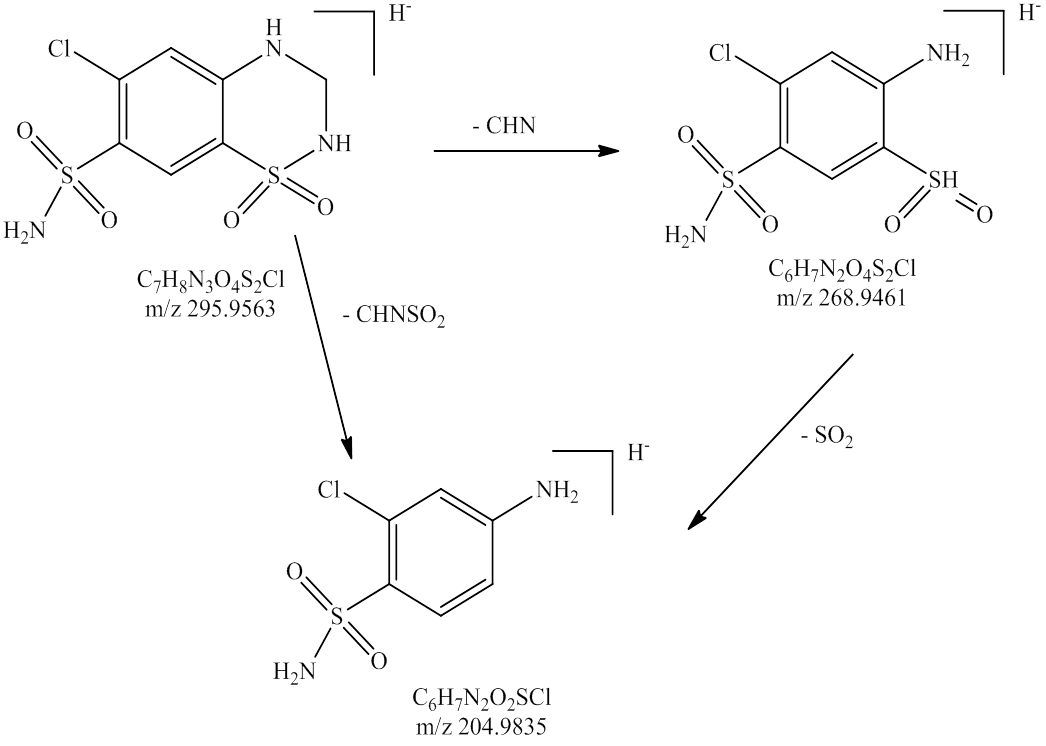
图4 负离子模式下氢氯噻嗪可能的质谱裂解规律
Fig. 4 Mass spectral fragmentation of hydrochlorothiazide with negative ion modes
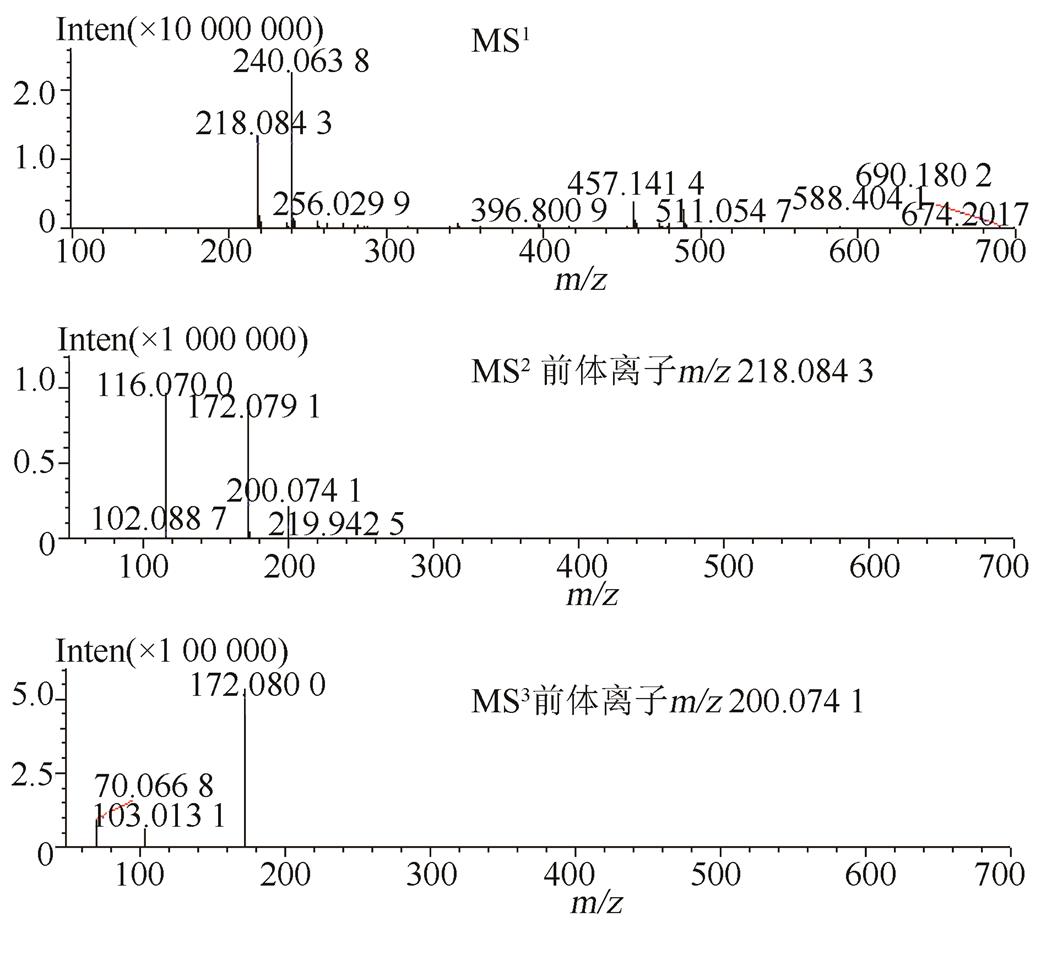
图5 正离子模式下卡托普利的多级质谱图
Fig. 5 Mass information of captopril with positive ion modes
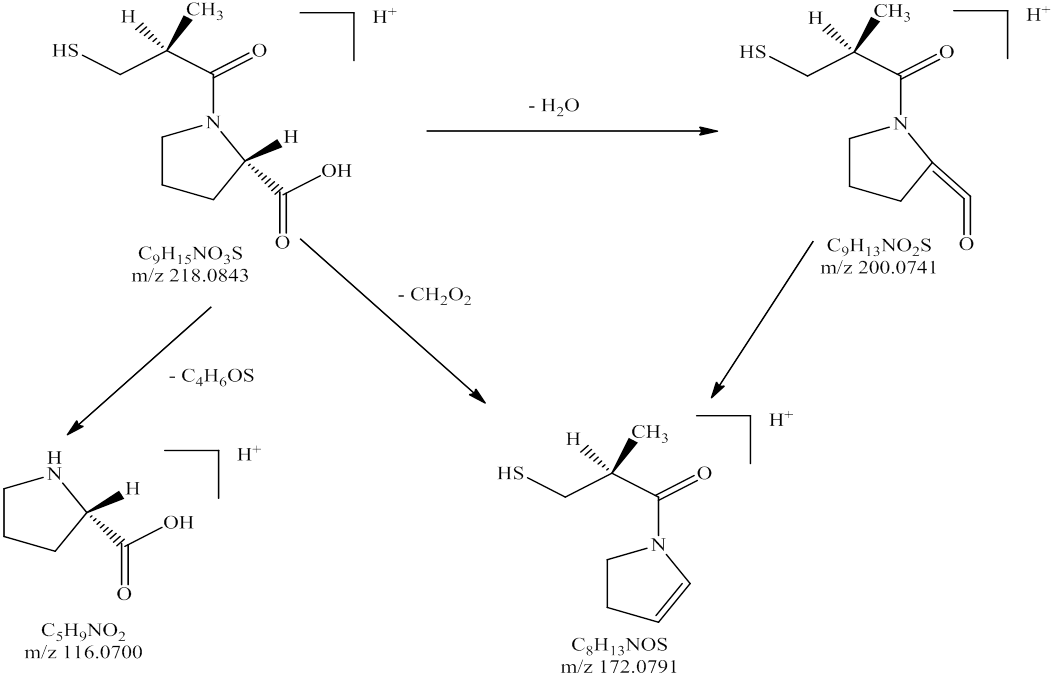
图6 正离子模式下卡托普利可能的质谱裂解规律
Fig. 6 Mass spectral fragmentation of captopril with positive ion modes
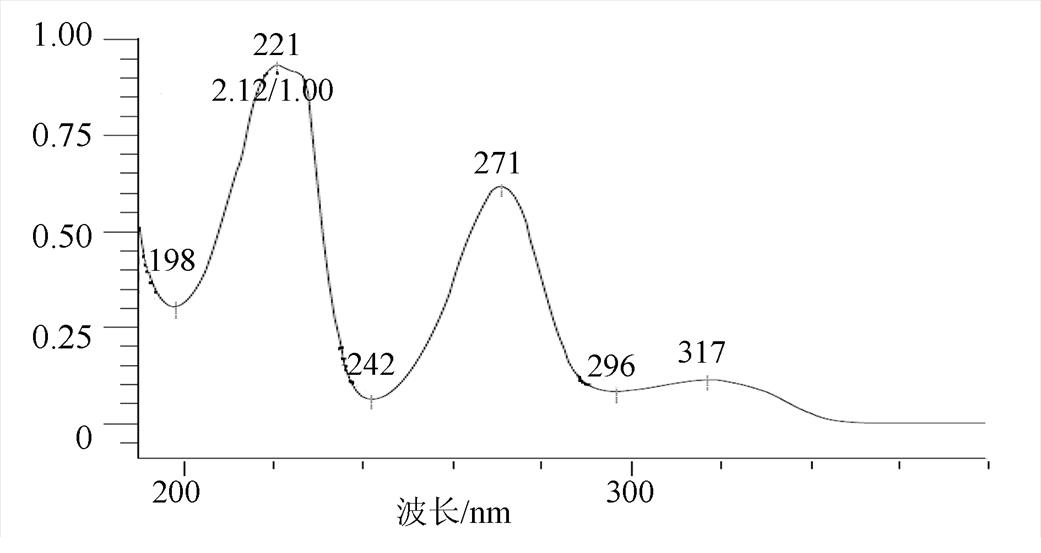
图7 氢氯噻嗪的紫外光谱图
Fig. 7 UV spectrogram of hydrochlorothiazide
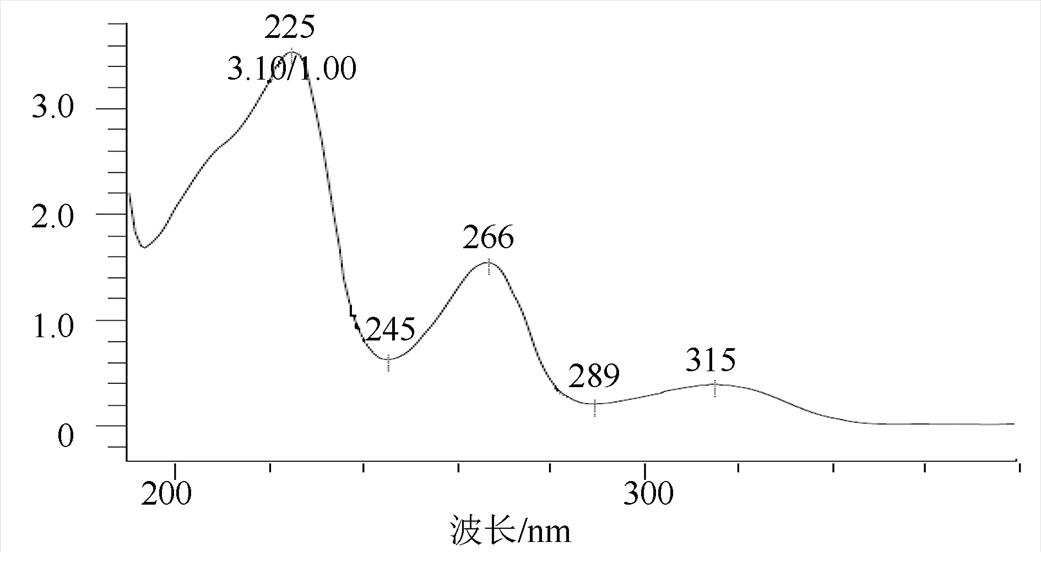
图8 未知杂质的紫外光谱图
Fig. 8 UV spectrogram of the unknown impurity
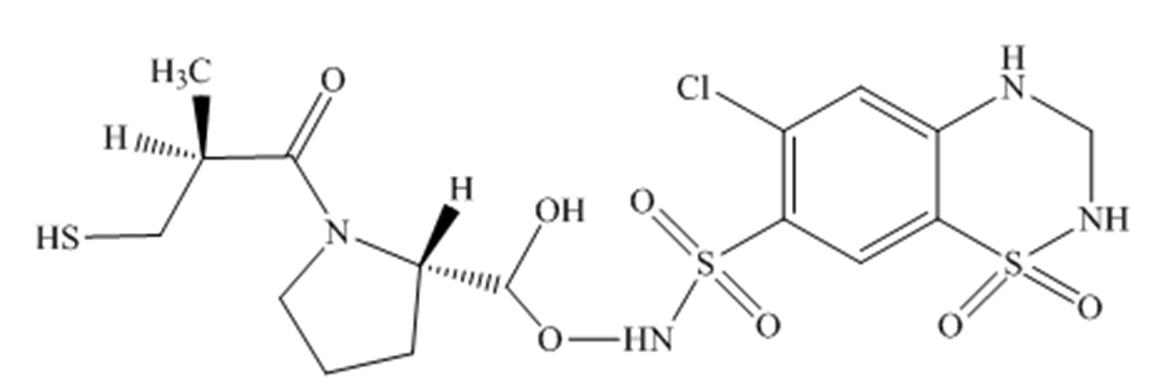
图10 未知杂质的结构式
Fig. 10 Structure of unknown impurity
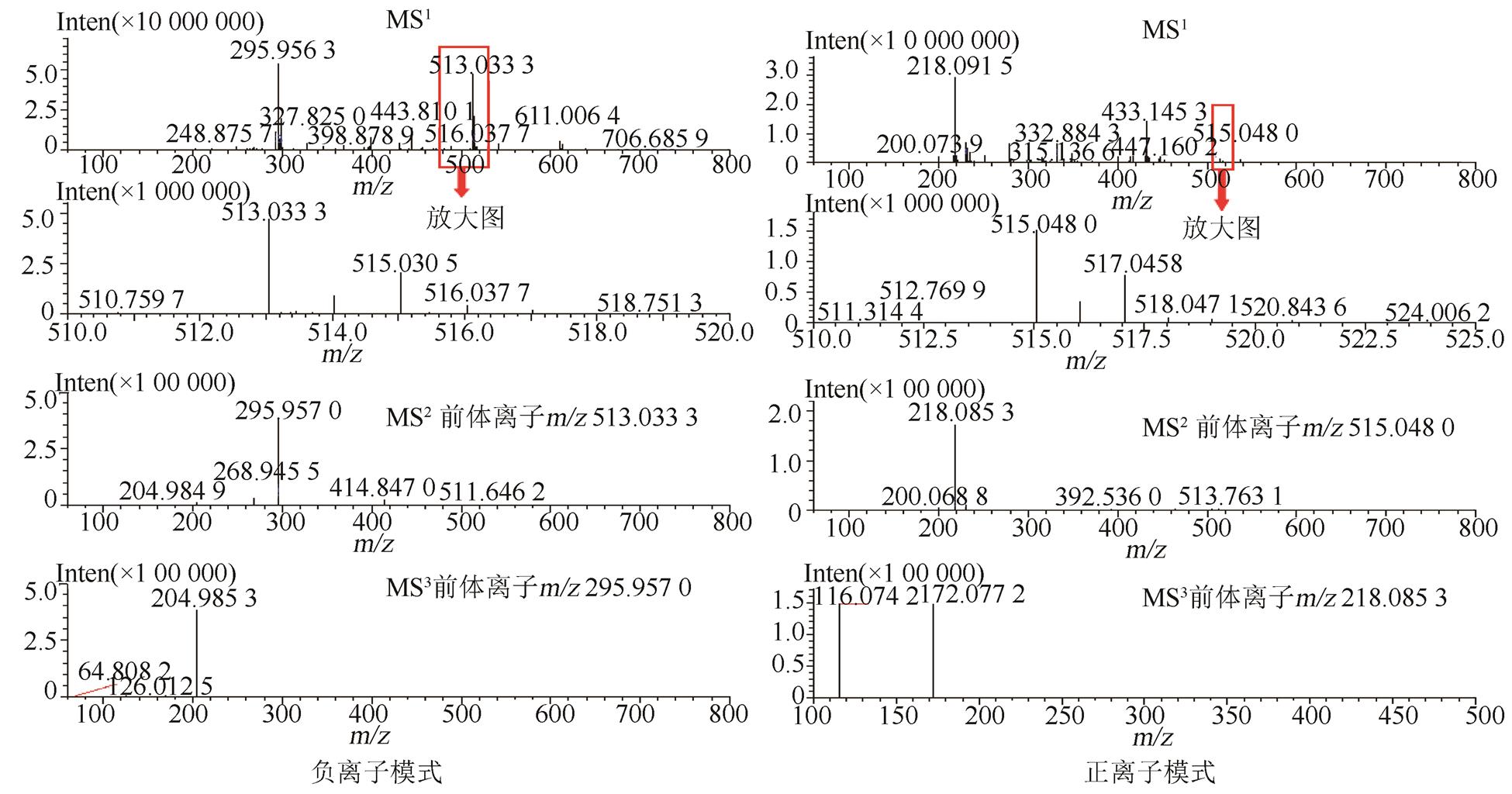
图9 未知杂质的多级质谱图
Fig. 9 Mass information figure of unknown impurity
对57批次市售复方卡托普利片中的未知杂质进行检测,结果表明,57批次的样品中有52批次检出该未知杂质,含量在0.05%~3.82%之间,>0.2%的批次为30批次,占比52.6%。
复方卡托普利片现有国内外的标准为中国药典2015年版二部与美国药典(USP40版)[6],采用中国药典2015年版二部中卡托普利二硫化物(卡托普利杂质Ⅰ)的方法检测,该杂质峰的峰型拖尾严重,不利于准确积分。采用美国药典的方法,并通过适当调整流动相的比例及采用梯度洗脱后,该峰完整分离并且峰型良好,适用于本次研究。
LC-MS技术日趋成熟,广泛地应用于各类杂质的分析[7-13]。本研究中首先采用强降解试验对复方卡托普利片中的未知杂质来源进行了分析。然后通过多级质谱数据,对氢氯噻嗪负离子模式下、卡托普利正离子模式下的质谱裂解途径进行了推测,并将未知杂质的二级和三级质谱图分别和氢氯噻嗪及卡托普利的一级和二级质谱图进行了比对,从而推测出了未知杂质的分子式和结构式。实验结果表明,LC-MS能够对复方卡托普利片中的未知杂质进行快速结构鉴别。
本研究对浙江市面上流通的57个批次的复方卡托普利样品进行了该未知杂质的检测,结果表明,多数的产品都存在该杂质。强降解试验提示,该杂质为2个主要成分氢氯噻嗪和卡托普利受热后产生的副产物,生产企业在生产工艺中受热环节应严格控制。为更好地保证产品质量,后续应对该杂质进行相应的毒理学研究,并将该杂质制订入质量标准。
REFERENCES
[1] 章承英. 开富特治疗老年高血压病临床观察[J]. 上海预防医学杂志, 2001, 13(6): 298.
[2] CHOBANIAN A V, BAKRIS G L, BLAEK H R, et al. The Seventh report of the joint national committee on the prevention, detection, evaluation and treatment of high blood pressure: the JNC 7 report [J]. JAMA, 2003, 289: 2560-2572.
[3] 张利华. 复方卡托普利片的药理作用和临床应用[J]. 天津药学, 1999, 11(3): 20-21.
[4] 中国药典. 二部[S]. 2015: 799-800.
[5] 化学药物杂质研究的技术指导原则(编号: [H]GPH3-1)[K]. 国家食品药品监督管理总局, 2005-3-18.
[6] USP40-NF35 Vol Ⅱ [S]. 2017: 3176-3177.
[7] ROK G, LUCIJA Z K. Identification of gentamicin impurities by liquid chromatography tandem mass spectrometry [J]. J Pharm Biomed Anal, 2009, 50(5): 1037-1043.
[8] LIANG J M, FU C, CHEN Y. Determination of genotoxic impurities in escitalopram oxalate by LC-MS/MS [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2016, 33(11): 1436-1440.
[9] HU M, HU C Q. Identification of the degradation compounds of cefathiamidine by liquid chromatography tandem mass spectrometry [J]. Acta Pharm Sin(药学学报), 2006, 41(10): 1015-1019.
[10] WU H X, WANG J J, HU K, et al. RRLC-QTOF applied to the impurities profile of lacosamide [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2014, 31(5): 563-566.
[11] HU M, HU C Q. Identification of the components and products of hydrolysis in acetylleucomycin by LC-MS [J]. Acta Pharm Sin(药学学报), 2006, 41(5): 476-480.
[12] LIANG J M, FU C, CHEN Y. Determination of N,N- dimethylaniline in quetiapine fumarate by LC-MS [J]. Her Med(医药导报), 2017, 36(3): 317-320.
[13] BAI P F, LI H X, GUO W M. High sensitive determination of the genotoxic impurities in olaparib by LC-MS/MS [J]. Chin J New Drugs(中国新药杂志), 2016, 25(8) :865-868.
Identification of the unknown impurity in Compound Captopril Tablet and Its Source Analysis
LIN Liqin, YANG Zhi, PENG Yan
(Hangzhou Institute for Food and Drug Control, Hangzhou 310022, China)
ABSTRACT:OBJECTIVETo improve the quality and provide technological support for reducing the impurity content of Compound Captopril tablet, the source and structure determination of the unknown-impurity is studied.METHODSA Kromasil Phenyl column(250 mm×4.6 mm, 5 μm) was used. The wavelength of UV detector was 210 nm. HPLC gradient elution was used with water-phosphoric acid (550︰0.5) and methanol as mobile phase to find the source and determine the content of the unknown impurity in Compound Captopril tablets. The structure of the unknown impurity was identified by LC-MS.RESULTSThe unknown impurity was elucidated as C16H23N4O7S3Cl, which was the dipolymer of hydrochlorothiazide and captopril by heating, and was included in most of the domestic generic Compound Captopril tablet.CONCLUSIONThis study provides reference for the improvement of quality control and process optimization of Compound Captopril tablet.
KEY WORDS:Compound Captopril tablet; unknown impurity; LC-MS
中图分类号:R917
文献标志码:B
文章编号:1007-7693(2018)10-1471-05
DOI:10.13748/j.cnki.issn1007-7693.2018.10.008
引用本文:林丽琴, 杨直, 彭彦. 复方卡托普利片中未知杂质的来源与结构分析[J]. 中国现代应用药学, 2018, 35(10):1471-1475.
收稿日期:2018-01-04
作者简介:林丽琴,女,硕士,副主任药师 Tel: (0571)85463890 E-mail: linliqin@aliyun.com
(本文责编:李艳芳)