
图1 扫描电镜下3种粉末图
彭继千1,陈扬武1,陈顺1*,王泽人1,2*
(1.深圳市华力康生物医药有限公司,广东 深圳 518057;2.南京大学深圳研究院,广东 深圳 518057)
摘要:目的考察3种方法制备扎那米韦鼻用粉雾剂粉体的性质。方法分别采用研磨法、气流粉碎法和喷雾干燥法制备不同粒径扎那米韦的粉体,并与吸入乳糖混合,对混合粉体的粒径、微观形态、流动性、堆密度和吸湿性进行考察。结果研磨法、喷雾干燥法和气流粉碎法得到的扎那米韦原料粉末粒径依次减小;与乳糖相比,3种混合粉体松密度逐渐减小,振实密度依次增加,流动性仅喷雾干燥略增加,研磨法和气流粉碎法无影响;3种方式得到的混合粉末均没有明显的吸湿性。结论研磨筛分法比较适合扎那米韦鼻用粉雾剂的进一步开发。
关键词:扎那米韦;鼻用粉雾剂;粉体;粒径
扎那米韦是第1个唾液酸酶抑制剂,由Glaxo Wellcome公司于1999年研制上市,化学名为5-乙酰氨基-4-[(氨基亚氨基甲基)-氨基]-2,6-氢-3,4,5-三去氧-D-丙三醇基D-半乳糖-2-烯醇酸。扎那米韦以其选择性高、毒性小、活性强、使用剂量小、作用范围广、预防效果好等优点,成为了抗禽流感的战略储备药物,用于A型和B型流感的治疗和预防[1-2]。
扎那米韦水溶性好,但是组织穿透性差,难以进入体内循环,且几乎以原型药物经肾排泄。此外,扎那米韦不需要进入细胞内即可在细胞外抑制病毒神经氨酸酶,在呼吸道即可抑制病毒复制扩散,因此适合开发成局部给药制剂[3]。
Glaxo Wellcome公司开发的产品为经口吸入肺部给药,用于流感的治疗。但是作为预防流感用药,需要考虑到流感的传播途径,鼻咽部位才是流感病毒感染的首要部位[4],尤其是对流感多发性或疫区,鼻腔才是人体预防感冒的重点部位。为此笔者预备开发用于预防流感的扎那米韦鼻腔吸入粉雾剂。
呼吸道吸入制剂对药物颗粒的粒径要求不一,对于作用于下呼吸道至肺部起效的吸入制剂一般要求粒径为1~5 µm,而对于作用于鼻腔的吸入制剂则要求粒径>10 µm[5]。由于吸入制剂一般给药量较低,粒径较细,对制剂开发中的装填、存储等提出较高要求,因此有必要对含药颗粒的粉体性质进行研究[6]。
目前已有商业化供鼻吸入粒径的乳糖产品,本实验以此为模型辅料载体,采用研磨法、气流粉碎法和喷雾干燥法制备不同粒径扎那米韦的粉体,并与吸入乳糖混合,并对其粒径、混合均匀度、流动性和吸湿性进行考察,为进一步开发作为参考。
AO气流粉碎机(宜兴市优特粉体机械设备有限公司);SD-06AG喷雾干燥机(Labplant UK Ltd);BT102S-1/YZ15蠕动泵(保定雷弗流体科技有限公司);Mastersizer 3000激光粒度仪(英国马尔文公司);JSM-5910LV扫描电子显微镜(日本电子株式会社);百分之一电子天平、万分之一电子天平(OHAUS);HBD-30实验室料斗混合机(创志集团);MA35快速水分仪(赛多利斯科学仪器有限公司)。
扎那米韦对照品(USP标准品,批号:FOM048);扎那米韦(济南鲁欣化工科技有限公司,批号:ZA-160415);乳糖(Inhalac230,批号:L1019470084980A538,德国美剂乐集团);乙酸钾(批号:20161001)、硝酸锂(批号:20160702)、溴化钠(批号:20160401)、氯化钾(批号:20160303)均购自广州化学试剂厂;氯化钠(国药集团化学试剂有限公司,批号:20160111);实验用水为纯化水。
研磨筛分:取扎那米韦原料洁净研磨,并取270目筛网筛分去除细粉末。
气流粉碎:取扎那米韦原料置气流粉碎机,设置参数为:粉碎压力0.7 MPa,进料速率60 g·h-1。
喷雾干燥:取扎那米韦原料溶于5倍体积纯化水至溶解完全,置喷雾干燥机处理,设置参数为:进风温度为150 ℃,风机50 r·min-1,蠕动泵4速。
取3种不同粒径的扎那米韦粉体分别与吸入乳糖按质量比1∶4置于实验室料斗混合机,充分混合。
采用激光粒度仪干法粒径测试,设置参数为:加样料斗加样0.3~0.5 g,料斗间隙0.5~1.5,非球形,折射率1.68,背景与样品测量持续时间均为10 s,进样气压2 bar,进样速度100%。
取粉体按操作置于电子扫描显微镜下观察,设置入射电压为10 kv,真空度为150 Pa,记录不同倍率下观察图像。
参考美国药典USP40<1174>粉体流动性测试法操作[7]。采用固定圆锥底法:取底盘直径为7 cm的培养皿,将2只玻璃漏斗上下交错重叠,固定在铁架台上,使原料药经过两只漏斗的缓冲逐渐堆积在地盘上,形成锥体,直到得到最高的锥体为止,测定锥体的高H,测定3次,取平均值,按下式计算休止角:α=arctg(H/R)。其中:α为休止角,R为底盘直径。
设定快速水分仪加热温度为105 ℃、加热时间为10 min,取一定量粉体样品于称量盘中,关闭仪器盖,仪器自动加热并开始测定,10 min后测定结束,显示屏中显示数值为粉体测定水分含量数值。
配制不同盐的过饱和溶液置于干燥器下部,取干燥的具塞玻璃称量瓶,实验前1 d置于适宜的(25±1)℃恒温干燥箱内,精密称定重量(m1);取已干燥后的原料药适量,平铺于上述称量瓶中,厚度约为1 mm,精密称定重量(m2);将称量瓶敞口,并与瓶盖同置于上述恒温恒湿条件下一定时间至恒重;盖好称量瓶盖子,精密称定重量(m3)。计算公式如下:吸湿增重百分率=(m3-m2)/(m2-m1)×100%。
参考美国药典USP40<616>粉体密度测试法操作[8]。松密度测试:取洁净、干燥的10 mL量筒,称量其重量m0。将粉末松缓垂直地转入量筒中至10 mL处,称量量筒与样品的质量m1,精确到0.1 g,并稍弄平粉末表面,读取固体粉末的体积V1。
振实密度测定:将上述盛有粉末的量筒放在台面上(铺有约5 mm厚的橡胶),由2 cm左右的高度自坠到台面上,重复此操作约100次,量得压紧后的粉末体积V0,继续上述操作约30次,量得粉末体积V2。当V0与V2相差<0.2 mL时,读取终体积V2,否则重复上述操作,直到符合为止。计算公式:松密度=(m1-m0)/V1×100;振实密度= (m1-m0)/V2×100。
吸入乳糖是德国美剂乐的市售筛分乳糖,其粒径适合鼻吸入制剂使用。将扎那米韦粉末与乳糖混合后,通过扫描电镜测试,结果见图1。

图1 扫描电镜下3种粉末图
A-乳糖;B-乳糖+研磨过筛原料;C-乳糖+喷雾干燥原料;D-乳糖+气流粉碎原料
Fig. 1 SEM of three types of powder
A-lactose; B-lactose + milling API; C-lactose + spry drying API; D-lactose + flow milling API.
各粉体进一步采用激光粒度仪测试结果见表1。
表1 不同粉体粒径测定结果(n=3)
Tab. 1 Results of particle size measurement(n=3) μm

由结果可知,3种工艺制备的原料粉体粒径与吸入乳糖充分混合之后,混合物粒径远小于乳糖,尤其是D10和D50,与混合前扎那米韦颗粒的粒径较接近。可以初步判断,小粒径原料与乳糖基本上没有相互吸附作用,也没有发生明显的自身的聚集。扫描电镜的结果可以看到,气流粉碎的原料粒径略小且不规整,与乳糖混合非常散乱。喷雾干燥的原料粉体呈规整的类球状,分散在乳糖较均匀。各粉末均没有明显的聚集。
对制备的不同混合粉体进行流动性的休止角考察结果见表2。
表2 不同粉体混合物的流动性(n=3)
Tab. 2 Results of powder flow measurement(n=3)

由结果可知,在添加原料粉体后,乳糖的休止角具有不同的变化,研磨过筛几乎没变,喷雾干燥的增加较多,气流粉碎的略有下降。这表明喷雾干燥法制备的扎那米韦颗粒与乳糖颗粒具有一定的摩擦力,可能是静电因素。其他方式制备的物料与乳糖颗粒之间无明显作用力。
根据FDA文献报道,扎那米韦没有吸湿性[9],本实验对经研磨过筛、气流粉碎及喷雾干燥法制备的扎那米韦颗粒进行了含水量测定,结果分别为7.47%,7.87%及7.54%。但考虑到其分子极性较大,加上粉碎后比表面积增大,需要考察吸湿性是否发生变化。
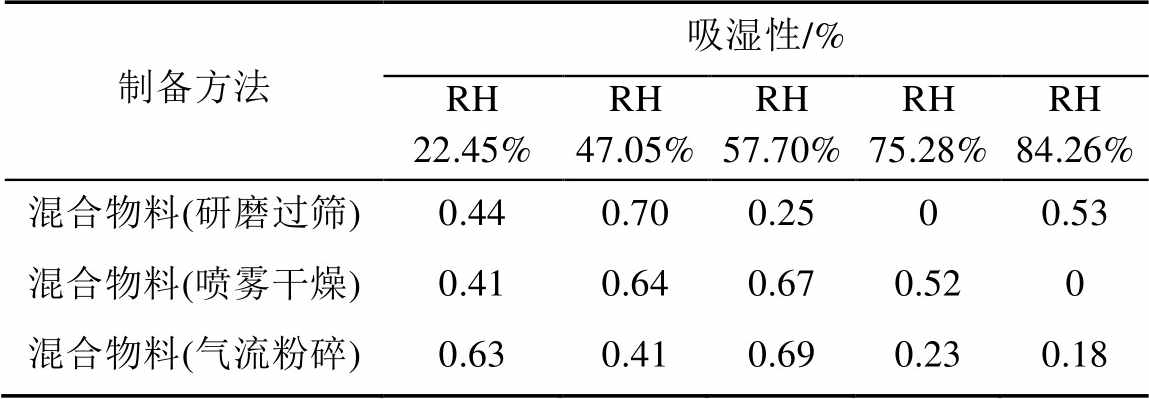
结果表明,通过3种方式制备方法得到的扎那米韦原料粉末与乳糖混合后均无明显吸湿性,表明制备工艺并不影响粉体的吸湿性改变,对后续粉雾剂的稳定性较好,见表3。
表3 均一混合物的吸湿性(n=3)
Tab. 3 Results of hygroscopicity measurement(n=3)
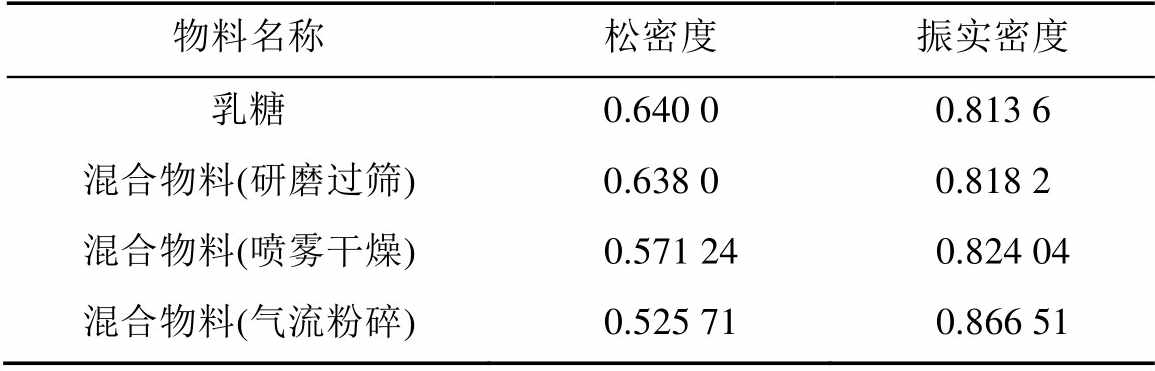
粉体的堆密度对装填和装量影响较大,随着混合物料中扎那米韦粒径的逐渐变小,其与乳糖相比松密度逐渐减小,而振实密度则逐渐增加,研磨过筛的原料粉末几乎不影响乳糖的堆密度。这可能是小粒径的扎那米韦颗粒填充在乳糖颗粒之间引起的,也间接表明扎那米韦颗粒与乳糖颗粒之间几乎无相互作用,结果见表4。
表4 均一混合物的堆密度(n=3)
Tab. 4 Results of bulk density measurement(n=3) g·mL-1
原研葛兰素的处方是乳糖与原料质量比为4∶1,本实验作为前期探索研究,也采用该质量比作为模型进行研究。
本实验选择的吸入乳糖粒径符合鼻腔给药的要求,因此扎那米韦可以通过吸附在乳糖颗粒表面实现鼻腔滞留,也可以制备符合鼻腔的粒径与乳糖物理混合。若是前者,则扎那米韦的粒径需较小且与乳糖混合后具有较强的吸附,以便得到合适粒径的含药颗粒。若是后者,则扎那米韦不能与乳糖发生强吸附,以免颗粒过大发生集聚。
由实验结果可知,经过粉碎得到的不同粒径原料粉末与乳糖混合后,并未发现扎那米韦与乳糖可能有吸附或聚集的倾向,因此粒径<10 μm的扎那米韦便不适合作为后续开发。不同粒径的扎那米韦与乳糖混合后的流动性影响较小,且并没有明显的吸湿性,表明乳糖是较好的辅料选择。
综合考虑,研磨过筛工艺是适合扎那米韦原料粉碎的制备工艺,但是具体粒径大小还需要进一步的模拟鼻腔滞留实验来确定,而乳糖是本产品开发较好的选择之一,可供后期实验参考。本实验是本项目的早期工艺研究,在后续工业化研究中将选择与研磨粉碎原理相似的粉碎机作进一步研究,且本实验的结论可作为参考指导。
REFERENCES
[1] Nguyen-Van-Tam J S, Openshaw P J, Nicholson K G. Antivirals for influenza: where now for clinical practice and pandemic preparedness? [J]. Lancet, 2014, 384(9941): 386-387.
[2] GU J F. An introduction to research advances in novel anti-influenza virus neuraminidase inhibitor [J]. World Notes Antibiotic(国外医药: 抗生素分册), 2013, 34(3): 97-105
[3] 蔡兴诗. 扎那米韦粉雾剂的研究[D]. 武汉工程大学, 2015: 12-23.
[4] Gabrielle B, Leah G, Zahir H, et al. Transmission of influenza A in human beings [J]. Lancet Infect Dis, 2007(7): 257-265.
[5] 梁文权. 生物药剂学与药物动力学[M]. 第3版. 北京: 人民卫生出版社, 2007: 81-89.
[6] DU Y, FENG Y, XU D S, et al. Advances in compression and binding characteristics of pharmaceutical powders [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2012, 29(1): 24-30.
[7] Powder flow. USP 40 [S]. 1602-1606.
[8] Bulk density and tapped density of powders. USP 40 [S]. 505-508
[9] Relenza. Chemistry Review. https: //www. accessdata. fda. gov/drugsatfda_docs/nda/99/021036-chem. Pdf.
Study on Powder Characterization of Zanamivir Nasal Powder
PENG Jiqian1, CHEN Yangwu1, CHEN Shun1*, WANG Zeren1,2*
(1.Shenzhen HLK Pharmaceuticals, Co., Ltd., Shenzhen 518057, China; 2.Nanjing University Shenzhen Research Institute, Shenzhen 518057, China)
ABSTRACT:OBJECTIVETo develop zanamivir nasal powder, three powder preparation technologies are evaluated.METHODSZanamivir powder was prepared by milling, air flow milling or spry drying technologies. Then three zanamivir powder mixed respectively with Inhalac 230, a special type of lactose for inhalation. All of the powder was investigated with particle size, characterization, flowability, density, and hygroscopicity.RESULTSParticle size of zanamivir powder prepared by milling, flow miling and spry drying technologies decreased in turn. Compared to lactose for inhalation, density of three types of mixed powder increased in turn, and no significantly change was found in flowability with miling and flow miling but spry drying. Three types of mixed powder had no significantly hygroscopicity.CONCLUSIONMilling technology may be a good choice to develop zanamivir nasal powder.
KEY WORDS:zanamivir; nasal powder; powder; particle size
中图分类号:R943
文献标志码:B
文章编号:1007-7693(2018)10-1462-04
DOI:10.13748/j.cnki.issn1007-7693.2018.10.006
收稿日期:2018-01-01
引用本文:彭继千, 陈扬武, 陈顺, 等. 扎那米韦鼻用粉雾剂粉体性质研究[J]. 中国现代应用药学, 2018, 35(10): 1462-1465.
基金项目:深圳市科技计划项目(JSGG20141016145810835)
作者简介:彭继千,男,硕士 Tel: (0755)86721006 E-mail: jiqian.peng@hlkpharma.com
*通信作者:王泽人,男,博士,研究员 Tel: (0755)86007001 E-mail: zeren.wang@hlkpharma.com 陈顺,男,博士 Tel: (0755)86721006 E-mail: shun.chen@hlkpharma.com
(本文责编:曹粤锋)