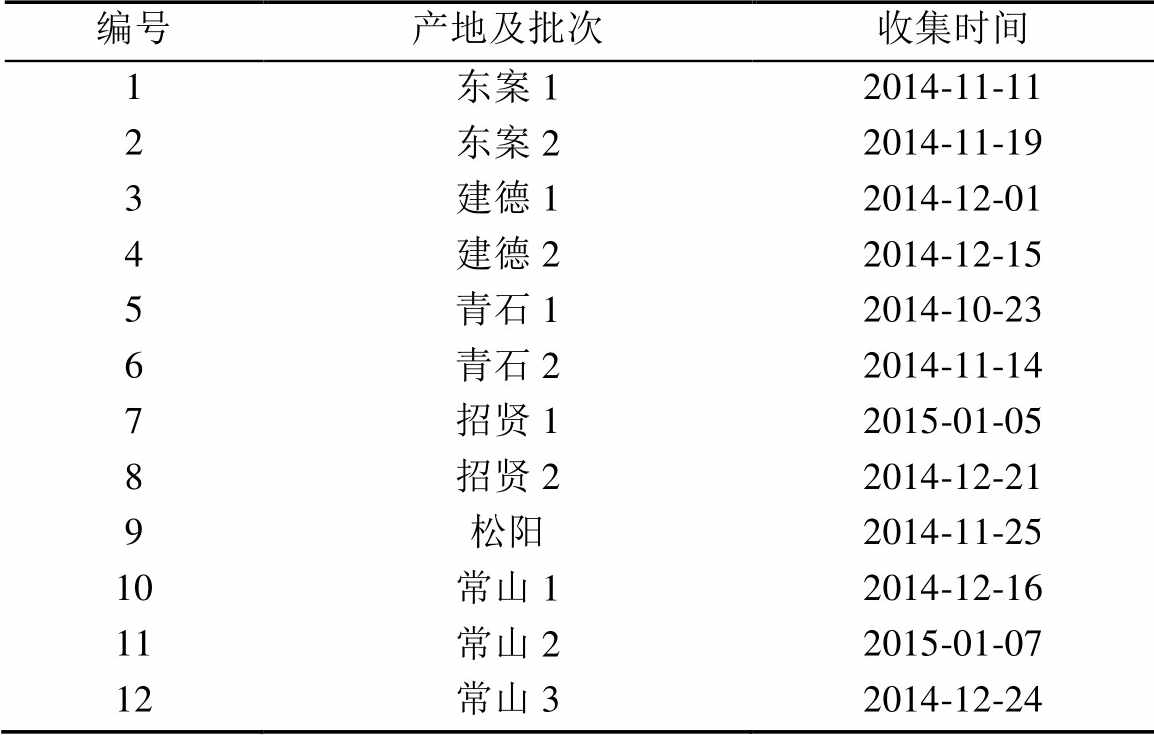
表1 常山胡柚皮药材产地及批次
Tab. 1 Regions and batches ofCitrus changshan-huyouY. B. peels
方健1,吴晓宁2*,蒋剑平3,毛磊2
(1.杭州市余杭区第三人民医院,杭州 311115;2.杭州医学院,杭州 310053;3.浙江省中医院,杭州 310006)
摘要:目的建立常山胡柚皮黄酮类成分的指纹图谱,并对指纹图谱特征指纹峰成分与其抗氧化活性进行相关性分析。方法采用高效液相色谱法建立常山胡柚皮黄酮类成分的指纹图谱,采用DPPH清除氧自由基能力进行体外抗氧化活性研究,对指纹图谱中的特征指纹峰成分含量及其抗氧化活性进行多元线性回归分析,初步推断指纹图谱与抗氧化活性的谱效相关性。结果胡柚皮提取物总黄酮成分、指纹图谱特征指纹峰成分(柚皮苷与新橙皮苷)的含量与其抗氧化活性之间存在显著的线性关系。胡柚皮提取物中柚皮苷含量与其DPPH自由基的清除率呈正相关(P<0.01),而新橙皮苷含量与其DPPH自由基的清除率略呈正相关(P<0.05)。结论柚皮苷和新橙皮苷等黄酮类化合物可能是常山胡柚皮抗氧化作用的主要物质基础。
关键词:常山胡柚皮;高效液相色谱法;指纹图谱;抗氧化活性
常山胡柚(Citrus changshan-huyouY. B. Chang)为芸香科植物柚[Citrusgrandis(L.) Osbeck]和甜橙[Citrussinensis(L.) Osbeck]的杂交种,主产于浙江常山,为地方特色柑橘品种。胡柚性凉,具有清热、化痰止咳、理气宽中、消食利尿的功效,用于胸胁气滞,胀满疼痛,食积不化,痰饮内停等[1]。现代研究表明,常山胡柚的果皮中含有多种生理活性成分,主要为果胶、黄酮类化合物、柠檬苦素类、挥发油类、香豆素类及其他三萜类化合物等[2-3]。药理学研究表明[4-5],常山胡柚皮提取物具有抗氧化、抑菌抗炎、抗肿瘤、降血糖、降血压、治疗非酒精性脂肪肝等药理作用。
本实验采用HPLC建立了12个产地的常山胡柚皮药材黄酮类成分的指纹图谱,并对胡柚皮药材指纹图谱中已鉴别的特征指纹峰成分(柚皮苷和新橙皮苷)及其清除DPPH自由基的作用进行关联,挖掘与抗氧化活性显著相关的特征。初步进行常山胡柚皮药材黄酮类成分HPLC指纹图谱与抗氧化活性的谱效学研究,以期建立以体外抗氧化活性药效为基础的常山胡柚皮药材的HPLC指纹图谱共有模式。
常山胡柚皮药材共12批,分别购自浙江常山、建德、青石等地,具体信息见表1,经杭州医学院生药教研室吴晓宁副教授鉴定为常山胡柚(Citrus changshan-huyouY. B. Chang)的果皮;新橙皮苷对照品(上海中药标准化研究中心,批号:05-1010;纯度:99.0%);柚皮苷对照品(中国药品生物制品检定所,批号:110722-200610;纯度:99.0%);DPPH试剂(美国Sigma公司);甲醇(色谱纯);超纯水,经Cascada LS超纯水仪制备;其余试剂均为分析纯。
表1 常山胡柚皮药材产地及批次
Tab. 1 Regions and batches ofCitrus changshan-huyouY. B. peels

Lumtech高效液相系统(德国Knauer公司,K-501二元泵,K-2501紫外检测器,East Chrom色谱工作站);TU-1901双光束紫外可见分光光度计(北京普析通用仪器有限责任公司);SK2510HP超声波清洗器(上海科导超声仪器有限公司);DKS-24电热恒温水浴锅(杭州蓝天化学仪器厂);AL204电子分析天平(梅特勒-托利多仪器有限公司)。
2.1.1 色谱条件 色谱柱为大连依利特公司Hypersil BDS C18柱(250 mm×4.6 mm,5 μm);流动相为甲醇(A)-0.5%醋酸(B),梯度洗脱(0~20 min,25%→35%A;20~35 min,35%→45%A;35~48 min,45%→74%A;48~55 min,74%→80%A;55~60 min,80%A);流速为1.0 mL·min-1;检测波长为324 nm;柱温25 ℃;进样量10 μL。
2.1.2 对照品溶液的制备 精密称取经105 ℃干燥至恒重的柚皮苷对照品15 mg,置50 mL量瓶中,加甲醇至刻度,摇匀,即得含柚皮苷300 μg·mL-1的对照品溶液,备用。
2.1.3 供试品溶液的制备 取胡柚皮粉末供试品(过三号筛)约0.5 g,加甲醇30 mL超声提取(250 w、59 kHz)20 min,过滤,定量转移至50 mL量瓶中,加甲醇至刻度,摇匀,备用。
2.1.4 方法学考察 仪器精密度试验:取同一份供试品溶液,按“2.1.1”项下色谱条件测定5次,各共有峰的相对保留时间的RSD均<0.70%,相对峰面积的RSD均<2.00%,表明仪器精密度良好。
稳定性试验:取同一份供试品溶液,分别在0,2,4,8,12 h按“2.1.1”项下色谱条件进行测定,所得各共有峰的相对保留时间的RSD均<1.50%,相对峰面积的RSD均<3.00%,表明样品在12 h内稳定。
重复性试验:取样品5份,按“2.1.3”项下方法分别制备供试品溶液,按“2.1.1”项下色谱条件进行测定,所得各共有峰的相对保留时间的RSD均<1.60%,相对峰面积的RSD均<4.00%,表明方法的重复性良好。
2.1.5 指纹图谱的建立 按“2.1.1”项下色谱条件,测得12批常山胡柚皮供试品HPLC图谱。在各产地常山胡柚皮药材样品图谱中,柚皮苷的色谱峰分离良好,峰位居中,峰面积较大,在图谱中较稳定且为所有样品共有,所以确定柚皮苷为参比峰(S)。
采用中药色谱指纹图谱相似度评价系统(2004A)软件对12批常山胡柚皮供试品HPLC图谱进行处理,经软件系统生成对照指纹图谱。柚皮苷对照品色谱图和12批次药材指纹图谱叠加分别见图1、图2。
2.1.6 共有峰的标定[9]以柚皮苷对照品为参照峰,结果12批药材有11个特征指纹峰,鉴定了2个特征指纹峰,即7(S)号为柚皮苷,9号为新橙皮苷。参照峰标为S,其他峰依次为1~11。共有峰的峰序(相对峰面积)分别为1(0.063 1),2(0.074 9),3(0.041 1),4(0.137 0),5(0.193 1),6(0.048 1),7(1.000,S),8(0.032 8),9(0.712 7),10(0.145 8),11(0.085 3)。
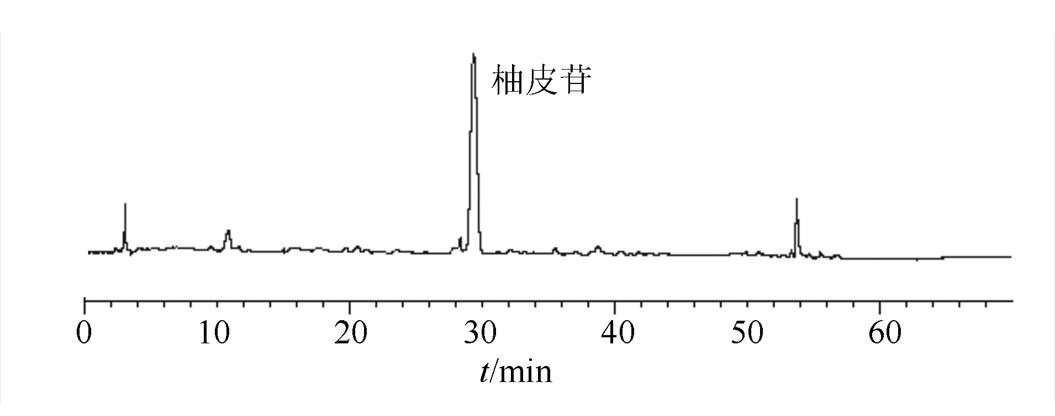
图1 柚皮苷对照品色谱图
Fig. 1 HPLC chromatogram of naringin
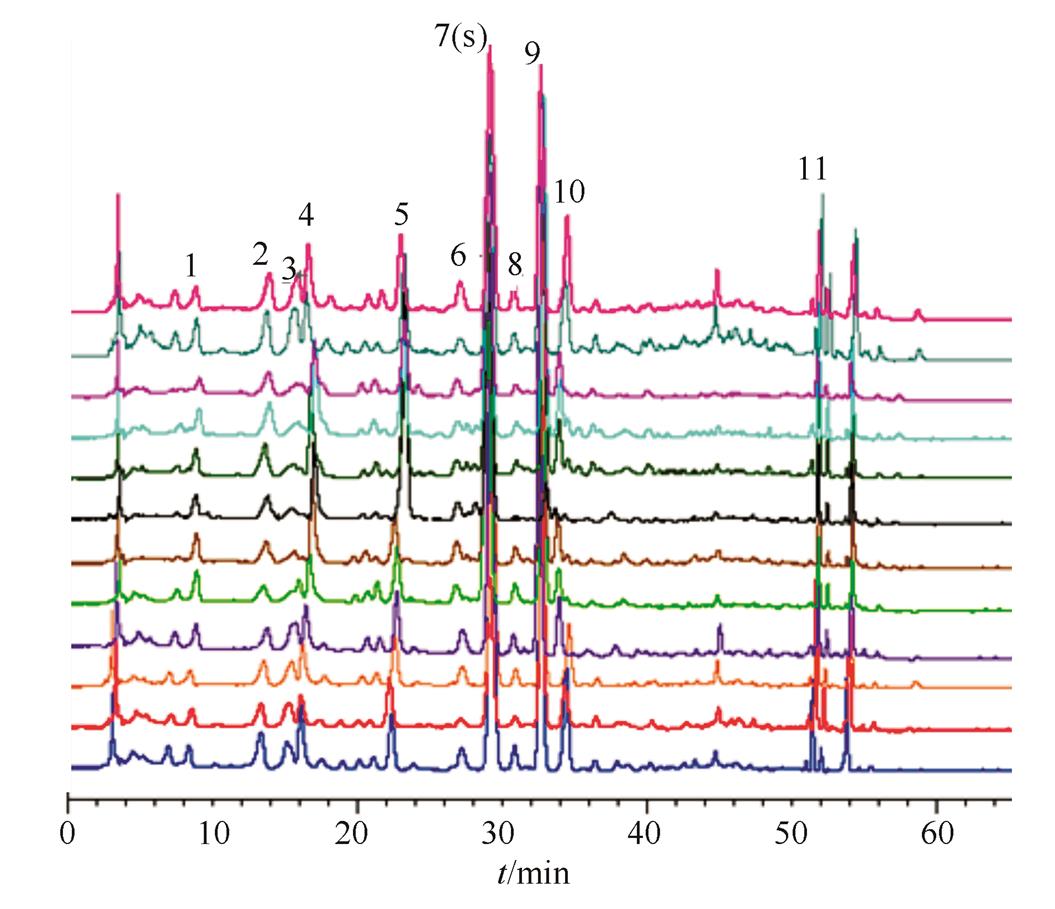
图2 12批次常山胡柚皮黄酮类成分色谱图
Fig. 2 HPLC of flavonoids extract from 12 batches ofCitrus changshan-huyouY. B. peels
2.2.1 对照品溶液的制备 精密称取经105 ℃干燥至恒重的柚皮苷对照品15 mg,置50 mL量瓶中,加甲醇至刻度,摇匀,即得含柚皮苷300 μg·mL-1的对照品溶液,备用。
精密称取经105 ℃干燥至恒重的新橙皮苷对照品15 mg,置50 mL量瓶中,加甲醇至刻度,摇匀,即得含新橙皮苷300 μg·mL-1的对照品溶液,备用。
2.2.2 供试品溶液的制备 同“2.1.3”项下,得生药含量为10 mg·mL-1的胡柚皮溶液,备用。
2.2.3 DPPH试剂的配制 精密称取DPPH粉末2.5 mg,用无水乙醇定容至100 mL,得浓度为25 µg·mL-1的DPPH溶液。
2.2.4 提取物的制备 称取不同产地的常山胡柚皮粗粉500 g,加80%乙醇2 L超声辅助提取30 min共3次,浸提液抽滤合并后用旋转蒸发仪减压回收乙醇,得到总浸膏。所得浸膏含量见表2。取浸膏50 mg,用无水乙醇溶解并定容至10 mL量瓶中,得到浓度为5 mg·mL-1的待测液。
2.2.5 自由基清除率的测定 取200 µL待测液及2 mL DPPH溶液,加入800 µL无水乙醇置于具塞试管中,摇匀,置暗处反应30 min。以无水乙醇为空白,在517 nm处测定吸光度Ai,按公式计算自由基清除率:清除率/%=(1-[DPPH]t/ [DPPH]t=0)×100%。
其中[DPPH]t=0表示0时刻体系的吸光度,[DPPH]t表示30 min时体系的吸光度,结果见表2。
2.2.6 总黄酮含量的测定 参照文献[11],经前期实验研究[12],以柚皮苷为对照品,采用紫外分光光度法测定胡柚皮药材总黄酮含量,结果见表2。
2.2.7 柚皮苷和新橙皮苷含量的测定[13-14]采用HPLC对常山胡柚皮中柚皮苷和新橙皮苷进行含量测定。
2.2.7.1 色谱条件 色谱柱为大连依利特公司Hypersil BDS C18柱(250 mm×4.6 mm,5 μm);流动相为甲醇-0.5%醋酸(38∶62);流速为1.0 mL·min-1;检测波长为283 nm;柱温25 ℃。对照品溶液和供试品溶液分别进样10 μL,记录色谱图。
2.2.7.2 柚皮苷线性关系的考察 精密吸取浓度300 μg·mL-1的柚皮苷对照品溶液,加甲醇分别稀释为3.0,12.0,30.0,60.0,90.0,150.0,300.0 μg·mL-1,按“2.2.7.1”项下色谱条件分别进样10 μL,测定峰面积值。以进样量为横坐标(x),峰面积为纵坐标(y)绘制标准曲线,得回归方程y=15.599x-17.318,R2=0.999 8,柚皮苷在3.0~300.0 μg·mL-1内线性关系良好。
2.2.7.3 新橙皮苷线性关系的考察 精密吸取浓度300 μg·mL-1的新橙皮苷对照品溶液,加甲醇分别稀释为3.0,12.0,30.0,60.0,90.0,150.0,300.0 μg·mL-1,按“2.2.7.1”项下色谱条件分别进样10 μL,测定峰面积值。以进样量为横坐标(x),峰面积为纵坐标(y)绘制标准曲线,得回归方程y=18.771x-38.242,R2=0.999 8,新橙皮苷在3.0~300.0 μg·mL-1内线性关系良好。
2.2.7.4 仪器精密度试验 精密吸取对照品溶液各10 μL,重复进样5次,测定柚皮苷及新橙皮苷的峰面积,柚皮苷峰面积RSD为1.06%,新橙皮苷峰面积RSD为1.00%,表明仪器精密度良好。
2.2.7.5 稳定性试验 精密称取胡柚皮粉末0.5 g,按“2.2.2”项下方法制备供试液,于0,2,4,6,8,10,12,24 h各进样10 μL,测定柚皮苷与新橙皮苷峰面积,柚皮苷峰面积RSD为1.81%,新橙皮苷峰面积RSD为1.38%,表明样品在24 h内稳定。
2.2.7.6 重复性试验 取同一批次胡柚皮粉末供试品5份,按“2.2.2”项下方法分别制备供试液,按“2.2.7.1”项下色谱条件进行测定,计算柚皮苷与新橙皮苷含量,柚皮苷含量RSD为0.89%,新橙皮苷含量RSD为0.67%,表明方法的重复性良好。
2.2.7.7 加样回收率试验 精密称取已知含量(柚皮苷2.470%、新橙皮苷1.970%)的胡柚皮粉末0.25 g,分别精密加入高、中、低浓度的柚皮苷和新橙皮苷对照品,按“2.2.2”项下方法分别制备3份样品溶液,进样10 μL,进行回收率测定,柚皮苷平均加样回收率为100.9%,RSD为1.50%,新橙皮苷平均加样回收率为102.6%,RSD为1.75%,符合加样回收率的要求。
2.2.7.8 样品的测定 分别称取不同产地的胡柚皮粗粉(过三号筛)各约0.5 g,按“2.2.2”项下方法方法制备供试液,精密吸取供试品溶液10 µL进样,记录色谱图,对照品及样品色谱图见图3。柚皮苷和新橙皮苷含量结果见表2。
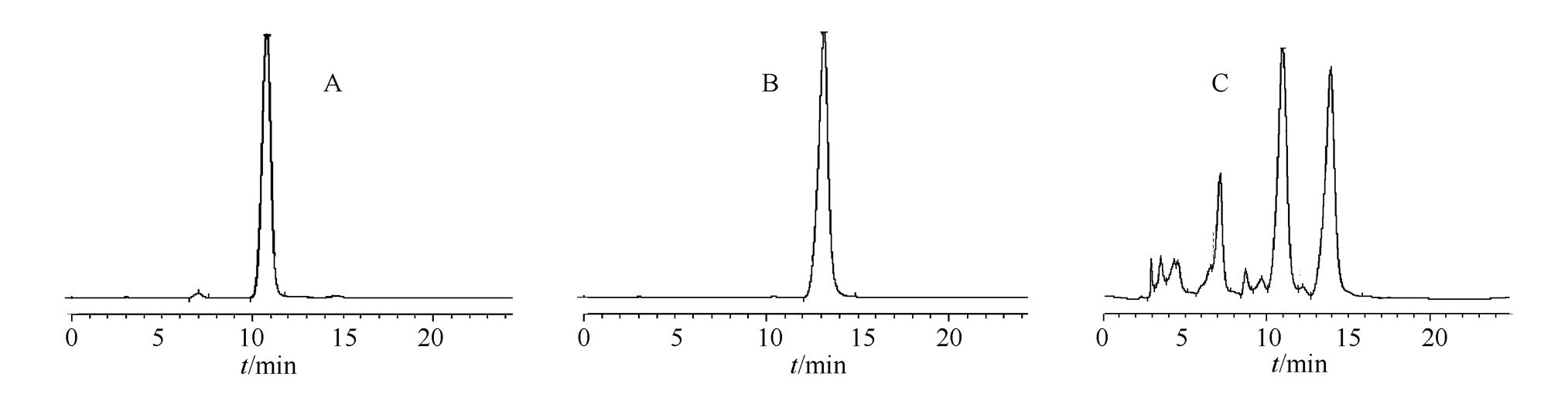
图3 柚皮苷(A)、新橙皮苷(B)和样品(C)对照品色谱图
Fig. 3 HPLC chromatogram of naringin(A), neohesperidin(B) and sample(C)
表2 胡柚皮体外抗氧化活性成分分析结果
Tab. 2 Antioxidant activity results ofCitrus changshan- huyouY. B. peelsin vitro%
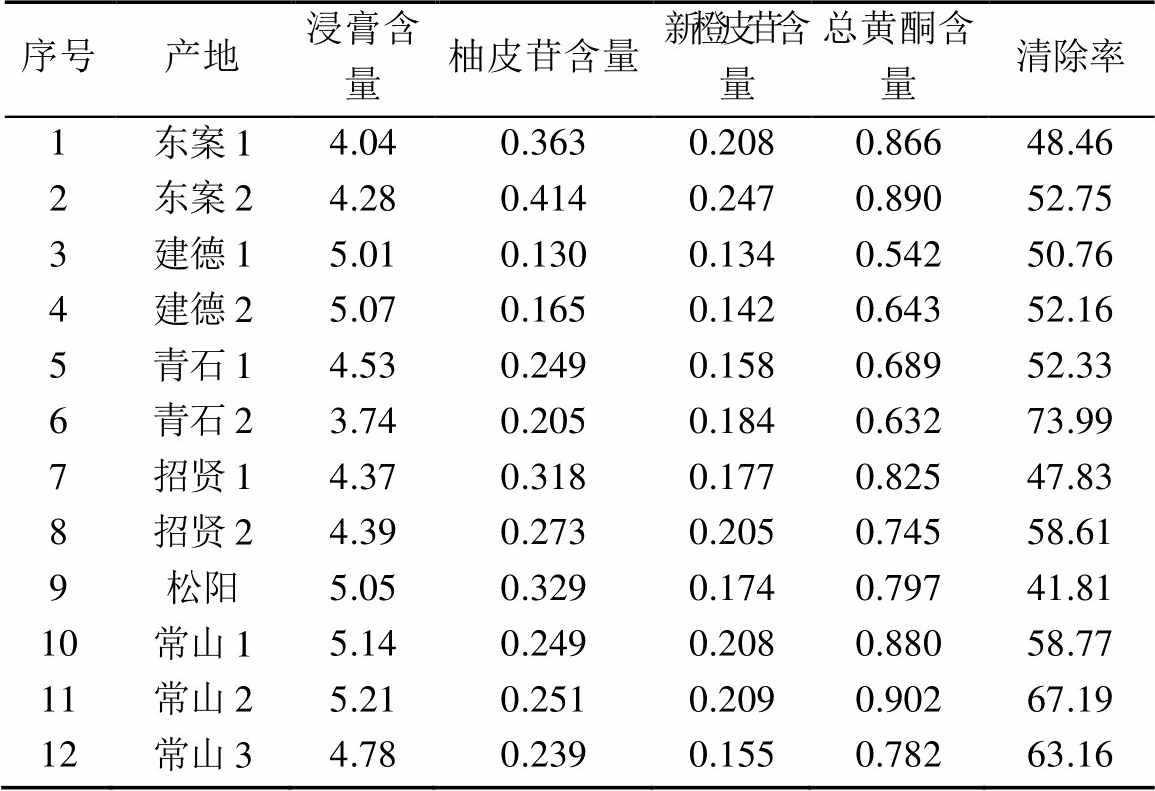
由表2可知,胡柚皮提取物中主要含有柚皮苷和新橙皮苷等黄酮类化合物,且具有较强的抗氧化活性,可提高DPPH自由基的清除率。
以浸膏含量(X1)、柚皮苷含量(X2)、新橙皮苷含量(X3)和总黄酮含量(X4)为横坐标,DPPH自由基清除率(Y)为纵坐标,采用SPSS 18.0软件对表2结果进行线性关系考察,得方差分析表和回归标准残差正态P-P图。结果见表3和图4。
表3 方差分析表
Tab. 3 Analysis of variance

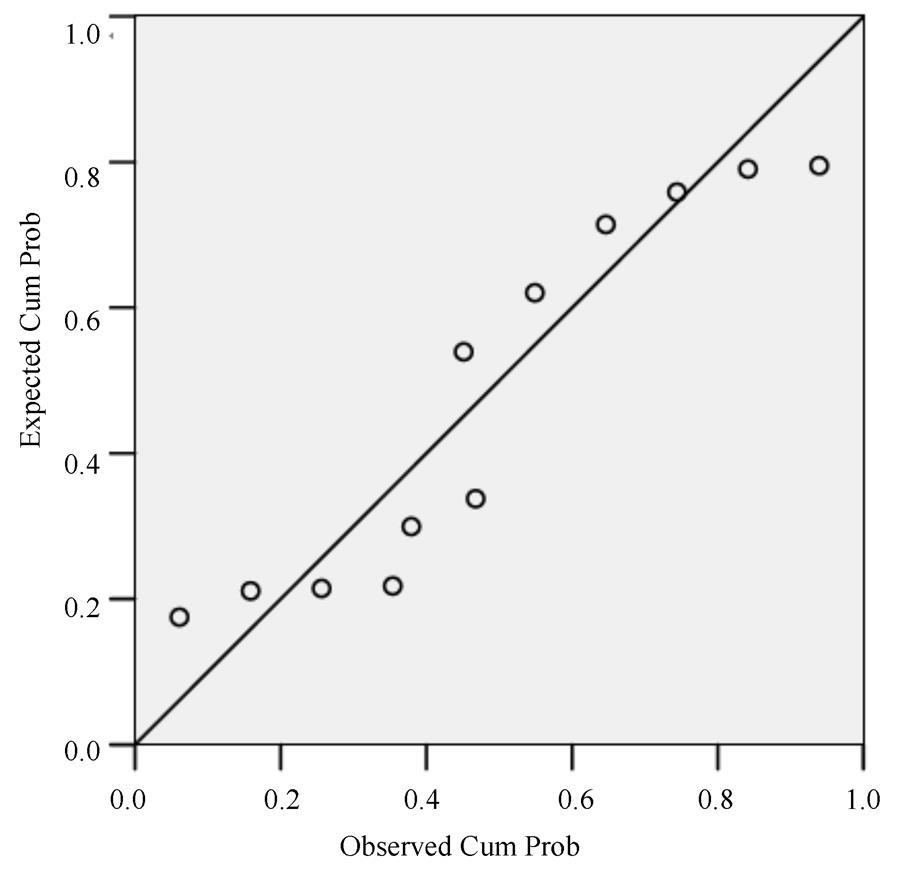
图4 回归残差正态图
Fig. 4 Normal P-P plot of regression
由表3和图4可知,自变量(Xn)与因变量(Y)服从正态分布(P<0.01),证明胡柚皮提取物黄酮类成分含量、指纹图谱中的特征指纹峰成分含量及与其抗氧化活性之间存在显著的线性关系。对其进行多元线性回归分析,得回归系数分析表4。
表4 回归系数分析表
Tab. 4 Analysis of regression
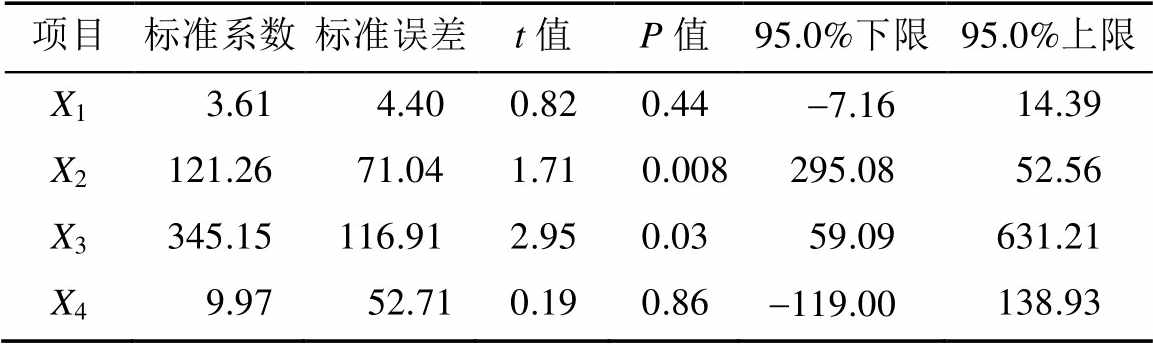
在95%可信区间内,线性相关系数R=0.986 6 (>积分门槛值0.80)。证明回归方程真实、可靠,具有统计学意义;可用于替代实验点对实验结果进行分析。相关性分析结果表明,柚皮苷含量与其DPPH自由基的清除率呈正相关(P<0.01),而胡柚皮提取物中新橙皮苷含量与其DPPH自由基的清除率略呈正相关(P<0.05)。
为消除各指标因统计单位带来的数据不一致性,故将数据经标准化后,常数值设定为0,拟合方程:Y=3.61X1+121.26X2+345.15X3+9.97X4。
现代研究表明,许多疾病如心脑血管疾病以及人体衰老等过程都与自由基的作用有关[15]。应用DPPH自由基清除能力实验,可通过检测其吸光度值来评价样品的抗氧化性[16]。黄酮类化合物是一种天然的抗氧化剂[17],其主要通过酚羟基与自由基进行抽氢反应生成稳定的半醌自由基,从而中断链式反应,达到抗氧化作用[18]。
本实验收集了12个不同产地不同批次的常山胡柚皮药材,采用HPLC获取化学数据,进行了胡柚皮的指纹图谱研究。通过胡柚皮药材的指纹图谱发现,不同产地或批次胡柚皮中化学成分之间既有相关性,又有区别。但是由于受产地、采收期等因素的影响,各共有色谱峰的相对峰面积有一定差异,即化学成分的相对含量有差异。如能获得更多的代表性样品,按照不同来源、不同产地、不同采收期、不同生长年限等进行分类测定,则能使胡柚皮质量的评价方法更为完善。
柚皮苷和新橙皮苷是胡柚皮提取物中主要黄酮类化合物,同时也是指纹图谱中的特征指纹峰。本实验对指纹图谱特征指纹峰成分与其抗氧化活性进行相关性分析,由结果推断柚皮苷和新橙皮苷等黄酮类化合物可能是其抗氧化作用的主要物质基础,可提高DPPH自由基的清除率。本实验可为今后研究和开发其他柑橘属新产品提供参考。
REFERENCES
[1] 浙江省中药炮制规范(2015年版)[S]. 2016: 180-182.
[2] JIANG J P, SHAN L T, CHEN Z Y, et al. Evaluation of antioxidant-associated efficacy of flavonoid extracts from a traditional Chinese medicine Hua Ju Hong(peels ofCitrus grandis(L. ) Osbeck) [J]. J Ethnopharmacol, 2014(158): 325-330.
[3] 刘春荣, 王登亮, 郑雪良. 胡柚果实的营养与功能性组分研究进展[J]. 浙江农业科学, 2015, 56(2): 253-257.
[4] SONG J, XU L, ZHANG C C, et al. Studies on effect of Huyoubao tablet on mice’s immunologic function [J]. Chin J Tradit Med Sci Technol(中国中医药科技), 2014, 21(6): 639-640.
[5] CHEN Z Y, LI J S, JIANG J P, et al. Effect of pure total flavonoids from Citrus on hepati SIRT1/PGC-αpathway in mice with NASH [J]. China J Chin Mater Med(中国中药杂志), 2014, 39(1): 100-105.
[6] QIU R L, WU Y L, YUE W. Comparison of four flavonoids fromCitri reticulataePericarpium andCirri reticulatae PericarpiumViride by HPLC [J]. Chin Tradit Pat Med(中成药), 2015, 37(1): 149-153.
[7] CHEN Y G, LIN L. Study and comparison on HPLC fingerprints of flavonoids of frequently used Chinese materia medica in Citrus [J]. China J Chin Mater Med (中国中药杂志), 2011, 36(19): 2660-2665.
[8] SU B R, DENG H M, MA H L, et al. Quality evaluation of Astragali Radix through chemical pattern recognition of fingerprint by HPLC-DAD-ELSD [J]. China J Chin Mater Med (中国中药杂志), 2013, 38(19): 3319-3322.
[9] 国家药典委员会. 中药注射剂色谱指纹图谱实验研究技术指南(试行) [M]. 2002.
[10] ZHENG X L, LIU C R, WANG D L, et al. Flavonoids contents and antioxidant activities inCitrus paradisicv. Changshan Huyou during development [J]. Acta Agric Zhejiang ensis(浙江农业学报), 2015, 27(7): 1185-1191.
[11] Feng C H, Li G, Zhang J, et al. Determination of the content of total flavone and naringin in hot Rhizoma Drynariae [J]. China Pharm(中国药业), 2016, 25(1): 63-65.
[12] Shu Z M, JIANG J P, WANG J P, et al. Purification of total flavonoids from peels ofCitrus Changshan-huyouY. B. Chang by macroporous resin [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2017, 34(5): 649-653.
[13] SONG J F, FENG J Q, HU J H, et al. Simultaneous determination for contents of naringin, hesperidin, and neohesperidin in flower ofCitrus changshan-huyouby RP-HPLC [J]. Chin Tradit Herb Drugs (中草药), 2014, 45(6): 854-856.
[14] GUO Z X, LI W T, LI Z K. Determination of naringin and neohesperidin in Aurantii Fructus from different habitats [J]. Chin Tradit Herb Drugs(中草药), 2012, 43(7): 1347- 1348.
[15] LI P Y, HUO L N, SU W, et al. Radical scavenging activity and total phenolics content ofKochia scoparia[J]. Hubei Agric Sci(湖北农业科学), 2016, 55(11): 2989-2901.
[16] XIONG S L, LU F, SHI M J. Advancement of evaluation methods about DPPH radical scavenging activity in screening antioxidant [J]. Sci Technol Food Indust(食品工业科技), 2012, 33(8): 380-383.
[17] Zhang M X, Yang T Y, Feng W H. Research progress on the flavonoids of Citrus plants [J]. J Henan Inst Sci Technol(河南科技学院学报), 2014, 42(5): 11-15.
[18] Huang X, Liang J P, Hao B C. Study on molecular modification and structure-activity relationship of flavonoids [J]. J Anhui Agric Sci(安徽农业科学), 2015, 43(11): 57-61.
Related Analysis Between Antioxidant Activities and HPLC Fingerprint of Flavonoids inCitrus Changshan-huyouY. B. Peels
FANG Jian1, WU Xiaoning2*, JIANG Jianping3, MAO Lei2
(1.The Third Hospital of Yuhang District, Hangzhou 311115, China; 2.Hangzhou Medical College, Hangzhou 310053, China; 3.Zhejiang Provincial Hospital of TCM, Hangzhou 310006, China)
ABSTRACT:OBJECTIVETo establish the HPLC fingerprints of flavonoid fromCitrus changshan-huyouY. B. peels, and related analysis between antioxidant activities and HPLC fingerprint.METHODSThe fingerprint of flavonoids inCitrus changshan-huyouY. B. peels was established by HPLC. Antioxidant activeties of the extracts were evaluatedin vitroaccording to DPPH assay. Then the correlation was surveyed between the components in HPLC fingerprint and antioxidant activities by the multiple linear regression analysis.RESULTSThe extract exhibited significant antioxidant activetiesin vitro.The DPPH free radical efficiency had a positive correlation with naringin content of the extract(P<0.01) while neohesperidin showed an approximate correlation(P<0.05).CONCLUSIONAntioxidant activities may be based on naringin and neohesperidin mainly.
KEY WORDS:Citrus changshan-huyouY. B. peels; HPLC; fingerprint; antioxidant activities
中图分类号:R284.1
文献标志码:B
文章编号:1007-7693(2018)10-1489-05
DOI:10.13748/j.cnki.issn1007-7693.2018.10.012
引用本文:方健, 吴晓宁, 蒋剑平, 等. 常山胡柚皮黄酮类成分指纹图谱与其抗氧化活性的谱效关系研究[J]. 中国现代应用药学, 2018, 35(10): 1489-1493.
收稿日期:2017-12-05
基金项目:国家自然科学基金项目(81573761);浙江省自然科学基金项目(LY13H290011)
作者简介:方健,男,主管药师 Tel: 15968803521 E-mail: 33706750@qq.com
*通信作者:吴晓宁,女,博士,副教授 Tel: (0571)87692684 E-mail: wxn1974168@126.com
(本文责编:曹粤锋)